Roztroušená skleróza a COVID‑19
V úvodu tradiční odborné akce RS Akademie, která se vlivem pandemie přesunula z jarního období do podzimních měsíců roku 2020, a to do virtuálního prostoru, prezentovala aktuální informace o infekci SARS‑CoV‑2 a jejím vlivu na léčbu roztroušené sklerózy (RS) prof. MUDr. Eva Kubala Havrdová, CSc., z Neurologické kliniky 1. LF UK a VFN v Praze. RS Akademii pravidelně organizuje právě 1. lékařská fakulta UK, za podpory společnosti Novartis. Loňská akce probíhala v období, kdy dosud nebyla k dispozici vakcína proti novému koronaviru ani nebyly zaznamenány rychleji se šířící mutace viru.
Na počátku přednášky
profesorka Kubala Havrdová zdůraznila, že o onemocnění
COVID 19 toho stále mnoho nevíme, ale od jara jsme již
nějaké poznatky získali. K nejčastějším příznakům
patří horečka (82 %), kašel (61 %), bolesti svalů, kloubů
a únava (36 %), dušnost (26 %), bolesti v krku
(10 %) a gastrointestinální potíže. Charakteristická je
ztráta čichu (anosmie) nebo chuti (ageuzie) – obojí
ve 32 %. Přítomny mohou být neurologické příznaky,
nejčastěji bolesti hlavy, ale mohou se objevit i další
onemocnění, například poruchy vědomí, ikty a některé
vzácnější syndromy.
Průběh může být bezpříznakový, avšak četnost tohoto průběhu není asi tak vysoká, jak se uvádělo zjara. Přesná data zatím nejsou k dispozici, protože ani vyšetření protilátek nemusí svědčit pro prodělání COVID 19, někteří jedinci nevytvoří protilátky, přestože nemocní byli a byla u nich prokázána přítomnost viru metodou PCR. Podle imunologů by bylo spolehlivější detekovat specifické paměťové T lymfocyty [1].
Častěji se dostavují mírné až středně těžké obtíže, ale může dojít k závažné pneumonii (15 %), k akutnímu syndromu dechové tísně (acute respiratory distress syndrome, ARDS), k septickému šoku a/nebo k multiorgánovému selhání, ke koagulopatii se všemi důsledky.
Kolem úmrtnosti stále panují jisté nejasnosti. Profesorka Kubala Havrdová ukázala závažnost rizika úmrtí na datech ze Spojených států amerických, kde týdenní úmrtnost na COVID 19 převyšuje 9,5–44,1krát týdenní úmrtnost na chřipku během posledních sedmi sezon. Průměrně tedy smrtnost COVID 19 převyšuje v USA smrtnost sezonní chřipky 20,5krát (poměr rizik [HR] 20,5; 95% interval spolehlivosti [CI] 16,3–27,7) [2]. Použitá data pocházejí z jarních měsíců a na definitivní zhodnocení smrtnosti COVID 19 v ČR si musíme ještě počkat.
COVID 19 je virová infekce dýchacích cest, která se šíří kapénkami i aerosolem. Není vyloučen ani přenos kontaminovanými předměty; na povrchu může podle publikace v The New England Journal of Medicine virus přežít (podle typů povrchu) až několik dnů [3].
Inkubační doba činí průměrně pět dnů (2–7), ale pro šíření je podstatný presymptomatický přenos (48–62 %). Nejvyšší virová nálož je v období prvních příznaků v prvním týdnu onemocnění.
Mechanismus infekce a šíření
Infekce SARS CoV 2 exprimuje na povrchu S (spike) protein, který se váže na receptory angiotenzin konvertázy (ACE2) na povrchu buňky. Děje se účastní rovněž transmembránová serinová proteáza (TMPRSS2), která aktivuje S protein a umožňuje průnik viru přes receptory ACE2 do buňky.
Receptor ACE2 je přítomen na alveolárních buňkách typu II, které představují zhruba 80 % buněk exprimujících ACE2. Z dalších možných vstupních míst se jeví jako pravděpodobná molekula CD147 (basigin) a integrin alfa 4.
Po vstupu do buňky virion uvolňuje svou RNA, využívá mechanismy hostitelské buňky ke své replikaci a nově vytvořené částice se následně dostávají do extracelulárního prostoru.
V časném stadiu onemocnění se infikují buňky bronchiální sliznice, alveolární a endoteliální buňky. Infikované buňky a alveolární makrofágy produkují cytokiny, které pak do místa zánětu atrahují T lymfocyty, monocyty, neutrofilní granulocyty, jež přispívají k zánětlivé odpovědi, včetně produkce dalších cytokinů (především tumor nekrotizující faktor alfa [TNFα], interleukin [IL] 1 a IL 6). V této časné fázi je cílem nastartovat mechanismy přirozené imunity [4].
V pozdní fázi se imunitní reakce vymyká kontrole. Při ARDS dochází k plicnímu edému se vznikem hyalinních membrán. Jde o hyperinflamatorní syndrom s respiračním selháním a multiorgánovým postižením. Připomíná ARDS indukovaný syndromem z uvolnění cytokinů a sekundární hemofagocytickou lymfohistiocytózu (sHLH) pozorovanou u pacientů se SARS CoV a MERS CoV [4].
Exprese receptorů ACE2 na epitelu nosní sliznice se vyvíjí s věkem. Nejméně je vyjádřena u dětí a maxima dosahuje po 25. roce života [5]. To je důvod, proč je u dětí infekce méně častá, respektive má lehčí průběh. Hyperinflamatorní stav napodobující Kawasakiho syndrom je u dětí spíše vzácností, uvedla profesorka Kubala Havrdová.
Zvýšená exprese ACE2 je příčinou horšího průběhu onemocnění u hypertoniků, ale i u lidí s demencí, u nichž je zvýšená exprese nejen na nosní sliznici, ale i v oblasti frontálních laloků.
Předpokládá se, že u disponovaných jedinců může SARS CoV 2 spustit produkci orgánově specifických autoprotilátek, které se nacházejí u 20–50 % pacientů s kritickou pneumonií. Mechanismem autoimunitní reakce mohou být molekulární mimikry, tzv. bystander activation, což je aktivace antigen prezentujících buněk, které aktivují primované autoreaktivní T lymfocyty následně produkující prozánětlivé cytokiny ničící tkáně či rozšiřování počtu epitopů z rozpadající se tkáně, a mohou se též odhalit kryptické antigeny, jež byly doposud imunitnímu systému skryty [6]. Zdá se, že za všemi poškozeními nemusí být virus, ale mnohdy jsou způsobena imunitní reakcí, včetně zkříženě reagujících protilátek.
Lymfopenie a cytokinová bouře
Pro pacienta je nejnebezpečnější lymfopenie a cytokinová bouře. Ze zkušeností se sezonními respiračními infekcemi, které jsou způsobeny koronaviry, víme, že protilátková odpověď není u koronavirů významná a dlouhodobá. Zásadní je buněčná imunita, a především Th1 imunitní odpověď. Pacienti s těžkým průběhem COVID 19 mají lymfopenii, přičemž nejvýraznější je pokles počtu T lymfocytů (především CD8+ = cytotoxické T lymfocyty), což jsou lymfocyty, které rozpoznávají virem infikovanou buňku a jsou schopny ji zničit. To koreluje s vysokými koncentracemi TNFα a IL 6 (cytokinová bouře). Vysoké koncentrace IL 6 poškozují cytotoxickou aktivitu T lymfocytů i tzv. natural killers (NK) buněk. Oproti tomu se zvyšuje počet neutrofilů, což není u virových infekcí obvyklé. U pacientů s těžkým průběhem COVID 19 jsou lymfocyty vyčerpány a vykazují znaky zvýšené programované smrti expresí znaků PD 1 (programmed cell death 1) a Tim 3 (T cell immunoglobulin and mucin domain 3). Exprese těchto znaků koreluje s tíží průběhu a potřebou intenzivní péče. Současně je snížena exprese aktivačních markerů – CD107a a interferonu gama ‒, což znamená, že T lymfocyty ztrácejí schopnost množení a působení proti infekci. Je pozorována snížená expanze T lymfocytů; některé geny zodpovědné za aktivaci a funkci T lymfocytů (například MAP2K7 a SOS1) jsou downregulovány. Počty Treg lymfocytů jsou normální [7,8].
Podle slov profesorky Kubala Havrdové se čeští imunologové domnívají, že za těžkým až smrtelným průběhem COVID 19 stojí právě lymfopenie způsobená prozánětlivými cytokiny. Dalším možným vysvětlením je, že dojde k infekci samotných T lymfocytů, v nichž se však virus nemůže množit, ale infekce vede k jejich vyčerpání, apoptóze, nekróze nebo pyroptóze.
B lymfocytární odpověď nehraje zásadní roli, naopak některé protilátky mohou být i poškozující. Kompenzací za vyčerpané T lymfocyty může být zvýšená sekrece prozánětlivých cytokinů aktivovanými makrofágy, neutrofily a monocyty s pomocí endoteliálních, epiteliálních a dendritických buněk. Neschopnost eliminovat infekci a virem napadené buňky vede k nekontrolovatelné aktivaci imunitního systému s excesivní produkcí cytokinů. Navíc má TNFα supresivní vliv na hematopoezu, což vede k cytopenii [9,10].
Dynamika protivirové odpovědi
Kinetika a intenzita antivirové
odpovědi je rozhodující pro průběh onemocnění COVID 19.
Prvním významným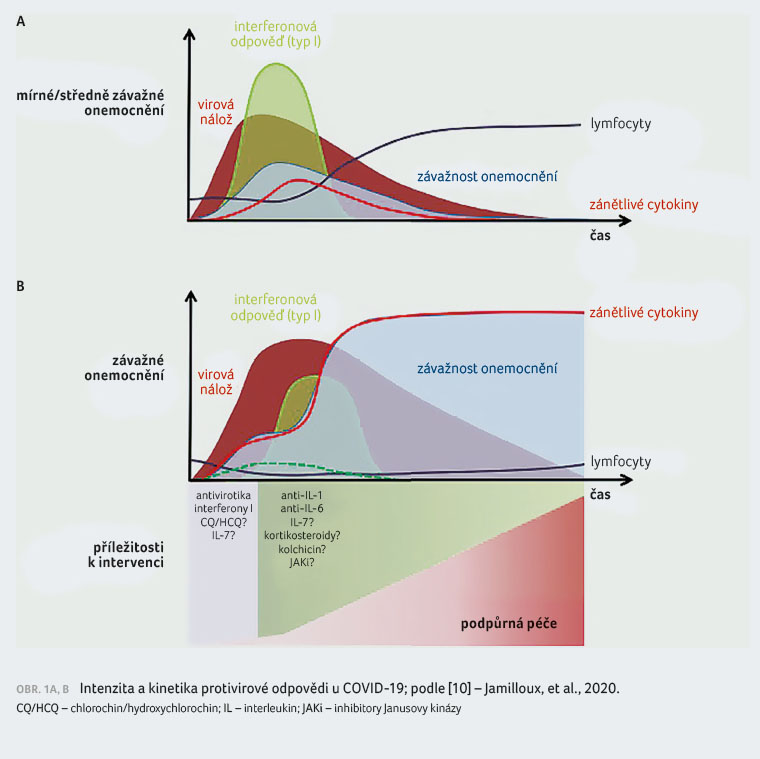 faktorem je počáteční virová nálož. Pro
lehký průběh onemocnění je typická nižší virová nálož,
po níž následuje promptní a silná interferonová
odpověď (interferony I: α, β a ω) se slabší odpovědí
cytokinovou a se vzestupem počtu lymfocytů. V důsledku
produkce interferonů dochází k omezení replikace viru
a k zábraně infikování dalších buněk. Při těžším
průběhu onemocnění dochází k pomalejší a nedostačující
produkci interferonů I, což umožňuje zvýšení virové nálože,
následně se nastartuje mohutná produkce prozánětlivých cytokinů
a dochází k lymfopenii (obr. 1A, B).
faktorem je počáteční virová nálož. Pro
lehký průběh onemocnění je typická nižší virová nálož,
po níž následuje promptní a silná interferonová
odpověď (interferony I: α, β a ω) se slabší odpovědí
cytokinovou a se vzestupem počtu lymfocytů. V důsledku
produkce interferonů dochází k omezení replikace viru
a k zábraně infikování dalších buněk. Při těžším
průběhu onemocnění dochází k pomalejší a nedostačující
produkci interferonů I, což umožňuje zvýšení virové nálože,
následně se nastartuje mohutná produkce prozánětlivých cytokinů
a dochází k lymfopenii (obr. 1A, B).
Neurologický obraz COVID 19
Neurologické komplikace COVID 19 jsou stále předmětem zkoumání. Mohou být důsledkem kardiorespiračního selhání a metabolických abnormalit spuštěných infekcí, přímou invazí viru do CNS (ojedinělý průkaz viru v likvoru pomocí PCR) nebo autoimunitní reakcí na virus.
Některé příznaky jako bolest hlavy a závratě jsou obecným jevem při virových onemocněních. Ke specifickým patří ztráta chuti a čichu, vzácněji jiné kraniální neuropatie. Vaskulární postižení CNS souvisí s hyperkoagulačním stavem provázeným arteriálními i venózními trombózami. Byly nalezeny antifosfolipidové protilátky, proto by měly být vyšetřeny u iktů pacientů mladších 50 let, u nichž se předpokládá autoimunitní podíl na cévní mozkové příhodě (CMP). Na endotelu mozkových cév je vyšší exprese receptorů ACE2, což značí predispozici k virem indukované vaskulitidě a CMP.
Soudí se, že vazba viru na receptor ACE2 rozvolňuje hematoencefalickou bariéru, což může být vysvětlením pro centrální neuropatie. Byly popsány případy Guillainova–Barréova syndromu, Millerova‒Fisherova syndromu, jeden případ encefalitidy s průkazem viru v likvoru a jeden případ transverzální myelitidy. Bolesti svalů a myozitida bývají součástí i dalších virových onemocnění, ale u COVID 19 byla popsána rhabdomyolýza, proto je nutné zejména u starších nemocných hlídat ledvinné funkce.
Jak se COVID 19 týká pacientů
s roztroušenou sklerózou?
Pacienti se obávají, zda jejich autoimunitní onemocnění nebo léky, které na ně užívají, je nepředurčují k horšímu průběhu COVID 19. U některých pacientů sledovaných ve Všeobecné fakultní nemocnici onemocnění probíhalo dvoufázově: v první fázi jako lehké nebo středně těžké onemocnění a v odstupu několika dnů po úzdravě se objevila pneumonie. „Vzhledem k tomu, že se u pacientů s RS snažíme brzdit aktivitu lymfocytů, musíme být velmi obezřetní a v managementu onemocnění COVID 19 i při očkování postupovat opatrně a individualizovaně,“ prohlásila profesorka Kubala Havrdová.
Dosavadní zkušenosti svědčí o tom, že více jsou ohroženi jedinci obézní, diabetici, lidé s hypertenzí, kardiovaskulárním onemocněním a starší jedinci s různými komorbiditami, ale kupodivu ne jedinci s imunodeficitem. Zatím se nejeví jako pravděpodobné, že by pacienti s RS nebo léčení pro RS byli náchylnější k infekci SARS CoV 2 nebo měli horší průběh onemocnění.
K 30. říjnu 2020 onemocnělo v České republice infekcí COVID 19 celkem 187 pacientů s RS: 20 ve stadiu klinicky izolovaného syndromu, 149 s relabující remitující RS, 11 se sekundárně progresivní RS (SP RS), sedm s primárně progresivní RS (PP RS) a čtyři s neuromyelitis optica spectrum disorder. Léčeni byli následujícími přípravky: 46 pacientů interferonem beta (IFNβ), 21 glatiramer acetátem, 16 natalizumabem, 24 fingolimodem, 17 dimetylfumarátem, 16 teriflunomidem, tři alemtuzumabem, 14 okrelizumabem, sedm kladribinem, jeden siponimodem, pět rituximabem a tři ponesimodem.
Celkem 12 pacientů bylo hospitalizováno, z toho dva léčení rituximabem, pět bez léčby, dva IFNβ, dva okrelizumabem a jeden teriflunomidem. U šesti pacientů byla nutná oxygenoterapie, neinvazivní ventilace byla použita u tří nemocných (jeden léčený IFNβ, dva bez léčby). Nebylo zapotřebí zavést invazivní ventilaci. Umístění na jednotku intenzivní péče si vyžádal stav dvou nemocných (jeden pacient s neuromyelitis optica léčený rituximabem, jeden pacient léčený azatioprinem v dávce 50 mg/den). K neurologickému zhoršení došlo u 23 pacientů, ataku v souvislosti s COVID 19 vyvinulo šest pacientů (dva léčení natalizumabem, dva IFNβ, jeden dimetylfumarátem a jeden glatiramer acetátem). Jediný pacient s neuromyelitis optica s velmi těžkým základním postižením a s komorbiditami zemřel. K datu prezentace (5. listopadu 2020) v ČR onemocnělo COVID 19 celkem 224 pacientů s RS.
Vliv léků pro RS na vnímavost
k infekci a na průběh onemocnění
Interferon beta. V roce 1957 byl objeven antivirový efekt IFNβ a k léčbě RS byl použit pro hypotézu redukce atak vznikajících po virózách, což mělo omezit i četnost atak. Původně se aplikoval intratekálně. V současnosti je zkoušen v Hongkongu spolu s remdesivirem. U pacientů léčených IFNβ není četnost infekce zvýšena, a dokonce se zdá, že lék chrání před těžším průběhem COVID 19 (jako všechny interferony I).
Koronaviry potlačují interferonovou odpověď interferencí s receptory pro regulaci imunitní odpovědi (pattern recognition receptors, PRRs) nebo se signální dráhou.
U 10 % pacientů s těžkým průběhem COVID 19 byla identifikována tvorba protilátek proti IFNα. V populaci mají asi 0,03 % lidí protilátky proti IFNα. Zatím se neví, zda byly tyto protilátky přítomny již před infekcí. U pacientů s těžkým průběhem COVID 19 byla také identifikována vrozená porucha signální dráhy pro odpověď na interferony I. Ta je charakterizována nulovou produkcí IFNβ a nízkou produkcí IFNα, což umožňuje průnik viru do buněk, jejich replikaci, a tím zvýšení virové nálože, po němž následuje zvýšení produkce TNFα, IL 6 a rozvoj zánětu s aktivací nukleárního faktoru kappa B (NFκB). „Existuje tedy vícero cest, jak mohou koronaviry poškozovat odpověď přirozené imunity,“ komentovala profesorka Kubala Havrdová.
Glatiramer acetát. Lék byl vytvořen jako laboratorní antigen pro vyvolání experimentální autoimunitní encefalitidy použitím čtyř aminokyselin, které jsou v myelinovém bazickém proteinu nejčastější, a posléze bylo zjištěno, že není encefalitogenní. Pak se zkoušel u akutní diseminované encefalomyelitidy a později následovala klinická studie u RS, u níž vyvolává switch z Th1 na Th2 lymfocytární odpověď. Na celkový stav imunity nemá žádný vliv.
Teriflunomid. Selektivní inhibicí dihydroorotát dehydrogenázy (DHODH) vede k cytostáze T a B lymfocytů. DHODH je klíčový mitochondriální enzym potřebný pro syntézu pyrimidinů de novo, což je podmínka pro rychlé dělení lymfocytů. Virová replikace vyžaduje hostitelské zdroje, aby mohl být vytvářen virový protein a replikován virový (DNA/RNA) genom. Teriflunomid vede k zastavení G1/S fáze, což brání virové replikaci. Bylo prokázáno snížení virové nálože i u dalších virů (HSC1, BKV, CMV) [12]. To znamená, že užívání teriflunomidu může být výhodou.
Dimetylfumarát. Zdá se, že redukuje virovou replikaci a zánět, takže nezvyšuje nebezpečí těžkého průběhu COVID 19. K těžké lymfopenii dochází vzácně, stejně tak jako k oportunním infekcím (progresivní multifokální leukoencefalopatie, PML). Počet infekcí zvyšuje jen minimálně. Naopak snižuje tvorbu prozánětlivých cytokinů, omezuje tedy riziko cytokinové bouře. Dimetylfumarát vede ke zmírnění zánětu cestou nukleárního faktoru NRF2 a potlačením cesty NFκB. NRF2 snižuje tvorbu IL 1, což je jeden z významných cytokinů cytokinové bouře. Ukázalo se také bez souvislosti s dimetylfumarátem, že antioxidační cesta přes NRF2 je v plicích pacientů s COVID 19 suprimována [13,14].
Modulátory sfingosin 1 fosfátových (S1P) receptorů. V tomto případě je lymfopenie mechanismem účinku. Obecně jsou u léčených pacientů častější infekce dolních dýchacích cest, herpetické infekce; vzácně hrozí nebezpečná PML. Přes očekávání nezvyšují nebezpečí rizika horšího průběhu COVID 19, ale naopak jsou zkoušeny k zabránění vzniku cytokinové bouře. Profesorka Kubala Havrdová doporučuje, aby nebyly vysazovány kvůli hrozícímu rebound fenoménu, zejména při lehčím a středně těžkém průběhu COVID 19. Léčba by měla být zahájena za přísných podmínek dodržení protiepidemických opatření a zvážení rizika nákazy koronavirem v porovnání s rizikem vysoké aktivity RS a s ohledem na lokální a rodinnou epidemiologickou situaci [15].
Natalizumab. Koronavirus může pro vstup do buňky použít i adhezní molekuly – integriny. Natalizumab je monoklonální protilátka proti integrinům, která celkový stav imunitního systému neovlivňuje, ale má vliv na bariérové funkce. Nezhoršuje průběh COVID 19. Přerušení léčby natalizumabem může vést k rebound fenoménu. Je doporučeno prodloužení intervalu mezi infuzemi (extended interval dosing [EID], 5–6 týdnů) i proto, aby byla umožněna clearance viru z CNS. Mezinárodní doporučení radí použít natalizumab i tam, kde se počítalo se zahájením léčby jinými léky pro RS s vyšší aktivitou (neřeší však další průběh léčby v případě pozitivity na John Cunningham virus) [16].
Protilátky anti CD20. Likvidací B lymfocytů v cirkulaci snižují protilátkovou odpověď, včetně odpovědi na očkování. Protilátková odpověď však není podstatná pro průběh onemocnění COVID 19, může být známkou toho, že došlo k setkání s antigenem, není trvalá a nezajišťuje dlouhodobou ochranu proti infekci koronavirem; pravděpodobně mizí v rozmezí 3–6 měsíců. U léčených pacientů jsou infekce četnější, vzácně však jsou těžší. Zkušenosti s COVID 19 u léčených pacientů (z registrů) svědčí spíše pro těžší průběh, nutné je však sledovat demografické údaje: většinou jde o starší pacienty v progresivní fázi RS (PP RS u okrelizumabu, SP RS a neuromyelitis optica u rituximabu) a o pacienty s těžší invaliditou. Věk a vysoká hodnota na škále Expanded Disability Status Scale (EDSS) jsou u RS hlavními prediktory horšího průběhu a nejhorší průběh je u neléčených nemocných s RS (většinou v sekundární progresi).
Zahájení terapie je možné za důsledných dodržení protiepidemických opatření a s ohledem na místní epidemiologickou situaci [17,18].
Data z francouzského registru [19], která byla taktéž prezentována na kongresu European Committee for Treatment and Research in Multiple Sclerosis (ECTRIMS), potvrzují výše uvedená tvrzení. Pravděpodobnost hospitalizace je vyšší u pacientů starších 50 let a s hodnotou EDSS vyšší než 5. Taktéž neléčení pacienti mají horší prognózu, stejně jako pacienti s komorbiditami. Všichni léčení pacienti mají nižší riziko těžkého průběhu a nejlépe na tom jsou léčení interferony a glatiramer acetátem, což jsou nemocní s nižší aktivitou RS.
Kladribin. Zatím nejsou dostatečná data, ale pravděpodobně podání kladribinu nezhoršuje průběh COVID 19. Zahájení léčby a podání druhého pulzu je vhodné naplánovat podle místní epidemiologické situace, druhou aplikaci lze v případě nutnosti oddálit. Je nutné sledovat počet lymfocytů. V prvním měsíci po podání kladribinu je vhodné pacienta izolovat.
Alemtuzumab. Zde platí podobná pravidla jako v případě kladribinu, jen je nutné vzít na vědomí, že úbytek T i B lymfocytů je výrazný a že tomu je nutné uzpůsobit režim a monitoraci pacienta. Lépe je pacienta déle izolovat a termíny farmakovigilančních vyšetření rozvolnit, aby pacient nemusel často cestovat. Léčba by měla být zahájena, hrozí li rychlá progrese RS. Pacient musí být o nežádoucích účincích dobře poučen!
Cytostatika a transplantace kostní dřeně. Nejsou dostatečné informace a jejich použití není doporučeno v době pandemie COVID 19.
Kortikoidy. Po vysokodávkovaných kortikoidech může být průběh COVID 19 horší. V léčbě relapsu je nutné nejprve vyloučit pseudorelaps a zároveň zvážit význam omezení aktivity RS, která ohrožuje pacienty ztrátou mozkové tkáně. Doporučuje se před podáním kortikoidů provést test na SARS CoV 2. Perorální aplikace by měla mít přednost pro možnost ponechání pacienta v izolaci (alespoň dva týdny) a jeho stav se doporučuje sledovat telemedicínsky (podle mezinárodních doporučení) [20].
Odpovědnost pacientů
„Je li pacient nepřítelem roušek, pak riskuje vážnou infekci a zhoršení zdravotního stavu,“ zdůraznila profesorka Kubala Havrdová. Ochrana dýchacích cest je prioritou stejně jako mytí rukou a dezinfekce, udržování odstupu od dalších osob. Při zdravotních potížích je nutné zůstat doma a necestovat. Přínos vitaminů C a D v prevenci viróz je dostatečně prokázán. Konzultace s lékaři by měla probíhat na dálku, telefonicky nebo přes aplikace, které umožňují videohovor. Avšak při relapsu je návštěva neurologa nezbytná. Pacient by měl sledovat výskyt nežádoucích účinků a hlásit je ošetřujícímu lékaři.
„U očkování proti COVID 19 čekáme na další bezpečnostní data a zatím vyčkáváme se stanoviskem, zda je pacientům s RS doporučit. Víme, že se po očkování vyskytla transverzální myelitida, což nás nabádá k opatrnosti,“ upozornila profesorka Kubala Havrdová.
Závěr
Závěrem profesorka Kubala Havrdová shrnula, že SARS CoV 2 je stále záhadou. Vakcínu zatím (v době konání akce – pozn. red.) nemáme k dispozici a, bohužel, ani dostatek bezpečnostních dat. Populace pacientů s RS není více ohrožena COVID 19, ale je namístě opatrnost, racionální zvažování terapie a vedení pacientů k odpovědnému chování. Zatím není jasné, jak se bude SARS CoV 2 chovat v budoucnosti. Dosud mutace neovlivňují jeho schopnost se šířit ani měnit průběh onemocnění.
Redakčně zpracovala MUDr. Marta Šimůnková
Seznam použité literatury
- [1] https://iweb3.fnusa.cz/laboratore‑icrc‑testuji‑bunecnou‑imunitu‑proti‑nemoci‑covid‑19/
- [2] Faust JS, Del Rio C. Assessment of Death From COVID‑19 and From Seasonal Influenza. JAMA Intern Med 2020; 180: 1045‒1046.
- [3] van Doremalen N, Morris DH, Holbrook MG, et al. Aerosol and Surface Stability of SARS‑CoV‑2 as Compared with SARS‑CoV‑1. N Engl J Med 2020; 382: 16.
- [4] Wiersinga WJ, Rhodes A, Cheng AC, et al. Pathophysiology, Transmission, Diagnosis, and Treatment of Coronavirus Disease 2019 (COVID‑19): A Review. JAMA 2020; 324: 782‒793.
- [5] Bunyavanich S, Do A, Vicencio A. Nasal Gene Expression of Angiotensin‑Converting Enzyme 2 in Children and Adulst. JAMA 2020; 323: 2427‒2429.
- [6] Ehrenfeld M, Tincani A, Andreoli L, et al. COVID‑19 and autoimmunity. Autoimmun Rev 2020; 19: 102597.
- [7] Tavakolpour S, Rakhshandehroo T. Lymphopenia during the COVID‑19 infection: What it shows and what can be learned. Immunol Lett 2020; 225: 31‒32.
- [8] Kuppalli K, Rasmussen AL. A glimpse into the eye of the COVID‑19 cytokine storm. EBioMedicine 2020; 5: 102789.
- [9] Fathi N, Rezaei N. Lymphopenia in COVID‑19: Therapeutic opportunities. Cell Biol Int 2020; 44: 1792–1797.
- [10] Jamilloux Y, Henry T, Belot A, et al. Should we stimulate or suppress immune responses in COVID‑19? Cytokine and anti‑cytokine interventions. Autoimm Rev 2020; 19: 201567.
- [11] Hadjadj J, Yatim N, Barnabei L, et al. Impaired type I interferon activity and inflammatory responses in severe COVID‑19 patients. Science 2020; 369: 718‒724.
- [12] Edwards KR, Turner TJ, Able RA Jr, Mandel M. Potential Antiviral Properties of Teriflunomide: A Consideration for Optimizing MS Treatment Sequencing. ACTRIMS 2017; P047.
- [13] Mantero V, Abate L, Basilico P, et al. COVID‑19 in dimethyl fumarate‑treated patients with multiple sclerosis. J Neurol 2020; 25: 1‒3.
- [14] Olagnier D, Farahani E, Thyrsted J, et al. SARS‑CoV2‑mediated suppression of NRF2‑signaling reveals potent antiviral and anti‑inflammatory activity of 4‑octyl‑itaconate and dimethyl fumarate. Nat Commun 2020; 11: 4938.
- [15] Barzegar M, Mirmosayyeb O, Nehzat N, et al. COVID‑19 infection in a patient with multiple sclerosis treated with fingolimod. Neurol Neuroimunol Neuroinflamm 2020; 7: e753.
- [16] Aguirre C, Meca‑Lallana V, Barrios‑Blandino A, et al. COVID‑19 infection in a patient with multiple sclerosis treated with natalizumab. May the blockade of integrins have a protective role? Mult Scler Relat Disord 2020; 44: 102250.
- [17] Meca‑Lallana V, Aguirre C, Río B, et al. COVID‑19 in 7 multiple sclerosis patients in treatment with anti‑CD20 therapies. Mult Scler Relat Disord 2020; 44: 102306.
- [18] Sormani MP, and Italian Study Group on COVID‑19 infection in multiple sclerosis. An Italian programme for COVID‑19 infection in multiple sclerosis. Lancet Neurol 2020; 19: 481‒482.
- [19] Louapre C, Collongues N, Stankoff B, et al. Clinical Characteristics and Outcomes in Patients With Coronavirus Disease 2019 and Multiple Sclerosis. JAMA Neurol 2020; 77: 1079‒1088.
- [20] Segamarchi C, Silva B, Saidon P, et al. Would it be recommended treating multiple sclerosis relapses with high dose oral instead intravenous steroids during the COVID‑19 pandemic? Yes. Mult Scler Rel Dis 2020; 46: 102449.