Sekundárně progresivní roztroušená skleróza – fenotyp RS
Roztroušená skleróza (RS) je závažné progresivní neurologické onemocnění. Charakterizuje ji zánět centrální nervové soustavy, postupná demyelinizace a neurodegenerace. Včasná léčba je pro prognózu nemocného zásadní. Ovlivňuje míru postižení, soběstačnost pacienta a kvalitu jeho života.
Fenotypy roztroušené sklerózy
U malé části nemocných (zhruba 5–15 %) probíhá onemocnění ve formě progresivního zhoršování klinického stavu bez výskytu relapsů a období remise od počátku nemoci, zde mluvíme o primárně progresivní RS.
O RS se ale obvykle hovoří jako
o dvoufázovém onemocnění. U většiny pacientů se
onemocnění v počátku projevuje jako tzv.
relabující remitující RS (RR RS), onemocnění probíhá
v podobě atak (relapsů) následovaných obdobím remise, kdy
se pacient zcela nebo částečně zotaví. V tomto období je
pacient stabilní, délka remise je individuální, k dalšímu
relapsu může dojít za půl roku nebo za 15 let.
V posledních letech bylo dosaženo znatelného pokroku
v možnostech léčby RR RS a ovlivnění průběhu
nemoci. Výrazně se při včasné léčbě snížilo riziko rychlé
progrese disability [1].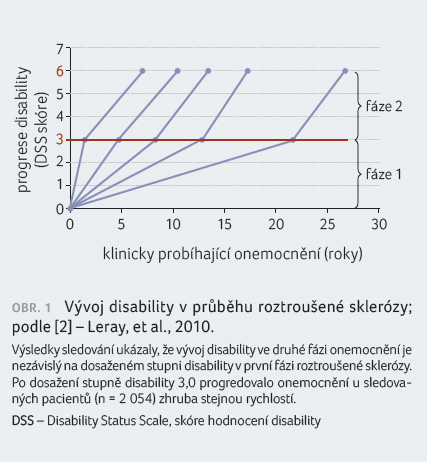
Zhoršování klinického stavu probíhá tedy individuální rychlostí a závisí rovněž na podané léčbě. Po fázi RR RS dojde po určité době k přechodu do sekundárně progresivní fáze (SP RS). Progrese nemoci je zapříčiněna ireverzibilním nárůstem neurologické disability, která je asociovaná s neurodegenerací a s akcelerovnou atrofií nervové tkáně.
Dříve se mělo za to, že
jakmile nemocní dosáhnou konverze do SP RS, je rychlost
progrese nemoci u všech téměř stejná (obr. 1) [2]. Nicméně pozdější analýzy [3] ukázaly, že
i v sekundárně progresivní fázi lze vysledovat rozdíly
ve zhoršování disability, které je možné léčbou ovlivnit
(obr. 2).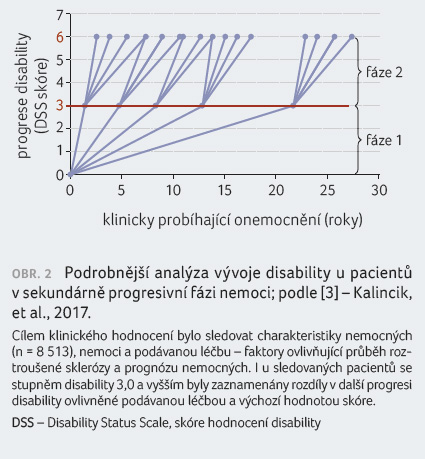
Progrese onemocnění
Pro definici podtypu RS je obvykle zásadní počáteční období. Na určení fenotypu nemoci (klinicky izolovaný syndrom, relabující remitující forma, primárně a sekundárně progresivní forma) jsou navázána úhradová kritéria pro léčbu. Průběh nemoci a její fenotyp je nutné průběžně revidovat. Onemocnění neprobíhá po celou dobu stejně, postupem času se mění charakter zánětu a převládající děje. Převažující zánět postupně přechází do neurodegenerativní fáze, nicméně jednotlivé pochody probíhají vedle sebe, liší se zejména kvantitou [4].
Dnes již víme, že k patologickým pochodům dochází ještě dříve, než je možné je klinicky zachytit [5]. Bylo doloženo, že progrese začíná již od počátku onemocnění a postupuje pomalu, bez závislosti na klinických relapsech (tzv. tichá progrese) [6]. Vydělení fenotypů nemoci je potřebné z hlediska komunikace, odhadu prognózy a rozhodnutí o léčbě. Zkoumání patofyziologických mechanismů odhaluje prolínání jednotlivých pochodů a ukazuje na nemožnost jednoznačného oddělení jednotlivých fází RS. Na pacienta je nutné pohlížet vždy individuálně a tak volit i léčbu.
Sekundárně progresivní fáze nemoci
Dosud neexistují jasná klinická, zobrazovací, imunologická nebo patologická kritéria pro určení bodu přechodu, kdy RR RS přechází ve fázi SP RS; přechod je obvykle postupný. Sekundárně progresivní RS bývá často diagnostikována retrospektivně anamnézou postupného zhoršování po počátečním průběhu relabujícího onemocnění, s akutními exacerbacemi anebo bez akutních exacerbací během progresivního průběhu.
Pro sekundárně progresivní formu RS existuje řada definic. Definice z roku 2003 [7] klasifikuje SP RS jako trvalou progresi nemoci s příležitostnými relapsy nebo bez nich, s částečnou remisí, plató fází, která následuje po období jasně definované relabující remitující fáze. Mezi relapsy je patrná trvalá progrese disability.
Detailní definice [8] vzniklá na podkladě studie MSBase ve snaze objektivizovat kritéria (nyní nazývaná také Lorscheiderova) definuje SP RS u pacienta s EDSS (Expanded Disability Status Scale, rozšířená stupnice stavu invalidity) minimálně 4,0, s progresí disability o 1 stupeň EDSS u pacientů s EDSS ≤ 5,5 (o 0,5 stupně EDSS u pacientů s EDSS ≥ 6) bez přítomnosti relapsu, s přítomným pyramidovým funkčním systémem alespoň stupně 2 a s potvrzenou progresí za tři měsíce. I tato klasifikace má své limitace, je vhodná zejména pro klinická hodnocení, pro běžnou klinickou praxi méně.
Pro neurologickou praxi je důležitý
nyní uplatňovaný princip aktivity a progrese (obr. 3) [9]. Sekundárně progresivní RS může být
charakterizována v různých časových bodech buď jako
aktivní (s relapsy a/nebo důkazy o nové aktivitě
zaznamenané pomocí MRI), nebo neaktivní, stejně jako s progresí
(důkaz zhoršení nemoci podle objektivní míry změny v čase,
s relapsy nebo bez relapsů) nebo bez progrese.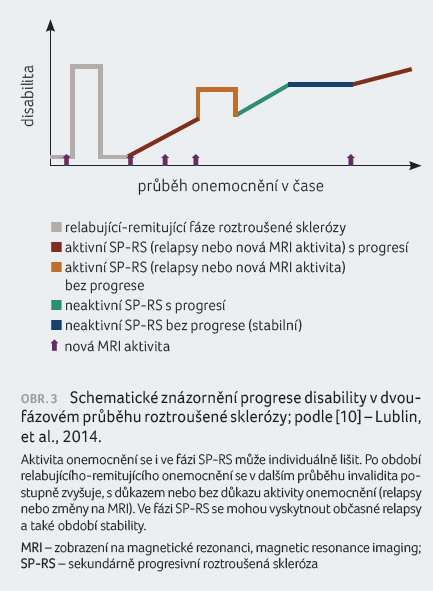
Doklady o aktivitě onemocnění a klinické progresi odrážejí probíhající zánětlivé nebo neurodegenerativní procesy [10], mohou mít dopad na prognózu a terapeutická rozhodnutí.
Pokroky v léčbě RR RS posouvají fázi přechodu do SP RS do pozdějšího období. Významná variabilita mezi pacienty v trvání a intenzitě symptomů RR RS komplikuje včasnou diagnostiku a management léčby u SP RS [11]. Mezi rizikové faktory spojené s dřívějším přechodem do SP RS patří neúplné zotavení z první ataky RS, vysoký výskyt relapsů, multifokální klinické projevy relapsů, přítomnost lézí v mozkovém kmeni a/nebo infratentoriálně, dále rychlá atrofie mozku, kouření nebo nízké sérové koncentrace vitaminu D.
Odlišná patogeneze
Patologie RR RS a SP RS se liší. Zánět je v počáteční fázi fokální, s perivaskulárními ložisky a s tvorbou nových plaků [12,13]. V průběhu nemoci se charakter mění na difuzní zánět s větší mírou postižení bílé hmoty. Dochází k extenzivní demyelinizaci, již existující léze se pozvolna rozšiřují. Zánětlivé buňky podněcují v zánětlivém procesu další. Oproti časné fázi RS, kdy je porušena hematoencefalická bariéra a aktivované T a B lymfocyty a myeloidní buňky migrují z periferní krve do centrálního kompartmentu, dochází u progresivní fáze k uzavření zánětu za hematoencefalickou bariérou a možnosti ovlivnění jsou omezené.
U imunitních dějů [14] dominují v počáteční fázi nemoci mechanismy adaptivní imunity (T a B buňky) a ovlivnění imunopatogeneze je významné. Postupem času převládají složky přirozené imunity (mikroglie, monocyty, dendritické buňky).
Patogenetické mechanismy v sekundárně progresivní fázi nemoci jsou méně prozkoumány, pozornost byla soustředěna hlavně na RR RS a možnosti léčebného ovlivnění.
Přechod do sekundárně progresivní fáze
Zachytit přechod do SP RS je v klinické praxi velmi obtížné [15]. Neexistuje jednoznačné ohraničení (obr. 4), přechod je postupný, onemocnění mezi pacienty je značně heterogenní, nemáme dosud k dispozici validované biomarkery či diagnostické nástroje. Pro definování přechodu do SP RS v praxi je velmi důležitý kontakt s pacientem, jeho znalost a pečlivé sledování pacienta. Progresivní onemocnění může být velice různorodé, individuální je i vnímání nemoci pacientem.
Je třeba si všímat změn, které
vnímá pacient, kontakt lékaře s nemocným je časově
omezen, probíhá v určitých intervalech, objektivní změny
(zhoršení EDSS, progrese na MRI, funkční testy) nemusejí
zcela zachytit drobné změny v čase, které pacient pociťuje.
Bývají pak často identifikovány až retrospektivně po diagnóze
SP RS [11].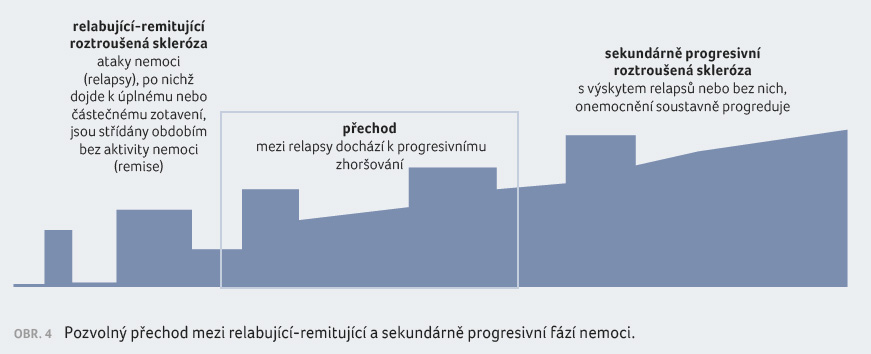
Příčin opožděného stanovení diagnózy SP RS je řada. Často se také nemocní zdráhají udat změnu symptomů ze strachu z progrese [11]. Diagnóza SP RS znamená i změnu v dostupném léčebném armamentariu a možnostech podávání léčby modifikující chorobu.
Výhledy
Roztroušená skleróza představuje vedoucí příčinu netraumatické disability jedinců ve věku 20–50 let [11]. Navzdory vysoké globální prevalenci zůstává její diagnóza a management v některých případech dosud výzvou. Většina doposud schválené léčby je zaměřena na devastující zánět, cílí na časné relapsy a prevenci progrese disability u RR RS. V léčbě SP RS je třeba podchytit také demyelinizaci a neurodegeneraci [16].
Redakčně zpracovala PharmDr. Kateřina
Viktorová
Seznam použité literatury
- [1] Capra R, Cordioli C, Rasia S, et al. Assessing long‑term prognosis improvement as a consequence of treatment pattern changes in MS. Mult Scler 2017; 23: 1757–1761.
- [2] Leray E. Yaouanq J, Le Page E, et al. Evidence for a two‑stage disability progression in multiple sclerosis. Brain 2010; 133; 1900–1913.
- [3] Kalincik T, Manouchehrinia A, Sobisek L, et al. Towards personalized therapy for multiple sclerosis: prediction of individual treatment response. Brain 2017; 140: 2426–2443.
- [4] Correale J, Marrodan M, Ysrraelit MC. Mechanisms of Neurodegeneration and Axonal Dysfunction in Progressive Multiple Sclerosis. Biomedicines 2019; 7: doi: 10.3390/biomedicines7010014.
- [5] Novakova L, Axelsson M, Malmeström C, et al. Searching for neurodegeneration in multiple sclerosis at clinical onset: Diagnostic value of biomarkers. PLOS ONE 2018; 13: e0194828.
- [6] University of California, San Francisco MS‑EPIC Team, Cree BAC, Hollenbach JA, et al. Silent progression in disease activity‑free relapsing multiple sclerosis. Ann Neurol 2019; 85: 653–666.
- [7] Lublin FD, Reinholds. Clinical features and subtypes of multiple sclerosis. Chapter 2 in Multiple sclerosis 2. Blue Books of Practical Neurology 2003; 27: 13–20.
- [8] Lorscheider J, Buzzard K, Jokubaitis V, et al. Defining secondary progressive multiple sclerosis. Brain 2016; 139: 2395–2405.
- [9] Lublin FD. New multiple sclerosis phenotypic classification. Eur Neurol 2014;72(Suppl 1): 1–5.
- [10] Lublin FD, Reingold SC, Cohen JA, et al. Defining the clinical course of multiple sclerosis. Neurology 2014; 83: 278–286.
- [11] Oh J, Alikhani K, Bruno T, et al. Diagnosis and management of secondary‑progressive multiple sclerosis: time for change. Neurodegener Dis Manag 2019;9: doi: 10.2217/nmt‑2019‑0024.
- [12] Lassmann H, van Horssen J, Mahad D. Progressive multiple sclerosis: pathology and pathogenesis. Nat Rev Neurol 2012; 8: 647–656.
- [13] Lassmann H. Multiple Sclerosis Pathology. Cold Spring Harb Perspect Med 2018; 8: doi: 10.1101/cshperspect.a028936.
- [14] Weiner HL. The challenge of multiple sclerosis: how do we cure a chronic heterogeneous disease? Ann Neurol 2009; 65: 239–248.
- [15] Katz Sand I, Krieger S, Farrell C, Miller AE. Diagnostic uncertainty during the transition to secondary progressive multiple sclerosis. Mult Scler 2014; 20: 1654–1657.
- [16] Bhatia R, Singh N. Can We Treat Secondary Progressive Multiple Sclerosis Now? Ann Indian Acad Neurol 2019; 22: 131–136.