Sekundární imunodeficience indukované biologickou léčbou
Souhrn:
Šedivá A. Sekundární imunodeficience indukované biologickou léčbou. Remedia 2018; 28: 407–410.
Sekundární imunodeficience představují širokou škálu poruch imunity, které jsou vyvolány celou řadou příčin, z nichž zvláště v poslední době s nástupem biologické terapie vystupují sekundární protilátkové deficity navozené depleční terapií cílenou na B lymfocyty. Přehledný článek shrnuje příčiny a charakter sekundárních protilátkových deficiencí a věnuje se imunologické stránce diagnostiky a léčby těchto stavů.
Summary:
Sediva A. Secondary immunodeficiencies induced by biologic therapy. Remedia 2018; 28: 407–410.
Secondary immunodeficiency represents a wide range of immune disorders that are triggered by a number of causes. These disorders started to get attention particularly lately with the onset of biologic therapy, when particularly B cell depleting therapies lead to a significant secondary antibody deficiency in a subset of patients. The article summarizes the causes and nature of secondary antibody deficiencies and deals with the immunological aspects of diagnosis and treatment of these conditions.
Key words: secondary immunodeficiencies, B lymphocytes, immunoglobulins
ÚVOD
Pojem imunodeficience označuje v obecném smyslu poruchu imunitního systému. Takové poruchy se dělí na dvě základní kategorie podle jejich geneze, na primární vrozená geneticky podmíněná onemocnění a na sekundární imunodeficience nasedající na řadu možných základních příčin. Pole primárních imunodeficiencí se v současné době nachází v éře velkého rozmachu znalostí hlavně díky pokročilým metodám testování NGS (next generation sequencing), které odhalují nové genetické příčiny imunodeficiencí a tím mechanismy jejich vzniku. Problematika primárních imunodeficiencí je dobře pokryta ve světové i české literatuře [1,2].
Sekundární imunodeficience potom
představují daleko širší škálu stavů zasahujících imunitní
systém a vedoucích k následné poruše imunitních
funkcí, která nasedá na základní příčinu. Jejich rámcový
přehled je uveden v tabulce 1.
Literární odkazy v oblasti sekundárních imunodeficiencí
jsou ve srovnání s primárními roztříštěné,
většinou zaměřené na jednotlivé stavy, jako je
imunodeficit vzniklý v souvislosti s HIV infekcí.
Přehledem problematiky se do určité míry zabývají učebnice
a výukové odkazy [3].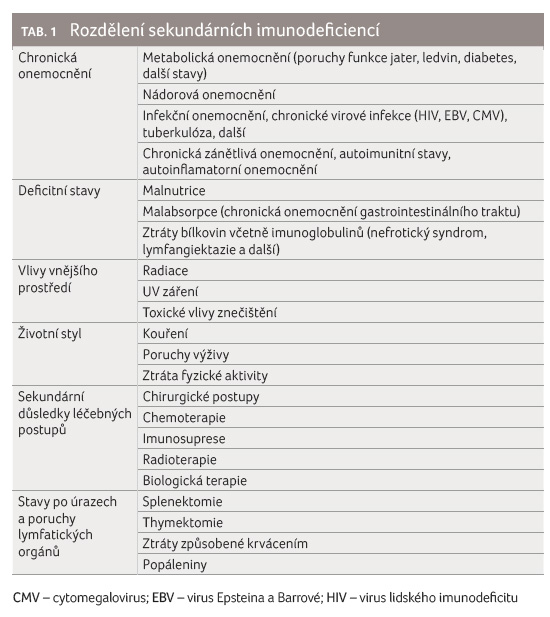
Základní přístup k sekundárním imunodeficiencím spočívá v diagnóze a léčbě základního onemocnění nebo v odstranění vlivu, který vede k imunodeficienci (viz tab. 1). Komplikující imunodeficience je většinou odhalena kombinací klinických projevů poruch imunity, hlavně ve formě infekčních komplikací, ale i různých forem dysregulace imunitního systému, a laboratorního vyšetření. Samotná porucha imunity se poté řeší podle výsledků laboratorních imunologických vyšetření a podle konkrétní situace a klinických problémů.
Určité aspekty sekundárních deficiencí jsou specifické a jsou předmětem samostatných oborů, jako je například již zmíněná imunodeficience v souvislosti s HIV infekcí nebo poruchy imunity v souvislosti s nádorovými onemocněními, které zvláště v poslední době přitahují velkou pozornost díky nastupující éře imunoterapie nádorů, ta potvrzuje klíčovou úlohu imunitního systému při kontrole nádorového onemocnění.
V tomto sdělení se budeme zabývat hlavně sekundárními imunodeficiencemi spojenými s biologickou terapií. Léčebné prostředky biologické terapie se ve významné míře objevují nově až v posledních letech a jejich účinky se stejně tak jako rizika a důsledky této léčby postupně začínají systematicky analyzovat. V souvislosti se sekundárně vzniklou imunodeficiencí na podkladě biologické terapie vystupují zvláště biologická léčiva cílící na B lymfocyty. U části pacientů se v těchto případech rozvíjí různý, i závažný, stupeň sekundární imunodeficience hlavně v oblasti protilátkové. V terapii takových stavů se potom uplatňuje substituce imunoglobulinů, pro kterou se postupně nastavují pravidla, jež nastíníme v závěru tohoto článku.
Sekundární imunodeficience vzniklé ve spojitosti s biologickou terapií
Biologické terapie představují velmi účinné moderní směry v terapeutických postupech. V souvislosti s imunitním systémem stojí biologické terapie ve velmi význačném postavení. Jednak principy vývoje a výroby biologických přípravků velmi často využívají mechanismy imunitního systému, a dále samy přípravky biologické terapie opět velmi často zasahují cíleně do patologických imunitních reakcí podmiňujících dané onemocnění. Biologické terapie fungují na principu velmi cíleného zásahu, nesetkáváme se u nich tedy s celkovou imunosupresí. Podle své povahy však vedou také k poruchám imunitních reakcí, které bývají velmi specifické pro daný typ přípravku. Mezi jejich nežádoucí účinky patří vnímavos
t k infekcím, často specifickým, odpovídajícím poruchám v drahách blokovaných danou biologickou terapií. Dalšími nežádoucími účinky bývají dysregulace imunity vyplývající z blokády cílové molekuly, autoimunity či nádory. Z hlediska sekundárních imunodeficiencí jsou nejdůležitější přípravky zasahující do funkce B lymfocytů a navozující sekundární protilátkové poruchy.
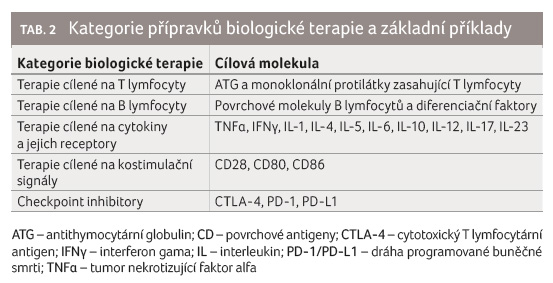
Základní přehled kategorií biologické terapie je uveden v tabulce 2, terapie cílené na B lymfocyty potom v tabulce 3.
Biologické terapie zaměřené na B lymfocyty
Buňky označované jako B lymfocyty
představují zásadní buňky imunitního systému, které vznikají
a procházejí vývojem v kostní dřeni a dále
v periferních lymfatických orgánech. Během tohoto vývoje
exprimují klíčové molekuly, které jsou rozhodující pro správný
vývoj B řady a které jsou využívány jako cíl biologické
terapie zaměřené na B lymfocyty (tab. 3). Hlavní funkcí B lymfocytů je zajištění tvorby
a sekrece širokého repertoáru protilátek. B lymfocyty se
však také uplatňují v patologii, a to především
u autoimunitních onemocnění, ale i u nádorových
onemocnění. Mechanismy patologické funkce jsou různorodé,
zahrnují produkci autoprotilátek, ale i poruchy prezentace
antigenu B lymfocyty a produkci cytokinů. B lymfocyty
mohou svými mechanismy působit prozánětlivě, ale rovněž
regulačně a protizánětlivě [4]. B lymfocyty dále
spolupracují s T lymfocyty v naprosto klíčových
stadiích imunitní odpovědi, ovlivňují také T regulační buňky
a všeobecně zasahují do komplexních procesů imunitní
odpovědi [5]. Protilátky samotné jsou rovněž zásadní pro
buněčné cytotoxické reakce závislé na protilátkách
(antibody dependent cell mediated cytotoxicity, ADCC).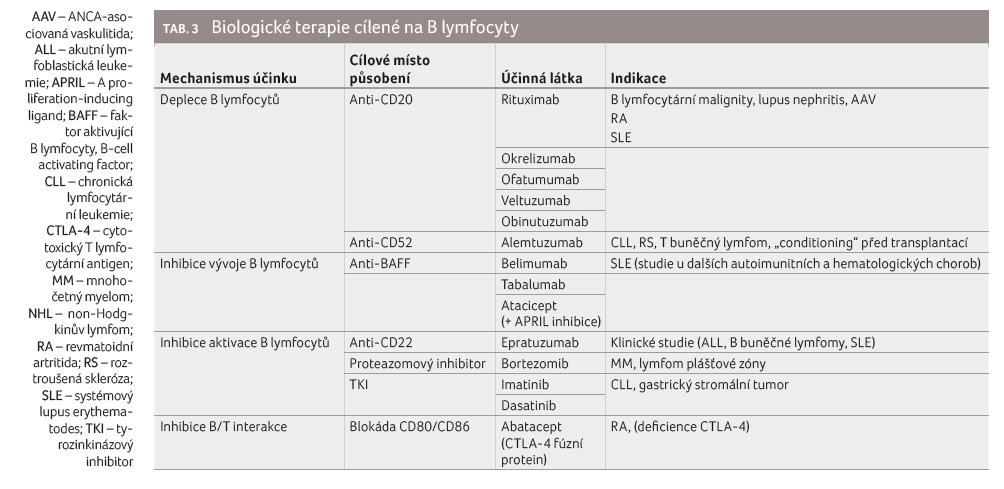
Biologické terapie cílené na jednotlivé pochody ve vývoji a funkci B lymfocytů tak dávají možnost velmi precizní indikace v daných onemocněních (viz dělení v tab. 3). Prvním a stále stěžejním přípravkem biologické terapie cílené na B buňky je rituximab, monoklonální protilátka proti CD20. Rituximab byl objeven v roce 1991 a poté byl používán v klinických studiích od roku 1993, což skýtá již dostatečně dlouhou historii k pozorování klinických a dalších účinků, včetně mapování sekundární imunodeficience navozené deplecí B lymfocytů [6].
Rituximab a jím navozené sekundární imunodeficience
Rituximab se používá v zavedených indikacích uvedených v souhrnné informaci o přípravku (SPC); mezi tyto indikace patří nehodgkinské lymfomy (NHL), chronická lymfocytární leukemie (CLL), revmatoidní artritida, granulomatóza s polyangiitidou a mikroskopická polyangiitida. Mechanismus účinku a počáteční zkušenosti vedly posléze k rozšíření použití rituximabu u širšího spektra hlavně autoimunitních onemocnění, která zahrnují systémový lupus erythematodes (SLE), Sjögrenův syndrom, vaskulitidy, dermatomyozitidy, spektrum autoimunitních neurologických onemocnění, autoimunitní endokrinopatie a další hematologická autoimunitní onemocnění, jako je idiopatická trombocytopenická purpura [5].
Rituximab patří mezi B depleční terapie, k depleci B lymfocytů v periferní krvi dochází u naprosté většiny pacientů [5]. Deplece B lymfocytů přetrvává v řádu měsíců až let, udávané časové údaje se vyznačují velkou individuální diverzitou mezi pacienty [7] (přehledná studie). Zajímavý je také posun k naivním formám B lymfocytů v populacích testovaných buněk po repopulaci v periferní krvi, což je v souladu s hypotézou deplece autoimunitních klonů B lymfocytů [7].
Deplece B lymfocytů po léčbě
rituximabem ale neodpovídá významnému snížení hodnot
imunoglobulinů všech izotypů, které je pozorováno u části,
ale ne u všech pacientů léčených rituximabem. Tyto hodnoty
byly sledovány ve vybraných studiích, řada publikovaných
prací překvapivě hodnoty imunoglobinů před terapií a po terapii
neuvádí. Publikovaná data shodně detekují podskupiny pacientů
predisponovaných k rozvoji hypogamaglobulinemie a porušené
specifické protilátkové odpovědi. Incidence hypogamaglobulinemie
se v literárních zdrojích velmi liší a pro rozdíly
daných studií hlavně ve velikosti kohort pacientů
a vybraného onemocnění jsou výsledky nesrovnatelné.
Počty pacientů s hypogamaglobulinemií po léčbě
rituximabem se pohybují kolem čtvrtiny jejich celkového počtu,
méně často jsou uváděna vyšší čísla blížící se až
téměř polovině počtu léčených pacientů. Z nich jen část
má klinicky významnou hypogamaglobulinemii provázenou významnými
infekčními komplikacemi a vyžaduje substituční terapii
imunoglobuliny. Retrospektivní analýzou dospívá většina studií
k závěru, že minimálně část těchto pacientů měla
klinické či laboratorní známky imunodeficience ještě před
zahájením B depleční terapie [7–9]. Zdá se tedy, že malá
část těchto pacientů má ve skutečnosti primární
imunodeficienci, nepoznanou a klinicky většinou provázenou
autoimunitními komplikacemi, které mohou dominovat klinickému
obrazu [5,8]. Další část pacientů s přetrvávající
deplecí B lymfocytů a s poruchou tvorby a funkce
protilátek má jasnou farmakologicky navozenou sekundární
imunodeficienci [10].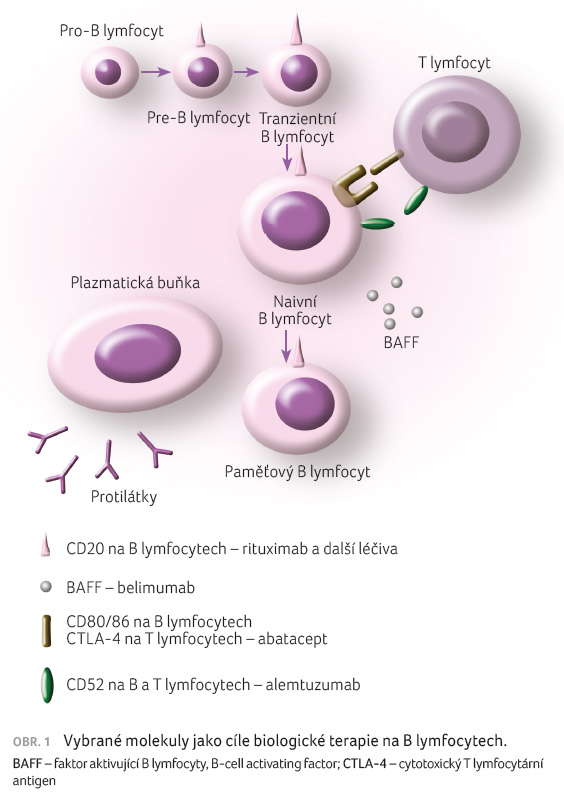
Terapie sekundární imunodeficience navozené B deplečními a dalšími biologickými terapiemi
V terapii uvedených stavů je indikována preventivní strategie spočívající v antibiotické profylaxi a u závažnějších potvrzených sekundárních imunodeficiencí substituční léčba imunoglobuliny. V současné době nejsou jednoznačná mezinárodní kritéria pro substituční léčbu imunoglobuliny u sekundárních imunodeficiencí s výjimkou klasických stavů, které jsou uváděny jako uznané situace pro terapii imunoglobuliny, jimiž jsou CLL a mnohočetný myelom. Tyto stavy jsou již uznány regulačními agenturami, substituce je u těchto pacientů indikována v přítomnosti hypogamaglobulinemie a klinických projevů významných infekcí [11].
Výše diskutované sekundární imunodeficience navozené biologickou terapií zatím nejsou oficiální součástí doporučených postupů, nicméně vzrůstající počty takto léčených pacientů a tím i rostoucí naléhavost řešit situace vzniklé u podskupiny těchto pacientů, u kterých se rozvine sekundární imunodeficience, vyžadují i v těchto případech řešení. Ve světové literatuře se tak tyto stavy postupně dostávají do seznamů indikované péče, extenzivní přehledný článek řešící tuto problematiku byl v loňském roce vydán v USA [12]. V České republice se postupně na základě klinických zkušeností ustanovuje konsenzus, který kopíruje literární podklady [11–14] a indikuje zahájení substituční imunoglobulinové terapie v případech, kdy je prokázána významná hypogamaglobulinemie spojená s infekčními komplikacemi a s poruchou specifické protilátkové odpovědi. Substituční léčba se potom řídí stejnými pravidly, která platí pro substituci v dalších indikacích.
I u sekundárních imunodeficiencí jsou k dispozici imunoglobulinové přípravky pro intravenózní či subkutánní použití. Volba vhodné eventuality se řídí základní diagnózou, tíží imunodeficience a tím i odpovídající dávky přípravku a zvážením celkové klinické i sociální situace daného pacienta. Léčba je vždy nastavena v intenzivní spolupráci s pacientem a jeho rodinou. Dávky se volí tak, aby bylo dosaženo účinných koncentrací IgG v pásmu věkové normy. U hluboké hypogamaglobulinemie potom je možné používat dávky doporučené pro závažné primární protilátkové deficity, které jsou 400–600 mg/kg/měsíc imunoglobulinového přípravku. Výjimečně jsou doporučeny i dávky vyšší. Dávkování je poté sledováno a upravováno podle monitorování koncentrací IgG a podle klinického stavu pacienta. Doba podávání se opětovně řídí individuálně. Pro velkou rozdílnost v základní diagnóze, ve formě terapie, která imunodeficienci nastolila, a v nutnosti ev. opakování B deplečních a dalších terapií není možné stanovit obecná striktní pravidla. V indikovaných případech je však již sekundární imunodeficience na podkladě indikačních kritérií nastavena a substituční podávání je nutné zpravidla na dlouhodobé bázi, v řádu měsíců a spíše let.
Závěrečná shrnutí klíčových bodů
- Sekundární imunodeficience jsou relativně častými stavy, které vedou k indikaci substituční terapie imunoglobuliny v případě průkazu významné hypogamaglobulinemie provázené infekčními komplikacemi a poruchou specifické protilátkové odpovědi.
- Sekundární imunodeficience navozené biologickou terapií, zvláště tou namířenou na depleci B lymfocytů, se laboratorně a klinicky projevují pouze u části těchto pacientů.
- Základní imunologické vyšetření před zahájením biologické terapie je indikováno k vyloučení možné primární imunodeficience, která se projeví v rámci dysregulace imunitního systému autoimunitním onemocněním, jež je podkladem pro započetí této biologické terapie.
- Terapie sekundární imunodeficience, zvláště navozené hypogamaglobulinemie, se provádí intravenózní či subkutánní substitucí imunoglobulinů za monitorování koncentrací IgG tak, aby tyto dosáhly referenčních hodnot a zároveň klinické účinnosti.
- V České republice je možno využít doporučení výboru ČSAKI (Česká společnost pro alergologii a klinickou imunologii) Návrh standardu imunoglobulinové léčby nemocných s protilátkovými imunodeficienciemi [15].
- Délka léčby je individuální a zpravidla probíhá na dlouhodobé bázi, v řádu měsíců a let.
Seznam použité literatury
- [1] Picard C, Al‑Herz W, Bousfiha A, et al. Primary Immunodeficiency Diseases: an Update on the Classification from the International Union of Immunological Societies Expert Committee for Primary Immunodeficiency 2015. J Clin Immunol 2015; 35: 696–726.
- [2] Šedivá A. Nové poznatky a pokroky v oblasti primárních imunodeficiencí. Postgraduální medicína 2015; 17: 294–303.
- [3] Bonilla FA. Secondary immunodeficiency due to underlying disease states, environmental exposures, and miscellaneous causes. UpToDate 2016, March 4. Dostupné na: https://aaaai.confex.com/aaaai/2016/…/Paper23258.html
- [4] Blüml S, McKeever K, Ettinger R, et al. B‑cell targeted therapeutics in clinical development. Arthritis Res Ther 2013; 15(Suppl 1): S4.
- [5] Sanz I. Indications of Rituximab in autoimmune diseases. Drug Discov Today Ther Strateg 2009; 6: 13–19.
- [6] Grillo‑Lopez AJ. Rituximab: an insiderʼs historical perspective. Semin Oncol 2000; 27(Suppl 12): 9–16.
- [7] Kaplan B, Kopyltsova Y, Khokhar A, et al. Rituximab and Immune Deficiency: Case Series and Review of the Literature. J Allergy Clin Immunol Pract 2014; 2: 594–600.
- [8] Van Vollenhoven RF, Fleischmann RM, Furst DE, et al. Longterm safety of rituximab: Final report of the rheumatoid arthritis global clinical trial program over 11 years. J Rheumatol 2015; 42: 1761–1766.
- [9] Casulo C, Maragulia J, Zelenetz AD. Incidence of hypogammaglobulinemia in patients receiving rituximab and the use of intravenous immunoglobulin for recurrent infections. Clin Lymphoma Myeloma Leuk 2013; 13: 106–111.
- [10] Makatsori M, Kiani‑Alikhan S, Manson AL, et al. Hypogammaglobulinaemia after rituximab treatment‑incidence and outcomes. QJM 2014; 107: 821–828.
- [11] Compagno N, Malipiero G, Cinetto F, Agostini C. Immunoglobulin replacement therapy in secondary hypogammaglobulinemia. Front Immunol 2014; 5: 626.
- [12] Perez EE, Orange JS, Bonilla F, et al. Update on the use of immunoglobulin in human disease: A review of evidence. J Allergy Clin Immunol 2017; 139: S1–S46.
- [13] Duraisingham SS, Buckland M, Dempster J, et al. Primary vs. secondary antibody deficiency: Clinical features and infection outcomes of immunoglobulin replacement. PLoS ONE 2014, 9 (6). Dostupné na: https://doi.org/10.1371/journal.pone.0100324
- [14] Roberts DM, Jones RB, Smith RM, et al. Immunoglobulin G replacement for the treatment of infective complications of rituximab‑associated hypogammaglobulinemia in autoimmune disease: A case series. J Autoimmun 2015; 57: 24–29.
- [15] Výbor ČSAKI. Návrh standardu imunoglobulinové léčby nemocných s protilátkovými imunodeficienciemi. Alergie 2016; 18: 29–30.