Sekundární osteoporóza a její terapie
Souhrn:
Článek podává přehled o příčinách a možnostech léčby sekundární osteoporózy. Hodnocení kostní denzity u pacientů se sekundární osteoporózou nepostačuje pro predikci rizika zlomenin. Anamnestická data a laboratorní vyšetření jsou nezbytná u všech pacientů. Léčebná opatření závisejí na příčině osteoporózy. První volbou je kauzální terapie základního onemocnění, která může zastavit úbytek a zhoršování kvality kostní hmoty a snížit riziko vzniku zlomenin. Metodou volby může být antiresorpční nebo osteoanabolická léčba.
Key words: osteoporosis – fracture – inflammation – glucocorticoids – hyperparathyroidism – aminobisphosphonates – denosumab – teriparatide.
Summary:
This review examines the clinical data available to date on etiology and treatments for secondary osteoporosis. The clinical value of bone mineral density as a predictor of fractures has not been established in secondary osteoporosis. History evaluation and laboratory testing should be considered in all patients. Treatment interventions may vary depending on the cause of bone loss. Treating the underlying disease is essential for successful outcome to reverse the bone loss and fracture risk. Antiresorptive or bone anabolic therapies may be effective in non-responders to the causal therapy.
Osteoporóza (OP) je charakterizována sníženou pevností kostí a zvýšeným rizikem zlomenin, přičemž pevnost kostí je výrazem zejména množství a kvality kostní hmoty. V České republice utrpí každý rok zlomeninu v oblasti kyčle 9 000–10 000 žen a téměř 4 000 mužů ve věku nad 50 let. Náklady na léčení zlomenin představují pro české zdravotnictví nemalý finanční výdaj (například v roce 2010 náklady činily kolem 5,5 miliardy Kč). Tím není vyčíslena ztracená kvalita života pacientů.
Cílem léčby OP je udržet nebo zlepšit množství a kvalitu kostní hmoty, snížit riziko zlomenin, a tím zachovat nebo zlepšit kvalitu života. K většině zlomenin dochází u lidí, kteří nemají denzitometricky prokazatelnou OP. Stanovení klinické diagnózy OP a její léčby je podmíněno nejen vyloučením jiných metabolických a nádorových onemocnění skeletu, ale zejména diferenciální diagnostikou idiopatické, involuční, postmenopauzální a sekundární OP. Pokud je u pacientů s nízkým objemem kostní hmoty prokázána některá z příčin sekundární OP, je nutné včas léčit tuto základní příčinu úbytku kostní hmoty. Antiosteoporotické léky registrované na základě klinických studií u žen s postmenopauzální OP nemají být (s výjimkou terapie glukokortikoidy indukované OP teriparatidem) pilířem léčby sekundární OP. Zejména aminobisfosfonáty nemusejí mít u pacientů se sekundární OP očekávaný účinek a je třeba je indikovat opatrně.
Pod pojem primární osteoporózy patří jednak involuční OP (úbytek kostní hmoty a zhoršování její kvality jako průvodní jev stárnutí), jednak idiopatická OP, k níž se řadí monogenní poruchy (osteogenesis imperfecta, Marfanův syndrom, hypofosfatasemie, osteoporosis pseudoglioma syndrom) a projevy polymorfismů genů (pro kolagen typu I, aromatázu, IGF‑I, receptor pro vitamin D, estradiol) [1]. Jako primární se také většinou označuje postmenopauzální OP, pokud není přidružena jiná příčina úbytku kostní hmoty. Příčina i léčení postmenopauzální OP jsou dobře známé a toto onemocnění při deficienci estrogenů (u žen po menopauze i u mužů) lze z tohoto hlediska klasifikovat i jako OP sekundární.
Jako sekundární osteoporóza se označuje snížení pevnosti kostí spojené se zvýšeným rizikem vzniku zlomenin navozené onemocněním nebo medikací (tab. 1). Sekundární příčiny OP jsou méně časté, obvykle dochází ke vzniku primární OP, ale účinné kauzální léčení vyvolávající příčiny postačuje ke snížení rizika vzniku zlomenin. Sekundární příčiny je třeba hledat zejména u pacientů s velmi nízkou hodnotou kostní denzity (bone mineral density, BMD) a u pacientů se zlomeninami, ale bez tradičně uváděných rizikových faktorů zlomenin. Mimořádně významnými, ale v klinické praxi zanedbávanými sekundárními faktory zhoršování kvality kosti jsou subklinický chronický zánět, subklinický hyperkortisolismus, sekundární hyperparatyreóza při deficienci vitaminu D a ztráta svalové hmoty (sarkopenie) (obr. 1). Tyto čtyři faktory jsou často dlouhodobě asociovány s involuční OP.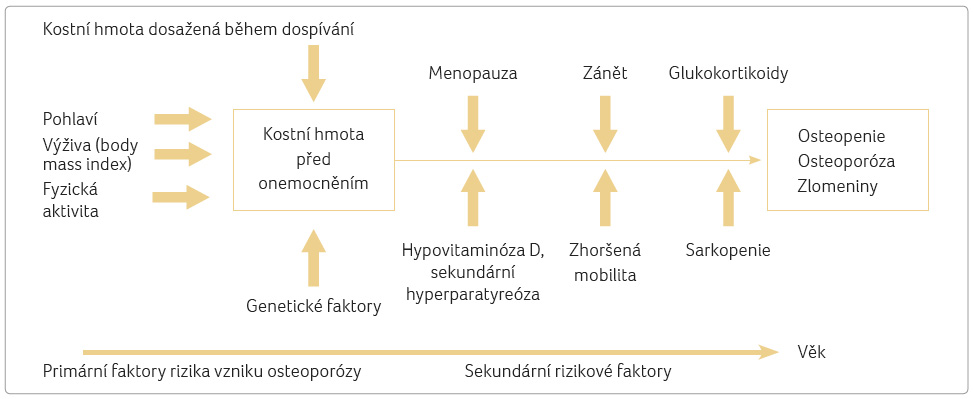
Klinicky manifestní sekundární příčiny úbytku kostní hmoty (tab. 1) jsou zjištěny u třetiny žen po menopauze a u 50‒80 % mužů s OP. Stanovení diagnózy sekundární OP vyžaduje pečlivou anamnézu a fyzikální a laboratorní vyšetření. Stupeň úbytku kostního minerálu se hodnotí dvouenergiovou rentgenovou absorpciometrií (DXA) bederní páteře a kyčle. Uvedené vyšetření měří plošnou denzitu kostního minerálu, nikoliv však množství nebo kvalitu kostní hmoty. Výsledek denzitometrie nevypovídá o příčině snížení BMD. Rozhodování o nutnosti terapie OP má proto vycházet z hodnocení pravděpodobnosti zlomeniny, kdy se kromě výsledku DXA zvažují validované klinické faktory rizik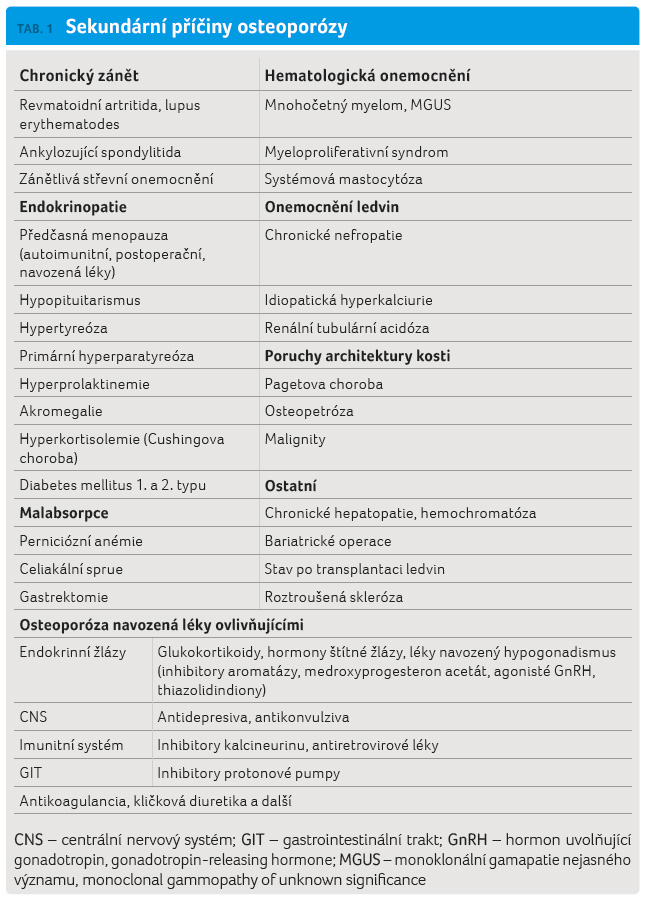 a fraktur. Potřebným nástrojem je elektronicky dostupný kalkulátor rizika zlomenin ‒ FRAX (http://www.shef.ac.uk/FRAX/tool.jsp?country=39). Riziko vzniku osteoporotických zlomenin však také závisí na rychlosti úbytku kostní hmoty, tedy na schopnosti kostních buněk kompenzovat nadměrnou osteoresorpci a ztracenou kost obnovovat. Pro klinické posouzení stupně osteoklastické osteoresorpce je doporučeno stanovení sérové koncentrace C‑terminálního telopeptidu kolagenu typu I (βCTX), markeru degradace kolagenu typu I. Pro hodnocení stupně novotvorby kostní organické matrix je doporučeno stanovení koncentrace N‑terminálního propeptidu kolagenu typu I (PINP), markeru syntézy kolagenu typu I. Tyto markery jsou také vhodné pro monitorování účinnosti antiosteoporotické terapie. K základním laboratorním vyšetřením krve dále patří krevní obraz, stanovení hodnoty vysoce senzitivního C‑reaktivního proteinu (hsCRP), kreatininu, tyreotropního hormonu (TSH), glukózy, vápníku, fosforu, kostní alkalické fosfatázy, 25‑hydroxyvitaminu D a parathormonu (PTH). V indikovaných situacích je vhodné tato vyšetření doplnit elektroforézou sérových bílkovin a stanovením hodnoty endomysiálních protilátek, kortisolu, ferritinu, testosteronu, 1,25‑dihydroxyvitaminu D nebo fibroblastového růstového faktoru (FGF) 23. Samotné zjištění zlomeniny ani žádné z uvedených vyšetření (DXA, FRAX, laboratorní testy) však samo o sobě klinickou diagnózu OP nestanovuje. Osteologické klinické, laboratorní a radiologické vyšetření je nezbytné u všech pacientů s nově prokázanou nízkou BMD nebo s nízkotraumatickou zlomeninou a u pacientů s onemocněním, které je spojeno se zhoršením kvality kostní hmoty a se zvýšeným rizikem vzniku nízkotraumatických zlomenin.
a fraktur. Potřebným nástrojem je elektronicky dostupný kalkulátor rizika zlomenin ‒ FRAX (http://www.shef.ac.uk/FRAX/tool.jsp?country=39). Riziko vzniku osteoporotických zlomenin však také závisí na rychlosti úbytku kostní hmoty, tedy na schopnosti kostních buněk kompenzovat nadměrnou osteoresorpci a ztracenou kost obnovovat. Pro klinické posouzení stupně osteoklastické osteoresorpce je doporučeno stanovení sérové koncentrace C‑terminálního telopeptidu kolagenu typu I (βCTX), markeru degradace kolagenu typu I. Pro hodnocení stupně novotvorby kostní organické matrix je doporučeno stanovení koncentrace N‑terminálního propeptidu kolagenu typu I (PINP), markeru syntézy kolagenu typu I. Tyto markery jsou také vhodné pro monitorování účinnosti antiosteoporotické terapie. K základním laboratorním vyšetřením krve dále patří krevní obraz, stanovení hodnoty vysoce senzitivního C‑reaktivního proteinu (hsCRP), kreatininu, tyreotropního hormonu (TSH), glukózy, vápníku, fosforu, kostní alkalické fosfatázy, 25‑hydroxyvitaminu D a parathormonu (PTH). V indikovaných situacích je vhodné tato vyšetření doplnit elektroforézou sérových bílkovin a stanovením hodnoty endomysiálních protilátek, kortisolu, ferritinu, testosteronu, 1,25‑dihydroxyvitaminu D nebo fibroblastového růstového faktoru (FGF) 23. Samotné zjištění zlomeniny ani žádné z uvedených vyšetření (DXA, FRAX, laboratorní testy) však samo o sobě klinickou diagnózu OP nestanovuje. Osteologické klinické, laboratorní a radiologické vyšetření je nezbytné u všech pacientů s nově prokázanou nízkou BMD nebo s nízkotraumatickou zlomeninou a u pacientů s onemocněním, které je spojeno se zhoršením kvality kostní hmoty a se zvýšeným rizikem vzniku nízkotraumatických zlomenin.
Cílem tohoto přehledového článku je zdůraznit nutnost kauzální léčby sekundární OP a uvést možnosti symptomatické terapie OP v situacích, kdy kauzální léčba není možná nebo selhává.
Onemocnění asociovaná se zvýšením resorpce a s utlumením novotvorby kosti a se zhoršením mikroarchitektury kosti i kvality kostní hmoty
Revmatoidní artritida
Při zánětu se mohou interakce mezi kostní hmotou a imunitním systémem projevit výrazněji než při pouhém deficitu sexagenů, hyperkortisolismu nebo při stárnutí. Úbytek kostní hmoty se při revmatoidní artritidě (RA) prokazuje jako periartikulární osteopenie, kostní eroze a generalizovaná OP. Prevalence generalizované OP je při RA proti kontrolám dvojnásobná [2]. Na rozdíl od postmenopauzální OP nastává při RA výrazný úbytek kostní hmoty nejen v obratlích, ale zejména v proximálním femuru a v distálním radiu. V době diagnózy RA se osteodenzitometricky zpravidla zvýšená prevalence OP neprokazuje a výpovědní hodnota BMD jako prediktoru rizika zlomenin je malá. Pokles BMD je největší v prvních letech onemocnění RA [3]. Hodnocení etiologie a prevalence generalizované OP při RA je komplikováno řadou dalších faktorů, které ovlivňují kostní remodelaci (věk, pohlaví, výživa, fyzická aktivita, trvání a aktivita onemocnění, vlivy léků, zejména glukokortikoidů).
Relativní riziko zlomeniny v oblasti kyčle je ve srovnání se zdravou populací zvýšeno dvakrát, relativní riziko zlomeniny obratle je zvýšeno 2,4× a klinické zlomeniny 1,5× (nezávisle na BMD axiálního skeletu) a zůstává zvýšeno i po adjustaci na léčbu glukokortikoidy (graf 1) [2,4]. Při současné léčbě glukokortikoidy je dále zvýšena incidence symptomatických zlomenin obratlů. Další významnou příčinou vyššího rizika zlomenin je vyšší relativní riziko pádů u pacientů s RA, na němž se kromě kloubního onemocnění podílejí svalová slabost (nižší svalová hmota a sarkopenie), snížená fyzická výkonnost a zhoršená stabilita. Alespoň jednou za rok upadne 42 % pacientů s RA.![GRAF 1A, B incidence zlomenin při revmatoidní artritidě ([a] 47 036 pacientů a 826 606 kontrol) a při zánětlivých střevních onemocněních ([b] 6 027 nemocných a 60 027 kontrol); podle [4,20] – kim, et al., 2010, Bernstein, et al., 2000. Ci – interval spolehlivosti, confi dence interval](https://www.remedia.cz/photo-a-30976---.jpg)
Cílem léčby RA je klinická remise onemocnění s úplným odezněním synovitidy. Prozánětlivé cytokiny (TNFα, interleukiny IL‑6, IL‑7, IL‑17) po vazbě na své receptory zvyšují produkci růstového hormonu pro makrofágy (M‑CSF) a RANKL (RANK ligandu) ve stromálních buňkách dřeně a v aktivovaných T lymfocytech [5]; T buňky rovněž exprimují inhibitory osteoklastogeneze jako osteoprotegerin nebo interferon gama a uplatňuje se citrulinace proteinů na povrchu těchto buněk. Na rozdíl od postmenopauzální OP je při RA významně utlumena reparace erodované kosti. Rekrutování nových osteoblastů je tlumeno jednak prozánětlivými cytokiny TNFα a IL‑17, jednak inhibitory Wnt signální cesty (secernovaným frizzled‑related proteinem, sklerostinem a proteinem dickkopf‑1 [Dkk‑1]).
Léky blokující TNFα snižují sérové koncentrace βCTX‑1 a brání poklesu BMD v bederní páteři a v proximálním femuru [6]. Osteoklastogeneze a osteoklastická osteoresorpce je inhibována také léčbou anti‑IL-6. Biologická léčba je proto při RA kauzálním léčebným opatřením i u pacientů se sekundární OP. Úspěšná biologická léčba zánětlivého procesu při RA zpomaluje až zastavuje úbytek a zhoršování kvality kostní hmoty [7]. Ve studii u 8 410 žen s RA se při monoterapii anti‑TNF snížilo riziko nízkotraumatické zlomeniny o 43 % (p = 0,035) [8].
Aminobisfosfonáty i denosumab zpomalují u pacientů s RA a sekundární OP úbytek kostní hmoty, ale nemají protizánětlivé účinky [9,10]. Nebyl prokázán účinek antiresorpční léčby na snížení rizika vzniku neobratlových zlomenin. Pokud se k utlumení aktivity RA užívají glukokortikoidy, představuje kauzální léčbu glukokortikoidy indukované OP teriparatid.
Ankylozující spondylitida
Ankylozující spondylitida (AS) je chronické zánětlivé onemocnění primárně postihující oblast úponů šlach a ligament na kost (enteze) axiálního skeletu. Na rozdíl od RA může být zánět, zejména v oblastech úponů, provázen zvýšenou novotvorbou kosti. Při pokročilé AS jsou ankylozující entezopatie a ankylóza páteře důsledkem degradace kosti a osifikace vazivového aparátu páteře. Osteoporóza se při AS zjišťuje u každého čtvrtého pacienta, osteopenie u 19–62 % pacientů [11]. Úbytek kostní hmoty závisí na aktivitě a trvání choroby. Syndesmofyty a ektopická kost podstatně nadhodnocují ukazetele BMD měřené v bederní páteři metodou DXA. Spolehlivější informaci poskytuje měření BMD v oblasti proximálního femuru nebo BMD obratlových těl metodou QCT (kvantitativní výpočetní tomografie) [12]. Prevalence zlomenin obratlů při ankylozující spondylitidě je 10‒30 % [11]. Pravděpodobnost klinické zlomeniny obratle při AS je proti kontrolám zvýšena 3,3× [13]. Při ankylozující spondylitidě jsou zlomeniny obratlů jednak podobné kompresivním zlomeninám při postmenopauzální OP, jednak vznikají v oblasti extraskeletální kosti. Důsledkem zlomenin mohou být závažné neurologické komplikace.
Cílem léčby AS by měl být jednak útlum tvorby syndesmofytů (lokální novotvorby kosti), jednak léčba systémového úbytku kostní hmoty. Upřednostněna má být biologická terapie AS, jejíž užívání je asociováno se zvýšením BMD bederní páteře i proximálního femuru [14]. S útlumem zánětu léky blokujícími TNFα je asociován pokles sérové koncentrace βCTX a zpomalení poklesu BMD, ale tomu nemusí odpovídat ústup tvorby syndesmofytů. Ve čtyřleté prospektivní studii mělo 26 % ze 105 zařazených pacientů s AS bazálně zlomeniny obratlů. Během anti‑TNF terapie trvající čtyři roky se zlepšil klinický stav a zvýšila se BMD, ale přesto 20 % pacientů utrpělo nové zlomeniny obratlů [15]. V prospektivní observační studii u 49 pacientů s aktivní AS, kdy bazálně mělo zlomeninu šest pacientů, utrpělo po dvou letech léčby etanerceptem novou zlomeninu obratle devět nemocných (p < 0,003), ačkoliv se významně zvýšila BMD proximálního femuru (o 2,2 %) a bederní páteře (o 7 %) a významně poklesla klinická aktivita onemocnění [16]. Účinnost anti‑TNF léčby na progresi OP může klesat v pozdějších stadiích onemocnění AS, zvláště pokud se vytvořily syndesmofyty a je významně zhoršena mobilita pacientů. Pokud u daného pacienta není indikována léčba anti‑TNF, platí pro prevenci úbytku kostní hmoty obdobná doporučení jako u žen a mužů s jinými typy OP.
Systémový lupus erythematodes
K nejčastěji uváděným příčinám zvýšeného rizika vzniku OP a nízkotraumatických zlomenin při systémovém lupus erythematodes (SLE) patří systémové důsledky prozánětlivých cytokinů (IL‑1, IL‑6, TNFα), ale také snížená fyzická aktivita, nedostatečná střevní absorpce vápníku (zhoršená renální produkce kalcitriolu a insuficience vitaminu D při nízké expozici slunečnímu záření, nedostatečná sekrece estradiolu a důsledky léčby zánětu ‒ glukokortikoidy, cyklosporin, cyklofosfamid, antikonvulziva, léčba heparinem v těhotenství) [17]. U žen před menopauzou dlouhodobě trpících onemocněním SLE a užívajících glukokortikoidy se incidence OP uvádí v rozmezí 12‒16 %. V kohortové studii u 242 pacientů se SLE (věk 40 let, trvání nemoci 7 let) mělo 9 % z nich zlomeniny, z toho třetinu tvořily ženy před menopauzou. Sníženou BMD v oblasti OP měla jen třetina pacientů se zlomeninami [18]. Úbytek kostní hmoty se prokazuje v trámčité i kortikální kosti v celém skeletu. Zlomeniny se prokazují u pětiny pacientů a zejména u mladších osob. Zlomeninami jsou ohroženi především pacienti s dlouhotrvajícím větším rozsahem orgánového postižení a pacienti léčení vyššími dávkami glukokortikoidů. Závažnou komplikaci při SLE může znamenat osteonekróza asociovaná s léčbou glukokortikoidy a s antifosfolipidovým syndromem. Vhodným opatřením k prevenci a léčbě sekundární OP je léčba základního onemocnění, suplementace vápníku a vitaminu D a zajištění fyzické aktivity. Reverzibilita úbytku kostní hmoty při účinné léčbě SLE nebyla studována. Při prokázané zvýšené osteoresorpci jsou vhodným medikamentózním opatřením antiresorpční léky. Při léčbě aminobisfosfonáty je nutná zvláštní opatrnost u pacientek ve fertilním věku. U pacientů s glukokortikoidy indukovanou OP je vhodné zvážit léčbu teriparatidem.
Střevní zánětlivá onemocnění
Osteopenie nebo OP (hodnocená měřením BMD) se uvádí u 38‒72 % pacientů [19]. Zvýšenou osteoresorpci a útlum novotvorby kostní hmoty navozují prozánětlivé cytokiny (TNFα, IL‑1β, IL‑6 a IL‑17). Úbytek a zhoršování kvality kosti závisí na stupni a trvání zánětu a na nutričních faktorech (deficit kalcia a vitaminu D). Podle výsledků studie u 6 027 pacientů se zánětlivým onemocněním střev byla v porovnání s 60 027 osobami z běžné populace prokázána vyšší incidence zlomenin (graf 1) [20]. Riziko zlomenin je vyšší při Crohnově chorobě než při ulcerózní kolitidě. Kauzální léčbu OP při zánětlivých střevních onemocněních představuje anti‑TNFα terapie [21]. Součástí léčby je zajištění zásobení vápníkem a vitaminem D. Glukokortikoidy naproti tomu navozují úbytek a zhoršování kvality kosti a zvyšují riziko vzniku fraktur [22].
Chronická obstrukční plicní nemoc
Prevalence OP posuzovaná podle BMD nebo podle zlomenin obratlů se uvádí mezi 24 a 80 procenty [23].
Onemocnění asociovaná s utlumením novotvorby kosti a se zhoršením kvality kostní hmoty
Glukokortikoidy indukovaná osteoporóza
Při nadbytku glukokortikoidů (GC) je sice mírně zvýšena osteoresorpce (zejména během prvních týdnů po zahájení léčby GC), tyto látky však současně zrychlují apoptózu osteoblastů a osteocytů. Snížená tvorba organické kostní matrix v osteoblastech pak nestačí kompenzovat ani důsledky normální osteoresorpce. Klíčovým místem pro vytvoření poolu funkčních osteoblastů a pro regulaci jejich přežívání je signální dráha Wnt/beta‑catenin. Při zánětu tuto dráhu tlumí prozánětlivé cytokiny, ale také glukokortikoidy užívané k léčení zánětu. Glukokortikoidy dráhu inaktivují jednak snižováním exprese Wnt7b a množství beta‑cateninu v osteoblastech, jednak zvýšením exprese Dkk‑1, který po navázání na transmembránový protein Kremen navozuje internalizaci LRP5/6 receptoru, a učiní ho tak nedosažitelným pro Wnt signalizaci. Dalšími významnými příčinami zhoršování kvality kostní hmoty při nadbytku GC jsou útlum diferenciace mezenchymálních kmenových buněk kostní dřeně do linie osteoblastů a převaha diferenciace do linie adipocytů, svalová atrofie, inhibice sekrece gonadotropinu, luteinizačního hormonu a folikuly stimulujícího hormonu, snížení gonadální produkce sexagenů, útlum aktivního střevního transportu vápníku a snížení tubulární reabsorpce vápníku. Přímé i nepřímé účinky glukokortikoidů na skelet jsou individuálně značně variabilní. Pro prevenci i pro léčbu glukokortikoidy indukované osteoporózy (GIO) je proto velmi významné poznání příčin individuálních rozdílů citlivosti skeletu a dalších tkání vůči účinkům GC.
Osteoporóza se prokazuje u 70 % pacientů s Cushingovým syndromem, kdy každý druhý pacient utrpí nízkotraumatickou zlomeninu [24]. Subklinický hyperkortisolismus je asociován s rizikem meolického syndromu. Pro onemocnění svědčící vyšší ranní sérová koncentrace kortisolu po supresi dexamethasonem je prokazována až u 5 % pacientů s nově diagnostikovanou těžkou OP. Pozitivita dexamethasonového testu vypovídá o zrychleném úbytku kostní hmoty i u zdravých mužů a žen ve věku nad 60 let. Subklinický hyperkortisolismus je tak jedním z možných vysvětlení involuční OP.
Glukokortikoidy indukovaná osteoporóza je nejčastější formou sekundární OP. Perorální glukokortikoidy užívá kolem 0,5‒1 % populace, ve věku nad 70 let 2,5‒5,2 %. Riziko zlomenin se zvyšuje již během prvních tří měsíců užívání GC až o 75 %. Při pokračujícím podávání GC se rychlost poklesu BMD snižuje. Po vysazení kortikoidů nebo po úspěšné chirurgické léčbě Cushingovy nemoci může být kostní ztráta do značné míry reverzibilní.
Klinický význam OP není určen hodnotou BMD, ale nízkotraumatickými zlomeninami. Ani dostupnost léčby GIO nemá být limitována hodnotou BMD ≤ ‒2,5 SD (standardní odchylky) v bederní páteři nebo v proximálním femuru zjištěnou DXA. Rozhodování o terapii se má odvíjet od individuální pravděpodobnosti, že v dalších 10 letech pacient prodělá nízkotraumatickou zlomeninu obratle, předloktí, paže nebo proximálního femuru, popř. zlomeninu kyčle (http://www.shef.ac.uk/FRAX/). Mezi faktory rizika vzniku fraktur má užívání GC nejvyšší váhu, protože riziko zlomenin je ve srovnání s rizikem u osob neléčených GC dvojnásobné, nezávisle na BMD.
Za rizikovou dávku GC se považuje kumulativní množství 30 g prednisolonu/rok, resp. 5 mg a více prednisolonu/den. Zlomeniny však vznikají i při denní dávce prednisolonu 2,5 mg [25]. Riziko vzniku klinických zlomenin obratlů je při užívání 2,5‒7,5 mg prednisolonu zvýšeno 2,6×. Nízkotraumatické a často klinicky asymptomatické zlomeniny se zjišťují u třetiny až poloviny nemocných léčených GC [25]. I asymptomatické zlomeniny znamenají zvýšení rizika nových zlomenin. Zvýšené riziko fraktur při léčbě GC je podmíněno hlavně zhoršením kvality kosti a hrozí pacientům bez ohledu na to, zda u nich byla denzitometricky diagnostikována OP. Zrychlená apoptóza osteocytů a zhoršená vaskularizace kosti navozená GC je až u čtvrtiny pacientů také spojena s rizikem osteonekrózy v oblasti proximálního femuru nebo humeru.
Prevence GIO by měla být zajištěna u všech pacientů, kteří začínají užívat GC v dávce 2,5 mg a vyšší, zejména pokud se předpokládá dlouhodobá léčba těmito přípravky. Doporučuje se ověření hodnot BMD před léčbou, užívání co nejnižší denní dávky GC a co nejkratší doba léčby. Pro prevenci GIO je také doporučována úprava životního stylu (omezení kouření, konzumace alkoholu, zvýšení fyzické aktivity) a suplementace vápníku a vitaminu D [26]. Hormonální léčba je preventivním opatřením u premenopauzálních žen s nedostatečnou produkcí estrogenů, u žen po předčasné menopauze, u žen v prvních letech po fyziologické menopauze a také u mužů mladších 50 let s prokázaným deficitem biologicky účinného testosteronu.
Kauzální terapií GIO u žen i u mužů s BMD v bederní páteři s hodnotou T‑skóre ‒2,5 SD a nižší a užívajících více než 5 mg prednisolonu denně po dobu alespoň šesti měsíců je osteoanabolická léčba teriparatidem (rekombinantní fragment 1‒34 lidského parathormonu). Teriparatid zajišťuje nahrazení staré a poškozené kosti zdravou tkání a vytvoření nové kostní hmoty i na klidových površích. Při léčbě teriparatidem se BMD v bederní páteři i v proximálním femuru zvýšila významně více než při užívání alendronátu. Po 18 měsících a dále pak po 36 měsících bylo při léčbě teriparatidem v porovnání se skupinou pacientů léčených alendronátem riziko zlomenin obratlů několikanásobně nižší [27]. Účinnost teriparatidu při léčbě GIO v běžné klinické praxi byla ověřena u více než 1 580 žen s těžkou postmenopauzální OP ambulantně léčených v osmi evropských zemích [28]. Riziko klinických zlomenin se snížilo o více než 80 % a pacientky měly významně menší bolesti zad a zlepšenou kvalitu života. Na dvouletou osteoanabolickou terapii má navazovat dlouhodobá antiresorpční léčba, která umožní potřebnou sekundární mineralizaci nově vytvořené kostní hmoty a zpomalí zhoršování mikroarchitektury při pokračujícím podávání GC.
Léčení GIO kterýmkoliv z dostupných aminobisfosfonátů zpomaluje zhoršování mikroarchitektury kosti s věkem, ale novou kostní hmotu nevytvoří. V jednoročních až dva roky trvajících klinických studiích kontrolovaných placebem zaměřených na perorální aminobisfosfonáty bylo snížení rizika zlomeniny obratlů u nemocných s GIO prokázáno při léčbě alendronátem a risedronátem [29]. Změny BMD při léčbě kyselinou zoledronovou (5 mg, aplikace v infuzi jednou za rok) byly přímo porovnávány s účinkem risedronátu (tableta, 5 mg denně) [30].
Diabetes mellitus
Příčinou zvýšeného rizika zlomenin při onemocnění diabetes mellitus 1. typu (DM1) [31] je především zhoršená kvalita kostní hmoty. Osteopenie se uvádí u 22–45 % pacientů, OP u 16 % pacientů [32]. U rostoucích dětí a dospívajících je onemocněním nepříznivě ovlivněno dosažení maxima kostní hmoty a nejvýraznější deficit BMD se zjišťuje v časných stadiích onemocnění. U dospělých osob jsou hodnoty BMD u pacientů s DM1 stabilní a hodnoty BMD nevysvětlují zvýšení rizika zlomenin [31]. Relativní riziko zlomeniny v oblasti kyčle při DM1 je významně (až 6,4×) vyšší než při diabetu 2. typu (2,2×) a 5,8‒6,3× vyšší v porovnání se zdravými osobami [33]. Relativní riziko jakékoliv nízkotraumatické zlomeniny je při DM1 v porovnání se zdravými osobami zvýšeno 3,2× [34]. Zvýšení rizika zlomenin je asociováno se zvýšením glykemie, s nedostatkem osteoanabolicky působícího inzulinu a inzulinu podobného růstového faktoru (IGF) I a s přítomností jiných orgánových komplikací onemocnění. Uplatňují se také nedostatečné zásobení vitaminem D a hyperkalciurie [35]. Významným nežádoucím účinkem hyperglykemie je převaha adipogeneze nad tvorbou osteoblastů z kmenové mezenchymální buňky a tvorba konečných produktů glykace kolagenu typu I (advanced glycation endproducts, AGE) ‒ zejména pentosidinu ‒, které zhoršují mechanické vlastnosti kolagenu. Riziko zlomenin je asociováno se zvýšenou sérovou koncentrací pentosidinu [36]. Zvýšení glykemie je negativně asociováno také s laboratorními ukazateli remodelace kostní hmoty (osteokalcinu, PINP a βCTX) [37].
Diabetes mellitus 2. typu je u žen spojen s 20% zvýšením relativního rizika vzniku nízkotraumatických zlomenin, přestože BMD je zpravidla v referenčních mezích nebo i vyšší [38]. Mezi příčinami zvýšené fragility kosti se také u diabetu 2. typu uvádí snížená remodelace kosti a zhoršená kvalita kostního kolagenu, která je důsledkem hromadění produktů glykace. Vývoj diabetické osteopatie je ovlivněn komplikacemi diabetu. Diabetická neuropatie a retinopatie zvyšují sklon k pádům a tím i k riziku zlomenin. V laboratorním nálezu u pacientů s diabetem je třeba sledovat nejen sérové koncentrace ukazatelů kostní remodelace (zejména PINP, osteokalcinu a βCTX‑1), ale i 25‑hydroxyvitaminu D a parathormonu. Účinnost antiresorpčních léků na BMD je u pacientů s diabetes mellitus obdobná jako u osob bez diabetu, ale dlouhodobě je tato terapie vhodná jen při prokázané zvýšené osteoresorpci.
Vhodným opatřením k prevenci sekundární OP je léčba základního onemocnění, a to s přihlédnutím k možným nežádoucím účinkům některých léků [39]. Sem patří léčba diabetu některými thiazolidindiony (rosiglitazonem a pioglitazonem), které jako aktivátory transkripčního faktoru PPARγ podporují diferenciaci mezenchymálních kmenových buněk na adipocyty a tlumí jejich diferenciaci na osteoblasty. Důsledkem je útlum novotvorby kostní hmoty, pokles BMD v bederní páteři i v proximálním femuru a zvýšení rizika zlomenin o více než 40 %, zejména u starších pacientů [39].
Onemocnění asociovaná se zvýšením resorpce kosti převažujícím nad vyšší novotvorbou kosti a se zhoršením mikroarchitektury kosti
Hypertyreóza a hypoparatyreóza
Hormony štítné žlázy jsou nezbytné pro vývoj skeletu u dětí a dospívajících a pro dosažení maxima kostní hmoty. V dospělosti se hormony štítné žlázy podílejí na stupni kostní remodelace. V kostních buňkách a také v osteoklastech byl prokázán receptor pro trijodtyronin. Stupeň kostní remodelace závisí rovněž na sérové koncentraci tyreotropního hormonu (TSH) [40]. Zvýšená sérová koncentrace T4, T3 a snížená koncentrace TSH při hypertyreóze a u osob léčených terapeutickými dávkami hormonů štítné žlázy významně zvyšuje osteoklastickou osteoresorpci a aktivační frekvenci remodelačního cyklu. Novotvorba bývá zvýšena v menším stupni než resorpce kosti. I mírná hypertyreóza může podstatně zhoršit úbytek kostní hmoty u žen po menopauze a tím zvýšit riziko zlomenin. Závažná je porotizace kortikální kostní hmoty (distální třetina kostí pedloktí a krčku femuru). Ženy starší 65 let při hodnotách TSH pod 0,1 mIU/l mají trojnásobné relativní riziko zlomenin v oblasti kyčle a čtyřikrát vyšší relativní riziko zlomenin obratlů [41]. Pokud substituční léčba tyreoidálními hormony nesnižuje koncentraci tyreotropinu pod dolní hranici normálních hodnot (0,3 mIU/l), riziko fraktur se u žen mladších 65 let a u mužů významně nezvyšuje [42]. Anamnestický údaj o prodělané hypertyreóze je indikací k osteodenzitometrickému a laboratornímu vyšetření.
Protože úbytek kostní hmoty a zhoršení kvality kostní hmoty navozené hypertyreózou mohou být alespoň zčásti reverzibilní, je základním opatřením k prevenci sekundární OP převedení pacientů do eutyreózy tak, aby se v referenčních mezích nacházely také hodnoty TSH (tyreostatická léčba, tyreoidektomie). Tyreotropní hormon má osteoprotektivní účinek, protože prostřednictvím systému RANKL/OPG tlumí kostní remodelaci. Je doporučeno zajistit celkový denní příjem vápníku 1 000 mg a suplementaci vitaminu D k zajištění sérové koncentrace 25‑hydroxyvitaminu D převyšující 75 nmol/l. Při prokázaném zvýšení osteoresorpce při hypertyreóze je u žen v prvních pěti letech po menopauze lékem první volby estradiol, popř. selektivní modulátory estrogenových receptorů (SERM). Alternativou jsou antiresorpční léky.
Hypotyreóza sice nevede k poklesu množství kostního minerálu, ale přesto je spojena s významným zvýšením rizika nízkotraumatických zlomenin [41]. Jedním z možných vysvětlení je zhoršování kvality kosti a zvyšování její lomivosti při dlouhodobě snížené aktivitě osteoblastů a nedostatečné obnově organické kostní matrix. Vhodným opatřením k prevenci sekundární OP je převedení pacientů do eutyreózy.
Primární hyperparatyreóza
Onemocnění postihuje 1–3 % žen starších 50 let. Zvýšení sérové koncentrace parathormonu o více než 50 % trvající déle než čtyři hodiny zvyšuje v osteoblastech a v osteocytech expresi RANKL a tlumí produkci osteoprotegerinu. Zvyšuje se proto diferenciace osteoklastů, osteoklastická osteoresorpce a sérová koncentrace vápníku a degradačních produktů kolagenu I (βCTX). Závažnými klinickými projevy déletrvající primární hyperparatyreózy (PHPT) jsou nefrolitiáza, porotizace kortikální kosti, pokles BMD trámčité a zejména kortikální kosti (distálního radia) a nízkotraumatické zlomeniny obratlů, distálního radia, žeber a pánve [43]. Osteoporóza nebo nízkotraumatická zlomenina jsou jednou z indikací pro paratyreoidektomii, která upravuje homeostázu vápníku a navodí zvýšení BMD osového i periferního skeletu. Pouze mírná hyperkalcemie bez orgánového postižení může být projevem asymptomatické PHPT, kdy kortikální BMD významněji ubývá až po deseti letech trvání nemoci a kdy lze zvážit konzervativní přístup. Zvýšenou osteoklastickou osteoresorpci při asymptomatické PHPT nebo při nemožnosti provést paratyreoidektomii lze příznivě ovlivnit antiresorpčními léky (estradiol, SERM, aminobisfosfonáty, denosumab) a suplementací vitaminu D [44]. Osteoporóza může být vedoucím příznakem také při normokalcemické primární hyperparatyreóze, kdy je zvýšena sérová koncentrace parathormonu, ale jsou trvale normální koncentrace sérového ionizovaného vápníku, a kdy jsou vyloučeny příčiny sekundární hyperparatyreózy (včetně insuficience vitaminu D) [45].
Sekundární hyperparatyreóza při hypovitaminóze D
Insuficience vitaminu D je charakterizována sníženými sérovými koncentracemi 25‑hydroxyvitaminu D (25–50 nmol/l), sekundární hyperparatyreózou, zhoršováním mikroarchitektury trámčité kosti a zvýšenou porotizací kortikální kostní hmoty. Při nízkých sérových hodnotách 25‑hydroxyvitaminu D se jedná o deficienci vitaminu D, kdy hrozí vysoké riziko osteomalacie. Hypovitaminóza D je častá při chronických onemocněních, u starých lidí a u pacientů s fotosenzitivitou při autoimunitních onemocněních. Dostatečného zásobení vitaminem D, kdy je zajištěna normální mineralizace kostní hmoty (sérové koncentrace vitaminu D vyšší než 75 nmol/l), se dosahuje při pravidelném příjmu 800‒1 000 IU vitaminu D.
Hypogonadismus navozený léky
Hypogonadismus u mužů je asociován se zvýšením osteoresorpce, snižováním BMD a se zvýšeným rizikem zlomenin. S věkem u mužů klesá hodnota biologicky dostupného estradiolu i testosteronu. Při androgen‑deprivační terapii (ADT) nemetastazujícího karcinomu prostaty je pokles koncentrace sexagenů akcelerován a během prvních šesti až dvanácti měsíců klesá BMD o 3–7 % a stoupá riziko zlomenin [46]. Nárůst rizika zlomenin je asociován s trváním ADT. Úbytek kostní hmoty při ADT účinně zpomaluje transdermální estradiol, raloxifen a bisfosfonáty [47]. O stupni osteoresorpce a nutnosti účinné antiresorpční terapie při ADT nemetastazujícího karcinomu prostaty svědčí účinnost léčby denosumabem, při níž se po dvou letech zvýšila BMD bederní páteře o 5,6 %, zatímco u neléčených mužů klesla o 1 %. Kostní denzita se významně zvýšila i v proximálním femuru a v distálním radiu. Po 36 měsících utrpělo novou zlomeninu obratle 3,9 % neléčených mužů a 1,5 % mužů léčených denosumabem (snížení relativního rizika o 62 %, p = 0,006) [48].
Inhibitory aromatázy (anastrozol, letrozol, exemestan), užívané k terapii karcinomu prsu a infertility (syndrom polycystických ovarií), navozují (v porovnání s tamoxifenem) zrychlení osteoresorpce, pokles BMD a zvýšení rizika zlomenin [49]. Aminobisfosfonáty a denosumab zpomalují pokles BMD a včas zahájená léčba denosumabem snižuje riziko vzniku zlomenin [50].
Závěr
V etiopatogenezi úbytku kostní hmoty se uplatňuje nerovnováha mezi stupněm resorpce a novotvorby při remodelaci kosti. Tato nerovnováha může být navozena geneticky, nedostatečnou fyzickou aktivitou, hormonálními a nutričními faktory, stárnutím, ale také řadou onemocnění a nežádoucími účinky některých léků. Léčení OP má být kauzální, a předpokladem zahájení jakékoliv léčby je proto klinické a laboratorní vyšetření a zjištění příčiny OP. Pokud je u žen i mužů s nízkou kostní hmotou prokázána některá z příčin sekundární OP, je nutné včasným účinným léčením základního onemocnění zajistit také prevenci a případně rovněž léčbu kostního onemocnění.
Seznam použité literatury
- [1] Ferrari S, Bianchi ML, Eisman JA, et al. Osteoporosis in young adults: pathophysiology, diagnosis, and management. Osteoporos Int 2012; 23: 2735–2748.
- [2] Haugeberg G, Uhlig T, Falch JA, et al. Bone mineral density and frequency of osteoporosis in female patients with rheumatoid arthritis: results from 394 patients in the Oslo County Rheumatoid Arthritis register. Arthritis Rheum 2000; 43: 522–530.
- [3] Gough AK, Lilley J, Eyre S, et al. Generalised bone loss in patients with early rheumatoid arthritis. Lancet 1994; 344: 23–27.
- [4] Kim SY, Schneeweiss S, Liu J, et al. Risk of osteoporotic fracture in a large population based cohort of patients with rheumatoid arthritis. Arthritis Res Ther 2010; 12: R154. doi: 10.1186/ar3107. Epub 2010 Aug 3.
- [5] Geusens PP, Landewé RB, Garnero P, et al. The ratio of circulating osteoprotegerin to RANKL in early rheumatoid arthritis predicts later joint destruction. Arthritis Rheum 2006; 54: 1772–1777.
- [6] Haugeberg G, Conaghan PG, Quinn M, et al. Bone loss in patients with active early rheumatoid arthritis: infliximab and methotrexate compared with methotrexate treatment alone. Explorative analysis from a 12 month randomised, double blind, placebo controlled study. Ann Rheum Dis 2009; 68: 1898–1901.
- [7] Vis M, Havaardsholm EA, Haugeberg G, et al. Evaluation of bone mineral density, bone metabolism, osteoprotegerin and receptor activator of the NFkappaB ligand serum levels during treatment with infliximab in patients with rheumatoid arthritis. Ann Rheum Dis 2006; 65: 1495–1499.
- [8] Coulson KA, Reed G, Gilliam BE, et al. Factors influencing fracture risk, T score, and management of osteoporosis in patients with rheumatoid arthritis in the Consortium of Rheumatology Researchers of North America (CORRONA) registry. J Clin Rheumatol 2009; 15: 155–160.
- [9] Cohen SB, Dore RK, Lane NE, et al. Denosumab treatment effects on structural damage, bone mineral density, and bone turnover in rheumatoid arthritis: a twelve month, multicenter, randomized, double blind, placebo controlled, phase II clinical trial. Arthritis Rheum 2008; 58: 1299–1309.
- [10] Dore RK, Cohen SB, Lane NE, et al. Effects of denosumab on bone mineral density and bone turnover in patients with rheumatoid arthritis receiving concurrent glucocorticoids or bisphosphonates. Ann Rheum Dis 2010; 69: 872–875.
- [11] Ghozlani I, Ghazi M, Nouijai A, et al. Prevalence and risk factors of osteoporosis and vertebral fractures in patients with ankylosing spondylitis. Bone 2009; 44: 772–776.
- [12] Karberg K, Zochling J, Sieper J, et al. Bone loss is detected more frequently in patients with ankylosing spondylitis with syndesmophytes. J Rheumatol 2005; 32: 1290–1298.
- [13] Prieto Alhambra D, Mu Muñoz Ortego J, De Vries F, et al. Ankylosing spondylitis confers substantially increased risk of clinical spine fractures: a nationwide case control study. Osteoporos Int 2015; 26: 85–91.
- [14] Haroon NN, Sriganthan J, Al Ghanim N, et al. Effect of TNF alpha inhibitor treatment on bone mineral density in patients with ankylosing spondylitis: a systematic review and meta analysis. Semin Arthritis Rheum 2014; 44: 155–161.
- [15] Maas F, Spoorenberg A, Brouwer E, et al. Radiographic vertebral fractures develop in patients with ankylosing spondylitis during 4 years of TNF alpha blocking therapy. Clin Exp Rheumatol 2016; 34: 191–199.
- [16] Van der Weijden MA, van Denderen JC, Lems WF, et al. Etanercept increases bone mineral density in ankylosing spondylitis, but does not prevent vertebral fractures: results of a prospective observational cohort study. J Rheumatol 2016; 43: 758–764.
- [17] Kipen Y, Buchbinder R, Forbes A, et al. Prevalence of reduced bone mineral density in systemic lupus erythematosus and the role of steroids. J Rheumatol 1997; 24: 1922–1929.
- [18] Yee CS, Crabtree N, Skan J, et al. Prevalence and predictors of fragility fractures in systemic lupus erythematosus. Ann Rheum Dis 2005; 64: 111–113.
- [19] Zanchetta MB, Longobardi V, Bai JC. Bone and celiac disease. Curr Osteoporos Rep 2016; 14: 43–48.
- [20] Bernstein CN, Blanchard JF, Leslie W, et al. The incidence of fracture among patients with inflammatory bowel disease. A population based cohort study. Ann Intern Med 2000; 133: 795–799.
- [21] Mauro M, Radovic V, Armstrong D. Improvement of lumbar bone mass after infliximab therapy in Crohn’s disease patients. Can J Gastroenterol 2007; 21: 637–642.
- [22] Ezri J, Marques Vidal P, Nydegger A. Impact of disease and treatments on growth and puberty of pediatric patients with inflammatory bowel disease. Digestion 2012; 85: 308–319.
- [23] Romme EA, Rutten EP, Geusens P, et al. Bone stiffness and failure load are related with clinical parameters in men with chronic obstructive pulmonary disease. J Bone Miner Res 2013; 28: 2186–2193.
- [24] Chiodini I, Torlontano M, Carnevale V, et al. Skeletal involvement in adult patients with endogenous hypercortisolism. J Endocrinol Invest 2008; 31: 267–276.
- [25] Van Staa TP, Leufkens HG, Cooper C. The epidemiology of corticosteroid induced osteoporosis: a meta analysis. Osteoporos Int 2002; 13: 777–787.
- [26] Lekamwasam S, Adachi JD, Agnusdei D, et al. A framework for the development of guidelines for the management of glucocorticoid induced osteoporosis. Osteoporos Int 2012; 23: 2257–2276.
- [27] Saag KG, Zanchetta JR, Devogelaer JP, et al. Effects of teriparatide versus alendronate for treating glucocorticoid induced osteoporosis: thirty six month results of a randomized, double blind, controlled trial. Arthritis Rheum 2009; 60: 3346–3355.
- [28] Fahrleitner Pammer A, Langdahl BL, Marin F, et al. Fracture rate and back pain during and after discontinuation of teriparatide: 36 month data from the European Forsteo Observational Study (EFOS). Osteoporos Int 2011; 22: 2709–2719.
- [29] Saag K, Lindsay R, Kriegman A, et al. A single zoledronic acid infusion reduces bone resorption markers more rapidly than weekly oral alendronate in postmenopausal women with tlow bone mineral density. Bone 2007; 40: 1238–1243.
- [30] Reid DM, Devogelaer JP, Saag K, et al. Zoledronic acid and risedronate in the prevention and treatment of glucocorticoid induced osteoporosis (HORIZON): a multicentre, double blind, double dummy, randomised controlled trial. Lancet 2009; 373: 1253–1263.
- [31] Vestergaard P. Discrepancies in bone mineral density and fracture risk in patients with type 1 and type 2 diabetes – a meta analysis. Osteoporos Int 2007; 18: 427–444.
- [32] Weber DR, Schwartz G. Epidemiology of skeletal health in type 1 diabetes. Curr Osteoporos Rep 2016; 14: 327–336.
- [33] Fan Y, Wei F, Lang Y, et al. Diabetes mellitus and risk of hip fractures: a meta analysis. Osteoporos Int 2016; 27: 219–228.
- [34] Shah VN, Shah CS, Snell Bergeon JK. Type 1 diabetes and risk of fracture: meta analysis and review of the literature. Diabet Med 2015; 32: 1134–1142.
- [35] The NS, Crandell JL, Lawrence JM, et al. Vitamin D in youth with type 1 diabetes: prevalence of insufficiency and association with insulin resistance in the SEARCH Nutrition Ancillary Study. Diabet Med 2013; 30: 1324–1332.
- [36] Farlay D, Armas LA, Gineyts E, et al. Nonenzymatic glycation and degree of mineralization are higher in bone from fractured patients with type 1 diabetes mellitus. J Bone Miner Res 2016; 31: 190–195.
- [37] Starup Linde J, Lykkeboe S, Gregersen S, et al. Differences in biochemical bone markers by diabetes type and the impact of glucose. Bone 2016; 83: 149–155.
- [38] Montagnani A, Gonnelli S, Alessandri M, et al. Osteoporosis and risk of fracture in patients with diabetes: an update. Aging Clin Exp Res 2011; 23: 84–90.
- [39] Aubert RE, Herrera V, Chen W, et al. Rosiglitazone and pioglitazone increase fracture risk in women and men with type 2 diabetes. Diabetes Obes Metab 2010; 12: 716–721.
- [40] Waung JA, Bassett JH, Williams GR. Thyroid hormone metabolism in skeletal development and adult bone maintenance. Trends Endocrinol Metab 2012; 23: 155–162.
- [41] Vestergaard P, Mosekilde L. Fractures in patients with hyperthyroidism and hypothyroidism: a nationwide follow up study in 16,249 patients. Thyroid 2002; 12: 411–419.
- [42] Biondi B, Cooper DS. The clinical significance of subclinical thyroid dysfunction. Endocr Rev 2008; 29: 76–131.
- [43] Marcocci C, Cetani F. Clinical practice. Primary hyperparathyroidism. N Engl J Med 2011; 365: 2389–2397.
- [44] Khan A, Grey A, Shoback D. Medical management of asymptomatic primary hyperparathyroidism: proceedings of the third international workshop. J Clin Endocrinol Metab 2009; 94: 373–381.
- [45] Tordjman KM, Greenman Y, Osher E, et al. Characterization of normocalcemic primary hyperparathyroidism. Am J Med 2004; 117: 861–863.
- [46] Mittan D, Lee S, Miller E, et al. Bone loss following hypogonadism in men with prostate cancer treated with GnRH analogs. J Clin Endocrinol Metab 2002; 87: 3656–3661.
- [47] Kearns AE, Northfelt DW, Dueck AC, et al. Osteoporosis prevention in prostate cancer patients receiving androgen ablation therapy: placebo controlled double blind study of estradiol and risedronate: N01C8. Support Care Cancer 2010; 18: 321–328.
- [48] Smith MR, Egerdie B, Hernandez Toriz N, et al. Denosumab in men receiving androgen deprivation therapy for prostate cancer. N Engl J Med 2009; 361: 745–755.
- [49] Eastell R, Hannon RA, Cuzick J, et al. Effect of an aromatase inhibitor on bmd and bone turnover markers: 2 year results of the Anastrozole, Tamoxifen, Alone or in Combination (ATAC) trial (18233230). J Bone Miner Res 2006; 21: 1215–1223.
- [50] Abdel Rahman O. Denosumab versus zoledronic acid to prevent aromatase inhibitors associated fractures in postmenopausal early breast cancer; a mixed treatment meta analysis. Expert Rev Anticancer Ther 2016; 16: 885–891.