Selhání léčby postmenopauzální osteoporózy – možné příčiny a opatření
Ke zlomenině může dojít u účinně léčených žen i při dobré adherenci. Za nedostatečnou odpověď na léčbu lze po nejméně roční antiresorpční terapii považovat novou zlomeninu (zlomeniny) při současně průkazném poklesu denzity kostního minerálu (BMD) nebo průkazný pokles BMD, pokud nedojde k očekávané změně odpovídajícího biochemického markeru kostní remodelace. Selhání antiresorpční léčby představuje zlomenina navozená lékem (atypická zlomenina při dlouhodobé antiresorpční terapii).
Osteoporóza patří mezi chronická onemocnění a vyžaduje dlouhodobou a nákladnou léčbu. U léčených pacientů je třeba individuálně potvrdit, že trpí osteoporózou, a vyloučit u nich jiná metabolická nebo nádorová kostní onemocnění. Také je třeba zvažovat, zda lze mechanismus působení léku využít i při jejich typu osteoporózy, individuálně zvažovat bezpečnost léku pro kosti a další tkáně a individuálně ověřit, že je doporučovaný lék vhodný pro dlouhodobou terapii. Nezbytná dlouhodobá adherence (compliance a perzistence) velmi záleží na preferencích pacienta (snášenlivost, zda vyhovuje způsob užívání léku). Všechny léky, které jsou pro léčbu onemocnění registrovány, snižují riziko obratlových zlomenin a některé z nich prokazatelně snižují riziko neobratlových zlomenin a zlomenin v oblasti kyčle. Žádný z dostupných léků však nemůže riziko zlomeniny zcela eliminovat a zdaleka ne 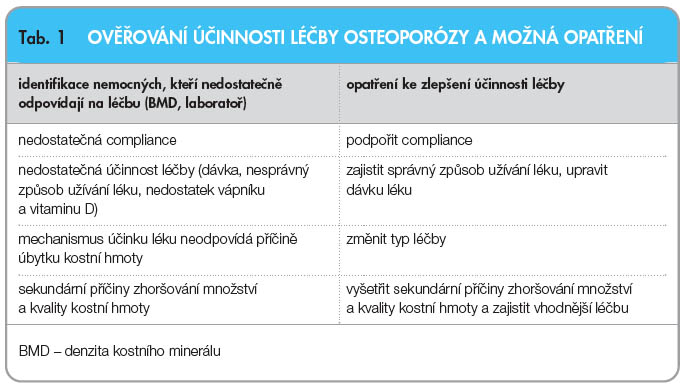 všichni pacienti odpovídají na pokračující pravidelné užívání téhož léku stejnou změnou kvality kostní hmoty. Proto se doporučuje ověřovat, že má lék očekávanou účinnost (snížení rizika zlomenin). K tomu se užívá zástupných ukazatelů působení léku, viz tab. 1 [1]. Na druhé straně se však namítá, že chybí kritérium selhání léčby a že monitorování účinnosti léčby je neodůvodněným plýtváním prostředky [2]. Jiný názor vyjádřila skupina expertů, kteří za selhání léčby považují novou hlavní osteoporotickou zlomeninu vzniklou již v prvním roce léčby. Za selhání léčby považují také dvě nebo více nízkotraumatických zlomenin anebo průkazný pokles denzity kostního minerálu (BMD) během 5 let léčby [3]. Jiní autoři neuvádějí selhání, ale rozlišují nepřiměřenou, pravděpodobně nepřiměřenou a přiměřenou odpověď na léčbu [4]. Tento článek je proto věnován výpovědi nové zlomeniny, výpovědi poklesu BMD a výpovědi změn biochemických markerů kostní remodelace o úspěšnosti dlouhodobé antiresorpční nebo osteoanabolické terapie osteoporózy.
všichni pacienti odpovídají na pokračující pravidelné užívání téhož léku stejnou změnou kvality kostní hmoty. Proto se doporučuje ověřovat, že má lék očekávanou účinnost (snížení rizika zlomenin). K tomu se užívá zástupných ukazatelů působení léku, viz tab. 1 [1]. Na druhé straně se však namítá, že chybí kritérium selhání léčby a že monitorování účinnosti léčby je neodůvodněným plýtváním prostředky [2]. Jiný názor vyjádřila skupina expertů, kteří za selhání léčby považují novou hlavní osteoporotickou zlomeninu vzniklou již v prvním roce léčby. Za selhání léčby považují také dvě nebo více nízkotraumatických zlomenin anebo průkazný pokles denzity kostního minerálu (BMD) během 5 let léčby [3]. Jiní autoři neuvádějí selhání, ale rozlišují nepřiměřenou, pravděpodobně nepřiměřenou a přiměřenou odpověď na léčbu [4]. Tento článek je proto věnován výpovědi nové zlomeniny, výpovědi poklesu BMD a výpovědi změn biochemických markerů kostní remodelace o úspěšnosti dlouhodobé antiresorpční nebo osteoanabolické terapie osteoporózy.
Zlomenina jako ukazatel selhání léčby
Cílem léčby osteoporózy je snížení rizika zlomenin. To bylo primárním kritériem při posuzování úspěchu léčby ve všech pivotních klinických studiích, při kterých byla zajištěna mj. potřebná compliance a perzistence. Všechny studie uvedené v grafu 1 prokázaly po 3 letech statisticky významný pokles relativního rizika (RR) zlomenin obratlů, tedy procentuální pokles rizika u léčených žen v porovnání se skupinou žen dostávajících placebo. Nicméně do každé z těchto studií byla zařazena jiná populace pacientek. 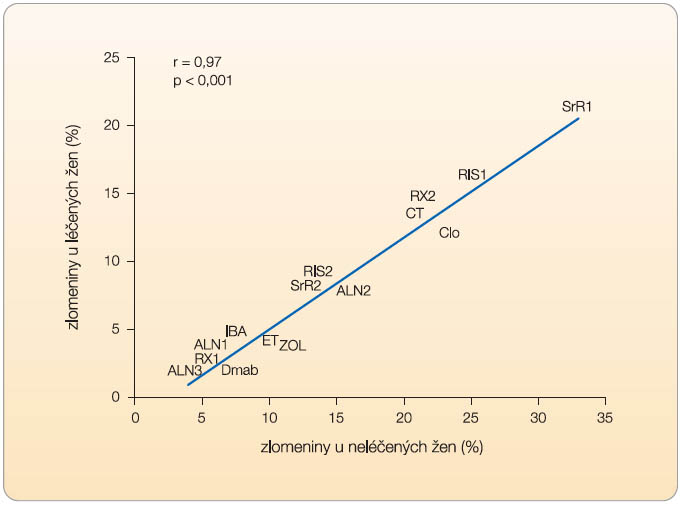 Proto se úspěch léčby v jednotlivých studiích porovnává zpravidla podle stupně snížení relativního rizika zlomenin. Naopak, ačkoli se to občas uvádí [5], nelze porovnávat úspěch léčby procentem pacientek, které v léčené skupině klinické studie neutrpěly zlomeninu (nebo – pomocí NNT – počet nemocných, které je třeba léčit, aby se předešlo jedné nové zlomenině). Nesprávné je také porovnávat neúspěch léčby procentem pacientek, které v léčené skupině klinické studie zlomeninu utrpěly. V obou případech totiž uvedené procento závisí na absolutním riziku, se kterým do studie daná populace pacientek vstupovala (graf 1). Vysokou incidenci (21 %) nových zlomenin obratlů ve studii SOTI [6] tedy nelze považovat za výraz většího neúspěchu léčby než 8 % nových zlomenin ve studii FIT1 [7]. V první z uvedených studií totiž v neléčené skupině během 3 let sledování utrpělo novou zlomeninu obratle 32 % žen a ve druhé studii jen 15 % žen.
Proto se úspěch léčby v jednotlivých studiích porovnává zpravidla podle stupně snížení relativního rizika zlomenin. Naopak, ačkoli se to občas uvádí [5], nelze porovnávat úspěch léčby procentem pacientek, které v léčené skupině klinické studie neutrpěly zlomeninu (nebo – pomocí NNT – počet nemocných, které je třeba léčit, aby se předešlo jedné nové zlomenině). Nesprávné je také porovnávat neúspěch léčby procentem pacientek, které v léčené skupině klinické studie zlomeninu utrpěly. V obou případech totiž uvedené procento závisí na absolutním riziku, se kterým do studie daná populace pacientek vstupovala (graf 1). Vysokou incidenci (21 %) nových zlomenin obratlů ve studii SOTI [6] tedy nelze považovat za výraz většího neúspěchu léčby než 8 % nových zlomenin ve studii FIT1 [7]. V první z uvedených studií totiž v neléčené skupině během 3 let sledování utrpělo novou zlomeninu obratle 32 % žen a ve druhé studii jen 15 % žen.
Pokud jde o neobratlové zlomeniny, které jsou klinicky nejčastější, bylo statisticky významné snížení jejich rizika prokázáno v pivotních klinických studiích antiresorpčních léků jen u pacientek léčených risedronátem [8], kyselinou zoledronovou [9], denosumabem [10] a stroncium ranelátem [11]. Ve velkých klinických studiích se tedy např. ani po 3 letech léčby alendronátem průkazně nesnižovalo riziko zlomeniny distálního předloktí a takto léčenou pacientku s novou Collesovou frakturou lze ujistit, že se nejedná o selhání léčby.
Snížení rizika zlomeniny proximálního femuru bylo v pivotních studiích antiresorpčních léků prokázáno jen u pacientek léčených alendronátem, kyselinou zoledronovou a denosumabem [7, 9, 10], v podskupinách s vysokým rizikem také při léčbě risedronátem a stroncium ranelátem [11, 12].
Všechny antiresorpční léky mají terapeutický potenciál u obratlových i neobratlových zlomenin.
Účinnost osteoanabolické léčby (parathormony, PTH) byla hodnocena v klinických studiích, které trvaly 18 měsíců (PTH 1-34, teriparatid) nebo 21 měsíců (PTH 1-84). U žen léčených PTH 1-84 se průkazně snížilo relativní riziko (RR) obratlových zlomenin (o 61 %), nikoli však RR zlomenin neobratlových [14]. Oproti tomu při léčbě teriparatidem se RR nové morfometrické zlomeniny obratle snížilo o 65 %, klinické zlomeniny obratle o 90 % a RR neobratlové zlomeniny o 53 % [13]. Přestože v tomto ohledu je osteoanabolická léčba zejména teriparatidem mimořádně účinná, nevylučuje ani tato terapie vznik nové zlomeniny.
Z výsledků pivotních studií tedy vyplývá, že za selhání antiresorpční nebo osteoanabolické léčby nelze považovat novou obratlovou ani neobratlovou zlomeninu, pokud k ní došlo po nepřiměřeně malém traumatu u pacientky, která lék užívá pravidelně a doporučeným způsobem, a pokud jsou dokumentovány očekávané změny BMD nebo markerů kostní remodelace. U takové pacientky je vhodné ověřit, zda se během léčby nezměnily rizikové faktory úbytku kostní hmoty (zda není přítomen nový rizikový faktor), ale není zpravidla nutné měnit typ léku (za „účinnější“). Platí však také, že pokud během léčby nedojde k nové obratlové nebo neobratlové zlomenině, není to nezbytně důkazem, že léčba byla u daného pacienta účinná. Vhodným upřesněním by bylo posuzovat novou zlomeninu podle absolutního rizika, s nímž pacientka léčbu začínala.
Za selhání léčby však lze považovat nové zlomeniny, které vzniknou v důsledku antiresorpční terapie, nejpravděpodobněji v důsledku nadměrného útlumu obnovy kostní hmoty. Jedná se zejména o subtrochanterické fraktury a fraktury v jinak netypických místech skeletu u pacientů léčených dlouhodobě alendronátem a některými dalšími aminobisfosfonáty [15]. Podobné fraktury v netypických místech skeletu se však popisují také u pacientů léčených glukokortikoidy a v některých klinicky méně častých situacích, např. při osteopetróze) [16]. Tyto závažné nežádoucí účinky mohou být důsledkem dlouhotrvajícího nadměrného útlumu kostní remodelace [17]. Samotné zjištění subtrochanterické zlomeniny však neznamená, že jde o „atypickou“ frakturu.
![Graf 2 Riziko zlomeniny proximálního femuru u žen léčených aminobisfosfonáty. Subtrochanterické fraktury utrpělo 716 žen, ostatní zlomeniny 9723 žen starších 68 let. Z celkového počtu 52 595 žen léčených aminobisfosfonáty alespoň 5 let utrpělo zlomeninu v subtrochanterické oblasti femuru během jednoho roku 71 žen (0,13 %) a během 2 let 117 žen (0,22 %); podle [22] – Park-Wyllie, et al., 2011.](https://www.remedia.cz/photo-a-28501---.jpg) Za atypické se považují zejména zlomeniny, k nimž dojde v proximální třetině femuru nebo kdekoli v diafýze distálně od malého trochanteru a jejichž vznik se nedá spojit s traumatem nebo je trauma nepřiměřeně malé (pád ze stoje). Úplné zlomeniny jsou zpravidla příčné nebo jen krátce zešikmené, často s mediálním zobcem, a nejsou tříštivé, při neúplné zlomenině je v laterální kortikalis příčná světlá linie [18]. Často pozorované ztluštění laterální kortikalis v místě fraktury svědčí o tom, že jde o stresovou frakturu. Bilaterální fraktury se uvádějí u více než 40 % pacientů s atypickou zlomeninou, opožděné hojení je zaznamenáno u více než třetiny atypických zlomenin a dvě třetiny pacientů s atypickou frakturou uvádějí prodromální bolesti kosti trvající řadu měsíců [15]. „Atypické“ transverzální nebo šikmé zlomeniny tvoří zhruba čtvrtinu subtrochanterických fraktur [19], které však zase tvoří jen 5–10 % všech zlomenin proximálního femuru [20]. V USA se v letech 1999 až 2007 statisticky významně zvýšila incidence subtrochanterických zlomenin proximálního femuru u žen po menopauze (o 20,4 %) a tento nárůst koreloval s nárůstem počtu žen léčených aminobisfosfonáty [21]. Podobné údaje poskytla také kanadská studie [22], viz graf 2. Americká studie, která hodnotila 600 subtrochanterických zlomenin vybraných z celkového počtu 15 000 zlomenin proximálního femuru, potvrdila progresivní zvyšování incidence atypických zlomenin s dobou užívání bisfosfonátů (0,002 %/ rok po dvou letech až 0,078 %/rok po 8 letech) [23]. Atypické zlomeniny femuru však mohou být jen špičkou ledovce, protože po dlouhodobé antiresorpční léčbě se popisují atypické zlomeniny i v jiných místech skeletu [24].
Za atypické se považují zejména zlomeniny, k nimž dojde v proximální třetině femuru nebo kdekoli v diafýze distálně od malého trochanteru a jejichž vznik se nedá spojit s traumatem nebo je trauma nepřiměřeně malé (pád ze stoje). Úplné zlomeniny jsou zpravidla příčné nebo jen krátce zešikmené, často s mediálním zobcem, a nejsou tříštivé, při neúplné zlomenině je v laterální kortikalis příčná světlá linie [18]. Často pozorované ztluštění laterální kortikalis v místě fraktury svědčí o tom, že jde o stresovou frakturu. Bilaterální fraktury se uvádějí u více než 40 % pacientů s atypickou zlomeninou, opožděné hojení je zaznamenáno u více než třetiny atypických zlomenin a dvě třetiny pacientů s atypickou frakturou uvádějí prodromální bolesti kosti trvající řadu měsíců [15]. „Atypické“ transverzální nebo šikmé zlomeniny tvoří zhruba čtvrtinu subtrochanterických fraktur [19], které však zase tvoří jen 5–10 % všech zlomenin proximálního femuru [20]. V USA se v letech 1999 až 2007 statisticky významně zvýšila incidence subtrochanterických zlomenin proximálního femuru u žen po menopauze (o 20,4 %) a tento nárůst koreloval s nárůstem počtu žen léčených aminobisfosfonáty [21]. Podobné údaje poskytla také kanadská studie [22], viz graf 2. Americká studie, která hodnotila 600 subtrochanterických zlomenin vybraných z celkového počtu 15 000 zlomenin proximálního femuru, potvrdila progresivní zvyšování incidence atypických zlomenin s dobou užívání bisfosfonátů (0,002 %/ rok po dvou letech až 0,078 %/rok po 8 letech) [23]. Atypické zlomeniny femuru však mohou být jen špičkou ledovce, protože po dlouhodobé antiresorpční léčbě se popisují atypické zlomeniny i v jiných místech skeletu [24].
Každá nová zlomenina prodělaná během léčby je důvodem pro podrobné ověření její etiologie. Pokud se podle morfologických kritérií prokáže atypická zlomenina, je to důvod pro ukončení antiresorpční léčby a zvážení osteoanabolické terapie, která podle řady kazuistik zlepšuje hojení fraktury [25]. Pokud jde o novou nízkotraumatickou zlomeninu, která nemá charakteristiky atypické fraktury, je vhodné ověřit základní diagnózu a účinnost léčby podle změny BMD. Výpověď biochemických markerů kostní remodelace je u pacientů se zlomeninou prodělanou v posledním roce obtížně hodnotitelná, protože zvýšení koncentrace markerů může být projevem hojení zlomeniny.
Při dlouhodobé nadměrné supresi novotvorby kostní hmoty lze kromě ukončení léčby zvažovat použití méně suprimujícího léku [26]. U pacientů léčených glukokortikoidy je vhodné po úvodní roční antiresorpční terapii zvážit osteoanabolický lék, který překoná útlum novotvorby a navodí potřebné zvýšení kostní hmoty [27].
Změna BMD a biochemického markeru jako ukazatel selhání léčby
Zástupnými ukazateli (surrogates) účinnosti léčby jsou zpravidla změny denzity kostního minerálu (BMD) v bederní páteři, proximálním femuru, případně v distálním předloktí, nebo koncentrace různých biochemických markerů kostní remodelace v séru nebo v moči. Nepřímým potvrzením snížení rizika zlomeniny a očekávaným efektem terapie je v případě antiresorpčního léku snížení kostní remodelace provázené udržením nebo zvýšením BMD. U osteoanabolického léku se očekává významné zvýšení BMD navozené zvýšením remodelace kosti, kdy zvýšení markeru novotvorby kosti (např. syntézy kolagenu typu I) převažuje nad markerem osteoresorpce (např. markerem degradace kolagenu typu I).
V klinických studiích s alendronátem, risedronátem a ibandronátem bylo 8–25 % pacientek, kterým se BMD v bederní páteři po 2 letech léčby nezměnila nebo snížila. Přesto ale pacientky, kterým při užívání perorálních aminobisfosfonátů klesla BMD, měly o 38–60 % nižší riziko zlomenin než ženy, které užívaly placebo [28]. Zvýšením BMD se při antiresorpční terapii osteoporózy vysvětluje pouze malé, byť předpověditelné procento (4–30 %) pozorovaného snížení rizika zlomenin obratlů [29]. Změnu BMD však nelze ani ve velkém souboru nemocných použít k predikci snížení rizika neobratlových zlomenin [30]. Snižování BMD tedy není samo o sobě dostatečným důkazem neúčinnosti léčby. Podobně ani zvyšování BMD samo o sobě není dostatečným důkazem účinnosti léčby. Přes statisticky významné zvýšení BMD i objemu kosti u žen léčených pro postmenopauzální osteoporózu solemi fluoru se riziko zlomenin obratlů u těchto pacientek dokonce zvyšovalo [31].
U žen s postmenopauzální osteoporózou léčených antiresorpčními léky predikuje pokles koncentrace markeru osteoresorpce snížení rizika obratlových fraktur (o 66 %) i neobratlových fraktur [32–36]. V souvislosti s výše uvedenými atypickými zlomeninami u pacientů dlouhodobě léčených velmi účinnými antiresorpčními léky zůstává otevřenou otázkou klinický význam nadměrného snížení markeru remodelace kosti a zejména markeru syntézy kolagenu typu I pro včasnou prevenci atypické zlomeniny. Při snížení sérové koncentrace aminoterminálního propeptidu prokolagenu typu I (PINP) o více než 2,5 SD pod průměr referenčních hodnot, které přetrvává po dobu více než 3 let, lze zvažovat přerušení antiresorpční léčby. Prospektivní studie, které by efekt takového opatření prokázaly, však zatím chybějí. Právě tak ale není zdůvodněno často doporučované přerušování antiresorpční léčby po 3–5 letech, zejména pokud markery kostní remodelace zůstávají v referenčních mezích.
Metodické předpoklady hodnocení účinnosti léčby podle zástupných ukazatelů
Z metodického hlediska je třeba uvést, že k hodnocení účinnosti léčby je vhodné použít metodu, která cíleně a kvantitativně hodnotí právě ten aspekt kvality kosti, který se v dané fázi léčby mění nejprůkazněji (markery v prvních 6 měsících léčby, BMD po roce a později). Současně je nutno ověřit, jaká změna BMD a markeru je na daném pracovišti průkazná. Rozdíly mezi dvěma po sobě jdoucími měřeními BMD nebo markeru je třeba hodnotit se znalostí ověřené nejistoty měření (nejmenší významná změna pro 95% hladinu spolehlivosti, Least Significant Change – LSC, nebo kritická diference – RCV) stanovené pro dané pracoviště (tab. 1). Je třeba mít na paměti, že variabilita a rychlost změn v čase při léčbě jsou odlišné pro BMD a pro markery.
Opatření ke zlepšení účinnosti léčby
Za úspěch léčby lze považovat situaci, kdy pacient neprodělá novou frakturu a současně se u něj průkazně nesníží BMD, přičemž hodnoty markerů remodelace jsou v referenčních mezích. Naopak, nová zlomenina a průkazné snížení BMD jsou nepochybným signálem nedostatečné odpovědi na léčbu, nikoli však selháním účinnosti léku. Pokud se prokáže nová nízkotraumatická fraktura nebo významný pokles BMD (zpravidla po jednom roce) spolu s průkazně nesníženou koncentrací markeru osteoresorpce při antiresorpční terapii, jsou oprávněné pochybnosti o dostatečné účinnosti léčby. Obě situace jsou důvodem pro přehodnocení základní diagnózy a případně pro úpravu dávkování a způsobu užívání léku [4]. Současně je však nutno zdůraznit, že jakékoli klinické vyšetření má opodstatnění, pouze pokud jeho výsledek přispěje k rozhodnutí o dalších klinicky potřebných opatřeních (tab. 1).
Příčinou nedostatečného účinku léčby je ve většině případů nepravidelnost nebo nesprávné užívání léků (non-compliance) nebo přerušení terapie (nedostatečná perzistence) [37, 38]. Jinými příčinami mohou být různé komorbidity, nedostatečný příjem vápníku a vitaminu D, malabsorpce, metabolické faktory, nedostatečná dávka léku aj. Ačkoli nejde o selhání, je zde třeba tyto situace uvést. Špatné vstřebávání léku ze střeva se může individuálně uplatňovat u perorálních aminobisfosfonátů, protože i u zdravých osob se do krve dostává průměrně jen necelé procento z podané dávky aminobisfosfonátu. Podobný problém může nastat, pokud se léky neužívají nalačno a nedodrží se doporučená doba dalšího lačnění (30–60 minut u aminobisfosfonátů, 2 hodiny u stroncium ranelátu). Při léčbě aminobisfosfonáty však lze už po 3–6 měsících ověřit očekávané snížení sérové koncentrace biochemického markeru osteoresorpce (např. beta-CTX). Pokud k poklesu nedojde, je zapotřebí znovu instruovat pacienta o způsobu užívání léku, vysvětlit mu důsledky nedostatečné compliance a perzistence, případně upravit dávku nebo dávkovací interval nebo doporučit parenterálně podávaný lék [37, 39].
Avšak ani parenterální podání antiresorpčního léku nezaručuje očekávaný efekt. Pokud je např. antiresorpční lék podáván pacientovi s hypovitaminózou D, zvýší se ještě více nároky na střevní absorpci vápníku a to může vést k závažné sekundární hyperparatyreóze [40]. Předpokladem očekávané účinnosti léčby je zajištění doporučeného příjmu vápníku a potřebného zásobení vitaminem D, jako tomu bylo i ve všech klinických studiích antiresorpčních a osteoanabolických léků. Platí to i pro prevenci osteoporózy a pro zajištění účinnosti hormonální léčby u pacientek s osteopenií [41].
Práce byla podpořena Záměrem MZd ČR 000 237280.
Seznam použité literatury
- [1] Štěpán J. Posuzování účinnosti terapie osteoporózy. Osteol Bull 2010; 15: 75–79.
- [2] Compston JE. Do we need to monitor anti-osteoporosis treatment anyway? Calcif Tissue Int 2003; 72: 328.
- [3] Confavreux CB, Paccou J, David C, et al. Defining treatment failure in severe osteoporosis. Joint Bone Spine 2010; 77 Suppl 2: S128–132.
- [4] Diez-Perez A, Gonzalez-Macias J. Inadequate responders to osteoporosis treatment: proposal for an operational definition. Osteoporos Int 2008; 19: 1511–1516.
- [5] Ringe JD, Doherty JG. Absolute risk reduction in osteoporosis: assessing treatment efficacy by number needed to treat. Rheumatol Int 2010; 30: 863–869.
- [6] Meunier PJ, Roux C, Seeman E, et al. The effects of strontium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis. N Engl J Med 2004; 350: 459–468.
- [7] Black DM, Cummings SR, Karpf DB, et al. Randomised trial of effect of alendronate on risk of fracture in women with existing vertebral fractures. Lancet 1996; 348: 1535–1541.
- [8] Harris ST, Watts NB, Genant HK, et al. Effects of risedronate treatment on vertebral and nonvertebral fractures in women with postmenopausal osteoporosis: a randomized controlled trial. JAMA 1999; 282: 1344–1352.
- [9] Black DM, Delmas PD, Eastell R, et al. Once-yearly zoledronic acid for treatment of postmenopausal osteoporosis. N Engl J Med 2007; 356: 1809–1822.
- [10] Cummings SR, San Martin J, McClung MR, et al. Denosumab for prevention of fractures in postmenopausal women with osteoporosis. N Engl J Med 2009; 361: 756–765.
- [11] Reginster JY, Seeman E, De Vernejoul MC, et al. Strontium ranelate reduces the risk of nonvertebral fractures in postmenopausal women with osteoporosis: Treatment of Peripheral Osteoporosis (TROPOS) study. J Clin Endocrinol Metab 2005; 90: 2816–2822.
- [12] McClung MR, Geusens P, Miller PD, et al. Effect of risedronate on the risk of hip fracture in elderly women. N Engl J Med 2001; 344: 333–340.
- [13] Neer RM, Arnaud CD, Zanchetta JR, et al. Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med 2001; 344: 1434–1441.
- [14] Greenspan SL, Bone HG, Ettinger MP, et al. Effect of recombinant human parathyroid hormone (1-84) on vertebral fracture and bone mineral density in postmenopausal women with osteoporosis: a randomized trial. Ann Intern Med 2007; 146: 326–339.
- [15] Giusti A, Hamdy NA, Papapoulos SE. Atypical fractures of the femur and bisphosphonate therapy: A systematic review of case/case series studies. Bone 2010; 47: 169–180.
- [16] Birmingham P, McHale KA. Case reports: treatment of subtrochanteric and ipsilateral femoral neck fractures in an adult with osteopetrosis. Clin Orthop Relat Res 2008; 466: 2002–2008.
- [17] Armamento-Villareal R, Napoli N, Panwar V, et al. Suppressed bone turnover during alendronate therapy for high-turnover osteoporosis. N Engl J Med 2006; 355: 2048–2050.
- [18] Shane E, Burr D, Ebeling PR, et al. Atypical subtrochanteric and diaphyseal femoral fractures: report of a task force of the American Society for Bone and Mineral Research. J Bone Miner Res 2010; 25: 2267–2294.
- [19] Neviaser AS, Lane JM, Lenart BA, et al. Low-energy femoral shaft fractures associated with alendronate use. J Orthop Trauma 2008; 22: 346–350.
- [20] Nieves JW, Bilezikian JP, Lane JM, et al. Fragility fractures of the hip and femur: incidence and patient characteristics. Osteoporos Int 2010; 21: 399–408.
- [21] Wang Z, Bhattacharyya T. Trends in incidence of subtrochanteric fragility fractures and bisphosphonate use among the US elderly, 1996–2007. J Bone Mineral Res 2011; 26: 553–560.
- [22] Park-Wyllie LY, Mamdani MM, Juurlink DN, et al. Bisphosphonate use and the risk of subtrochanteric or femoral shaft fractures in older women. JAMA 2011; 305: 783–789.
- [23] Dell R, Greene D, Ott S, Silverman S, et al., editors. A retrospective analysis of all atypical femur fractures seen in a large California HMO from the years 2007 to 2009. ASBMR Annual Meeting; 2010; Toronto, Canada.
- [24] Rachkidi RE, Sari-Leret ML, Wolff S. Atypical bilateral pedicle fracture in long-term bisphosphonate therapy. Spine 2011; in press.
- [25] Visekruna M, Wilson D, McKiernan FE. Severely suppressed bone turnover and atypical skeletal fragility. J Clin Endocrinol Metab 2008; 93: 2948–2952.
- [26] Michalska D, Štěpán JJ, Basson BR, et al. The effect of raloxifene after discontinuation of long-term alendronate treatment of postmenopausal osteoporosis. J Clin Endocrinol Metab 2006; 91: 870–877.
- [27] Teitelbaum SL, Seton MP, Saag KG. Should bisphosphonates be used for long-term treatment of glucocorticoid-induced osteoporosis? Arthritis Rheum 2011; 63: 325–328.
- [28] Sebba AI. Significance of a decline in bone mineral density while receiving oral bisphosphonate treatment. Clin Ther 2008; 30: 443–452.
- [29] Cummings SR, Karpf DB, Harris F, et al. Improvement in spine bone density and reduction in risk of vertebral fractures during treatment with antiresorptive drugs. Am J Med 2002; 112: 281–289.
- [30] Delmas PD, Seeman E. Changes in bone mineral density explain little of the reduction in vertebral or nonvertebral fracture risk with anti-resorptive therapy. Bone 2004; 34: 599–604.
- [31] Meunier PJ, Sebert JL, Reginster JY, et al. Fluoride salts are no better at preventing new vertebral fractures than calcium-vitamin D in postmenopausal osteoporosis: the FAVOStudy. Osteoporos Int 1998; 8: 4–12.
- [32] Hochberg MC, Greenspan S, Wasnich RD, et al. Changes in bone density and turnover explain the reductions in incidence of nonvertebral fractures that occur during treatment with antiresorptive agents. J Clin Endocrinol Metab 2002; 87: 1586–1592.
- [33] Bauer DC, Black DM, Garnero P, et al. Change in bone turnover and hip, non-spine, and vertebral fracture in alendronate-treated women: the fracture intervention trial. J Bone Miner Res 2004; 19: 1250–1258.
- [34] Bjarnason NH, Sarkar S, Duong T, et al. Six and twelve month changes in bone turnover are related to reduction in vertebral fracture risk during 3 years of raloxifene treatment in postmenopausal osteoporosis. Osteoporos Int 2001; 12: 922–930.
- [35] Sarkar S, Reginster J-Y, Crans GG, et al. Relationship between changes in biochemical markers of bone turnover and BMD to predict vertebral fracture risk. J Bone Miner Res 2004; 19: 394–401.
- [36] Eastell R, Hannon RA, Garnero P, et al. Relationship of early changes in bone resorption to the reduction in fracture risk with risedronate: review of statistical analysis. J Bone Miner Res 2007; 22: 1656–60.
- [37] Siris ES, Harris ST, Rosen CJ, et al. Adherence to bisphosphonate therapy and fracture rates in osteoporotic women: relationship to vertebral and nonvertebral fractures from 2 US claims databases. Mayo Clin Proc 2006; 81: 1013–1022.
- [38] Patrick AR, Brookhart MA, et al. The complex relation between bisphosphonate adherence and fracture reduction. J Clin Endocrinol Metab 2010; 95: 3251–3259.
- [39] Payer J, Cierny D, Killinger Z, et al. Preferences of patients with post-menopausal osteoporosis treated with bisphosphonates-the VIVA II study. J Int Med Res 2009; 37: 1225–1229.
- [40] Štěpán JJ, Burckhardt P, Hána V. The effects of three-month intravenous ibandronate on bone mineral density and bone remodeling in Klinefelter's syndrome: the influence of vitamin D deficiency and hormonal status. Bone 2003; 33: 589–596.
- [41] Nieves JW, Komar L, Cosman F, et al. Calcium potentiates the effect of estrogen and calcitonin on bone mass: review and analysis. Am J Clin Nutr 1998; 67: 18–24.
- [42] Liberman UA, Weiss SR, Broll J, et al. Effect of oral alendronate on bone mineral density and the incidence of fractures in postmenopausal osteoporosis. N Engl J Med 1995; 333: 1437–1443.
- [43] Cummings SR, Black DM, Thompson DE, et al. Effect of alendronate on risk of fracture in women with low bone density but without vertebral fractures: results from the Fracture Intervention Trial. JAMA 1998; 280: 2077–2082.
- [44] McCloskey E, Selby P, Davies M, et al. Clodronate reduces vertebral fracture risk in women with postmenopausal or secondary osteoporosis: results of a double-blind, placebo-controlled 3-year study. J Bone Miner Res 2004; 19: 728–736.
- [45] Chesnut CH, Silverman S, Andriano K, et al. A randomized trial of nasal spray salmon calcitonin in postmenopausal women with established osteoporosis: the prevent recurrence of osteoporotic fractures study. Am J Med 2000; 109: 267–276.
- [46] Watts NB, Harris ST, Genant HK, et al. Intermittent cyclical etidronate treatment of postmenopausal osteoporosis. N Engl J Med 1990; 323: 73–79.
- [47] Chesnut IC, Skag A, Christiansen C, et al. Effects of oral ibandronate administered daily or intermittently on fracture risk in postmenopausal osteoporosis. J Bone Miner Res 2004; 19: 1241–1249.
- [48] Reginster J, Minne HW, Sorensen OH, et al. Randomized trial of the effects of risedronate on vertebral fractures in women with established postmenopausal osteoporosis. Osteoporos Int 2000; 11: 83–91.
- [49] Ettinger B, Black DM, Mitlak BH, et al. Reduction of vertebral fracture risk in postmenopausal women with osteoporosis treated with raloxifene: results from a 3-year randomized clinical trial. JAMA 1999; 282: 637–645.