Současná léčba trigeminových autonomních bolestí hlavy
Souhrn:
Nežádal T. Současná léčba trigeminových autonomních bolestí hlavy. Remedia 2019; 29: 158–163.
Trigeminové autonomní bolesti hlavy (TAC) tvoří podle recentní mezinárodní klasifikace ICHD‑3 třetí skupinu primárních bolestí hlavy. Ačkoliv je jejich prevalence relativně nízká, výrazně ovlivňují kvalitu života dané populace pacientů. Jedná se totiž o velmi silné repetitivní unilaterální bolesti s ipsilaterálními autonomními příznaky, jako je například mióza, ptóza, slzení nebo kongesce nosní sliznice. Podle délky trvání a frekvence atak je můžeme rozdělit do čtyř podjednotek: cluster headache (syndrom nakupených bolestí hlavy), paroxysmální hemikranie, krátce trvající jednostranné neuralgiformní bolesti hlavy (SUNCT/SUNA) a hemicrania continua. Přestože je patofyziologický podklad jednotlivých podskupin obdobný, terapeutické postupy se částečně liší a stávají se tak i jejich diferenciálně diagnostickým kritériem. Přes mnohá recentní vědecká zjištění zůstávají TAC obtížně léčitelným neurologickým problémem.
Summary:
Nezadal T. Current treatment of trigeminal autonomic cephalalgias. Remedia 2019; 29: 158–163.
According to the recent International Classification of Headache Disorders (ICHD‑3), trigeminal autonomic cephalalgias (TAC) form the third group of primary headaches. Although their prevalence is relatively low, they significantly affect the quality of life of said patient population. TAC are characterized by strong repetitive unilateral pain with ipsilateral autonomic symptoms such as myosis, ptosis, tearing or nasal mucosa congestion. Depending on the duration and frequency of attacks, we can divide TAC into 4 subunits: cluster headache, paroxysmal hemicrania, short‑lasting unilateral neuralgiform headaches (SUNCT/SUNA) and hemicrania continua. Although the pathophysiological background of the individual subgroups is similar, the therapeutical procedures differ somewhat and thus become their differential diagnosis criterion. Despite many recent scientific findings, the TAC remains a difficult‑to‑treat neurological problem.
Key words: trigeminal autonomic cephalalgias, cluster headache,,pharmacotherapy, neuromodulation.
Úvod
Trigeminové autonomní bolesti hlavy
(trigeminal autonomic cephalalgias, TAC) jsou v nejnovější
verzi klasifikace ICHD 3 (International Classification of
Headache Disorders 3) z ledna 2018 řazeny na třetí
místo primárních bolestí hlavy – za migrénu a tenzní
bolesti hlavy. Jsou charakterizovány středně až velmi silnou
nepříjemnou bodavou nebo hlubokou vrtavou bolestí a jsou
spojeny se stejnostrannými autonomními obličejovými příznaky,
jak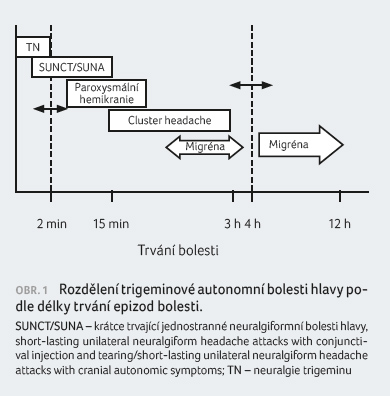 o je slzení oka, nastříknutí spojivek, otok očního víčka,
ptóza, mióza, rinorea a kongesce nosní sliznice. Jednotlivé
syndromy TAC se liší trváním a frekvencí atak bolesti,
u cluster headache (CH) jsou nejdelší a nejméně
frekventní, kratší u paroxysmální hemikranie (PH) a velmi
krátké a nejčetnější u krátce trvajících
jednostranných neuralgiformních bolestí hlavy (SUNC/SUNA), obr. 1. Hemicrania continua (HC)
je chronická perzistentní bolest s kolísavou intenzitou
a s atakami silnější bolesti. V diferenciální
diagnóze při neuralgii trigeminu jsou bolesti velmi krátké, bez
bolesti hlavy frontálně nebo periorbitálně a zpravidla bez
autonomních příznaků. Ataka CH může v některých
případech trvat déle než 4 hodiny, naopak migréna může mít
při adekvátní akutní terapii dobu trvání kratší než 4 hodiny
(viz také tab. 1).
o je slzení oka, nastříknutí spojivek, otok očního víčka,
ptóza, mióza, rinorea a kongesce nosní sliznice. Jednotlivé
syndromy TAC se liší trváním a frekvencí atak bolesti,
u cluster headache (CH) jsou nejdelší a nejméně
frekventní, kratší u paroxysmální hemikranie (PH) a velmi
krátké a nejčetnější u krátce trvajících
jednostranných neuralgiformních bolestí hlavy (SUNC/SUNA), obr. 1. Hemicrania continua (HC)
je chronická perzistentní bolest s kolísavou intenzitou
a s atakami silnější bolesti. V diferenciální
diagnóze při neuralgii trigeminu jsou bolesti velmi krátké, bez
bolesti hlavy frontálně nebo periorbitálně a zpravidla bez
autonomních příznaků. Ataka CH může v některých
případech trvat déle než 4 hodiny, naopak migréna může mít
při adekvátní akutní terapii dobu trvání kratší než 4 hodiny
(viz také tab. 1).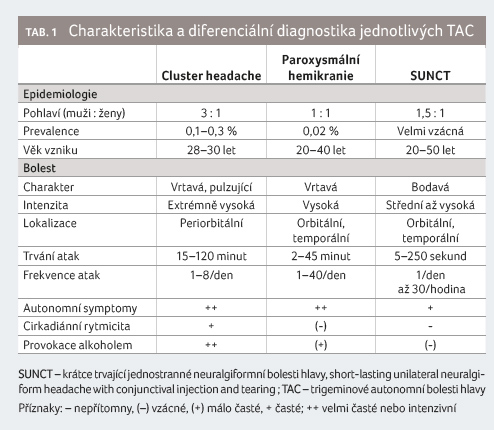
I když se jedná o vzácné poruchy, mohou být TAC, a zejména pak CH, geneticky vázané. Genetické epidemiologické průzkumy prokázaly, že příbuzní prvního stupně pacientů s CH mají vyšší (14–48krát) pravděpodobnost, že se u nich onemocnění objeví. Polymorfismy HCRTR2 1246G> A a ADH4 925A> G jsou asociovány s CH. Farmakogenetické studie naznačily, že polymorfismus GNB3 825C> T může modifikovat odpověď na léčbu triptany mezi pacienty trpícími CH [1].
Patofyziologie
Patofyziologie TAC není ještě jednoznačně objasněna. Základními jsou tři okruhy: trigeminovaskulární systém, periodicita a autonomní příznaky. Stále probíhá diskuse o převaze periferního oproti centrálnímu typu bolesti. Centrální původ nyní převažuje, neboť proti perifernímu svědčí například genderová vazba nebo cirkadiánní rytmicita u CH. Obdobně jako u migrény hraje vůdčí roli trigeminovaskulární systém. Vzhledem k lokalizaci bolesti se předpokládá účast oftalmické části trigeminu s perivaskulární reakcí [2] i v oblasti vnitřní karotidy s lokálními vlivy chemickými i prostorovými při vazodilataci – dysfunkcí sympatiku (Hornerův syndrom) a iritaci parasympatiku (lakrimace, nosní kongesce). Změny však trvají i po odeznění nebo bez vazodilatace [3]. Stimulace trigeminu spouští i takzvaný trigeminoparasympatický reflex (TPR) cestou nucleus salivatorius superior a ganglion sphenopalatinum s postganglionickým vlivem na žlázy, sliznice a cévy v dané oblasti [4]. Aktivaci parasympatiku odpovídá zvýšená koncentrace vazoaktivního intestinálního peptidu (vasoactive intestinal peptide, VIP). Dalšími vyplavenými působky jsou CGRP (calcitonin gene related peptide) a oxid dusnatý (NO). Infuze CGRP vyvolá bolest v aktivní fázi epizodické i chronické CH, ale ne v remisi [5]. Naopak indometacin snižuje koncentrace VIP a CGRP u PH a CGRP u CH [6]. U některých subtypů TAC jsou přítomny periferní triggery obdobné neuralgii trigeminu, nejvíce u SUNCT (krátce trvající jednostranné neuralgiformní bolesti hlavy, short lasting unilateral neuralgiform headache attacks with conjunctival injection and tearing) [7].
Zásadní roli v centrálních mechanismech vzniku TAC (periodicita, rytmicita, vazba na spánek) hraje zadní část hypotalamu. Experimentální výsledky prokázaly, že jeho stimulace významně inhibovala podněty vyvolanou aktivitu v kaudální části jádra trigeminu [8]. Hypothalamus posterior přes dorzální retikulární jádro ovlivňuje ganglion sphenopalatinum a TPR. Nucleus suprachiasmaticus přední části hypotalamu přijímá impulzy přímo z oblasti retiny a podílí se tak na řízení sekrece melatoninu. Při CH je 24hodinová produkce melatoninu snížená, pozorovány jsou i sezonní vlivy [9]. Kromě melatoninu je u CH snížena sekrece hypokretinu z posterolaterálního hypotalamu, který má vliv na modulaci bolesti a na cyklus spánku a bdění, na hypofyzární hormony a na tvorbu melatoninu [10]. Efekt hluboké stimulace (deep brain stimulation, DBS) hypotalamu u CH uvedené závěry potvrzuje [11]. V případě HC jsou postiženy i kmenové oblasti typické pro migrénu (dorzální pons, locus coeruleus a periakveduktální šedá hmota) [12]. Byly pozorovány i sekundární TAC, a proto by mělo být u všech TAC provedeno vyšetření mozku magnetickou rezonancí. Charakteristika jednotlivých TAC je uvedena v tabulce 1 [13].
Cluster headache
Cluster headache, syndrom nakupených bolestí hlavy (dříve též erytromelalgie, erytroprosopalgie, histaminová bolest hlavy, Hortonova bolest hlavy, Sluderova neuralgie) je nejčastější TAC s těžkou periorbitální bolestí hlavy a s výraznými ipsilaterálními autonomními příznaky (nejčastější je slzení, v 90 %). Incidence se pohybuje mezi 0,05−0,3 % a je vyšší u mužů (v poměru k ženám asi 3 : 1, jak uvádějí novější studie). Typický věk vzniku je mezi 20−29 lety [14]. Unikátní je cirkadiánní a cirkanuální periodicita u epizodické formy. Ataky bolesti trvající 15−180 minut se objevují nejméně jedenkrát denně v úseku několika týdnů ve stejnou dobu ve dne nebo v noci. Aktivní periody (6−12 týdnů) jsou následovány remisí v trvání týdnů i roků. Záchvaty bolesti jsou kratší a slabší na začátku a na konci periody. Počátek aktivního období bývá sezonní, na jaře nebo na podzim. Byla pozorována i vazba na délku denního světla a na změnu časového pásma.
Rozlišujeme dva různé typy CH: epizodická forma (v 80−85 %, s nejméně dvěma clustery a více než měsíčním bezbolestným obdobím) a forma chronická, kdy se ataky opakují po dobu více než jednoho roku bez remise nebo s remisemi kratšími než jeden měsíc. Může být přítomna i interiktální bolest jiného charakteru. Polovina pacientů s chronickou CH přechází zpět do epizodické formy [14]. Délka atak se s průběhem onemocnění může prodlužovat. Noční CH se vyskytuje asi v 51−73 % a bolest hlavy je vázána na začátek REM fáze. Následná spánková deprivace vede k časnému nástupu REM a ke spouštění bolesti. Pacienti s CH mají větší sklon k syndromu obstrukční spánkové apnoe [15], léčba jedné entity zlepšuje i druhou. Alkohol provokuje záchvaty bolesti. Překvapivě i u tak dramatického syndromu trvá diagnostika onemocnění průměrně 3−6 let. Pacienti bývají často vyšetřováni stomatologem (34−45 %) nebo otorinolaryngologem (27−33 %) [16].
Terapie cluster headache
Akutní léčba CH
Lékem první volby jsou triptany, agonisté serotoninových receptorů 5 HT1B/1D. Vzhledem k nutnosti rychlého účinku volíme formu nosního spreje (sumatriptan 20 mg, zolmitriptan 5 mg již není k dispozici) nebo subkutánní injekce (sumatriptan 6 mg). Triptany jsou kontraindikovány u pacientů s infarktem myokardu v anamnéze, u ischemické choroby srdeční, u významných srdečních arytmií, cévní mozkové příhody nebo tranzitorní ischemické ataky v anamnéze, u onemocnění periferních cév, při nekontrolované hypertenzi, u těžkého poškození jater. Dále při současném podávání ergotaminu, inhibitorů monoaminooxidázy (MAO) a při léčbě lithiem.
Dobrý efekt měl i dihydroergotamin ve formě nosního spreje nebo ve formě injekcí. Po nástupu triptanů a vzhledem k četným potenciálním nežádoucím účinkům, jako jsou akutní nauzea, zvracení, křeče v břiše nebo chronické poruchy cirkulace způsobené vazokonstrikcí a retroperitoneální fibróza, bylo používání dihydroergotaminu v léčbě omezeno a v současné době není v ČR v žádné formě registrován.
Inhalace 100% kyslíku (O2) je dostupná při akutním ošetření v ambulantní péči, ale kyslíkovou láhev lze objednat na základě neurologického doporučení do domácí péče (u firmy Linde). Doporučená aplikace je rychlostí 10−12 l/min (u rezistentních bolestí 15 l/min) po dobu přibližně 15 minut [17].
Vcelku jednoduchou lokální akutní terapií CH je blokáda ganglion sphenopalatinum 4% lidokainem aplikovaným transnazálně, ve starší studii u 30 pacientů s CH nastala úleva ve 27 % případů [18]. Další variantou je obstřik okcipitálního nervu 1% mezokainem, popřípadě kortikoidem.
Překlenovací léčba CH
V krátké překlenovací terapii CH se užívá metylprednisolon v dávce od 80 mg denně první 2 dny s redukcí o 20 mg každé 2 dny a poslední 2 dny v dávce 10 mg za den. Další variantou je opět blokáda okcipitálního nervu.
Profylaktická léčba CH
Profylaktickou léčbu zahajujeme hned na začátku periody (nebo dalších period), v léčbě pokračujeme tak dlouho, dokud bolest neodezní, a léčbu ukončujeme nejdříve po dvou týdnech, kdy je již pacient bez bolestí. Dlouhodobější léčba zpravidla nezabrání vzniku další periody epizodické CH.
Lékem první volby je kalciový blokátor verapamil pro svoji účinnost, relativní bezpečnost a menší množství interakcí (inhibice metabolismu). V nerandomizované studii zahrnující 48 pacientů (33 s epizodickou CH a 15 s chronickou CH) došlo u 69 % z nich ke zlepšení o více než 75 %. Průměrná denní dávka verapamilu byla 354 mg (240−600 mg) u epizodické CH a 572 mg u chronické CH. Tři pacienti užívající dávku 240 mg/den přerušili léčbu pro nežádoucí účinky [19]. Multicentrická zaslepená studie srovnávala u pacientů s chronickou CH efekt 360 mg verapamilu a 900 mg lithia za den. Obě léčby byly efektivní, klinické zlepšení činilo 50 % při podávání verapamilu a 37 % u lithia. Incidence nežádoucích účinků byla nižší u verapamilu (12 % vs. 29 %) [20]. Verapamil se podává v dávce 240−480 mg/den (max. 960 mg), a to 3× denně 80 mg, nebo lépe v retardované formě 240 mg jednou denně. Začíná se od dávky 80 mg/den, která se zvyšuje na 3× 80 mg denně během 3−5 dnů a dále se titruje pozvolna, za kontroly EKG při vzestupu o 80 mg nebo po třech měsících léčby. Zejména při vyšších dávkách vzniká riziko arteriální hypotenze, bradykardie, atrioventrikulárního bloku, při dlouhodobém užívání je možná hyperplazie gingiv.
K léčbě druhé volby řadíme topiramát a lithium carbonicum.
Topiramát se podává v dávce obvyklé v profylaktické léčbě migrény, od 25 mg/den do průměrné denní dávky 100 mg, nicméně dle intenzity bolesti lze vystoupat až nad 200 mg/den. Mezi specifické nežádoucí účinky lze zařadit parestezie, redukci hmotnosti, vzácně reverzibilní akutní glaukom s myopií nebo nefrolitiázu. V kombinované léčbě se může vyskytnout porucha kognice nebo zhoršení řeči. Ve vyšší dávce, nad 200 mg na den, může topiramát snižovat účinnost hormonální kontracepce.
Lithium carbonicum je indikováno k léčbě chronické CH až při neúspěchu ostatních farmak vzhledem k úzkému terapeutickému oknu s nutností kontroly sérových koncentrací a kvůli vysokému počtu nežádoucích účinků. Celkem ve více než 28 klinických studiích zahrnujících 468 pacientů byly dobré až výborné výsledky referovány u 78 % pacientů s chronickou CH a u 63 % pacientů s epizodickou CH [21]. V placebem kontrolované studii však nebyl efekt léčby lithiem tak významný [22]. Počáteční dávka je 300 mg na noc a zvyšuje se maximálně do 900 mg/den. Sérová koncentrace lithia by se měla pohybovat v rozmezí 0,6–1,2 mmol/l. Nejčastějšími nežádoucími účinky jsou třes, průjem a polyurie.
Léčbu další volby představuje kyselina valproová nebo valproát sodný. V klinických studiích prokázal tento přípravek nejednoznačné výsledky – v otevřeném malém souboru měl relativní efekt u 11 z celkem 15 pacientů, ale v zaslepené studii s 96 pacienty zůstalo jeho podávání bez výrazného rozdílu oproti placebu [23]; je proto užíván až jako terapie další volby ve standardní dávce od 500 mg denně. Mezi možné nežádoucí účinky léčby patří zvýšení tělesné hmotnosti, tremor, alopecie, hepatální a pankreatická dysfunkce. Valproát je kontraindikován u žen ve fertilním věku pro riziko vrozených vývojových vad.
Melatonin může mít efekt u nočních CH při podávání v typické dávce 9 mg. Byla provedena pouze dvojitě zaslepená pilotní studie bez jednoznačného závěru [24]. Limitací je cena nehrazeného přípravku.
Methysergid byl lékem účinným v profylaxi CH v dávce 3× 2 mg/den. Léčbu bylo nutné přerušit jednou za 4 měsíce na alespoň 2 týdny vzhledem k nežádoucím účinkům (fibrotickým komplikacím jako u jiných námelových derivátů). Léčba methysergidem nyní není doporučena a výrobce ukončil jeho produkci. Účinek gabapentinu v některých studiích a nízké riziko nežádoucích účinků a interakcí může být důvodem k jeho vyzkoušení v léčbě epizodické i chronické CH.
Klonidin v transdermálním podání prokázal svůj pozitivní vliv na CH v jedné studii [25], ale nezopakoval jej v dalších.
Onabotulinumtoxin A byl aplikován u pacientů s CH s částečným efektem.
Potenciální možností terapie CH
jsou CGRP monoklonální protilátky. Dvouměsíční studie
prokázala, že galcanezumab
redukoval výskyt frekventních atak CH (17,5/týden)
o 50 % během prvních tří týdnů ve srovnání
s placebem [26]. Terapie CH a dalších TAC je přehledně
uvedena v tabulce 2.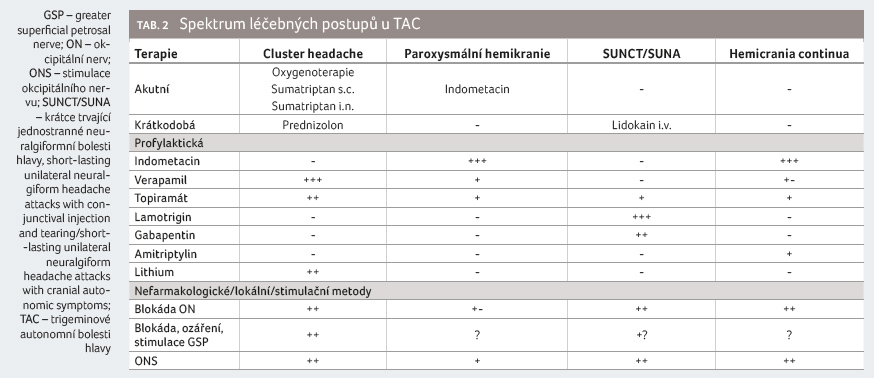
Paroxysmální hemikranie
Paroxysmální hemikranie (PH) se
vyskytuje podle recentních studií v poměru 1 : 1 u žen
a mužů [27]. Střední věk počátku obtíží je kolem 34−41
let. Záchvaty u PH jsou obdobné jako u CH, ale kratšího
trvání (2−30 minut) v nejméně pěti atakách/den,
ipsilaterální autonomní známky jsou obdobné jako u CH.
Zásadním diagnostickým kritériem je přerušení záchvatů
indometacinem (tab. 3).
Ataky se mohou objevit i ve spánku, ale méně často než
u CH, a také zpravidla chybí cirkadiánní a anuální
periodicita. Spouštěči bolestí mohou být stres, úleva
po stresu, cvičení, alkohol a také pohyby krční páteří
[27]. Existuje epizodická (20 %) a chronická forma PH, která
je častější.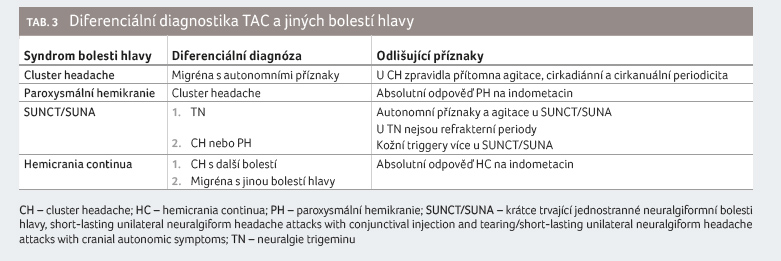
Akutní léčba PH
Ačkoliv se objevily občasné zmínky o částečném efektu sumatriptanu (ataky jsou také velmi krátké), v malé studii u sedmi pacientů se subkutánním podáním 6 mg sumatriptanu nebyl jeho efekt prokázán [28]. Kyslík při akutním podání není u PH účinný [27].
Indometacin je zlatým standardem léčby PH a je také diagnostickým nástrojem ve formě modifikovaného „Indotestu“. Indotest byl prováděn při dostupnosti i.v. formy indometacinu 50−100 mg a efekt byl srovnáván s placebem. Ve studii bylo šesti pacientům s PH podáno první den 50 mg a druhý den 100 mg indometacinu. Dva pacienti dostali placebo. Úlevy od bolesti bylo dosaženo na dobu 8,2 ± 4,2 hodiny (dávka 50 mg) a 11,1 ± 3,5 hodiny (dávka 100 mg) ve srovnání před zahájením terapie, kdy další bolest započala již za 51 ± 18 minut. Terapie placebem nepřinesla zlepšení (94 min před terapií a 58 min po léčbě). V jiné studii referovalo sedm pacientů úplný ústup bolesti po dobu 13,4 ± 7,7 hodiny [29,30]. Výhodou „Indotestu“ je možnost rychlého stanovení diagnózy.
Místo i.v. podání je k dispozici indometacin 50 mg a 100 mg ve formě rektálních čípků. Perorální terapie (podle doporučení zároveň s přidáním gastroprotektiva) začínala dávkou 25 mg podávanou po dobu 3 dnů, poté dávkou 50 mg na 10 dnů a u parciálních respondérů a non respondérů dále pokračovala v dávce 75 mg podávané 10 dnů. Pakliže se stav při léčbě touto dávkou nelepší, je třeba přehodnotit diagnózu PH. Ve starších studiích činila užitá dávka 25−300 mg s mediánem 150 mg/den [31]. V současné době však není perorální indometacin v ČR dostupný. Při akutním podání jsou někdy pozorovány závratě, rizikem dlouhodobého podávání indometacinu jsou gastrointestinální nežádoucí účinky, více v perorální než v rektální formě, nejčastěji riziko vředové choroby. Pareja sledoval 26 pacientů trpících PH nebo HC po průměrnou dobu 3,8 roku od začátku užívání terapie, z nichž přibližně čtvrtina měla gastrointestinální nežádoucí účinky, které ustoupily po zahájení léčby ranitidinem. Proto je doporučeno užívat současně s indometacinem gastroprotektiva [31].
V případě, že indometacin není tolerován, lze v druhé linii použít jiná nesteroidní antirevmatika (NSAID), jako je aspirin, naproxen nebo diklofenak. Variantou je přípravek s preferenčním působením na cyklooxygenázu 2 (COX2) nimesulid. Podle literatury byly podávány inhibitory COX2 (rofekoxib, celekoxib), které nejsou nyní užívány pro kardiovaskulární a cerebrovaskulární riziko.
Profylaktická léčba PH
V profylaktické léčbě chronické PH lze zvážit verapamil v obdobné dávce jako u CH. V otevřené studii se souborem 10 pacientů byl u poloviny z nich v profylaxi účinný verapamil (do dávky 320 mg/den) [32]. V našem souboru sledujeme pacientku, která je po dobu dvou let kompenzována při léčbě verapamilem, dříve byla rezistentní na léčbu topiramátem a byl u ní zaznamenán pouze přechodný efekt léčby indometacinem. Z dalších kalciových blokátorů lze vyzkoušet flunarizin (u nás je již několik let nedostupný). Na následujícím místě je topiramát. Účinnost další medikace, jako je dihydroergotamin, methysergid, acetaminofen s kofeinem, lamotrigin, gabapentin a lithium carbonicum, byla prezentována v kazuistických sděleních. Na tomto místě je však samozřejmě potřeba zvážit i diferenciální diagnózy. Lokální nervové blokády nemají efekt a u jednoho pacienta byla účinná stimulace ipsilaterálního zadního hypotalamu.
V letošním roce vyšla práce o efektu neinvazivní vagové stimulace u PH, u šesti pacientů z osmi došlo k redukci frekvence záchvatů o 50 %, u dvou pak o 75 % [33].
Krátce trvající neuralgiformní bolest hlavy (SUNCT/SUNA)
Tyto syndromy mají nejkratší trvání atak (1−600 s) s frekvencí 3−200 záchvatů za den, jsou o něco častější u mužů než u žen a rozlišují se dva typy podle přítomnosti doprovodných příznaků. SUNCT (Short lasting Unilateral Neuralgiform headache attacks with Conjunctival injection and Tearing) je bolest spojená se slzením oka a se zarudnutím spojivky a SUNA (Short lasting Unilateral Neuralgiform headache attacks with cranial Autonomic symptoms), která je v ICHD 3 odlišena přítomností pouze jednoho nebo žádného z uvedených autonomních příznaků. SUNCT je tedy pravděpodobně podjednotkou SUNA. Bolest je středně silná až silná, bodavá, lokalizovaná v oblasti kolem jednoho oka, šíří se frontálně, do spánku, ke kořeni nosu, do tváře či patra. Bolest je doprovázena autonomními příznaky. Rozeznáváme tři typy průběhu bolestí: a) jednotlivá bodnutí, b) skupiny bodnutí a c) pilovitý charakter bolesti, bez plné úpravy. U některých pacientů je bolest vyvolána stimulací trigger zóny (dotyk obličeje nebo hlavy, mytí hlavy, česání vlasů, holení, dýchání nosem, žvýkání, čištění zubů, mluvení, kašel, cvičení, ostré světlo). Diagnóza je stanovena po prodělání 20 atak.
Terapie SUNCT/SUNA
Bolesti hlavy u SUNCT/SUNA jsou rezistentní na akutní léčbu včetně triptanů a indometacinu. Efekt může mít metylprednisolon v obdobném dávkovacím schématu jako u překlenovací léčby CH. V profylaktické léčbě jsou užívána antiepileptika: v první řadě lamotrigin, jehož efekt je uváděn přibližně v 66 % případů [34], a až v druhé řadě topiramát a gabapentin.
Lamotrigin má široké receptorové spektrum působení, vedle inhibice sodíkových kanálů ovlivňuje i R typ kalciových kanálů obdobně jako topiramát a tím může být vysvětlen jeho efekt v léčbě bolestí hlavy (SUNCT/SUNA, vestibulární migréna). Má nízký sedativní účinek, pozitivní psychotropní efekt, používá se v psychiatrii jako stabilizátor nálady a pro vlastní antidepresivní účinek. Nevýhodou je nutnost pomalého zahajování léčby pro riziko vzniku závažných idiosynkratických účinků při rychlé titraci (rash až v 5–10 %). V terapii SUNCT/SUNA se běžně užívá 100−300 mg lamotriginu.
Intravenózní lidokain v infuzi 1,5−3,5 mg/kg/h po dobu sedmi dní byl účinný u čtyř pacientů trpících rezistentní SUNCT a těžkým lokálním drážděním, které jim bránilo jíst a pít. Efekt léčby trval týdny až měsíce po ukončení infuze. Dva pacienti poté byli kompenzováni léčbou topiramátem [35].
Hemicrania continua
Hemicrania continua (HC) je syndrom kontinuálních unilaterálních bolestí hlavy a obličeje, které trvají bez přerušení po dobu nejméně tří měsíců. Poměr výskytu u žen a mužů činí 2–2,8 : 1, se středním věkem nástupu ve 28–33 letech [36]. Na pozadí konstantní bolesti exacerbují silné bolesti hlavy, které trvají hodiny až dny. Ataky bolesti jsou spojeny s ipsilaterálními kraniálními autonomními symptomy, s agitací nebo neklidem. Svědění nebo pocit písku v oku byly často hodnoceny jako identifikační příznak HC, ale pravděpodobně se jedná o společný příznak všech TAC [37]. Hemicrania continua má některé společné rysy s migrénou, například agravaci bolesti námahou nebo fotofobii. Onemocnění má dvě formy: remitentní (2−15 dní bez bolesti) a kontinuální. Hemicrania continua je často poddiagnostikována (čas do stanovení správné diagnózy je průměrně 5 let) a neléčena [38].
Terapie HC
Zlatým standardem léčby HC je indometacin (s efektem až u 68 % pacientů) [39]. V případě intolerance indometacinu lze vyzkoušet jiná NSAID s preferencí COX-2. V malém souboru čítajícím devět pacientů s HC (z retrospektivního souboru 1 600 pacientů specializované ambulance pro bolesti hlavy za 19 let) byl prokázán při podávání amitriptylinu v dávce 50−75 mg/den efekt v 67 %, při podávání gabapentinu v dávce 1 800 mg efekt v 20 % a u topiramátu podávaného v dávce 50 mg byl zaznamenán efekt v 10 % [40].
Neurochirurgické intervence u TAC
Stimulace okcipitálního nervu (ONS), která byla popsána u chronické migrény, je slibnou možností i u CH. Pacientů s CH je poměrně méně než trpících chronickou migrénou, ale i u nás s nimi máme zkušenost [41,42]. Dobrý efekt byl sledován i u SUNCT/SUNA [43] a HC [44], nikoliv u PH.
Ozáření ganglion sphenopalatinum gama nožem je indikováno u chronické formy CH.
Ze starších metod je známá radiofrekvenční termokoagulace ganglion trigeminale, ale s možností vzniku lokálních bolestivých příznaků.
Stimulace ganglion sphenopalatinum mikročidlem (SPGS), kdy je pod lícní kost chirurgicky zaveden do blízkosti ganglia mikrostimulátor řízený externím ovladačem, je nyní propagována v zahraničí. V ČR zatím není k dispozici [45,46].
Hluboká stimulace zadního hypotalamu (DBS) je užívána v léčbě CH a dalších TAC, ve světě byly uskutečněny implantace s dobrým efektem již u více než 60 pacientů [11]. Málo frekventním, ale závažným nežádoucím účinkem zde může být intracerebrální krvácení.
Závěr
Syndromy TAC jsou charakterizovány silnými unilaterálními bolestmi s autonomními příznaky, liší se tíží a trváním jednotlivých atak. Hlavní roli v patofyziologických mechanismech vzniku bolestí hraje zadní hypotalamus s přímými hypotalamo trigeminálními spoji a modulující trigemino autonomní reflex. Léčebné postupy jsou specifické pro určitý syndrom vyjma blokády nebo stimulace okcipitálního nervu, které mohou být účinné u většiny TAC.
Seznam použité literatury
- [1] Russell MB. Epidemiology and genetics of cluster headache. Lancet Neurol 2004; 3: 279.
- [2] Gobel H, Czech N, Heinze‑Kuhn K, et al. Evidence of regional protein plasma extravasation in cluster headache using Tc‑99m albumin SPECT. Cephalalgia 2000; 20: 287.
- [3] Leone M, Bussone G. Pathophysiology of trigeminal autonomic cephalalgias. Lancet Neurol 2009; 8: 755–764.
- [4] Holland PR, Afridi S. Migraine Pathophysiology. ACNR 2014; 13: 19.
- [5] Vollesen ALH, Snoer A, Beske RP, et al. Effect of Infusion of Calcitonin Gene‑Related Peptide on Cluster Headache Attacks: A Randomized Clinical Trial. JAMA Neurol 2018; 75: 1187–1197.
- [6] Goadsby PJ, Edvinsson L. Human in vivo evidence for trigeminovascular activation in cluster headache: neuropeptide changes and effects of acute attacks therapies. Brain 1994; 117: 427–434.
- [7] Lain AH, Caminero AB, Pareja JA. SUNCT syndrome: absence of refractory periods and modulation of attack duration by lengthening of the trigger stimuli. Cephalalgia 2000; 20: 671–673.
- [8] Gelfand AA, Reider AC, Goadsby PJ. Cranial autonomic symptoms in pediatric migraine are the rule, not the exception. Neurology 2013; 81: 431.
- [9] Waldenlind E, Gustafsson SA, Ekbom K, et al. Circadian secretion of cortisol and melatonin in cluster headache during active cluster periods and remission. J Neurol Neurosurg Psychiatry 1987; 50: 207–213.
- [10] Stillman M, Spears R. Endocrinology of cluster headache: potential for therapeutic manipulation. Curr Pain Headache Rep 2008; 12: 138–144.
- [11] Leone M, Franzini A, Cecchini AP, et al. Hypothalamic deep brain stimulation in the treatment of chronic cluster headache. Ther Adv Neurol Disord 2010; 3: 187–195.
- [12] Matharu MS, Cohen AS, McGonigle DJ, et al. Posterior hypothalamic and brainstem activation in hemicrania continua. Headache 2004; 44: 747.
- [13] Goadsby PJ, Lipton RB. A review of paroxysmal hemicranias, SUNCT syndrome and other short‑lasting headaches with autonomic feature, including new cases. Brain 1997; 120: 193–209.
- [14] Manzoni GC, Terzano MG, Bono G, et al. Cluster headache: clinical findings in 180 patients. Cephalalgia 1983; 3: 21–30.
- [15] Chervin RD, Zallek SN, Lin X, et al. Timing patterns of cluster headaches and association with symptoms of obstructive sleep apnea. Sleep Res Online 2000; 3: 107–112.
- [16] Larner AJ. Trigeminal autonomic cephalalgias: frequency in a general neurology clinic setting. J Headache Pain 2008; 9: 325–326.
- [17] Cohen AS, Burns B, Goadsby PJ. High‑flow oxygen for treatment of cluster headache: a randomized trial. JAMA 2009; 302: 2451.
- [18] Robbins L. Intranasal lidocaine for cluster headache. Headache 1995; 35: 83–84.
- [19] Gabai IJ, Spierings ELH. Prophylactic treatment of cluster headache with verapamil. Headache 1989; 29: 167–168.
- [20] Bussone G, Leone M, Peccarisi M, et al. Double blind comparison of lithium and verapamil in cluster headache prophylaxis. Headache 1990; 30: 411–417.
- [21] Ekbom K. Lithium for cluster headache: review of the literature and preliminary results of long‑term treatment. Headache 1981; 21: 132–139.
- [22] Steiner TJ, Hering R, Couturier EG, et al. Double‑blind placebo‑controlled trial of lithium in episodic cluster Headache. Cephalalgia 1997; 17: 673–675.
- [23] El Amrani M, Massiou H, Bousser MG. A negative trial of sodium valproate in cluster headache: methodological issues. Cephalalgia 2002; 22: 205–208.
- [24] Leone M, D’Amico D, Moschiano F, et al. Melatonin versus placebo in the prophylaxis of cluster headache: a double‑blind pilot study with parallel groups. Cephalalgia 1996; 16: 494–496.
- [25] Leone M, Attanasio A, Grazzi L, et al. Transdermal clonidine in the prophylaxis of episodic cluster headache: an open study. Headache 1997; 37: 559−560.
- [26] Lilly Receives FDA Priority Review Designation for Emgality (galcanezumab‑gnlm) Injection for the Preventive Treatment of Episodic Cluster Headache in Adults [news release]. Eli Lilly. Dostupné na: https://investor.lilly.com/news‑releases/news‑release‑details/lilly‑receives‑fda‑priority‑review‑designation‑emgalityr. Accessed March 5, 2019.
- [27] Cittadini E, Matharu MS, Goadsby PJ. Paroxysmal hemicrania: A prospective clinical study of 31 cases. Brain 2008; 131: 1142–1155.
- [28] Antonaci F, Pareja JA, Caminero AB, Sjaastad O. Chronic paroxysmal hemicrania and hemicrania continua: Lack of efficacy of sumatriptan. Headache 1998; 38: 197–200.
- [29] Antonaci F, Pareja JA, Caminero AB, Sjaastad O. Chronic paroxysmal hemicrania and hemicrania continua. Parenteral indomethacin: The ‘indotest’. Headache 1998; 38: 122–128.
- [30] Pareja J, Sjaastad O. Chronic paroxysmal hemicrania and hemicrania continua. Interval between indomethacin administration and response. Headache 1996; 36: 20–23.
- [31] Pareja JA, Caminero AB, Franco E, et al. Dose, efficacy and tolerability of long‑term indomethacin treatment of chronic paroxysmal hemicrania and hemicrania continua. Cephalalgia 2001; 21: 906–910.
- [32] Evers S, Husstedt IW. Alternatives in dvrug treatment of chronic paroxysmal hemicrania. Headache 1996; 36: 429–432.
- [33] Kamourieh S, Lagrata S, Matharu MS. Non‑invasive vagus nerve stimulation is beneficial in chronic paroxysmal hemicrania. J Neurol Neurosurg Psychiatry 2019; doi: 10.1136/jnnp‑2018‑319538.
- [34] Williams MH, Broadley SA. SUNCT and SUNA: clinical features and medical treatment. J Clin Neurosci 2008; 15: 526–534.
- [35] Matharu MS, Cohen AS, Goadsby PJ. SUNCT syndrome responsive to intravenous lidocaine. Cephalalgia 2004b; 24: 985.
- [36] Peres MF, Silberstein SD, Nahmias S, et al. Hemicrania continua is not that rare. Neurology 2001; 57: 948–951.
- [37] Cittadini E, Goadsby PJ. Hemicrania continua: a clinical study of 39 patients with diagnostic implications. Brain 2010; 133: 1973.
- [38] Rossi P, Faroni J, Tassorelli C. Diagnostic delay and suboptimal management in a referral population with hemicrania continua. Headache 2009; 49: 227–234.
- [39] Peres MF, Silberstein SD, Nahmias S, et al. Hemicrania continua is not that rare. Neurology 2001; 57: 948–951.
- [40] Moura LM, Bezerra JM, Fleming NR. Treatment of hemicrania continua: case series and literature review. Rev Bras Anestesiol 2012; 62: 173.
- [41] Magis D, Allena M, Bolla M, et al. Occipital nerve stimulation for drug‑resistant chronic cluster headache: a prospective pilot study. Lancet Neurol 2007; 6: 314.
- [42] Nežádal T, Masopust V, Urgošík D, et al. Occipital nerve stimulation – first Czech experiences. Cephalalgia 2015; 35: 111−112.
- [43] Matharu M, Watkins L, Shanahan P. Treatment of medically intractable SUNCT and SUNA with occipital nerve stimulation. J Neurol Neurosurg Psychiatry 2010; 81: e51.
- [44] Burns B, Watkins L, Goadsby PJ. Treatment of hemicrania continua by occipital nerve stimulation with a bion device: long‑term follow‑up of a crossover study. Lancet Neurol 2008; 7: 1001.
- [45] Jürgens TP, May A. Role of sphenopalatine ganglion stimulation in cluster headache. Curr Pain Headache Rep 2014; 18: 433.
- [46] Martelletti P. Neuromodulation of chronic headaches: position statement from the European Headache Federation. J Headache Pain 2013; 14: 86.