Současná podoba antiretrovirové léčby
Souhrn:
Rozsypal H. Současná podoba antiretrovirové léčby. Remedia 2020; 30: 545–552.
Antiretrovirová terapie je základem léčby osob infikovaných HIV (lidským virem imunodeficience). Antiretrovirotika se rozdělují do šesti skupin podle mechanismu účinku a chemické struktury. Jedna blokují funkci tří virových enzymů a jiná brání vstupu viru do buňky. U většiny pacientů se dosáhne suprese virové replikace, která je předpokladem pro návrat, resp. udržení dostatečné funkce imunitního systému. Léčba má také význam pro omezení přenosu infekce HIV na druhé osoby. Ačkoliv léčba brání klasickým zdravotním komplikacím infekce HIV vázaným na imunodeficit, nezabrání úplně aktivaci imunitního systému a tím nebezpečí non‑AIDS komplikací. Obvyklá počáteční kombinace antiretrovirotik zahrnuje dva nukleosidové, resp. jeden nukleosidový a jeden nukleotidový inhibitor reverzní transkriptázy spolu s inhibitorem integrázy. Za určitých okolností přichází v úvahu i použití např. nových nenukleosidových inhibitorů reverzní transkriptázy nebo inhibitorů proteinázy. Vedle této konvenční terapie se zvolna prosazuje používání dvojkombinačních režimů založených na spolehlivosti dolutegraviru. Tyto režimy slibují snížení toxicity, lékových interakcí a nákladů při zachování účinku. Určité teoretické překážky nejsou vyloučeny a přínos lze očekávat u vybraných skupin pacientů.
Summary:
Rozsypal H. Current approach to antiretroviral therapy. Remedia 2020; 30: 545–552.
Antiretroviral therapy is a basis for HIV (human immunodeficiency virus) treatment of positive people. Antiretroviral drugs are divided into six groups according to the mechanism of action and chemical structure. Some block the function of three viral enzymes and other block the viral entry into the cell. In most patients, a suppression of viral replication is reached that is a pre‑requisite for the return and maintenance of sufficient immune system function. The treatment is also important for reducing the risk of HIV infection transfer to other people. Although the treatment prevents classic medical complications of HIV infection associated with immunodeficiency, it does not prevent completely the activation of immune system and the risk of non‑AIDS complications. The usual initial combination of antiretroviral drugs includes two nucleoside or rather one nucleoside and one nucleotide inhibitor of reverse transcriptase together with integrase inhibitor. In certain circumstances, the use of for example the new non‑nucleoside inhibitors of reverse transcriptase or protease inhibitors is warranted. Alongside this conventional therapy, the use of dual combination regimens based on the reliability of dolutegravir is slowly asserted. The promise of the decrease of toxicity, drug interactions and cost while maintaining efficacy comes with these regimens. Certain theoretical obstacles are not out of the question and the benefit can be expected in selected groups of patients.
Key words: HIV infection, human immunodeficiency virus (HIV), antiretroviral therapy
V tomto roce se ještě jednou
vracíme na stránkách časopisu Remedia k tématu infekce
lidským virem imunodeficience (human immunodeficiency virus, HIV).
Ve čtvrtém čísle letošního ročníku vyšel článek
doc. Sedláčka a dr. Hofmana, v němž autoři
referovali o novinkách z literatury a mezinárodních
kongresů. Upozornili na některé zajímavé objevy a nastínili
perspektivy léčby. Cílem tohoto sdělení je shrnout aktuální
možnosti léčby a vyhodnotit pozici nově registrovaných
léků.
Úvod
Antiretrovirotika jsou léčiva účinně potlačující infekci HIV. První antiretrovirový lék – zidovudin, dříve označovaný jako azidothymidin ‒ byl pro léčbu infekce HIV zaregistrován roku 1987. Velký pokrok zaznamenala antiretrovirová léčba v polovině 90. let, kdy se zrodila koncepce tzv. vysoce účinné antiretrovirové léčby (highly active antiretroviral therapy, HAART), později označované skromněji jako kombinovaná antiretrovirová terapie (combination antiretroviral therapy, cART) a později už jen čistě ART (přívlastek „kombinovaná“ je pleonasmus – ART je vždy kombinovaná). Mezitím došlo k objevu dalších dokonalejších zástupců původních skupin i nových skupin léků, zejména v druhé polovině prvního desetiletí 21. století to byly inhibitory integrázy. Současná antiretrovirotika jsou vysoce účinná, odolná proti vzniku rezistentních mutací HIV a mají minimum nežádoucích účinků. Za těchto podmínek se nově vyvinutá léčiva jen obtížně prosazují, protože je těžké doložit nějakou přednost proti existujícím výborně fungujícím látkám. Možným východiskem z této situace je nalezení revolučního způsobu léčby, odvaha překročit vžitá pravidla a zahájit nekonvenční způsob léčby infekce HIV.
Antiretrovirotika se rozdělují podle
mechanismu účinku a chemické struktury do šesti skupin:
1) nukleosidové inhibitory reverzní transkriptázy (NRTI), 2)
nukleotidové inhibitory reverzní transkriptázy (NtRTI), 3)
nenukleosidové inhibitory reverzní transkriptázy (NNRTI), 4)
inhibitory proteinázy (PI), 5) inhibitory integrázy (II, resp.
InSTI = integrase strand transfer inhibitors) a 6)
inhibitory vstupu (entry inhibitors, EI), tj. inhibitory fúze,
antagonisté koreceptoru CCR5 a inhibitory připevnění (tab. 1). Antiretrovirotika tedy fungují jako inhibitory všech tří
specifických virových enzymů: reverzní transkriptázy, proteinázy
a integrázy. Inhibitory vstupu zahrnují antagonistu receptoru
CCR5, který slouží jako koreceptor receptoru CD4 pro vstup viru
do buňky, a inhibitor fúze, který se váže na virový
protein gp41 vytvářející vstupní pór pro virovou kapsidu.
Podobně jako léky poslední skupiny brání vstupu viru do buňky
i monoklonální protilátka ibalizumab (Trogarzo).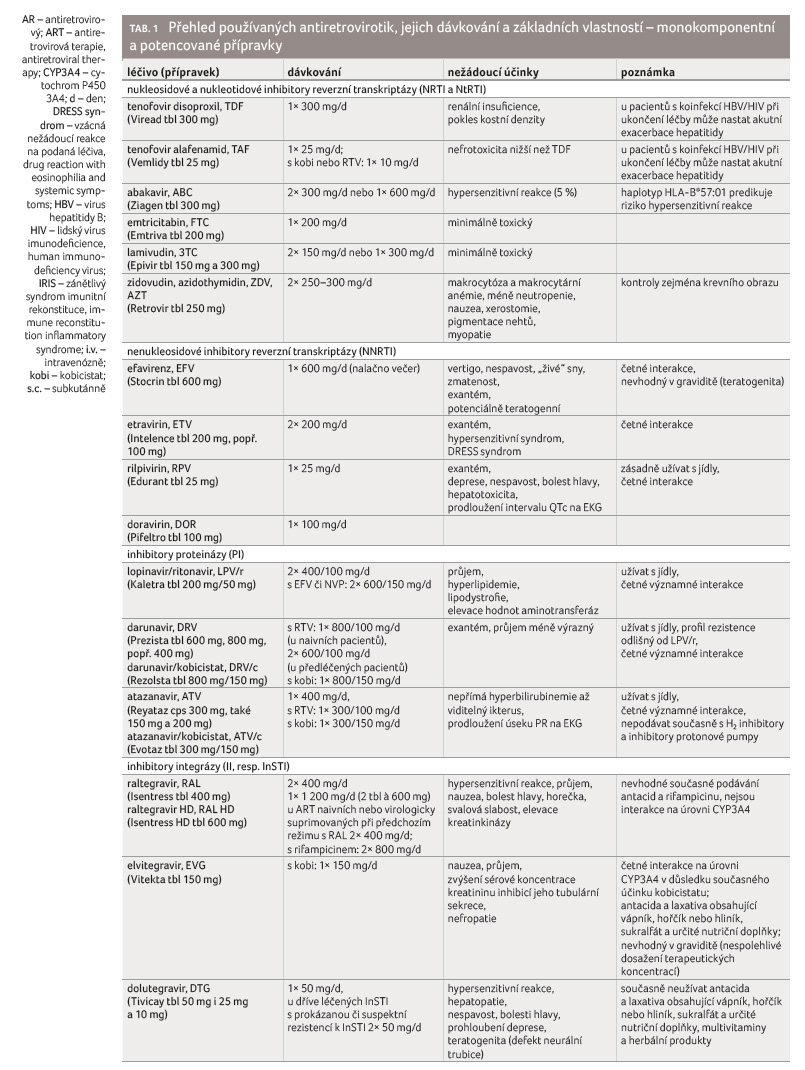
O suverénním efektu antiretrovirotik na morbiditu a mortalitu HIV pozitivních osob není pochyb. ART dokáže již během několika měsíců zásadně potlačit množení viru. Suprese virové replikace je předpokladem pro návrat, resp. udržení řádné funkce imunitního systému. Brzy po zahájení léčby se upravuje počet CD4 lymfocytů, který nejvíce vypovídá o imunokompetenci HIV pozitivních osob. Normální hodnota CD4 lymfocytů svědčí o tom, že pacient není v ohrožení oportunními infekcemi a je klinicky zdráv. Většina HIV pozitivních se dnes těší dobrému zdraví, ale za cenu dlouhodobého, vlastně celoživotního užívání léků. Léčba brání klasickým zdravotním komplikacím infekce HIV vázaným na imunodeficit a zajišťuje příznivou individuální prognózu pacientů. Navzdory tomu zůstává sice malé, ale reálné nebezpečí non AIDS (acquired immune de
ficiency syndrome, syndrom získaného selhání imunity) komplikací. Chronická infekce HIV i adekvátně léčená představuje rizikový faktor běžných onemocnění spojených se stárnutím, zejména navýšení kardiovaskulárního rizika a výskytu nádorů. Je nevelkým a jen statisticky prokazatelným příspěvkem k přirozeným procesům, které vedou k aterogenezi, karcinogenezi a trombogenezi.
Primárním cílem ART je tedy dosažení nedetekovatelné virové nálože HIV RNA, tj. podle používané metody obvykle méně než 50, resp. 20 kopií/ml. Na indikaci ART se od roku 2016 nic nemění. Panuje všeobecná shoda o potřebě časného zahájení léčby tak, jak to vyplynulo ze studie START (the Strategic Timing of AntiRetroviral Treatment study), a to nehledě na počet CD4+ lymfocytů [1]. Jmenovaná studie s 4 685 účastníky ukázala, že časné zahájení léčby ve skupině pacientů s hodnotami CD4+ nad 500 buněk/μl bylo spojeno s potlačením progrese nemoci a s nižší mortalitou oproti skupině s odloženým zahájením léčby. Podobná studie Temprano s 2 056 pacienty z Pobřeží slonoviny prokázala nižší výskyt těžkých infekcí a úmrtí u osob se zahájenou léčbou při hodnotách CD4+ převyšujících 500 buněk/μl [2]. Výsledky studií z rozvinutých zemí a z rozvojového světa se shodovaly a byly podpořeny ještě dalšími studiemi.
Přínos léčby je však nejen individuální, ale i kolektivní – epidemiologický. Časná ART jednak brání nevratným změnám imunitního systému, jednak potlačení virové replikace s praktickou nepřítomností viru v tělních tekutinách omezuje přenos a chrání okolí nakaženého člověka. Správnost tohoto konceptu „léčby jako prevence“ byla ověřena přinejmenším dvěma velkými studiemi: observační studií s 3 400 sérodiskordantními páry, kde ART vedla k 92% redukci přenosu na HIV negativního partnera [3], a studií HPTN 052 s ochranou séronegativního partnera u heterosexuálních párů časnou, resp. odloženou ART [4].
Další možnou indikací podání antiretrovirotik je postexpoziční a preexpoziční profylaxe (PEP a PrEP) infekce HIV, které přesahují rozsah a záměr sdělení.
Z výše uvedeného vyplývá, že se ART zahajuje záhy po odkrytí HIV infekce. Nicméně i nejnovější doporučení akceptují rozhodnutí lékaře v případě, kdy pacient není připraven nebo ochoten řádně užívat celoživotní léčbu. Pokud má být léčba neúplná nebo poznamenaná non adherencí, odklad má přednost před okamžitým zahájením, a to zejména u pacienta s uspokojivými imunologickými parametry [5].
Volba počátečního režimu
Konvenční trojkombinace
a) Základní dvojice („backbone“)
Klasický počáteční režim je typicky založen na trojkombinaci dvou nukleosidových inhibitorů reverzní transkriptázy (2 NRTI) nebo jednoho nukleosidového (1 NRTI) a jednoho nukleotidového RTI (NtRTI) s třetím členem, kterým je v současné době zástupce oblíbené skupiny inhibitorů integrázy (InSTI).
Volba konkrétního režimu se řídí více okolnostmi, zejména komorbiditami, potenciálními nežádoucími účinky a interakcemi, množstvím tablet, graviditou nebo možností otěhotnět, výsledky testů rezistence, ale i dostupností, preskripčními limity úhrady pojišťoven, popř. cenou.
Obecně se dává přednost jednoduchým, pokud možno jednotabletovým režimům (single tablet regimens, STR).
Rezistence vyšetřená in vitro je v České republice vyžadována u většiny nových antivirotik, ale záchyt primární rezistence u dosud neléčených je výjimečný – objevuje se v jednotlivých procentech.
V současné době je k dispozici několik páteřních (backbone) dvojkombinací založených na dvou nukleosidech, popř. na jednom nukleotidu a jednom nukleosidu.
Nejdůležitější jsou tenofovir disoproxil/emtricitabin (TDF/FTC) nebo tenofovir alafenamid/emtricitabin (TAF/FTC) a abakavir/lamivudin (ABC/3TC). Monokomponentní léky TDF a 3TC se dají spojit do kombinace TDF + 3TC. Fixní kombinace zidovudin (ZDV)/3TC se v první volbě nepoužívá.
Dvěma nejpoužívanějšími kombinacemi pro dosud neléčené pacienty jsou tedy TDF/FTC (Truvada a generické přípravky) nebo ABC/3TC (Kivexa a generické přípravky).
Přípravek TAF/FTC (Descovy) jako fixní dvojkombinace není k dispozici pro tzv. naivní pacienty a je určen pro nemocné předléčené konvenčním tenofovirem (TDF). TAF pro dosud neléčené osoby je obsažen ve fixních trojkombinacích – nejvíce používány jsou Odefsey (TAF/FTC/rilpivirin [RPV]), Genvoya (TAF/FTC/ elvitegravir „boostovaný“ kobicistatem [EVG/c]) a Biktarvy (TAF/FTC/biktegravir [BIC]). Na TAF je možno nahlížet jako na představitele nové generace NtRTI a jako na moderního nástupce TDF. Řada klinických studií dokazuje jeho výborný bezpečnostní profil a potlačení nefrotoxicity [6‒10]. Referovaný přírůstek hmotnosti ve studiích vesměs není zásadní překážkou.
Rozhodnutí mezi režimem s tenofovirem a režimem s abakavirem, tj. TDF/FTC, resp. TAF/FTC, nebo ABC/3TC, se může opřít o přímá srovnání ve studiích HEAT (s lopinavirem) a ACTG 5202 (s efavirenzem a atazanavirem) a později v kombinaci s dolutegravirem (DTG). Nebyly shledány zásadní rozdíly, ale ve studii ACTG 5202 byl zaznamenán vyšší podíl virologického selhání v podskupině osob s výchozí virovou náloží HIV nad 100 000 kopií/ml léčených ABC. Mimoto byl zaznamenán vyšší výskyt kardiovaskulárních komplikací u léčených kombinací s ABC [11‒13]. Závěry byly sice kritizovány a zpochybněny, ale příspěvek ke kardiovaskulárnímu riziku nebyl zcela vyloučen [14]. Nevýhodou ABC je nebezpečí hypersenzitivní reakce. Tu lze do jisté míry predikovat z přítomnosti alely HLA B*57:01, proto je testování haplotypu HLA vyžadováno před zahájením léčby ABC.
Je možná i kombinace TDF a ABC, např. pokud je přítomna rezistence HIV k 3TC a FTC.
b) Třetí komponenta („core“)
Uvedené „backbone“ kombinace jsou doplněny třetí komponentou. Přicházejí v úvahu zástupci ze tří skupin antiretrovirotik, ale ani nové doporučení Evropské klinické společnosti pro AIDS (European AIDS Clinical Society, EACS) neposkytuje velký manévrovací prostor pro volbu třetí komponenty [15]. Proti předchozímu vydání byla vypuštěna kategorie „preferované“, a proto vedle skupiny doporučených léků již následují „alternativy“. Národní doporučený postup z roku 2019 je méně rigorózní a dává lékaři možnost svobodněji rozhodovat o optimálním individualizovaném režimu [16].
V účinnosti mezi skupinami jsou malé rozdíly a výběr ovlivňuje řada faktorů. Doporučenou skupinou u osob bez specifických limitací jsou v současnosti inhibitory integrázy. Dostupné jsou čtyři, mají své výhody a nevýhody. Tři z nich jsou doporučeny v posledních guidelines EACS. Nejdéle používán je raltegravir (Isentress). Ve studiích (BENCHMRK 1 a 2) byl výborně tolerován. Jeho výhodou je bezpečnost a nízký interakční potenciál, lze jej bezpečně ordinovat gravidním ženám, a tedy i ženám ve fertilním věku, které počítají s otěhotněním. Není ve formě fixní kombinace. Jednotabletový režim s elvitegravirem zahrnuje ještě čtvrtou složku – booster kobicistat ‒ a tím odsouvá kombinaci (LP Genvoya) do kategorie alternativ. Další dva zástupci – DTG a BIC – mají vyšší genetický práh vzniku rezistence, nevyžadují booster a mohou se užívat nezávisle na příjmu jídla. Dolutegravir v samostatné formě (Tivicay) i ve fixní kombinaci s ABC a 3TC (Triumeq) je vysoce účinným antiretrovirotikem, jehož efekt je doložen řadou komparativních dvojitě zaslepených studií. Kromě prokázané non inferiority ve srovnání s raltegravirem (SPRING 1) byl zjištěn lepší virologický efekt než u kombinací s efavirenzem (SINGLE), atazanavirem i boostovaným darunavirem (FLAMINGO trial) [17‒19]. Hlavními nežádoucími účinky jsou bolest hlavy a nespavost.
Poslední zaregistrovaný inhibitor integrázy je BIC. Díky dlouhému poločasu (18 h) při vysoké vazbě na plazmatické bílkoviny nevyžaduje booster. Biktegravir je vysoce účinné a výborně tolerované antiretrovirotikum, které je k dispozici jako koformulace s TAF a FTC (Biktarvy). Jeho účinnost byla prokázána non inferioritou ve studiích, v nichž byl komparátorem DTG (Studie 1489, 1490, 1844, 1878, 1961, 1474 společnosti Gilead) [20,21].
Ve specifických indikacích je možno použít režimy založené na NNRTI nebo PI. Pro suverénní efekt a výborný bezpečnostní profil InSTI jsou indikace režimů bez InSTI využívány méně často. Teoretickou překážkou je prokázaná rezistence nebo alergie k InSTI, ale reálně k této situaci dochází výjimečně.
S ohledem na mechanismus účinku mohou být upřednostněny PI, které mohou mít za určitých okolností příznivý vliv na některou komplikaci infekce HIV – neuroprotektivní efekt lopinaviru/ritonaviru (Kaletra) využívaný v léčbě encefalopatie asociované s HIV infekcí nebo možný přímý supresivní účinek PI na Kaposiho sarkom. Výhodou je vysoký práh pro vznik rezistence. Vznik klinicky významné rezistence na lopinavir vyžaduje několik bodových mutací v genu pro virovou proteinázu. Dlouhodobá léčba je vzhledem k ovlivnění tukového metabolismu a k možnému vývoji lipodystrofie spíše nahrazována jinými léky.
Použití NNRTI je další možnou alternativou InSTI. Jednoznačné přednosti proti InSTI nejsou, ale za určitých okolností může být jejich podání výhodné. Nejnovější zástupce – doravirin – prokázal non inferioritu s efavirenzem nebo darunavirem [22,23]. Rilpivirin a doravirin jsou k dispozici samostatně (Edurant, Pifeltro) nebo jako součásti fixních kombinací (Odefsey, Delstrigo). Mírnou výhodou RPV v kombinovaném přípravku je „backbone“ složka obsahující TAF a FTC a zkušenost dovolující léčbu těhotných žen, výhodou doravirinu je nezávislost užívání na jídle a referovaný lepší profil rezistence. Samostatné NNRTI lze využít k doplnění režimu na trojkombinaci při kontraindikaci některé obvyklé složky, zejména nemožnost použití NRTI a NtRTI. U kombinace s RPV je u dosud neléčených pacientů požadováno několik podmínek: počet CD4+ nad 200 buněk/ml, virová nálož HIV RNA < 100 000 kopií/ml, pacient nesmí užívat inhibitory protonové pumpy a lék se podává striktně s jídlem. Efavirenzu a etravirinu nezůstává příliš prostoru pro použití v současné racionální ART. Hlavní překážkou pro další podávání efavirenzu jsou jeho neuropsychické nežádoucí účinky. Etravirin (Intelence) lze u nás podle preskripčních limitů hrazené péče podávat jen s PI. Současní pacienti mají tyto dva léky spíše ordinované v minulosti a dosud ponechané. Za určitých okolností mohou být doplňkem složité kombinace vynucené nesnášenlivostí, rezistencí nebo kontraindikacemi běžnějších léků.
Moderní dvojkombinace
Trojkombinační léčba se osvědčila po více než dvě desetiletí. Potřeba celoživotního podávání léků otevřela otázku možnosti redukce počtu komponent ze tří na dvě. Dvojkombinace slibuje snížení toxicity, lékových interakcí a nákladů při zachování účinku.
Dřívější pokusy s monoterapií (např. boostovaným darunavirem) ztroskotaly na rychlém rozvoji rezistence. Logickým krokem bylo vyzkoušení dvojkombinace. Řada počátečních observačních a prospektivních studií (NEAT 001, ACTG 5142, MODERN) napovídala, že dvojkombinace jsou více náchylné k virologickému selhání nebo přinejmenším ke zvýšenému záchytu mutací v těchto režimech. Teprve studie s léky s vysokou genetickou bariérou pro vznik rezistence umožnily překonat dogma o nepodkročitelnosti trojkombinace a studie s 96týdenním sledováním ukázaly přinejmenším non inferioritu nově navrženého přístupu při použití DTG [24].
Nebezpečí léčby dvojkombinací – snazší vznik rezistentních mutací – uvedené studie víceméně nepotvrzují. Avšak ani zřetelný pokles počtu nežádoucích účinků ve větvi s dvojkombinací proti trojkombinaci nebyl pozorován. Pilotní studie PADDLE (Pilot Antiretroviral Design with Dolutegravir LamivudinE) s dvojkombinací DTG a 3TC s 20 dosud neléčenými pacienty přinesla povzbudivé výsledky o možnosti léčby dvojkombinací a následně byla potvrzena větší studií ACTG A5353 [25,26]. Ve velkých klinických studiích GEMINI 1 a 2 prokázala kombinace 3TC + DTG stejnou účinnost jako klasická trojkombinace TDF/FTC + DTG [27]. Renální a kostní parametry byly ve větvi s TDF horší, ale jen tehdy, pokud byl jako komparátor užit TAF. Studie SWORD 1 a 2 ukazovaly účinek dvojkombinace DTG/RPV u předléčených pacientů [28]. Studie se opíraly o soubory přísně selektovaných účastníků.
Dalším potenciálním nebezpečím režimů s dvojkombinací je únik viru v útočištích – např. v centrálním nervovém systému. Otázkou zůstává, jak se v reálném životě uplatní non adherence pacientů.
Některá pozorování ukazují, že při supresi virové replikace, která se v krvi jeví jako nedetekovatelná, může být virus prokazatelný např. v lymfatické tkáni [29]. Účinek dvojkombinace může být oproti trojkombinaci méně důrazný, a proto perzistující virus může aktivovat imunitní systém a vést k chronickému zánětu. Tyto okolnosti odpovídají za vznik non AIDS onemocnění v průběhu řady let léčené infekce HIV. Není vyloučena možnost, že snížení expozice lékům bude vykoupeno nárůstem chronického zánětu a paradoxně rychlejší progresí non AIDS komplikací infekce HIV.
Je zřejmé, že u řady pacientů se dvojkombinace vyplatí. Přesto zbývá dluh v jednoznačném vymezení kritérií, jež napovědí, u kterých pacientů bude výhodnější redukce toxicity při léčbě dvojkombinací a u kterých bude lepší razantní suprese virové replikace trojkombinací, jež nedovolí aktivaci imunitního systému a doutnání chronického zánětu.
Závěr
Protiretrovirová terapie spočívá
v podávání důmyslné kombinace antiretrovirových léků
alespoň ze dvou skupin. Správně volená kombinace léků,
které pacient řádně užívá a na něž si virus
nevyvinul odolnost (rezistenci), má rozhodující dopad na zdravotní
stav a prognózu pacienta i infekčnost pro okolí.
Eradikace infekce zatím nelze dosáhnout. Tím léčba zůstává
dlouhodobá a časově neomezená. Vývoj antiretrovirotik
postupně přináší léky vysoce účinné, dobře tolerované,
s nízkou toxicitou a snadným u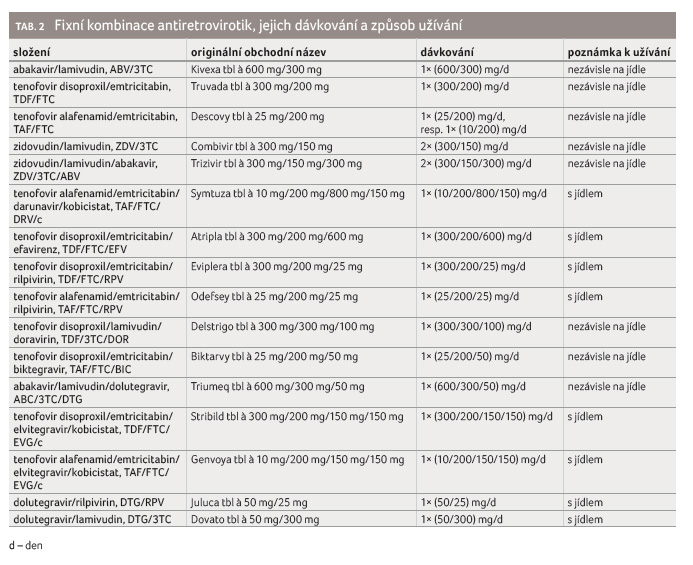 žíváním. Pacienti
snáze dodržují jednoduché režimy, tj. mají k takovým
režimům vyšší adherenci. Ke zjednodušování
(simplifikaci) režimu přispívá nízký počet denních dávek,
malý počet tablet v dílčí dávce, nezávislost na příjmu
stravy a spojování účinných látek do kombinovaných
přípravků (tab. 2). Dlouhodobá léčba otvírá otázku
redukce počtu komponent z konvenčních tří na dvě.
Dvojkombinace slibuje snížení toxicity, lékových interakcí
a nákladů při zachování účinku. Studie naznačují, že
nebezpečí selekce rezistence HIV k antiretrovirotikům není
tak naléhavé. Obava pramení z méně důsledné suprese
virové replikace. A tak stále zbývá dluh do budoucna
v jednoznačném vymezení kritérií napovídajících, kteří
pacienti budou mít z dvojkombinační léčby největší
prospěch.
žíváním. Pacienti
snáze dodržují jednoduché režimy, tj. mají k takovým
režimům vyšší adherenci. Ke zjednodušování
(simplifikaci) režimu přispívá nízký počet denních dávek,
malý počet tablet v dílčí dávce, nezávislost na příjmu
stravy a spojování účinných látek do kombinovaných
přípravků (tab. 2). Dlouhodobá léčba otvírá otázku
redukce počtu komponent z konvenčních tří na dvě.
Dvojkombinace slibuje snížení toxicity, lékových interakcí
a nákladů při zachování účinku. Studie naznačují, že
nebezpečí selekce rezistence HIV k antiretrovirotikům není
tak naléhavé. Obava pramení z méně důsledné suprese
virové replikace. A tak stále zbývá dluh do budoucna
v jednoznačném vymezení kritérií napovídajících, kteří
pacienti budou mít z dvojkombinační léčby největší
prospěch.
Seznam použité literatury
- [1] INSIGHT START Study Group. Initiation of antiretroviral therapy in early asymptomatic HIV infection. N Engl J Med 2015; 373: 795‒807.
- [2] TEMPRANO ANRS 12136 Study Group. A trial of early antiretrovirals and isoniazid preventive therapy in Africa. N Engl J Med 2015; 373: 808‒822.
- [3] Donnell D, Baeten JM, Kiarie J, et al. Heterosexual HIV‑1 transmission after initiation of antiretroviral therapy: a prospective cohort analysis. Lancet 2010; 375: 2092‒2098.
- [4] Cohen MS, Chen YQ, McCauley M, et al. Prevention of HIV‑1 infection with early antiretroviral therapy. N Engl J Med 2011; 365: 493‒505.
- [5] Langewitz W, Denz M, Keller A, et al. Spontaneous talking time at start of consultation in outpatient clinic: cohort study. BMJ 2002; 325: 682‒683.
- [6] Hagins D, Orkin C, Daar ES, et al. Switching to coformulated rilpivirine (RPV), emtricitabine (FTC) and tenofovir alafenamide from either RPV, FTC and tenofovir disoproxil fumarate (TDF) or efavirenz, FTC and TDF: 96‑week results from two randomized clinical trials. HIV Med 2018; 19: 724‒733.
- [7] Gaur AH, Kizito H, Prasitsueubsai W, et al. Safety, efficacy, and pharmacokinetics of a single‑tablet regimen containing elvitegravir, cobicistat, emtricitabine, and tenofovir alafenamide in treatment‑naive, HIV‑infected adolescents: a single‑arm, open‑label trial. Lancet HIV 2016; 3: e561‒e568.
- [8] Sax PE, Wohl D, Yin MT, et al. Tenofovir alafenamide versus tenofovir disoproxil fumarate, coformulated with elvitegravir, cobicistat, and emtricitabine, for initial treatment of HIV‑1 infection: two randomised, double‑blind, phase 3, non‑inferiority trials. Lancet 2015; 385: 2606‒2615.
- [9] Mills A, Arribas JR, Andrade‑Villanueva J, et al. Switching from tenofovir disoproxil fumarate to tenofovir alafenamide in antiretroviral regimens for virologically suppressed adults with HIV‑1 infection: a randomised, active‑controlled, multicentre, open‑label, phase 3, non‑inferiority study. Lancet Infect Dis 2016; 16: 43‒52.
- [10] Mayer KH, Molina JM, Thompson MA, et al. Emtricitabine and tenofovir alafenamide vs emtricitabine and tenofovir disoproxil fumarate for HIV pre‑exposure prophylaxis (DISCOVER): primary results from a randomised, double‑blind, multicentre, active‑controlled, phase 3, non‑inferiority trial. Lancet 2020; 396: 239‒254.
- [11] Behrens GM, Reiss P. Abacavir and cardiovascular risk. Curr Opin Infect Dis 2010; 23: 9‒14.
- [12] Sabin CA, Worm SW, Weber R, et al. Use of nucleoside reverse transcriptase inhibitors and risk of myocardial infarction in HIV‑infected patients enrolled in the D:A:D study: a multi‑cohort collaboration. Lancet 2008; 371: 1417‒1426.
- [13] Walmsley SL, Antela A, Clumeck N, et al. Dolutegravir plus abacavir‑lamivudine for the treatment of HIV‑1 infection. N Engl J Med 2013; 369: 1807‒1818.
- [14] Crowell TA, Gebo KA, Blankson JN, et al. Hospitalization rates and reasons among HIV elite controllers and persons with medically controlled HIV infection. J Infect Dis 2015; 211: 1692‒1702.
- [15] EACS Guidelines Version 10.1 ‒ October 2020 [cit. 6. 10. 2020]. Dostupné na: https://www.eacsociety.org/guidelines/eacs‑guidelines/eacs‑guidelines.html
- [16] Snopková S, Rozsypal H, Aster V, et al. Doporučený postup péče o dospělé infikované HIV a postexpoziční profylaxe infekce HIV (vydaný 25. 6. 2019). Dostupný na: https://www.infekce.cz/DPHIV19.htm
- [17] Stellbrink HJ, Reynes J, Lazzarin A, et al. Dolutegravir in antiretroviral‑naive adults with HIV‑1: 96‑week results from a randomized dose‑ranging study (SPRING‑1). AIDS 2013; 27: 1771‒1778.
- [18] Walmsley SL, Antela A, Clumeck N, et al; SINGLE Investigators. Dolutegravir plus abacavir‑lamivudine for the treatment of HIV‑1 infection. N Engl J Med 2013; 369: 1807‒1818.
- [19] Clotet B, Feinberg J, van Lunzen J, et al. Once‑daily dolutegravir versus darunavir plus ritonavir in antiretroviral nnaive adults with HIV‑1 infection (FLAMINGO): 48 week results from the randomised open‑label phase 3b study. Lancet 2014; 383: 2222‒2231.
- [20] Gallant J, Lazzarin A, Mills et al. Bictegravir, emtricitabine, and tenofovir alafenamide versus dolutegravir, abacavir, and lamivudine for initial treatment of HIV‑1 infection (GS‑US‑380‑1489): a double‑blind, multi‑centre, phase 3, randomised controlled non‑inferiority trial. Lancet 2017; 390: 2063–2072.
- [21] Sax PE, Pozniak A, Montes ML, et al. Coformulated bictegravir, emtricitabine, and tenofovir alafenamide versus dolutegravir with emtricitabine and tenofovir alafenamide, for initial treatment of HIV‑1 infection (GSUS‑380‑1490): a randomised, double‑blind, multicentre, phase 3, non‑inferiority trial. Lancet 2017; 390: 2073–2082.
- [22] Molina JM, Squires K, Sax P, et al. Doravirine versus ritonavir‑boosted darunavir in antiretroviral‑naive adults with HIV‑1 (DRIVE‑FORWARD): 48‑week results of a randomised, double‑blind, phase 3, non‑inferiority trial. Lancet HIV 2018; 5: e211–e220.
- [23] Orkin C, Squires KE, Molina J‑M, et al. Doravirine/lamivudine/tenofovir disoproxil fumarate is non‑inferior to efavirenz/emtricitabine/tenofovir disoproxil fumarate in treatment‑naive adults with human immunodeficiency virus‑1 infection: Week 48 results of the DRIVE‑AHEAD Trial. Clin Infect Dis 2019; 68: 535–544.
- [24] Perez‑Molina JA, Pulido F, Di Giambenedetto S, et al. Individual patient data meta‑analysis of randomized controlled trials of dual therapy with a boosted PI plus lamivudine for maintenance of virological suppression: GeSIDA study 9717. J Antimicrob Chemother 2018; 73: 2927–2935.
- [25] Cahn P, Rol on MJ, Figueroa MI, et al. Dolutegravir lamivudine as initial therapy in HIV‑1 infected, ARV‑naive patients, 48‑week results of the PADDLE (Pilot Antiretroviral Design with Dolutegravir LamivudinE) study. J Int AIDS Soc 2017; 20: 21678.
- [26] Taiwo BO, Zheng L, Stefanescu A, et al. ACTG A5353: a Pilot Study of Dolutegravir Plus Lamivudine for Initial Treatment of Human Immunodeficiency Virus‑1 (HIV‑1)‑infected Participants With HIV‑1 RNA<500000 Copies/mL. Clin Infect Dis 2018; 66: 1689–1697.
- [27] Cahn P, Sierra Madero J, Arribas JR, et al. Dolutegravir plus lamivudine versus dolutegravir plus tenofovir disoproxil fumarate and emtricitabine in antiretroviral‑naive adults with HIV‑1 infection (GEMINI‑1 and GEMINI‑2): week 48 results from two multicentre, double‑blind, randomised, noninferiority, phase 3 trials. Lancet 2019; 393: 143–155.
- [28] Llibre JM, Hung CC, Brinson C, et al. Efficacy, safety, and tolerability of dolutegravir‑rilpivirine for the maintenance of virological suppression in adults with HIV‑1: phase 3, randomized, non‑inferiority SWORD‑1 and SWORD‑2 studies. Lancet 2018; 391: 839–849.
- [29] Yukl SA, Gianella S, Sinclair E, et al. Differences in HIV burden and immune activation within the gut of HIV positive patients receiving suppressive antiretroviral therapy. J Infect Dis 2010; 202: 1553–1561.