Současné možnosti a zásady farmakoterapie relabující-remitující roztroušené sklerózy
Zavedení dlouhodobé imunomodulační léčby k omezení aktivity roztroušené sklerózy a oddálení invalidity se datuje od počátku devadesátých let minulého století. Prvním lékem používaným v léčbě relabující-remitující roztroušené sklerózy (RR RS) byl interferon beta, následoval glatiramer acetát. Vývoj dalších léků byl velmi rychlý a ubíral se cestou ověření účinnosti monoklonálních protilátek a perorálních léků. Tato léčiva se ukázala jako účinnější, ale s poněkud horším bezpečnostním profilem. V roce 2014 bylo registrováno několik nových léků, jejichž uvedení na trh očekáváme i v ČR. Článek shrnuje poznatky o léčivech používaných v současnosti, jeho hlavním tématem je strategie vedení terapie léky první a druhé volby u pacientů s klinicky izolovaným syndromem a RR RS, monitorace léčby, lékový switch, eskalace léčby, problematika farmakovigilance a léčebný algoritmus.
Úvod
Roztroušená skleróza (RS) je chronické zánětlivé a degenerativní onemocnění centrálního nervového systému (CNS), které postihuje mladé lidí převážně ve věku 20–40 let. Prevalence onemocnění je 170–200 pacientů na jeden milion obyvatel v mírných klimatických pásmech. Ženy jsou postiženy 2–3krát častěji než muži. Zatímco projevy autoimunitního zánětu postupně ustupují, projevy neurodegenerace jsou patrné již od počátku onemocnění. Charakteristickým morfologickým rysem je perivaskulární infiltrace převážně autoreaktivními T lymfocyty, če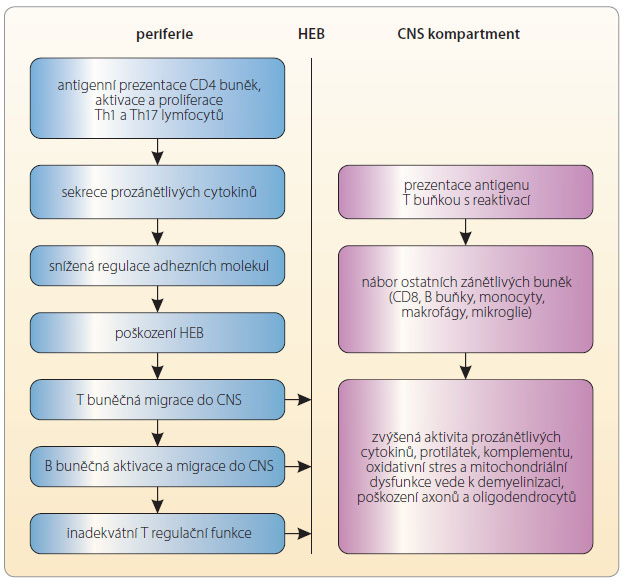 muž odpovídají plaky na magnetické rezonanci (MR) mozku a/nebo míchy. V imunopatogenezi se však uplatňují i B lymfocyty, jejichž původ je v lymfatických meningeálních folikulech a které produkují protilátky. Na neuroaxonální destrukci a demyelinizaci se podílejí makrofágy, mikroglie, oxid dusnatý a lymfocyty s povrchovým znakem CD8. Autoimunitní zánět postihuje i normálně vypadající bílou hmotu a mozkovou kůru, což je současnými vyšetřovacími technikami obtížně prokazatelné. Již od počátku jsou však zřejmé projevy periventrikulární a korové atrofie, která může probíhat nezávisle na zánětu a koreluje s časnými kognitivními poruchami [1]. Imunopatologickou kaskádu dějů probíhajících u pacientů s RS znázorňuje obr. 1.
muž odpovídají plaky na magnetické rezonanci (MR) mozku a/nebo míchy. V imunopatogenezi se však uplatňují i B lymfocyty, jejichž původ je v lymfatických meningeálních folikulech a které produkují protilátky. Na neuroaxonální destrukci a demyelinizaci se podílejí makrofágy, mikroglie, oxid dusnatý a lymfocyty s povrchovým znakem CD8. Autoimunitní zánět postihuje i normálně vypadající bílou hmotu a mozkovou kůru, což je současnými vyšetřovacími technikami obtížně prokazatelné. Již od počátku jsou však zřejmé projevy periventrikulární a korové atrofie, která může probíhat nezávisle na zánětu a koreluje s časnými kognitivními poruchami [1]. Imunopatologickou kaskádu dějů probíhajících u pacientů s RS znázorňuje obr. 1.
Dlouhodobá imunomodulační léčba relabující-remitující RS
Velmi těžko si lze dnes představit dobu, kdy vládl naprostý terapeutický nihilismus. Ještě koncem osmdesátých let minulého století převažoval názor, že je vhodné léčit ataku kortikoidy (adrenokortikotropním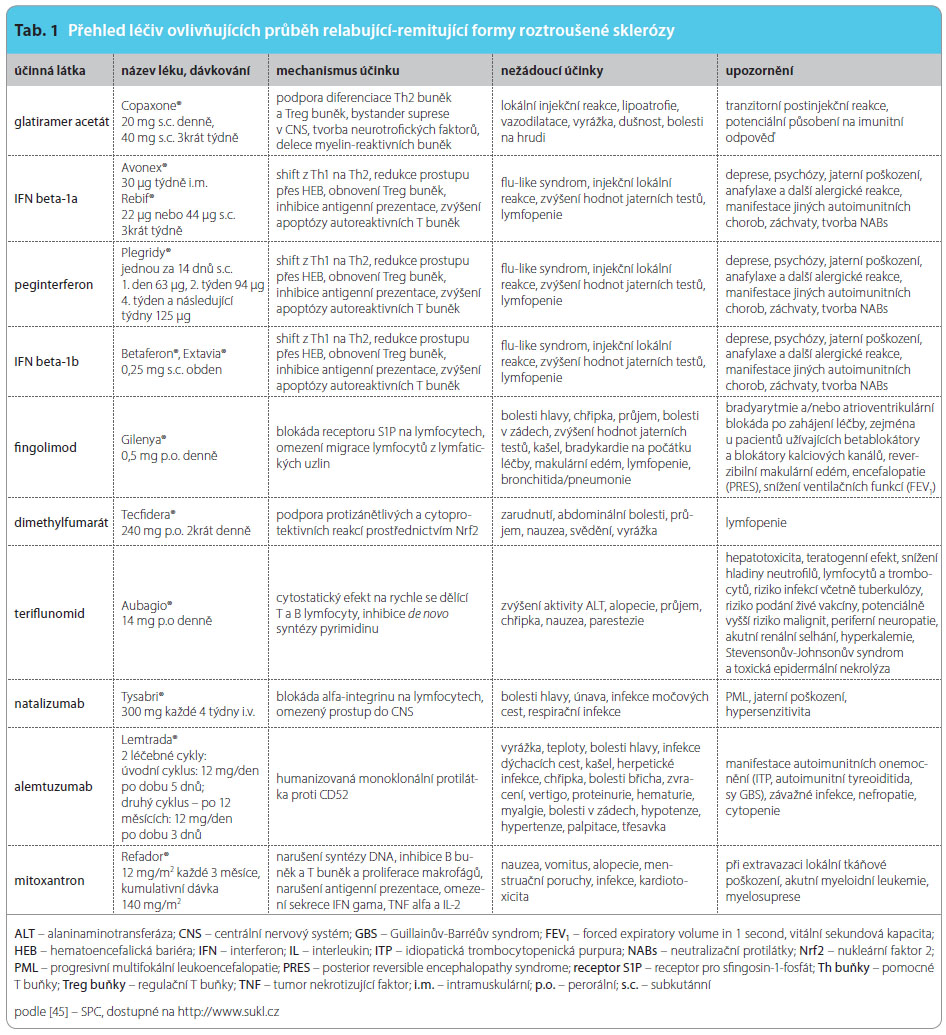 hormonem, ACTH), ale dlouhodobá léčba byla považována za léčbu non lege artis. Dnes má neurolog k dispozici celou paletu protizánětlivých léků s imunosupresivními a imunomodulačními vlastnostmi. O to více chybí léč
hormonem, ACTH), ale dlouhodobá léčba byla považována za léčbu non lege artis. Dnes má neurolog k dispozici celou paletu protizánětlivých léků s imunosupresivními a imunomodulačními vlastnostmi. O to více chybí léč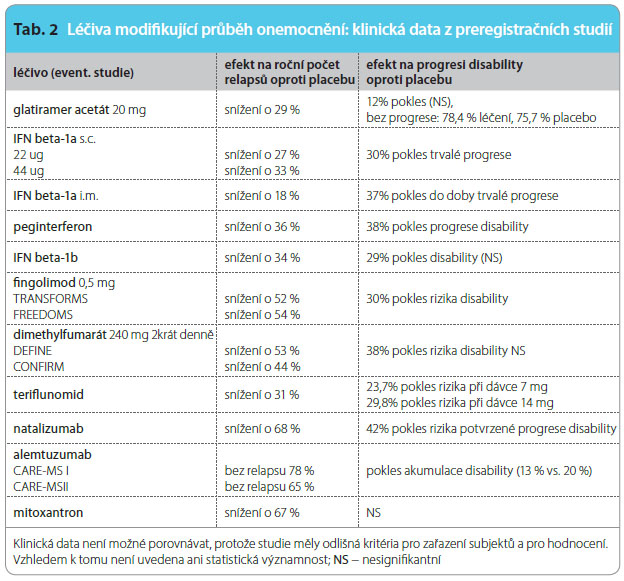 ba, která by měla neuroprotektivní potenciál. Pacienti s pokročilejším stupněm onemocnění tedy nemají z moderní léčby žádný prospěch. Nejvýraznější účinek léčby ovlivňující průběh onemocnění (disease modifying therapy, DMT) je proto zaznamenáván u relabující-remitující roztroušené sklerózy (RR RS), která se vyskytuje v 85 % případů, nebo ještě lépe v nejranějších fázích onemocnění, v období tzv. klinicky izolovaného syndromu (clinically isolated syndrome, CIS). CIS je epizoda s neurologickou monofokální či multifokální symptomatologií trvající více než 24 hodin, s odpovídajícím nálezem na MR mozku, eventuálně krční páteře, pokud je vyloučena jiná příčina obtíží [2].
ba, která by měla neuroprotektivní potenciál. Pacienti s pokročilejším stupněm onemocnění tedy nemají z moderní léčby žádný prospěch. Nejvýraznější účinek léčby ovlivňující průběh onemocnění (disease modifying therapy, DMT) je proto zaznamenáván u relabující-remitující roztroušené sklerózy (RR RS), která se vyskytuje v 85 % případů, nebo ještě lépe v nejranějších fázích onemocnění, v období tzv. klinicky izolovaného syndromu (clinically isolated syndrome, CIS). CIS je epizoda s neurologickou monofokální či multifokální symptomatologií trvající více než 24 hodin, s odpovídajícím nálezem na MR mozku, eventuálně krční páteře, pokud je vyloučena jiná příčina obtíží [2].
Jaké jsou hlavní hodnotící parametry lékových studií? Bývá to jednak počet relapsů za rok (relaps rate, RR), v některých studiích i podíl pacientů bez relapsů, doba do manifestace dalšího relapsu a jeho tíže, rozvoj, respektive zpomalení disability podle kritérií EDSS (Expanded Disability Status Scale, škála kvantifikující postižení nervového systému u pacientů s RS) a parametrů na MR (celkový počet a objem lézí – lesion load, počet gadolinium vychytávajících lézí, a nově i mozková a míšní atrofie). 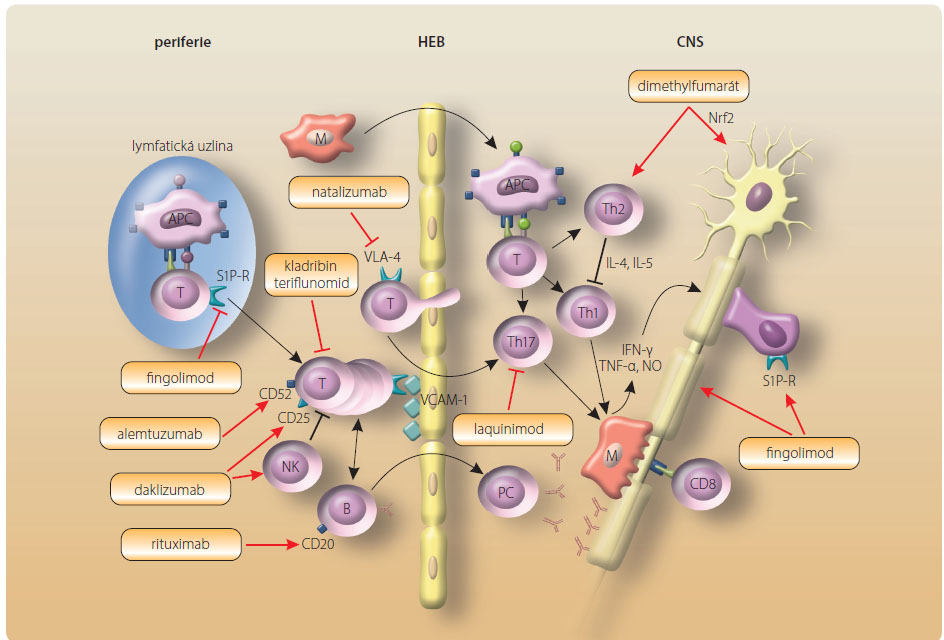
Následující přehled shrnuje informace o účinnosti, nežádoucích účincích biologických léků první generace a jejich modifikací, perorálních léků, monoklonálních protilátek, imunosupresiv a léků v klinických zkouškách. Charakteristika léků, jejich stručný mechanismus účinku včetně nežádoucích reakcí jsou uvedeny v tab. 1. Přehled klinických dat z preregistračních studií je patrný z tab. 2. Z obr. 2 jsou zřejmé terapeutické cíle působení jednotlivých farmak. Článek se nezabývá léčbou ataky a symptomatickou terapií.
Biologické léky první generace
Interferony
První pokusy o biologickou léčbu pocházejí z roku 1984, kdy Panitch a kol. prokázali, že interferon gama nejenže RS neléčí, ale naopak jeho podávání vede u pacientů s RS k rozvoji relapsu [3]. Přesto interferony (IFN) zůstaly v zorném poli některých vědeckých týmů. Přirozené IFN jsou produktem fibroblastů; IFN beta-1a je produkován savčími buňkami, zatímco IFN beta-1b je biotechnologicky vyráběn modifikovanými bakteriemi Escherichia coli. I když mechanismy jejich účinku nejsou zcela jasné, mají protizánětlivé a imunomodulační vlatnosti. Inhibují aktivaci T buněk a jejich proliferaci, podporují apoptózu autoreaktivních T buněk, indukují regulační T buňky, inhibují migraci leukocytů přes hematoencefalickou bariéru a mají potenciální antivirovou aktivitu.
Několik malých studií věnovalo pozornost léčebnému efektu IFN beta s nepřesvědčivými výsledky [4]. Data první rozsáhlejší multicentrické, randomizované, dvojitě zaslepené a placebem kontrolované studie s účastí 372 subjektů byla publikována v roce 1993. Šlo o IFN beta-1b podávaný obden podkožně v dávkách 50 μg nebo 250 μg oproti placebu [5]. Účinnost intramuskulárně podávaného IFN beta-1a byla ověřena randomizovanou, dvojitě zaslepenou studií, v níž byla podávána účinná látka 30 μg jednou týdně proti placebu [6].
Přínos subkutánně (s.c.) podávaného IFN beta-1a byl prokázán dvojitě slepou studií PRISMS, která randomizovaně rozdělila 560 pacientů s RR RS k léčbě IFN beta-1a v dávkách 22 μg nebo 44 μg podávaných 3krát týdně po dobu dvou let proti placebu [7]. Stejně jako při předchozí léčbě IFN beta došlo k poklesu počtu atak. V extenzi studie PRISMS přestoupili pacienti původně léčení placebem do jedné nebo druhé léčené skupiny. Léčení pacienti měli statisticky významně nižší počet atak, došlo ke zpomalení rozvoje onemocnění podle EDSS a ke stabilizaci MR nálezů [8]. Z další extenze, které se účastnilo 68 % subjektů, plyne, že léčení pacienti měli menší počet a objem MR lézí než ti, kteří zpočátku dostávali placebo [9].
Glatiramer acetát
Glatiramer acetát (GA), původně nazývaný Copolymer 1, je tvořen směsí syntetických polypeptidů odvozených ze 4 aminokyselin původně vytvořených jako peptidový analog myelinového bazického proteinu. Má proti IFN zcela odlišný mechanismus účinku. GA tlumí zánět a současně má neuroprotektivní účinek. Ovlivňuje lymfocyty tím, že zvyšuje populaci Th2 lymfocytů na úkor Th1 buněk. Tyto Th2 imunoregulační lymfocyty přestupují hematoencefalickou bariéru a v centrálním nervovém systému produkují protizánětlivé cytokiny a neurotrofní faktory.
Efekt byl prokázán dvojitě slepou studií, do které vstoupilo 251 subjektů. Po dvou letech došlo u pacientů léčených GA (20 mg s.c. každý den) ke snížení počtu atak [10]. V extenzi této studie bylo prokázáno signifikantně větší zastoupení subjektů dostávajících placebo, u nichž došlo ke zvýšení EDSS o více než 1,5 stupně oproti léčené skupině [11]. Jiná studie, čítající 239 pacientů, prokázala významné snížení počtu T2 lézí na MR mozku [12]. Alternativní léčbu představoval GA podávaný v dávce 40 mg s.c. 3krát týdně. Celkem 1404 pacientů bylo randomizováno do léčebné a placebové větve a bylo léčeno 12 měsíců. Výsledky klinické studie prokázaly klinický a MR efekt podobný jako při předchozím podávání [13].
Klinické studie porovnávající účinnost IFN beta a GA neprokázaly žádné rozdíly v riziku vzniku relapsu, v progresi onemocnění či v MR parametrech; např. studie BEYOND randomizovala pacienty v poměru 2 : 2 : 1 (IFN beta-1b
v dávkách 250 μg nebo 500 μg, n = 1796, nebo GA, n = 448) [14].
Modifikované léky první generace
Pegylace je technologie spočívající v navázání polyethylenglykolu (PEG) na jinou molekulu, v tomto případě na molekulu IFN beta-1a. Peginterferon beta-1a má větší molekulovou hmotnost (320 kDa), delší absorpční čas, delší biologický poločas, vyšší aktivitu in vivo a z toho plynoucí možnost méně časté frekvence podání. ADVANCE byla dvojitě zaslepená, placebem kontrolovaná dvouletá studie, v níž bylo 1512 subjektů randomizovaně rozděleno do tří skupin: v první byli pacienti léčeni peginterferonem beta-1a podávaným v dávce 125 μg jednou za 2 týdny, ve druhé skupině dostávali stejnou dávku jedenkrát za 4 týdny a ve třetí skupině bylo podáváno placebo [15]. Lék byl již registrován FDA (Food and Drug Administration) i EMA (European Medicines Agency) a v dohledné době bude k dispozici v ČR. Čtyřletou extenzí studie ADVANCE bude studie ATTAIN.
Perorální léky
Fingolimod
Prvním perorálním lékem uvedeným do klinické praxe je fingolimod. Je to analog sfingosinu, který moduluje receptor pro sfingosin-1-fosfát. Tím dochází k blokádě úniku lymfocytů z lymfatických uzlin [16]. Byly provedeny dvě velké studie, které prokázaly, že léčba fingolimodem významně snižuje počet atak. Do studie FREEDOMS bylo zařazeno 1272 pacientů s RR RS v poměru 1 : 1 : 1. V první skupině dostávali pacienti dávku 0,5 mg fingolimodu denně, ve druhé 1,25 mg fingolimodu denně, ve třetí skupině bylo podáváno placebo [17]. Ve studii TRANSFORMS bylo randomizováno 1200 nemocných k léčbě stejnými dávkami fingolimodu, ale místo placeba bylo podáváno 30 μg IFN beta-1a [17].
Dimethylfumarát
Dimethylfumarát (BG-12) má neuroprotektivní a neuromodulační vlastnosti uplatňované prostřednictvím transkripčního faktoru Nrf2 (nuclear factor erythroid-derived 2-like 2) [18]. Za vlastní účinek je odpovědný aktivní metabolit, monomethylfumarát. Jeho protizánětlivé účinky spočívají ve snížení aktivity prozánětlivých buněk snížením aktivity signální dráhy zánětu prostřednictvím NFκB (nuclear factor kappa-light-chain-
-enhancer of activated B cells), potlačením exprese prozánětlivých cytokinů a snížením exprese adhezních molekul. Podpora antioxidační odpovědi Nrf2 umožňuje buňkám CNS neutralizovat poškození volnými radikály a poskytuje ochranu před reaktivními formami kyslíku (reactive oxygen species, ROS), které vznikají během zánětu.
Do studie DEFINE bylo zařazeno 1200 pacientů, kteří byli léčeni BF-12 podávaným v dávce 480 mg 2krát denně nebo 720 mg 3krát denně [19]. Ve studii CONFIRM bylo v poměru 1 : 1 : 1 : 1 randomizovaně rozděleno 1400 dospělých, kterým byly podávány stejné dávky BF-12, placebo, ale i aktivní komparátor – GA v dávce 20 mg denně [20]. Dimethylfumarát je schválen FDA i EMA pro léčbu RR RS.
Teriflunomid
Teriflunomid je aktivním metabolitem leflunomidu, který inhibuje biosyntézu pyrimidinu a omezuje tak interakci T buněk s antigen prezentující buňkou [21]. EMA schválila teriflunomid pro léčbu RR RS v roce 2013, a to na základě výsledků dvou studií. V první z nich – TEMSO – bylo randomizovaně rozděleno 1088 pacientů do skupin s aktivní léčbou a s placebem; teriflunomid byl podáván v dávce 7 mg nebo 14 mg jednou denně [22]. Ve studii TOWER bylo randomizováno 1169 pacientů, doba studie byla kratší, sledované parametry a léčebné dávky byly stejné [23]. Studie TENERE srovnávala účinek teriflunomidu podávaného ve dvou výše uvedených dávkách s IFN beta-1a v dávce 44 µg [24]. Dimethylfumarát a teriflunomid by měly být v dohledné době k dispozici i v ČR.
Monoklonální protilátky
Natalizumab
Natalizumab je humanizovaná monoklonální protilátka proti alfa 4-integrinu (adhezní molekula na aktivovaných monocytech a lymfocytech). Pokud se alfa 4-integrin nenaváže na VCAM-1 (vascular cell adhesion molecule-1), je blokován přestup autoreaktivních T lymfocytů přes hematoencefalickou bariéru [25]. Do dvouleté studie AFFIRM bylo zařazeno 942 pacientů s RR RS; dvěma třetinám z celkového počtu pacientů zařazených do studie byla podávána účinná látka – natalizumab v dávce 300 mg, třetině pacientů bylo podáváno placebo. Ukázalo se, že v porovnání s ostatními dosud zkoušenými léky je ovlivnění aktivity RR RS nejvýraznější [26]. Do studie SENTINEL byli zařazeni pacienti, kteří neodpovídali na léčbu IFN beta-1a podávaným intramuskulárně (i.m.). Šlo o dvojitě zaslepenou, randomizovanou studii porovnávající podání 300 mg natalizumabu a placeba [27].
Alemtuzumab
Alemtuzumab je humanizovaná monoklonální protilátka proti povrchovému znaku (CD52), která je exprimována na povrchu T buněk, NK buněk a na povrchu monocytů. Studie CARE-MS I sledovala 550 dospělých pacientů s RR RS s nízkou disabilitou, kteří dosud nebyli léčeni. Pacienti byli randomizovaně rozděleni v poměru 2 : 1 k léčbě alemtuzumabem nebo IFN beta-1a. Alemtuzumab byl podáván intravenózně v dávce 12 mg denně po dobu 5 dnů a pak po roce ve stejné dávce po dobu 3 dnů. IFN beta-1a byl podáván jako aktivní komparátor v dávce 44 μg 3krát týdně [28]. Podobná studie – CARE-MS II – sledovala 800 subjektů, u nichž došlo k jednomu relapsu onemocnění při léčbě IFN beta-1a nebo GA [29]. Alemtuzumab není podáván v USA, ale byl registrován EMA.
Imunosupresiva
Role imunosupresiv v léčbě RS byla v posledních letech přehodnocena. Vzhledem k jejich nepříznivému poměru účinek/bezpečnost jsou užívána jako léky druhé volby.
Mitoxantron
Mitoxantron je interkalační cytostatikum a inhibitor topoizomerázy II, který účinkuje jako blokátor replikace DNA a způsobuje zastavení buněčného cyklu [30]. Dvouletá studie kontrolovaná placebem, která byla publikována v roce 2002, porovnávala účinek mitoxantronu podávaného pacientům s aktivní RR RS v dávce 12 mg/m2 a 5 mg/m2 jednou za 3 měsíce oproti placebu [31].
Cyklofosfamid
Cyklofosfamid je alkylační látka, která se váže na DNA a zabraňuje replikaci buňky. Užívá se hlavně u pacientů se sekundárně progresivní formou RS nebo při imunoablativní léčbě s podporou kmenových hematopoetických buněk. Dvojitě zaslepená kontrolovaná studie prokázala účinek cyklofosfamidu na snížení aktivity onemocnění při podávání v dávce 1000 mg jednou měsíčně [32]. K hlavním nežádoucím účinkům léčby cyklofosfamidem patří riziko vzniku druhotných malignit (karcinom močového měchýře) v pozdních fázích léčby, hemoragická cystitida a gonadální toxicita. Léčba není schválena v indikaci RR RS.
Farmaka s prozatím ozastavenou registrací
Kladribin je purinový analog, který inhibuje adenosindeaminázu. Ve studii CLARITY, která sledovala 1326 subjektů a trvala 96 týdnů, byl pacientům podáván kladribin v dávce 3,5 mg/kg nebo 5,25 mg/kg oproti placebu. Roční počet atak byl při podání první dávky 0,14, u druhé dávky 0,14, zatímco u placeba 0,33 [33]. Pro zvýšený výskyt nežádoucích účinků, zejména malignit, nebyl kladribin schválen k léčbě RR RS ani FDA, ani EMA.
Laquinimod je syntetický imunomodulátor s vysokou perorální biologickou dostupností. Ve studii ALLEGRO bylo randomizováno 1106 pacientů k podávání laquinimodu v dávce 0,6 mg denně proti placebu. Po dvou letech došlo k poklesu počtu atak o 23 % proti placebu, k 36% snížení progrese disability a 33% snížení objemu lézí na MR mozku [34]. Studie BRAVO srovnávala účinek laquinimodu navíc s IFN beta-1a podávaným v dávce 30 μg týdně. Výsledky byly obdobné [35]. Kvůli zvýšenému riziku výskytu malignit byla registrace pozastavena. V současné době probíhá další studie – CONCERTO, která porovnává efekt laquinimodu podávaného ve dvou dávkách – 0,6 mg a 1,2 mg – proti placebu. Primárním cílem studie bude srovnání progrese disability. Data budou k dispozici v roce 2018.
Farmaka ve výzkumu
Řada léků se v současné době nachází ve fázi klinických zkoušek. Ze skupiny monoklonálních protilátek je to např. daklizumab, monoklonální protilátka proti interleukinu 2 (IL-2) blokující aktivaci T lymfocytů. Skupina monoklonálních protilátek proti povrchovému znaku CD20 na B lymfocytech – rituximab, okrelizumab a ofatumumab – blokuje B buňky v meningeálních lymfatických folikulech. Belimumab a tabalumab jsou monoklonální protilátky proti faktoru aktivujícímu B buňky (BAFF, B-cell activating factor). ONO4641, MT-1303 je selektivní agonista S1P s afinitou k receptorovým podtypům S1P1 a S1P5, siponimod (BAF312) je dalším lékem ze skupiny modulátorů sfingosin-1-fosfátu se selektivním působením na S1P1 a S1P5. Ibudilast (MN166) je neselektivní inhibitor fosfodiesterázy a ve studiích fáze II omezoval transformaci T2 vážených (T2W) lézí na MR do tzv. černých děr [36].
Management léčby
S nástupem nových léků se objevuje problém, jakým způsobem vést léčbu u pacienta s chronickým onemocněním s často nepředvídatelnou prognózou. Existují sice určité prediktivní ukazatele, ze kterých by se dalo usuzovat na méně závažný průběh RS (např. senzitivní příznaky, optická neuritida, žádné reziduum po atace, dlouhý interval mezi atakami, první ataka u mladých žen apod.), ale žádný z nich není specifický. V současné době je v ČR k dispozici pět skupin léků se zcela rozdílným mechanismem účinku a bezpečnostním profilem. Další tři se v dohledné době objeví.
Požadavky kladené na optimální léčivo:
- co možná největší minimalizace klinické aktivity onemocnění (relaps rate),
- zastavení progrese disability,
- ovlivnění neurodegenerace, mozkové atrofie a změn probíhajících v normálně vypadající bílé hmotě,
- zlepšení kvality života,
- snížení počtu a velikosti lézí na MR, nepřítomnost gadolinium vychytávajících lézí,
- snadná forma aplikace,
- maximální bezpečnost.
Žádný lék tyto požadavky nesplňuje, nebo je splňuje jen zčásti a jen v některých parametrech. V klinické praxi jsme tak postaveni před někdy obtížný úkol optimálně nastavit iniciální léčbu a dle dalšího vývoje onemocnění terapii modifikovat.
Léčba klinicky izolovaného syndromu
Pro léčbu CIS jsou v současné době k dispozici čtyři léky. Všechny byly ověřovány v klinických studiích, které demonstrovaly klinický a radiologický přínos léčby a definitivně prokázaly, že jedině farmakoterapie podaná v co nejčasnější fázi onemocnění dokáže oddálit nevratnou disabilitu. Bezpečnostní profil těchto léků je uspokojivý.
Do studie CHAMPS byli zařazeni pacienti s CIS, kteří měli při vyšetření mozku pomocí MR nejméně dvě T2 léze a byli léčeni IFN beta-1a v dávce 30 μg i.m. 1krát týdně nebo placebem. Studie prokázala účinek IFN beta-1a
na oddálení rozvoje klinicky definitivní RS (clinically definite multiple sclerosis, CD MS). Po dvou a třech letech bylo riziko rozvoje CD MS 21 % a 35 % ve skupině s léčbou IFN beta-1a a 39 % a 50 % u pacientů s placebem [37].
Ve studii ETOMS byli pacienti léčeni IFN beta-1a v dávce 22 μg s.c. 1krát týdně nebo placebem po dobu dvou let. Léčbou byl snížen počet pacientů, u nichž došlo ke konverzi do stadia CD MS, na 34 %, zatímco v placebové skupině došlo ke snížení na 45 % [38]. Pacienti léčení IFN beta-1a vykazovali signifikantní zpomalení rozvoje mozkové atrofie ve srovnání s pacienty léčenými placebem. V průběhu dvou let aktivní léčba redukovala rozvoj mozkové atrofie o téměř 30 % [39].
Další studie s názvem REFLEX testovala účinek IFN beta-1a, tentokrát podávaného v dávce 44 μg s.c. 1krát nebo 3krát týdně proti placebu u pacientů s CIS. Po dvou letech došlo u pacientů léčených vyšší dávkou IFN beta-1a k relativnímu snížení konverze do CD RS, a to o 51 %, ve srovnání se skupinou placeba [40].
Ve studii BENEFIT dostávali pacienti s CIS a s nejméně dvěma lézemi zjištěnými vyšetřením pomocí MR mozku každý druhý den 250 mg IFN beta-1b nebo placebo podkožně po dobu dvou let. Tito pacienti byli v případě vývoje druhé ataky (CD MS) převedeni na léčbu IFN beta-1b. Skupina léčená IFN vykazovala 50% redukci rizika vzniku druhého relapsu ve srovnání s placebovou větví. Signifikantní prodloužení přechodu do CD MS při dvouletém sledování bylo 69 % ve srovnání s 85 % ve skupině s placebem [41].Do studie PRECISE byli zařazeni nemocní s nálezem CIS na MR mozku, kteří byli léčeni GA v dávce 20 mg denně nebo placebem. Rozvoj CD MS byl u léčené skupiny nižší a činil 25 % proti 43 %. Významný je také 61% pokles vzniku nových T2W lézí a 60% snížení vzniku nových kontrastních lézí na MR [42].
Léčba relabující-remitující roztroušené sklerózy
Pro léčbu RR RS jsou v současné době k dispozici IFN beta-1a, IFN beta-1b a GA. Úhradové podmínky stanoví, že léčba bude hrazena pacientům, kteří mají dokumentované minimálně dvě ataky za rok nebo tři ataky za dva roky, přičemž jejich závažnost vyžadovala léčbu vysokými dávkami methylprednisolonu. V praxi se může stát, že ataka buď nebyla přeléčena, nebo měl pacient jednu ataku za rok. Ač se to může zdát jakkoliv absurdní, v těchto případech nemá nemocný nárok na hrazenou léčbu.Jaký přípravek zvolit pro léčbu první volby? Na tuto otázku nám klinické studie příliš neodpovědí, neboť ve všech sledovaných parametrech je účinnost léčby podobná. Jako krajní případy lze uvést, že u nemocných, kteří mají autoimunitní komorbiditu nebo trpí závažnými depresemi, volíme raději GA. U pacientů s vyšší klinickou aktivitou choroby a závažnými neurologickými příznaky volíme spíše IFN podávaný v nejvyšší dávce, zejména pokud se léze na MR nacházejí v nepříznivé lokalizaci (mozkový kmen, mozeček, krční mícha).
Kombinaci GA a IFN plátci zdravotní péče nehradí, studie CombiRx neprokázala větší klinický přínos než samostatně podávaná léčba jednotlivými přípravky [43]. Dříve používaná indukční léčba např. mitoxantronem se v současné době nepoužívá vzhledem ke zvýšení rizika při další eskalační léčbě [44]. V případě velmi vysoké aktivity nemoci a eventuálně i při aktivitě na MR lze zahájit léčbu natalizumabem nebo fingolimodem. Jde o pacienty s rychle se vyvíjející těžkou RR RS, kteří prodělali nejméně dva relapsy v jednom roce a současně vykazují jednu nebo více gadolinium vychytávajících lézí na MR mozku nebo významné zvýšení zátěže T2 lézí ve srovnání s předchozí MR (provedenou před 3–6 měsíci) [45].
Monitorace léčby
Jak v případě CIS, tak při RR RS je třeba provádět průběžnou monitoraci pacientů v RS centrech. Prvotní je klinické sledování, které registruje počet atak a EDSS. Bohužel je velmi podceňováno hodnocení kognitivních funkcí, jejichž postižení je patrné již v nejčasnějších stadiích onemocnění, a může dokonce predikovat vývoj ze stadia CIS do CD RS [46]. U každého pacienta se provádí i laboratorní monitoring (krevní obraz včetně diferenciálního rozpočtu a základní biochemické vyšetření).
Za další ukazatel úspěšnosti léčby se považuje vyšetření MR mozku a krční páteře, které se provádí přibližně jednou ročně. Sleduje se počet a objem T2W lézí, jejichž nárůst znamená trvající aktivitu onemocnění [47]. Dalším důležitým parametrem, který v ČR bohužel není až na výjimky sledován, je hodnocení výsledků měření celkové a regionální mozkové atrofie, která významně koreluje s neurodegenerací a disabilitou [48].Klinickou účinnost IFN beta je možné sledovat vyšetřením neutralizačních protilátek (NAbs), které se tvoří až u 42 % pacientů, nejčastěji mezi 6.–18. měsícem léčby. Dle mezinárodních doporučení je vhodné vyšetření NAbs po 12 a 24 měsících léčby. Pokud jsou výsledky negativní, vyšetření již není nutné opakovat. Pokud se objeví pozitivita, vyšetření je nutné konfirmovat a provést navíc vyšetření hladiny Myxovirus resistance proteinu A (MxA), který je přímým markerem biologického účinku IFN beta. Je-li hladina MxA přes případnou pozitivitu NAbs dostatečná, pacient je respondérem na léčbu. Pokud tomu tak není, doporučuje se provedení MxA indukčního testu. V případě, že se hladina MxA zvýší 4 hodiny po aplikaci IFN beta alespoň čtyřikrát proti odběru před aplikací, je nemocný částečným respondérem. V opačném případě je non-respondérem, a léčbu se doporučuje ukončit [59].
Průkaz protilátek proti natalizumabu je spojen s výskytem nežádoucích účinků (anafylaktická reakce, nauzea, bolesti hlavy), se snížením účinku léku a je důvodem k ukončení léčby [50].
Adherence
Až 22 % nemocných trpí injekční fobií, což významně snižuje adherenci pacientů k léčbě IFN beta a GA. Aplikace může být náročná a může se i zhoršovat zhoršením motoriky na horních končetinách. V důsledku různých okolností může být aplikace injekce bolestivá, může být spojena s lokální i celkovou reakcí. Injekce narušují životní styl pacientů, připomínají jim jejich onemocnění. U mladých pacientů dochází k mylnému přesvědčení, že injekční aplikace je zbytečná, protože se cítí zdravě [51]. Ke zvýšení adherence přispívá důkladná edukace nemocného, pomoc ze strany zdravotních sester a zdravotních asistentek. Farmaceutické firmy se snaží o usnadnění aplikace injekcí formou autoinjektorů. Postupná titrace dávky snižuje lokální postinjekční reakce. Nástup nových perorálních léků adherenci výrazně zvyšuje.
Změna a eskalace léčby
Léčebná strategie spočívá v zahájení DMT první volby, ve výjimečných případech i léky druhé volby. Změna léčby (tzv. switch) je možná v rámci skupiny léků první volby, nejčastěji při intoleranci, odhalení non-respondérů na léčbu IFN beta nebo v rámci skupiny léků druhé volby (např. tvorba NAbs spojená s hypersenzitivitou u natalizumabu nebo komplikace při léčbě fingolimodem).Eskalací rozumíme přechod na intenzivnější léčbu u pacientů, kteří neodpovídají na léčbu první volby. Léky první a druhé volby jsou relativně dobře definované, s nástupem nových léků je spojena diskuse o tom, kde spočívá jejich uplatnění.
Ukončení léčby
Přestože současná léčba má potenciál zpomalit průběh onemocnění a oddálit invaliditu, dochází bohužel k situaci, kdy pacient není schopen samostatné chůze. Za těchto okolností již nemá smysl v podávání DMT dále pokračovat a ani žádná klinická studie neprokázala léčebný efekt v sekundárně progresivní fázi onemocnění s převažujícími neurodegenerativními pochody v CNS.V případě plánované gravidity je nutné léčbu ukončit při podávání fingolimodu a teriflunomidu pro jejich potenciální teratogenní efekt, v ostatních případech lze podávání DMT ukončit až po zjištění gravidity [52]. Po porodu a ukončení laktace se léčba obnovuje.
Farmakovigilance
V klinické praxi je lékař neustále konfrontován s možným rizikem zahájené léčby. U monoklonálních protilátek a perorálně podávaných léků je toto riziko větší než u biologické léčby první generace, jejíž účinnost je o něco nižší.
Před započetím léčby natalizumabem je třeba provést MR s gadoliniem, vyšetření mozkomíšního moku, podmínkou je normální krevní obraz a jaterní testy, vyloučení malignity a imunodeficience. Vždy je nutné zvážit poměr rizika a přínosu léčby u pacientů s předchozí imunosupresivní léčbou a pozitivitou protilátek proti JC viru s ohledem na zvýšené riziko rozvoje progresivní multifokální leukoencefalopatie (PML), která může být ve 23 % fatální. Kromě těchto dvou rizikových faktorů se možnost manifestace PML zvyšuje i po dvou letech léčby, takže pacienti musejí stvrzením informovaného souhlasu po předchozí edukaci s další léčbou souhlasit. Situaci komplikuje fakt, že u pacientů původně séronegativních může dojít k sérokonverzi, takže vyšetření protilátek proti JC viru je nutné opakovat v šestiměsíčních intervalech. Rizikoví pacienti musejí po dvouleté léčbě absolvovat kontrolní MR vyšetření ve zkráceném protokolu (sekvence FLAIR) vždy po třech měsících. U pacientů s pozitivními protilátkami bez předchozí imunosupresivní léčby je riziko PML v období prvních dvou let léčby vyjádřeno poměrem 0,6/1000 případů. V období 25. až 48. měsíce expozice se riziko zvyšuje na 5,2/1000 případů, ve 49. až 72. měsíci dosahuje poměru 5,4/1000 případů. U pacientů s negativními protilátkami je riziko rozvoje PML 0,07 případů na 1000 léčených natalizumabem [53].
Praktická opatření spojená se zahájením léčby fingolimodem spočívají ve vyšetření krevního obrazu (léčbu nelze zahájit při lymfopenii s počtem lymfocytů nižším než 0,7 × 109/l a při hepatopatii), pacient nesmí mít nekontrolovanou hypertenzi a bradykardii nebo A/V blokádu 1. stupně, musí mít pozitivní IgG protilátky proti varicella zoster viru a musí u něj být vyloučen makulární edém. První podání je spojeno s šestihodinovým monitoringem EKG k vyloučení bradykardie nebo A/V bloku. Po třech měsících je opět nutná oční kontrola. Další kontroly prováděné v odstupu tří měsíců sledují hodnoty krevního obrazu (počet lymfocytů nižší než 0,2 × 109/l je důvodem k ukončení léčby), jaterních testů, kontroly krevního tlaku a pulzu [54].
Před zahájením léčby mitoxantronem je nutné vyšetření EKG, ECHO, krevního obrazu a jaterních testů. Hodnota ejekční frakce levé komory nesmí poklesnout pod 50 %. Pacient musí být pod zvýšenou kontrolou kvůli možné manifestaci zejména hematologických malignit [55].
Terapie alemtuzumabem vyžaduje profylaxi infekce herpes virem, čtyři týdny po realizaci každého cyklu je doporučeno podávání acikloviru [56]. Hrozí manifestace bronchopneumonie během léčby a po dobu několika týdnů po ukončení léčby. Nutné je delší sledování rizika pancytopenie, infekcí a autoimunitních onemocnění, např. imunitní trombocytopenie. Podání dimethylfumarátu bývá spojeno s poklesem počtu lymfocytů, zhruba u 3 % pacientů dokonce na hodnoty pod 0,5 × 109/l. Trvalá těžká lymfopenie je důvodem k ukončení léčby [57].
Terapie teriflunomidem je kontraindikována při těžší hepatopatii. Během léčby je nutné kontrolovat krevní obraz, jaterní testy a krevní tlak, vzhledem k riziku jeho zvýšení. Chybějí klinická data týkající se dlouhodobého podávání teriflunomidu, i když více než osmileté sledování v rámci studie fáze nebylo spojeno s většími bezpečnostními riziky [58].
Závěr
Překotný nástup nových léků ovlivňujících průběh onemocnění je spojen s výrazným pokrokem v možnostech snížit zánětlivou aktivitu, nepřímo ovlivnit neurodegeneraci a oddálit nevratnou disabilitu. Na druhou stranu je nutné dodržovat zásadu primum non nocere, aby přínos léčby převážil případná rizika.
Seznam použité literatury
- [1] Lublin FD, Reingold SC. Defining the clinical course of multiple sclerosis: Results of an international survey. National Multiple Sclerosis Society (USA) Advisory Committee on Clinical Trials of New Agents in Multiple Sclerosis. Neurology 1996; 46: 907–911.
- [2] Frischer JM, Bramow S, Dal-Bianco A, et al. The relation between inflammation and neurodegeneration in multiple sclerosis brains. Brain 2009; 132: 1175–1189.
- [3] Giovannoni G, Bever CT Jr. Patients with clinically isolated syndromes suggestive of MS: does MRI allow earlier diagnosis? Neurology 2003; 60: 6–7.
- [4] Panitch HS, Hirsch RL, Haley AS, et al. Exacerbations of multiple sclerosis in patients treated with gamma interferon. Lancet 1987; 1: 893–895.
- [5] Interferon beta-1b is effective in relapsing-remitting multiple sclerosis. I. Clinical results of a multicenter, randomized, double-blind, placebo-controlled trial. The IFNB Multiple Sclerosis Study Group. Neurology 1993; 43: 655–661.
- [6] Goodin DS, Reder AT, Ebers GC, et al. Survival in MS: a randomized cohort study 21 years after the start of the pivotal IFNβ-1b trial. Neurology 2012; 78: 1315–1322.
- [7] Jacobs LD, Cookfair DL, Rudick RA, et al. Intramuscular interferon beta-1a for disease progression in relapsing multiple sclerosis. The Multiple Sclerosis Collaborative Research Group (MSCRG). Ann Neurol 1996; 39: 285–294.
- [8] Randomised double-blind placebo-controlled study of interferon beta-1a in relapsing/remitting multiple sclerosis. PRISMS (Prevention of Relapses and Disability by Interferon beta-1a Subcutaneously in Multiple Sclerosis) Study Group. Lancet 1998; 352: 1498–1504.
- [9] Kappos L, Traboulsee A, Constantinescu C, et al. Long-term subcutaneous interferon beta-1a therapy in patients with relapsing-remitting MS. Neurology 2006; 67: 944–953.
- [10] Johnson KP, Brooks BR, Cohen JA, et al. Copolymer 1 reduces relapse rate and improves disability in relapsing-remitting multiple sclerosis: results of a phase III multicenter, double-blind placebo-controlled trial. The Copolymer 1 Multiple Sclerosis Study Group. Neurology 1995; 45: 1268–1276.
- [11] Johnson KP, Brooks BR, Cohen JA. Extended use of glatiramer acetate (Copaxone) is well tolerated and maintains its clinical effect on multiple sclerosis relapse rate and degree of disability. Copolymer 1 Multiple Sclerosis Study Group. Neurology 2001; 50: 701–708.
- [12] Comi G, Filippi M, Wolinsky JS. European/Canadian multicenter, double-blind, randomized, placebo-controlled study of the effects of glatiramer acetate on magnetic resonance imaging--measured disease activity and burden in patients with relapsing multiple sclerosis. European/Canadian Glatiramer Acetate Study Group. Ann Neurol 2001; 49: 290–297.
- [13] Khan O, Rieckmann P, Boyko A, et al. Three times weekly glatiramer acetate in relapsing-remitting multiple sclerosis. Ann Neurol 2013; 73: 705–713.
- [14] O’Connor P, Filippi M, Arnason B, et al. 250 microg or 500 microg interferon beta-1b versus 20 mg glatiramer acetate in relapsing-remitting multiple sclerosis: a prospective, randomised, multicentre study. Lancet Neurol 2009; 8: 889–897.
- [15] Calabresi PA, Kieseier BC, Arnold DL, et al. Pegylated interferon β-1a for relapsing-remitting multiple sclerosis (ADVANCE): a randomised, phase 3, double-blind study. Lancet Neurol 2014; 13: 657–665.
- [16] Cohen JA, Chun J. Mechanisms of fingolimod’s efficacy and adverse effects in multiple sclerosis. Ann Neurol 2011; 69: 759–777.
- [17] Kappos L, Radue EW, O’Connor P, et al. A placebo-controlled trial of oral fingolimod in relapsing multiple sclerosis. N Engl J Med 2010; 362: 387–401.
- [18] Hybertson BM, Gao B, Bose SK, et al. Oxidative stress in health and disease: the therapeutic potential of Nff2 activation. Mol Aspects Med 2011; 32: 234–246.
- [19] Gold R, Kappos L, Arnold DL, et al. Placebo-controlled phase 3 study of oral BG-12 for relapsing multiple sclerosis. N Engl J Med 2012; 367: 1098–1107.
- [20] Fox RJ, Miller DH, Phillips JT. Placebo-controlled phase 3 study of oral BG-12 or glatiramer in multiple sclerosis. N Engl J Med 2012; 367: 1087–1097.
- [21] Zeyda M, Poglitsch M, Geyeregger R. Disruption of the interaction of T cells with antigen-presenting cells by the active leflunomide metabolite teriflunomide: involvement of impaired integrin activation and immunologic synapse formation. Arthritis Rheum 2005; 52: 2730–2739.
- [22] O’Connor P, Wolinsky JS, Confavreux C. Randomized trial of oral teriflunomide for relapsing multiple sclerosis. N Engl J Med 2011; 365: 1293–1303.
- [23] Confavreux C, O’Connor P, Comi G, et al. Oral teriflunomide for patients with relapsing multiple sclerosis (TOWER): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Neurol 2014; 13: 247–256.
- [24] Vermersch P, Czlonkowska A, Grimaldi LM. Teriflunomide versus subcutaneous interferon beta-1a in patients with relapsing multiple sclerosis: a randomised, controlled phase 3 trial. Mult Scler 2014; 20: 705–716.
- [25] Rudick RA, Sandrock A. Natalizumab: alpha 4-integrin antagonist selective adhesion molecule inhibitors for MS. Expert Rev Neurother 2004; 4: 571–580.
- [26] Polman CH, O’Connor PW, Havrdova E, et al A randomized, placebo-controlled trial of natalizumab for relapsing multiple sclerosis. N Engl J Med 2006; 354: 899–910.
- [27] Rudick RA, Stuart WH, Calabresi PA, et al. Natalizumab plus interferon beta-1a for relapsing multiple sclerosis. N Engl J Med 2006; 354: 911–923.
- [28] Cohen JA, Coles AJ, Arnold DL, et al. Alemtuzumab versus interferon beta 1a as first-line treatment for patients with relapsing-remitting multiple sclerosis: a randomised controlled phase 3 trial. Lancet 2012; 380: 1819–1828.
- [29] Coles AJ, Twyman CL, Arnold DL. Alemtuzumab for patients with relapsing multiple sclerosis after disease-modifying therapy: a randomised controlled phase 3 trial. Lancet 2012; 380: 1829–1839.
- [30] Fox EJ. Mechanism of action of mitoxantrone. Neurology 2004; 63 (Suppl 6): S15–18.
- [31] Hartung HP, Gonsette R, König N, et al. Mitoxantrone in progressive multiple sclerosis: a placebo-controlled, double-blind, randomised, multicentre trial. Lancet 2002; 360: 2018–2025.
- [32] Killian JM, Bressler RB, Armstrong RM, et al. Controlled pilot trial of monthly intravenous cyclophosphamide in multiple sclerosis. Arch Neurol 1988; 45: 27–30.
- [33] Giovannoni G, Comi G, Cook S, et al A placebo-controlled trial of oral cladribine for relapsing multiple sclerosis. N Engl J Med 2010 ; 362: 416–426.
- [34] Comi G, Jeffery D, Kappos L, et al. Placebo-controlled trial of oral laquinimod for multiple sclerosis. N Engl J Med 2012; 366: 1000–1009.
- [35] Vollmer TL, Sorensen PS, Selmaj K, et al. A randomized placebo-controlled phase III trial of oral laquinimod for multiple sclerosis. J Neurol 2014; 261: 773–783.
- [36] Dufek M. Léčba roztroušené sklerózy v České republice – možnosti a realita. Neurol praxi 2014; 15: 31–35.
- [37] Jacobs LD, Beck RW, Jimon JH, et al. Intramuscular interferon b-1a therapy initiated during a first demyelinating event in multiple sclerosis. N Engl J Med 2000; 343: 898–904.
- [38] Comi G, Filippi M, Barkhof F, et al. Effect of early interferon treatment on conversion to definite multiple sclerosis: a randomised study. Lancet 2001; 357: 1576–1582.
- [39] Tintoré M. Early MS treatment. Int MS J 2007; 14: 5–10.
- [40] Comi G, De Stefano N, Freedman MS, et al. Comparison of two dosing frequencies of subcutaneous interferon beta-1a in patients with a first clinical demyelinating event suggestive of multiple sclerosis (REFLEX): a phase 3 randomised controlled trial. Lancet Neurol 2012; 11: 33–41.
- [41] Kappos L, Polman ChH, Freedman MS, et al. Treatment with interferon beta-1b delays conversion to clinically definite and McDonald MS with clinically isolated syndromes. Neurology 2006; 67: 1242–1249.
- [42] Comi G, Martinelli V, Rodegher M, et al. Effect of glatiramer acetate on conversion to clinically definite multiple sclerosis in patients with clinically isolated syndrome (PreCISe study): a randomised, double-blind, placebo-controlled trial. Lancet 2009; 374: 1503–1511.
- [43] Lublin FD, Cofield SS, Cutter GR, et al. Randomized study combining interferon and glatiramer acetate in multiple sclerosis. Ann Neurol 2013; 73: 327–340.
- [44] Cocco E, Marrosu MG. The current role of mitoxantrone in the treatment of multiple sclerosis. Expert Rev Neurother 2014; 14: 607–616.
- [45] dostupné z url: http://www.sukl.cz
- [46] Siracusa G, Sorbi S, Portaccio E, et al. Cognitive impairment predicts conversion to multiple sclerosis in clinically isolated syndromes. Mult Scler 2010; 16: 62–67.
- [47] Sormani MP, Bonzano L, Roccatagliata L, et al. Magnetic resonance imaging as a potential surrogate for relapses in multiple sclerosis: a meta-analytic approach. Ann Neurol 2009; 65: 268–275.
- [48] Sormani MP, Arnold DL, De Stefano N. Treatment effect on brain atrophy correlates with treatment effect on disability in multiple sclerosis. Ann Neurol 2014; 75: 43–49.
- [49] Bertolotto A, Capobianco M, Amato MP, et al. Guidelines on the clinical use for the detection of neutralizing antibodies (NAbs) to IFN beta in multiple sclerosis therapy: report from the Italian Multiple Sclerosis Study group. Neurol Sci 2014; 35: 307–316.
- [50] Pilz G, Harrer A, Oppermann K, et al. Molecular evidence of transient therapeutic effectiveness of natalizumab despite high-titre neutralizing antibodies. Mult Scler 2012; 18: 506–509.
- [51] Hradílek P. Adherence k léčbě u roztroušené sklerózy. Neurol praxi 2012; 13: 155–158.
- [52] Killestein J, Rudick RA, Polman CH. Oral treatment for multiple sclerosis. Lancet Neurol 2011; 10: 1026–1034.
- [53] Hoepner R, Faissner S, Salmen A, et al. Efficacy and side effects of natalizumab therapy in patients with multiple sclerosis. J Cent Nerv Syst Dis 2014; 6: 41–49.
- [54] Scott LJ. Fingolimod: a review of its use in the management of relapsing-remitting multiple sclerosis. CNS Drugs 2011; 25: 673–698.
- [55] Marriott JJ, Miyasaki JM, Gronseth G, et al. Evidence Report: The efficacy and safety of mitoxantrone (Novantrone) in the treatment of multiple sclerosis: Report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. Neurology 2010; 74: 1463–1470.
- [56] Coles AJ. Alemtuzumab treatment of multiple sclerosis. Semin Neurol 2013; 33: 66–73.
- [57] Ruggieri S, Tortorella C, Gasperini C. Pharmacology and clinical efficacy of dimethyl fumarate (BG-12) for treatment of relapsing-remitting multiple sclerosis. Ther Clin Risk Manag 2014; 10: 229–239.
- [58] Teriflunomide for the treatment of relapsing multiple sclerosis: a review of clinical data. Brunetti L, Wagner ML, Maroney M, et al. Ann Pharmacother 2013; 47: 1153–1160.