Současné možnosti léčby projevů hereditárního angioedému
Hereditární angioedém je vrozená porucha C1 inhibitoru systému komplementu. Je řazen mezi primární imunodeficity. Článek shrnuje patogenezi, klinické příznaky (otoky kožní a slizniční), diferenciální diagnostiku (odlišení získaného angioedému) a uvádí současné možnosti diagnostiky (imunologické a genetické). Dále je pojednáno o současných terapeutických doporučeních a postupech, o léčbě akutní a profylaktické a o možnostech léčby postižených pacientů v rámci České republiky. Zmíněny jsou i problémy, s nimiž se imunologové při léčbě potýkají.
Úvod
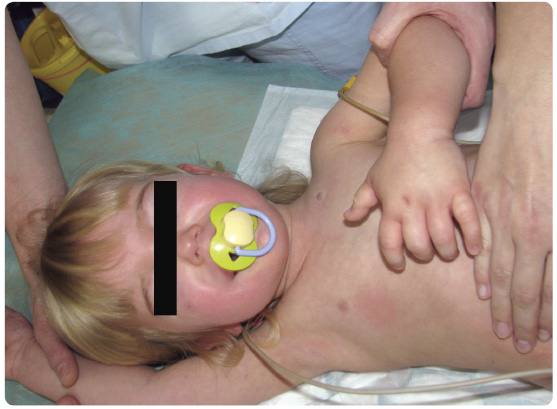 Hereditární angioedém (HAE) je relativně vzácné vrozené onemocnění, jehož hlavním klinickým projevem jsou masivní otoky podkoží a/nebo sliznic. HAE se počítá k primárním imunodeficitům, i když svými projevy poněkud vybočuje. Podstatou onemocnění je mutace genu pro C1 inhibitor (C1-INH), způsobující jeho buď výrazně sníženou tvorbu, nebo afunkčnost (obr. 1).
Hereditární angioedém (HAE) je relativně vzácné vrozené onemocnění, jehož hlavním klinickým projevem jsou masivní otoky podkoží a/nebo sliznic. HAE se počítá k primárním imunodeficitům, i když svými projevy poněkud vybočuje. Podstatou onemocnění je mutace genu pro C1 inhibitor (C1-INH), způsobující jeho buď výrazně sníženou tvorbu, nebo afunkčnost (obr. 1).
C1-INH je inhibitor proteáz z rodiny serpinů a jeho hlavními funkcemi jsou inhibice spontánní aktivace klasické cesty komplementu a inhibice kallikreinu v kininovém systému. Porucha inhibice kallikreinu a spuštění kininové kaskády jsou považovány za hlavní příčinu masivních otoků.
Historicky první zmínky o otocích pocházejí od J. L. Miltona z roku 1876. V osmdesátých letech 19. století popsali edémy pod názvem angio-neurotic oedema H. Quincke (1882) a W. Osler (1888) [1], který již rozeznal vrozenou formu klinických projevů od jiných otoků. V roce 1963 popsali V. H. Donaldson a R. R. Evans defekt C1-INH jako příčinu onemocnění [2]. Postupně byla odhalena genetická příčina a zjištěna dlouhá řada různých typů mutací genu. Bylo odhaleno mnoho souvislostí funkce C1-INH a systémů koagulace, fibrinolýzy, komplementu a kininové kaskády [1, 3, 4]. Přesto existuje ještě řada nejasností v patofyziologii procesu vzniku edémů jako klinických projevů HAE.
Současná prevalence výskytu představující poměr zhruba 1 : 50 000 umožňuje považovat HAE za vzácné onemocnění.
Předpokládá se, že v ČR trpí tímto onemocněním kolem 150–200 lidí, ne všichni jsou ovšem pod lékařským dohledem; existují i pacienti, jejichž klinické projevy jsou minimální, a proto u nich onemocnění HAE dosud nebylo diagnostikováno. Péče o pacienty je u nás soustředěna do specializovaných center zejména z terapeutických důvodů, neboť léčba je velmi nákladná a – jak uvidíme dále – také administrativně náročná. V České republice jsou zřízena celkem čtyři centra – v Praze, Brně, Hradci Králové a v Plzni, vždy v rámci imunologických pracovišť fakultních nemocnic. Celkem je registrováno 131 nemocných (v Praze 37, v Brně 65, v Plzni 17, v Hradci Králové 12 pacientů). V těchto centrech probíhá diagnostika nemocných stejně jako i léčba jednotlivých pacientů. Genetické vyšetření je prováděno na brněnském pracovišti.
Patogeneze, klinické projevy a diagnostika HAE
Hereditární angioedém je v současné době z patofyziologického pohledu některými autory označován jako bradykininem indukovaný angioedém [4]. Z posledních výzkumů a hlavně z hledání nových možností terapeutického ovlivnění vyplývá, že bradykinin (BK) je skutečně hlavním mediátorem v patogenezi edémů. BK je peptid, který je součástí kininového systému, a jeho funkcí je zvýšení cévní permeability, což při patologickém zvýšení jeho koncentrace vede k extravazaci tekutiny do intersticiálního prostoru podkožního a slizničního a k následnému vzniku otoku.
![Obr. 2 Vztahy mezi aktivací plazmatických kaskádových systémů a C1 inhibitoru, volně podle [4] – Caballero, et.al., 2011. – místa inhibice C1-INH; ACE – angiotenzin konvertující enzym; APP – protein akutní fáze; B1R – bradykininový receptor 1; B2R – bradykininový receptor 2; C1-INH – C1 inhibitor; tPA – tkáňový plazminogenový aktivátor; UK – urokináza](https://www.remedia.cz/photo-a-29107---.jpg) Vztahy mezi aktivací plazmatických kaskádových systémů a C1-INH schematicky zachycuje obr. 2.
Vztahy mezi aktivací plazmatických kaskádových systémů a C1-INH schematicky zachycuje obr. 2.
Inhibice C1-INH se v zásadě vztahuje ke třem systémům. Patří sem klasická cesta aktivace komplementového systému (dochází k vazbě na složky komplementu C1r, C1s a C1q) a MB (mannose binding) lektinová cesta aktivace komplementu (tvorba komplexů se serinovou proteázou MASP) [5]. Tím třetím je kontaktní systém koagulace (působení na kallikrein, aktivovaný faktor XII a na vnitřní kaskádu koagulace, působení na faktor XI).
Pro vznik angioedému se zdá být stěžejní systém kininové kaskády, kde aktivovaný kallikrein uvolňuje BK z vysokomolekulárního kininogenu. BK potom působí cestou svých receptorů: konstitučního receptoru B2R (tato cesta je velmi dobře známá a její ovlivnění je podkladem léčby akutních atak HAE) a receptoru B1R, který je indukován produkty zánětu (poškození tkáně, bakteriální endotoxiny, prozánětlivé cytokiny – TNF-α a IL-1-β). To následně vede ke zmíněné extravazaci a klinickému otoku [1].
Studiem genetických podkladů deficience C1-INH byla zjištěna řada mutací – v současné době je jich známo více než 150. Gen pro C1-INH se nachází na 11. chromozomu (11q12-q13.1) [6]. Typy mutací jsou různé, nejčastějšími jsou delece, bodové mutace, frameshift mutace, částečné duplikace.
Podle typu mutace rozlišujeme HAE I. typu, II. a III. typu. U I. typu, který se vyskytuje nejčastěji (85 %), jde o deficienci C1-INH, u II. typu je jeho produkce zachována v normálním množství, ale protein je nefunkční (15 %). III. typ je obtížně diagnostikovatelný. Pacienti mají normální hladinu i funkci C1-INH, ale přesto se u nich objevují klinické projevy otoků. Předpokládá se souvislost se zvýšenou hladinou estrogenu, u některých pacientů byla prokázána mutace genu pro faktor XII, čímž je výrazně zvýšena jeho aktivita. Zvýšená hladina estrogenů může vést ke zhoršení epizod angioedému (AE) různým způsobem. Ve studiích byl zjištěn vzestup hladiny faktoru XII, kallikreinu a kininů [7] jako reakce na exogenní podání estrogenů. Estrogeny také mohou inhibovat angiotenzinkonvertázu (ACE) a zvyšovat expresi B2R [1, 4].
Z hlediska diferenciální diagnostiky je nutno odlišit získaný AE (acquired angioedema). Získaný AE lze rozdělit také do určitých subtypů. Nejčastěji se vyskytuje subtyp paraneoplastický, neoplastické tkáně spotřebovávají C1-INH, jde tedy o konsumpční mechanismus. U některých pacientů byly prokázány autoprotilátky proti C1-INH, ale nejde o autoimunitní jednotku. Autoprotilátky byly prokázány např. u pacientů s neoplazmaty. Vzácně se může vyskytnout parainfekční AE, zejména u infekcí Helicobacter pylori [8]. Polékový AE je znám u pacientů léčených pro hypertenzi inhibitory ACE. K akutnímu vzniku otoku může dojít i po dlouhodobém užívání těchto léků, které dosud bylo bez komplikací. Navíc diferenciálnědiagnostický postup ztěžuje fakt, že inhibitor ACE může být podán pacientovi s HAE, který dosud byl klinicky němý.
Klinické projevy AE
Pacient s HAE je heterozygotem pro mutaci genu C1-INH a mezigenerační přenos je autozomálně dominantní; riziko vzniku nemoci je tedy 50 %. Pro HAE je typický familiární výskyt s podílem asymptomatických jedinců, hlavně v mladém věku. Klinické projevy jsou velmi variabilní a individuální. Existují rodiny se stejnou zděděnou mutací, kde se u každého postiženého člena projeví jiné příznaky nemoci. Nejčastější jsou kožní otoky objevující se v různých lokalizacích na celém těle. Otoky jsou poměrně masivní, bledé, nesvědivé, bez lokálního zvýšení teploty, někdy mohou být bolestivé z napětí tkání. Gastrointestinální projevy jsou dány lokálními otoky střevní sliznice imitujícími náhlou břišní příhodu s mnohdy krutými bolestmi a částečnou střevní neprůchodností a někdy jsou doprovázeny také zvracením a průjmy. V lehčí formě může jít jen o projevy mírného střevního diskomfortu. Udává se, že až třetina pacientů může být operována pro náhlou příhodu břišní v případě, že jde o první projev nemoci [9].
Laryngeální projevy jsou nejnebezpečnější. Dříve až třetina pacientů umírala na zadušení při neprůchodnosti dýchacích cest. Udává se, že se u poloviny pacientů může alespoň jedenkrát za život objevit život ohrožující laryngeální edém [9]. Při chybné diagnóze a pozdním zahájení terapie může dojít k úmrtí i v současnosti. Vzácné mohou být projevy pleurální, cystitida a uretritida imitující zánět močových cest. Velmi vzácné jsou projevy neurologické při afekci mozkových cév.
Diagnostika
Diagnóza v běžných případech není složitá, prokazujeme nízkou hladinu C4 složky komplementu vlivem konsumpce a velmi nízkou hladinu C1-INH u I. typu nemoci. U II. typu se hladina nefunkčního C1-INH objevuje v mnohdy zvýšené hodnotě. Určení hladin C4 složky komplementu a C1-INH vyžaduje pouze rutinní jednoduché laboratorní metody. K jejich určení se dnes zpravidla využívá analyzátorů pracujících na principu nefelometrie. Principem stanovení funkčnosti C1-INH je tvorba komplexu s přirozeným reaktantem C1s složkou a detekce tohoto komplexu metodou ELISA. Nefunkční C1-INH komplex se na rozdíl od kontrol netvoří. Vyšetření komplementu ale neodliší spolehlivě formu získaného AE. Proto je při podezření na vrozenou formu onemocnění prováděno i genetické vyšetření. Vzhledem k tomu, že jde většinou o rodinný výskyt, pečlivá anamnéza je velmi dobrým diagnostickým vodítkem. Při podezření na získaný AE je nutno pátrat po primárním onemocnění, a to zejména onkologickém.
Léčba HAE a její strategie
Indikace k léčbě je dána mezinárodními konsenzy [10, 11].
Léčba klinických příznaků u pacientů s HAE závisí na velikosti a lokalitě otoků. Léčebný přístup je jiný v případech ak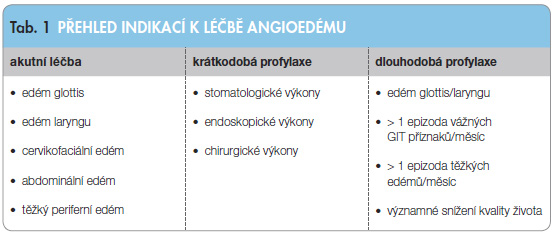 utních atak a jiný v případě krátkodobé či dlouhodobé profylaxe (tab. 1). V případech akutních je léčba indikována vždy, když se jedná o život ohrožující otok v oblasti laryngu, ale i tam, kde jde o otok v oblasti krku a obličeje; dále potom při abdominální symptomatologii s bolestmi břicha a zvracením. Otok střevní sliznice může v neléčeném případě rezultovat v totální uzavření a intususcepci se všemi následky. Těžký periferní edém je také indikací k akutní léčbě. V případech lehčích periferních edémů se obvykle čeká na spontánní odeznění.
utních atak a jiný v případě krátkodobé či dlouhodobé profylaxe (tab. 1). V případech akutních je léčba indikována vždy, když se jedná o život ohrožující otok v oblasti laryngu, ale i tam, kde jde o otok v oblasti krku a obličeje; dále potom při abdominální symptomatologii s bolestmi břicha a zvracením. Otok střevní sliznice může v neléčeném případě rezultovat v totální uzavření a intususcepci se všemi následky. Těžký periferní edém je také indikací k akutní léčbě. V případech lehčích periferních edémů se obvykle čeká na spontánní odeznění.
Krátkodobá profylaxe je jednoznačně indikována před velkými, ale i menšími zákroky [1, 10]. Přestože všechny mezinárodní konsenzy posledních let krátkodobou profylaxi jednoznačně doporučují, v indikačních doporučeních jednotlivých preparátů zcela chybí. Dlouhodobá profylaxe je indikována zejména u pacientů s velmi závažnými a častými atakami edémů, i když vyvolává vedlejší účinky a její účinnost není zcela stoprocentní [1, 10, 11].
Strategii léčby HAE je možno rozdělit na léčbu akutních atak a léčbu profylaktickou.
Akutní léčba
Základní léčbou pro akutní ataky je intravenózní podání koncentrátu C1-INH nebo rekombinantního C1-INH (konestat alfa). Doporučené dávkování je u koncentrátu C1-INH 20 jednotek/kg hmotnosti, obvykle ale stačí jedna lahvička (500 jednotek) pro dospělého pacienta. U 69 % pacientů se efekt dostaví do 30 minut, u 95 % pacientů do 2 hodin po podání. Poločas tohoto preparátu je 64 hodin. Preparát obsahující C1-INH je sice v ČR registrován, ale nemá dohodnutou úhradu zdravotní pojišťovny, proto je nutno v případě jeho indikace dovézt tento přípravek jako mimořádný dovoz, podat žádost na SÚKL a doložit povolení revizního lékaře zdravotní pojišťovny.
U rekombinantního C1-INH je dávka závislá na tělesné hmotnosti pacienta. Pro nemocné s hmotností do 84 kg je doporučená dávka 50 jednotek/kg, při tělesné hmotnosti vyšší než 84 kg se podává dávka 4200 jednotek. Vzhledem k možnému obsahu stop králičí bílkoviny v preparátu je nutno pacienty před léčbou konestatem alfa vyšetřit na přítomnost specifických IgE protilátek proti králičím alergenům. U pacientů alergických na králičí alergeny je přípravek kontraindikován.
Historicky je léčba koncentrátem C1-INHpoužívána v Evropě od roku 1973. Zpočátku byla zatížena nebezpečím přenosu viru nonAnonB hepatitidy, ale současný způsob zpracování plazmy toto v podstatě vylučuje.V současné době je však lékem první volby i přes svoji cenu antagonista receptoru B2R pro bradykinin, jehož zablokováním se zabrání rozvinutí edému [12]. Účinná látka ikatibant je podávána ve formě subkutánní injekce v předplněné stříkačce a je určena k podání samotným pacientem nebo blízkou osobou po zácviku lékařem se zkušeností s léčbou HAE. Doporučenou dávkou je jedna injekce, a pokud do 6 hodin nedojde k odeznění příznaků, je indikováno podání další dávky. Během 24 hodin smí být podány maximálně 3 injekce.
Další možností, ne však v ČR, je inhibitor kallikreinu ekalantid, který je zatím registrován jen v USA v indikaci pro dospělé pacienty. Existuje i ve formě subkutánní injekce, jejíž aplikaci by kvůli možným nežádoucím anafylaktickým účinkům měl provádět lékař [13].
Konestat alfa a ikatibant jsou léky se zvláštním režimem úhrady, která je vázána jen na léčebná centra. Konestat alfa není některými pojišťovnami hrazen ani v tomto režimu a je třeba o úhradu žádat revizního lékaře zdravotní pojišťovny.
Lékem volby při absenci jakékoliv jiné možnosti je čerstvá nebo mražená plazma, kde ale koncentrace C1-INH mnohdy nedostačuje k vyřešení problému.
Profylaktická léčba
Dlouhodobá profylaxe
K dlouhodobé profylaxi projevů HAE se od konce padesátých let používají atenuované androgeny, které zatím ne zcela jasným mechanismem zvyšují tvorbu C1-INH.
V roce 1960 popsal Spalding [1] tyto účinky u methyltestosteronu. V roce 1963 byl syntetizován derivát ethinyltestosteronu danazol, jehož vedlejší androgenní virilizující účinky jsou mírnější a který je od roku 1976 v Evropě používán pro prevenci otoků při HAE. Doporučené dávkování je na začátku léčby 400–600 mg/den podávaných každé 4 týdny, potom se dávka snižuje až k nejnižší účinné dávce. Většina pacientů je léčena dávkou 50–200 mg/den v dávkování denně nebo obden [4]. Kontraindikací je těhotenství, laktace, dětský věk a karcinom prostaty. Rizikem dlouhodobého podávání je častější vznik hepatocelulárního karcinomu. Je proto nutno pacienty pravidelně (doporučeno je jedenkrát za 6 měsíců) sledovat laboratorně (jaterní testy, krevní obraz s diferenciálním počtem) i sonograficky. Danazol není v ČR registrován a pacientům, u kterých je dlouhodobá profylaxe indikována, je zprostředkován jako mimořádný dovoz.
Antifibrinolytika jsou používána k dlouhodobé profylaxi od šedesátých let dvacátého století. Jejich účinnost je poměrně velmi nízká, jen u 30 % pacientů mají efekt na snížení počtu a tíže atak AE [1, 10, 11].
Kyselina ε-aminokapronová (8–12 g/den ve 4 dávkách) má bohužel řadu nepříjemných vedlejších účinků, jako je nebezpečí trombózy, hypotenze, myozitida. Méně vedlejších účinků, ale také nižší účinnost, 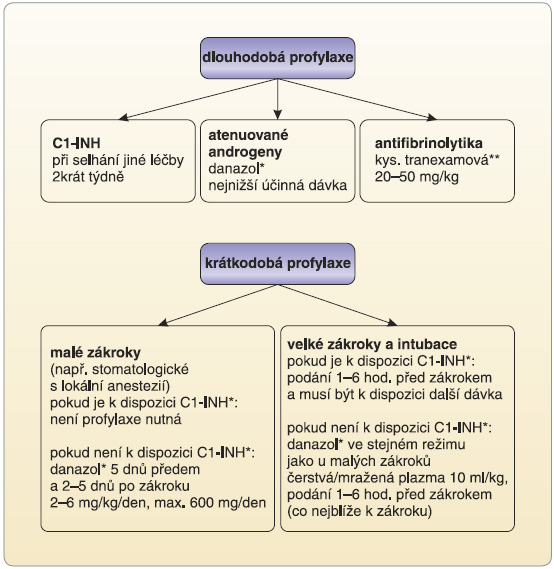 má kyselina tranexamová v dávkách 1–3 g/den.
má kyselina tranexamová v dávkách 1–3 g/den.
Vzhledem k mírnějším vedlejším účinkům je kyselina tranexamová terapeutickou volbou při dlouhodobé profylaxi, pokud je nutná, a u dětí, kde jsou atenuované androgeny kontraindikovány. Nutno říci, že v terapeutických indikacích preparátu není zahrnuta profylaxe AE.
V případech těžkého průběhu nemoci s opakovanými atakami ohrožujícími nebo značně znesnadňujícími život pacienta a při selhání jiné léčby je indikováno podávání koncentrátu C1-INH 2krát týdně i.v. (obr. 3) [10, 11].
Krátkodobá profylaxe
Krátkodobá profylaxe je doporučována pro případy malých či větších stomatologických a chirurgických zákroků, při nichž hrozí nebezpečí indukce akutní ataky AE u pacientů se známým onemocněním HAE [4]. Pravidla pro použití jednotlivých preparátů jsou popsána ve schématu (obr. 3). Rozdílný přístup je dán tíží a velikostí zákroku [10]. Hlavním problémem krátkodobé profylaxe je, že není zahrnuta v indikacích pro použití preparátů (SPC) u žádného z přípravků uváděných mezinárodními doporučeními. Tento problém, v současné době velmi žhavý, se řeší na evropské i republikové úrovni. Paradoxem je, že neregistrovaný danazol lze například objednat a koupit přes internet bez lékařského předpisu.
Léčba získaného AE
Specifickým problémem jsou pacienti, u nichž neprokážeme genetickou poruchu, a přesto mají velmi nízké hladiny C1-INH a časté ataky. Než dojde ke stanovení diagnózy primární příčiny a k jejímu odstranění, pokud je to možné, je třeba tyto nemocné léčit stejně jako pacienty s vrozenou poruchou, tedy substitucí C1-INH.
Bohužel žádná oficiální doporučení pro takové případy neexistují, pravidla pro léčbu se vztahují pouze na pacienty s HAE. Tyto stavy také samozřejmě nejsou brány v úvahu v doporučeních pro použití preparátů (SPC).
Léčba dětí
Zcela specifickým problémem je léčba dětí mladších 13 let. Pro akutní léčbu lze použít pouze jeden z koncentrátů C1-INH, který lze objednat po udělení souhlasu revizního lékaře jako mimořádný dovoz. Rekombinantní C1-INH, který je registrován, lze použít až u pacientů starších 13 let, ikatibant pro subkutánní použití až od 18 let. Problematika dlouhodobé profylaxe je podobná. Danazol je kontraindikován pro dlouhodobé použití, kyselina tranexamová nemá použití u HAE v indikacích. Nicméně doporučované možnosti vyplývají ze schématu (obr. 3) a jsou vyzkoušeny hlavně v maďarských a německých centrech [11, 14].
Z výše uvedeného vyplývá, že vzácné, ale závažné onemocnění HAE lze v současné době poměrně dobře diagnostikovat. Máme v rukou řadu léků, jimiž lze projevy ovlivnit a zajistit tak pacientům kvalitní život. Jde však o léčbu velmi nákladnou a lékaři se potýkají s řadou komplikujících administrativních faktorů, které bohužel mohou prodloužit interval mezi diagnózou a léčbou a ohrozit tak zdraví pacienta.
Seznam použité literatury
- [1] Agostoni A, Emel Aygoren-Pursun, Binklez KE, et al. Hereditary and acquired angioedema: Problems and progress: Proceedings of the third C1 esterase inhibitor deficiency workshop and beyond. JACI 2004; 114: S 51–131.
- [2] Donaldson VH, Evans RR. A biochemical abnormality in hereditary angioneurotic edema: absence of serum inhibitor of C1-esterase. Am J Med 1963; 35: 37–44.
- [3] Bowen T, Cicardi M, Farkas H, et al. International Consensus Algorithm For the Diagnosis, Therapy and Management of Hereditary angioedema. JACI 2004; 114: 629–637.
- [4] Caballero T, Baeza ML, Cabañas R, et al. Consensus Statement on the Diagnosis, Management, and Treatment of Angioedema Mediated by Bradykinin. Part I. Classification, Epidemiology, Pathophysiology, Genetics, Clinical Symptoms, and Diagnosis. J Investig Allergol Clin Immunol 2011; 21: 333–347.
- [5] Matsushita M, Thiel S, Jensenius JC, et al. Proteolytic activities of two types of mannose--binding lectin-associated serine protease. J Immunol 2000; 165: 2637–2642.
- [6] Janson M, Larsson C, Werelius B, et al. Detailed physical map of human chromosomal region 11q12-13 shows high meiotic recombination rate around the MEN1 locus. Proc Natl Acad Sci U S A 1991; 88: 10609–10613.
- [7] Cichon S, Martin L, Hennies HC, et al. Increased activity of coagulation factor XII (Hageman factor) causes hereditary angioedema type III. Am J Hum Genet 2006; 76: 1098–1104.
- [8] Farkas H, Gyeney L, Majthenyi P, et al. Angioedema due to acquired C1-esterase inhibitor deficiency in a patient with Helicobacter pylori infection. Z Gastroenterol 1999; 37: 513–518.
- [9] Agostoni A, Cicardi M. Hereditary and acquired C1-inhibitor deficiency: biological and clinical characteristics in 235 patients. Medicine (Baltimore) 1992; 71: 206–215.
- [10] Bowen T, Cicardi M, Farkas H, et al. 2010 International consensus algorithm for the diagnosis, therapy and management of hereditary angioedema. AACI Journal 2010; 6: 24.
- [11] Farkas H. Pediatric hereditary angioedema due to C1-inhibitor deficiency. Allergy Asthma Clin Immunol 2010; 6: 18.
- [12] Weller K, Magerl M, Maurer M. Successful treatment of an acute attack of acquired angioedema with the bradykinin-B2-receptor antagonist icatibant. J Eur Acad Dermatol Venereol 2011; 25: 119–120.
- [13] Zuraw B. HAE therapies: past present and future. Allergy Asthma Clin Immunol 2010, 6: 23.
- [14] Wahn V, Aberer W, Eberl W, et al. Hereditary angioedema (HAE) in children and adolescents a consensus on therapeutic strategies. Eur J Pediatr 2012; 171: 1339–1348.