Současné možnosti léčby průlomové bolesti u onkologických pacientů
Současné možnosti léčby průlomové bolesti se nástupem rychlých forem fentanylu výrazně zlepšily. Fentanyl je silný opioid, který se váže na opioidní receptory m, k, d. Největší afinitu má k m-receptorům. Nové aplikační formy jsou schopny účinně, rychle a bezpečně zmírnit ataky průlomových bolestí, což potvrzují četné klinické studie. Důležitá je postupná titrace během podávání. Pro pacienty jsou tyto nové aplikační formy jednoduchou a bezpečnou metodou léčby průlomové bolesti. K léčbě průlomové bolesti patří také adjuvantní analgetika.
Úvod
Bolest je zkušenost, kterou prožije až 30 % pacientů podstupujících onkologickou léčbu generalizovaného onkologického onemocnění s metastázami a více než 70 % onkologických pacientů v pokročilých stadiích onemocnění bez generalizace [1].
 Nádorová bolest je různorodá, pokud budeme vyhodnocovat její charakter (tab. 1). Závisí na mnoha faktorech, které zahrnují mimo jiné typ a stadium onkologického onemocnění, léčbu a toleranci pacienta k bolesti. V klasické učebnici bolesti Challenge of Pain poukázali Melzack a Wall [2] na to, že ve srovnání s jinými druhy bolesti je nádorová bolest samostatným typem bolesti, a zdůraznili, že by se k ní mělo přistupovat diferencovaně. V roce 1986 zveřejnila Světová zdravotnická organizace (WHO) soubor pokynů k léčbě nádorové bolesti na základě třístupňového analgetického žebříčku [3]. Hlavním cílem pokynů WHO bylo vhodnou formou podpořit předepisování silných opioidů, protože léčba bolesti u onkologických pacientů byla opakovaně odborníky posuzována jako zcela nedostatečná. Mezi hlavní příčiny nedostatečné preskripce opioidů patřily obavy ze vzniku návyku, tolerance a zneužívání těchto látek. I přes velké zkušenosti s efektivitou a účinností silných opioidů byl opakovaně kritizován třetí stupeň analgetického žebříčku WHO pro nedostatek validních dat k podpoře tohoto doporučeného postupu [4]. Mezi nejvíce používané opioidy v léčbě nádorové bolesti dosud stále patří morfin, který také dodnes zůstává jejím základním lékem. Je však třeba říci, že i přes velkou zkušenost lékařů s preskripcí morfinu a navzdory jeho široké dostupnosti v různých lékových formách neexistují nezvratné důkazy o jednoznačné výhodě léčby bolesti jedním či druhým opioidem [5]. Přibližně 10–30 % pacientů léčených perorální formou morfinu nemá očekávaný přínos z léčby kvůli nežádoucím účinkům, nedostatečné analgezii nebo kvůli kombinaci nežádoucích účinků a nedostatečné analgezie [6]. Individualizace léčby je potřebná hlavně k minimalizaci nežádoucích účinků a ke zlepšení opioidní odezvy pacienta. V současné době už je známo, že se individuální reakce pacientů na podání opioidů výrazně liší. Pacienti, u nichž byl zjištěn neadekvátní analgetický účinek a špatná snášenlivost jednoho opioidu, budou s vysokou pravděpodobností bez problémů tolerovat jiné opioidy.
Nádorová bolest je různorodá, pokud budeme vyhodnocovat její charakter (tab. 1). Závisí na mnoha faktorech, které zahrnují mimo jiné typ a stadium onkologického onemocnění, léčbu a toleranci pacienta k bolesti. V klasické učebnici bolesti Challenge of Pain poukázali Melzack a Wall [2] na to, že ve srovnání s jinými druhy bolesti je nádorová bolest samostatným typem bolesti, a zdůraznili, že by se k ní mělo přistupovat diferencovaně. V roce 1986 zveřejnila Světová zdravotnická organizace (WHO) soubor pokynů k léčbě nádorové bolesti na základě třístupňového analgetického žebříčku [3]. Hlavním cílem pokynů WHO bylo vhodnou formou podpořit předepisování silných opioidů, protože léčba bolesti u onkologických pacientů byla opakovaně odborníky posuzována jako zcela nedostatečná. Mezi hlavní příčiny nedostatečné preskripce opioidů patřily obavy ze vzniku návyku, tolerance a zneužívání těchto látek. I přes velké zkušenosti s efektivitou a účinností silných opioidů byl opakovaně kritizován třetí stupeň analgetického žebříčku WHO pro nedostatek validních dat k podpoře tohoto doporučeného postupu [4]. Mezi nejvíce používané opioidy v léčbě nádorové bolesti dosud stále patří morfin, který také dodnes zůstává jejím základním lékem. Je však třeba říci, že i přes velkou zkušenost lékařů s preskripcí morfinu a navzdory jeho široké dostupnosti v různých lékových formách neexistují nezvratné důkazy o jednoznačné výhodě léčby bolesti jedním či druhým opioidem [5]. Přibližně 10–30 % pacientů léčených perorální formou morfinu nemá očekávaný přínos z léčby kvůli nežádoucím účinkům, nedostatečné analgezii nebo kvůli kombinaci nežádoucích účinků a nedostatečné analgezie [6]. Individualizace léčby je potřebná hlavně k minimalizaci nežádoucích účinků a ke zlepšení opioidní odezvy pacienta. V současné době už je známo, že se individuální reakce pacientů na podání opioidů výrazně liší. Pacienti, u nichž byl zjištěn neadekvátní analgetický účinek a špatná snášenlivost jednoho opioidu, budou s vysokou pravděpodobností bez problémů tolerovat jiné opioidy.
Rotace opioidu se doporučuje při nepříznivých účincích, pokud je pomyslná analgetická rovnice vychýlena směrem k nežádoucím účinkům, a to navzdory dostatečné adjuvantní léčbě. Nahrazením opioidů a používáním nižších dávek, než se by se očekávalo (podle tabulek ekvivalence a konverze), je možné ve většině případů nejen snížit nebo zmírnit příznaky závislosti na opioidech, ale také zlepšit analgezii a celkovou opioidní odezvu. Tato strategie využívá aplikace nižších dávek alternativních opioidů u pacientů, kteří reagují na vysoké dávky morfinu. Biologický základ pro individuální variabilitu a citlivosti na různé opioidy je multifaktoriální a některé aspekty zůstávají stále nejasné [7].
Koncept ekvianalgezie je těžké uplatňovat v klinickém prostředí, kde pacienti trpí řadou nežádoucích účinků opioidů, a navíc s nedostatečnou analgezií. Často jsou také v kritickém stavu, který vyžaduje okamžitý zásah. Mnoho pacientů vyvine toleranci k většině nežádoucích účinků opioidů (např. nauzea/zvracení nebo nadměrná sedace) za několik dní po nastavení analgetické léčby. Nicméně je jisté, že někteří pacienti nemusí být schopni tolerovat perorální léky, protože mají problém s motilitou jícnu nebo trpí gastrointestinální obstrukcí (např. pacienti s karcinomy hlavy a krku nebo jícnu či s obstrukcí střeva).
Mezi novější a nyní již dobře zavedené aplikační formy patří transdermální podávání opioidů, kde je výhodou udržování vyrovnané plazmatické koncentrace účinné látky a jednoduchá aplikace pro pacienty. V náplasťové formě jsou k dispozici dva opioidy – fentanyl a buprenorfin.
Průlomová bolest
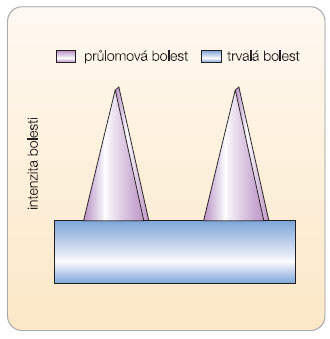 Za průlomovou bolest (breakthrough pain) považujeme náhlé, přechodné a krátkodobé vzplanutí bolesti, které se nejčastěji objevuje u pacientů s trvalou léčbou opioidy. Průlomová bolest představuje přechodné zhoršení bolesti u pacientů s dobře kontrolovanou základní bolestí [8]. Trvalá bolest (background pain) je charakterizována jako trvalá perzistentní bolest u nádorového onemocnění [9]. Graf 1 ukazuje typické epizody průlomové bolesti doprovázející bolest stálou.
Za průlomovou bolest (breakthrough pain) považujeme náhlé, přechodné a krátkodobé vzplanutí bolesti, které se nejčastěji objevuje u pacientů s trvalou léčbou opioidy. Průlomová bolest představuje přechodné zhoršení bolesti u pacientů s dobře kontrolovanou základní bolestí [8]. Trvalá bolest (background pain) je charakterizována jako trvalá perzistentní bolest u nádorového onemocnění [9]. Graf 1 ukazuje typické epizody průlomové bolesti doprovázející bolest stálou.
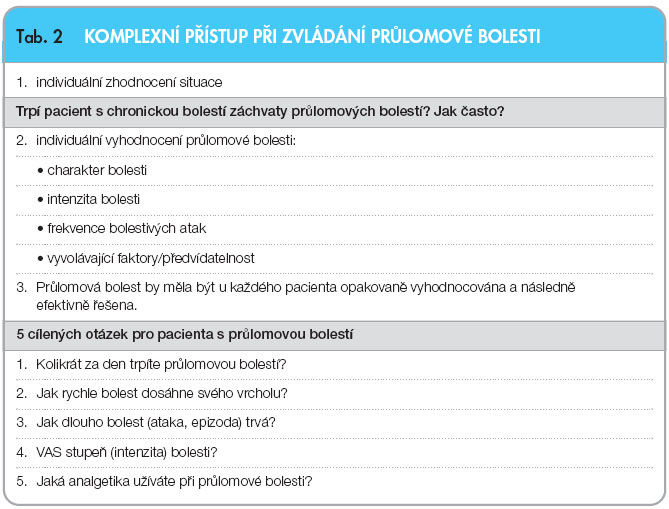 Většina pacientů byla dle průzkumů dlouhodobě nespokojena s léčbou průlomové bolesti [10]. Častým důvodem, proč průlomová bolest nebyla cíleně a adekvátně léčena, je fakt, že ataka průlomové bolesti odezněla dříve, než
Většina pacientů byla dle průzkumů dlouhodobě nespokojena s léčbou průlomové bolesti [10]. Častým důvodem, proč průlomová bolest nebyla cíleně a adekvátně léčena, je fakt, že ataka průlomové bolesti odezněla dříve, než  dostupná analgetika začala účinkovat [11]. Důležité je pacienta podrobně vyšetřit a zeptat se na stěžejní momenty vzniku průlomové bolesti, viz tab. 2 a 3.
dostupná analgetika začala účinkovat [11]. Důležité je pacienta podrobně vyšetřit a zeptat se na stěžejní momenty vzniku průlomové bolesti, viz tab. 2 a 3.
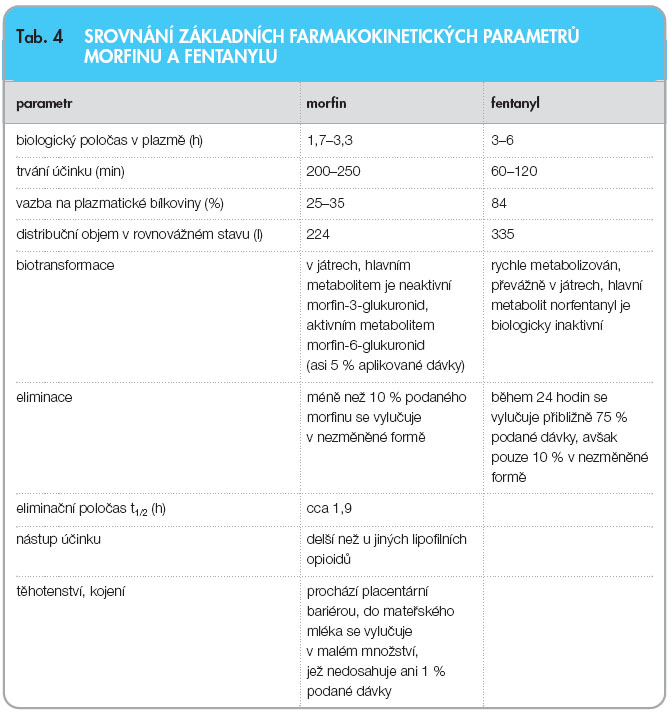 Téměř 50 % atak průlomových bolestí dosáhne svého maxima v průběhu 5 minut od vzniku bolesti. Do 15 minut od vzniku dosáhne průlomová bolest svého maxima až u 60 % jedinců. Důležité je srovnání působení morfinu podávaného per os, který začne účinkovat do 30 minut a jeho plazmatická hladina se udrží 4 hodiny, a fentanylu podávaného intranazálně, sublinguálně nebo bukálně, který začne účinkovat cca za 5 až 10 minut od podání a plazmatickou hladinu udrží průměrně hodinu. Základní rozdíly vidíme při srovnání základních farmakokinetických parametrů morfinu a fentanylu (tab. 4).
Téměř 50 % atak průlomových bolestí dosáhne svého maxima v průběhu 5 minut od vzniku bolesti. Do 15 minut od vzniku dosáhne průlomová bolest svého maxima až u 60 % jedinců. Důležité je srovnání působení morfinu podávaného per os, který začne účinkovat do 30 minut a jeho plazmatická hladina se udrží 4 hodiny, a fentanylu podávaného intranazálně, sublinguálně nebo bukálně, který začne účinkovat cca za 5 až 10 minut od podání a plazmatickou hladinu udrží průměrně hodinu. Základní rozdíly vidíme při srovnání základních farmakokinetických parametrů morfinu a fentanylu (tab. 4).
Fentanyl a jeho nové formy pro léčbu průlomové bolesti
Dlouhodobě trvala potřeba dostupnosti jednoduše aplikovatelné formy analgetika zajišťující účinnou kontrolu průlomové bolesti u pacientů s chronickými bolestmi, především v souvislosti s nádorovým onemocněním. Nové analgetikum vyvíjené k léčbě průlomové bolesti mělo být vysoce potentní s jednoduchým způsobem podání, rychlým nástupem účinku, který by měl trvat relativně krátkou dobu, s dobrou účinností, minimem nežádoucích účinků a finanční dostupností.
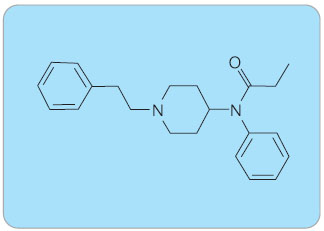 Fentanyl je agonista na µ-opioidních receptorech, je vysoce lipofilní, volně rozpustný v organických rozpouštědlech a mírně rozpustný ve vodě. Fentanyl obsahuje jádro piperidinu (obr. 1), který hraje důležitou roli v jeho účinnosti. Piperidinové jádro usnadňuje spojení s m-opioidními receptory. Fentanyl je potentnější než morfin. Fentanyl působí také na serotoninových receptorech, protože jeho analgetický efekt se snižuje v kombinaci s antagonisty na receptorech 5-HT1A. Fentanyl je schopen se extenzivně vázat na bílkoviny a zároveň je málo rozpustný ve vodě, má velký distribuční objem a vysokou molekulovou hmotnost, a proto jej není možné oddialyzovat. Fentanyl je metabolizován hlavně N-dealkylací na norfentanyl (4-N-[N-propionylanilino]piperidin) a hydroxyfentanyl, které jsou přítomny v plazmě a v moči. Izoformy cytochromu P-450, které se vyskytují v tenkém střevě, jsou zodpovědné za first-pass metabolismus fentanylu, pokud je podáván per os. Fentanyl může být podáván transdermálně, intravenózně, subkutánně, transmukozálně, intranazálně a sublinguálně.
Fentanyl je agonista na µ-opioidních receptorech, je vysoce lipofilní, volně rozpustný v organických rozpouštědlech a mírně rozpustný ve vodě. Fentanyl obsahuje jádro piperidinu (obr. 1), který hraje důležitou roli v jeho účinnosti. Piperidinové jádro usnadňuje spojení s m-opioidními receptory. Fentanyl je potentnější než morfin. Fentanyl působí také na serotoninových receptorech, protože jeho analgetický efekt se snižuje v kombinaci s antagonisty na receptorech 5-HT1A. Fentanyl je schopen se extenzivně vázat na bílkoviny a zároveň je málo rozpustný ve vodě, má velký distribuční objem a vysokou molekulovou hmotnost, a proto jej není možné oddialyzovat. Fentanyl je metabolizován hlavně N-dealkylací na norfentanyl (4-N-[N-propionylanilino]piperidin) a hydroxyfentanyl, které jsou přítomny v plazmě a v moči. Izoformy cytochromu P-450, které se vyskytují v tenkém střevě, jsou zodpovědné za first-pass metabolismus fentanylu, pokud je podáván per os. Fentanyl může být podáván transdermálně, intravenózně, subkutánně, transmukozálně, intranazálně a sublinguálně.
Sublinguální tablety fentanylu
Sublinguální fentanyl se podává přímo pod jazyk, kde je produkováno velké množství slin, což umožňuje rychlé rozpuštění tablety. Pokud má pacient sucho v ústech, zvlhčí dutinu ústní jednoduše vodou a pak následovně tabletu užije. Ústní sliznice se vyznačuje vysokou permeabilitou a vaskularizací, což umožňuje rychlou absorpci fentanylu a potřebný rychlý nástup analgetického účinku. Cílem randomizované, placebem kontrolované, dvojitě zaslepené studie fáze III bylo zhodnocení změn v intenzitě bolesti a ústupu bolesti. Do titrační fáze bylo zařazeno 131 pacientů, z toho do 12měsíční bezpečnostní fáze vstoupilo celkem 72 pacientů. Snížení intenzity bolesti po podání sublinguálního fentanylu bylo statisticky významně lepší než u placeba a statisticky významný efekt byl pozorován již 10 minut po podání. Léčba sublinguálním fentanylem byla dobře tolerována po celou dobu 12 měsíců [12]. Další studie hodnotila změnu v intenzitě bolesti v dávkách 100, 200 a 400 µg fentanylu oproti placebu. Aplikace všech sil a placeba byla podávána v náhodném pořadí při čtyřech epizodách bolesti. Do studie bylo zařazeno 38 pacientů, z nichž 23 studii dokončilo. Intenzita bolesti se statisticky významně snížila po podání 400 µg ve srovnání s placebem po 15 minutách (p = 0,005). Již po 5 minutách od podání byl zaznamenán trend snížení intenzity bolesti. Dávky 100 a 200 µg ukázaly pouze trend směrem ke zlepšení úlevy od bolesti. Výskyt nebo závažnost nežádoucích účinků se nezvyšovaly s rostoucí dávkou fentanylu [13].
Bukální tablety fentanylu
Tablety se užívají na začátku epizody průlomové bolesti. Tablety by měly být vyjmuty z obalu těsně před podáním mezi dáseň a tvář. Alternativně může být tableta rozpuštěna pod jazykem. Tablety se obvykle rozpustí ve 14.–25. minutě od podání; dochází k uvolnění účinné látky, která se vstřebává přímo do krevního řečiště. Po 30 minutách může pacient zbylé kousky tablety polknout a zapít sklenicí vody. Tablety se nesmí lámat nebo drtit a neměly by se cucat, žvýkat nebo polykat celé. Pacienti by neměli jíst ani pít nic, pokud je tableta v ústech.
Bukální tableta fentanylu byla účinnější než placebo při snižování bolesti v následujících studiích [14, 15]. V první studii poklesla intenzita bolesti v průměru o 3,2 bodu za 30 minut po podání ve srovnání s placebem. Ve druhé studii intenzita bolesti poklesla o 9,7 bodu za 60 minut po podání ve srovnání se změnou o 4,9 bodu proti placebu.
Bezpečnost a účinnost bukálních tablet fentanylu byla hodnocena u pacientů, kteří užívali opioidy, na začátku epizody průlomové bolesti. Pro každou epizodu průlomové bolesti byla intenzita bolesti hodnocena před atakou a po ní a u 67 % pacientů bylo možno jednoduše vytitrovat účinnou dávku.
Intranazální fentanyl
Intranazální aplikace fentanylu je umožněna díky vysoké propustnosti nosní sliznice pro lipofilní látky s celkovým objemem nosní dutiny 15–20 ml a povrchem nosní sliznice 150–180 cm2. Intranazální epitel má husté cévní zásobení s velmi vysokou krevní perfuzí, která umožní rychlou absorpci intranazálně aplikovaných látek, především liposolubilních. Intranazální podávání obchází jaterní first-pass metabolismus, výhodou je tato aplikační forma také u pacientů s xerostomií a nebo mukozitidou dutiny ústní. Pro pacienty tato forma podání opioidu představuje neinvazivní a snadný způsob aplikace, okamžitou úlevu od bolesti a aplikační formu, kterou pacient může kdykoliv a kdekoliv použít [16]. Původně byl intranazální fentanyl vyvíjen a zkoušen pro léčbu akutní pooperační bolesti. Ve studii Christrupa a kolektivu z roku 2008 [17] bylo srovnáváno podávání fentanylu intravenózní a intranazální, hodnocena byla především bezpečnost a účinnost při jednorázovém podání fentanylu. Studie byla randomizovaná, dvojitě zaslepená, zařazeni byli pacienti podstupující oboustrannou extrakci molárů. Zúčastnilo se jí 24 pacientů a 23 z nich studii dokončilo. Placebo bylo připraveno a podáváno společně jak pro intranazální, tak pro intravenózní podání. Každý pacient dostal jak intranazální, tak intravenózní fentanyl. 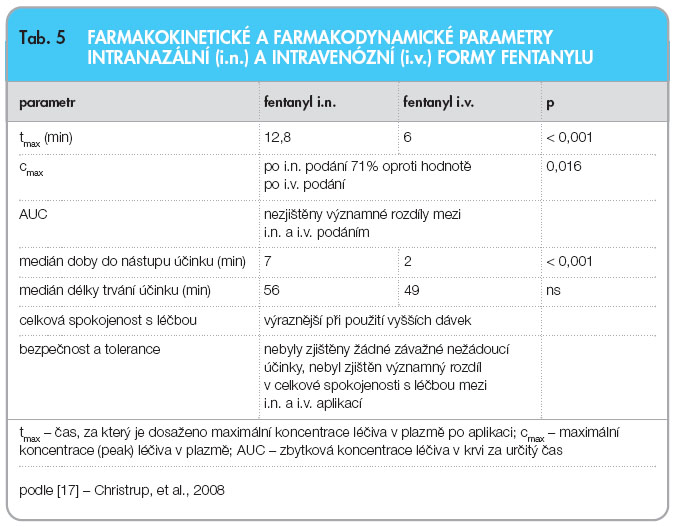 Hodnoceny byly čtyři různé dávky fentanylu, a to 75, 100, 150 a 200 µg, a sledovány byly následující parametry: změna (Δ) intenzity bolesti (PI) v období 0–60 minut od podání, doba do nástupu účinku, délka trvání analgetického účinku, celkové vnímání účinnosti v odstupu čtyř hodin po podání/nebo v době podání záchranné léčby. Hodnocenými ukazateli byly nežádoucí účinky, snášenlivost obou aplikačních forem fentanylu a celková bezpečnost léčby. Z farmakokinetických parametrů byly hodnoceny tmax (čas, za který je dosaženo maximální koncentrace léku v plazmě po aplikaci), cmax (maximální koncentrace – peak – léku v plazmě) a AUC (zbytková hodnota léků v krvi za určitý čas). Tab. 5 shrnuje nejdůležitější farmakokinetické parametry.
Hodnoceny byly čtyři různé dávky fentanylu, a to 75, 100, 150 a 200 µg, a sledovány byly následující parametry: změna (Δ) intenzity bolesti (PI) v období 0–60 minut od podání, doba do nástupu účinku, délka trvání analgetického účinku, celkové vnímání účinnosti v odstupu čtyř hodin po podání/nebo v době podání záchranné léčby. Hodnocenými ukazateli byly nežádoucí účinky, snášenlivost obou aplikačních forem fentanylu a celková bezpečnost léčby. Z farmakokinetických parametrů byly hodnoceny tmax (čas, za který je dosaženo maximální koncentrace léku v plazmě po aplikaci), cmax (maximální koncentrace – peak – léku v plazmě) a AUC (zbytková hodnota léků v krvi za určitý čas). Tab. 5 shrnuje nejdůležitější farmakokinetické parametry.
Adjuvantní léčba
Antidepresiva a antiepileptika jsou nejčastěji podávána jako koanalgetika v kombinaci s opioidy, a to zejména při přítomnosti neuropatické bolesti. Gabapentin se ukázal jako účinný při snižování bolesti a dysestezie, ale nikoliv alodynie, ve srovnání s placebem u pacientů s neuropatickou onkologickou bolestí, která nebyla dostatečně kontrolována podáváním opioidů systémově [18]. Podobně amitriptylin byl schopen celkově snížit bolest, ale produkoval více centrálních nežádoucích účinků ve srovnání s pacienty, kteří užívali opioidy samostatně [19]. V léčbě průlomové bolesti je poměrně zásadní, aby trvalá perzistentní bolest byla dobře kontrolována, a to se většinou podaří při kombinaci opioidů a koanalgetik.
Seznam použité literatury
- [1] Cleeland CS, Gonin R, Hatfield AK, et al. Pain and its treatment in outpatients with metastatic cancer. N Engl J Med 1994; 330: 592–596.
- [2] Melzack R, Wall PD. The challenge of pain. Updated 2nd edition. Penguin; 2008; pp 53–54.
- [3] World Health Organization Cancer pain relief and paliative care. WHO, Ženeva, 1990.
- [4] Mercadante S. Pain treatment and outcomes for patients with advanced cancer who receive follow-up care at home. Cancer 1999; 85: 1849–1858.
- [5] Mercadante S. Opioid titration in cancer pain: a critical review. Eur J Pain 2007; 11: 823–830.
- [6] Cherny N, Ripamonti C, Pereira J, et al. Expert Working Group of the European Association of Palliative Care Network 2001.
- [7] Benitez-Rosario M, Salinas-Martin A, Aguirre-Jaime A, et al. Morphine-methadone opioid rotation in cancer patients: analysis of dose predicting factors. J Pain Symptom Manage 2009; 37: 1061–1068.
- [8] Portenoy RK, Hagen NA. Breakthrough pain: definition, prevalence and characteristics. Pain 1990; 41: 273–281.
- [9] Webster LR. Breakthrough Pain in the Management of Chronic Persistent Pain Sydromes. Am J Manag Care 2008; 14: 116–122.
- [10] Davis MP, Walsh D, Lagman R, et al. Controversies in pharmacotherapy of pain management. Lancet Oncol 2005; 6: 696–704.
- [11] Davies AN, Vriens J, Kennett A, McTaggart M. An observational study of oncology patients’ utilization of breakthrough pain medication. J Pain Symptom Manage 2008; 35: 406–411.
- [12] Rauck RL, Tark M, Reyes E, et al. Efficacy and long-term tolerability of sublingual fentanyl orally disintegrating tablet in the treatment of breakthrough cancer pain. Curr Med Res Opin 2009; 25: 2877–2885.
- [13] Lennernäs B, Frank-Lissbrant I, Lennernäs H, et al. Sublingual administration of fentanyl to cancer patients is an effective treatment for breakthrough pain: results from a randomized phase II study. Palliative Medicine 2010; 24: 286–293.
- [14] Portenoy RK, Tailor D, Messina J, et al. A randomised, placebo-controlled study of fentanyl buccal tablet for breakthrough pain in opioid-treated patiens with cancer. Clin J Pain 2006; 22: 805–811.
- [15] Slatkin NE, Xie F, Messina J, Segal TJ. Fentanyl buccal tablet for relief of breakthrough pain in opioid-tolerant patients with cancer-related chronic pain. J Support Oncol 2007; 5: 327–334.
- [16] Dale O, Hjortkjaer R, Kharasch ED. Nasal administration of opioids for pain management in adults. Acta Anaesthesiol Scand 2002; 46: 759–770.
- [17] Christrup LL, Foster D, Popper LD, et al. Pharmacokinetics, efficacy, and tolerability of fentanyl following intranasal vs intravenous administration in adults undergoing third-molar extraction a randomised, double-blind, double-dummy, two-way, crossover study. Clin Ther 2008; 30: 469–481.
- [18] Caraceni A, Zecca E, Bonezzi C, et al. Gabapentin for neuropathic cancer pain: a randomized controlled trial from the Gabapentin Cancer Pain Study Group. J Clin Oncol 2004; 22: 2909–2917.
- [19] Mercadante S, Arcuri E, Tirelli W, el at. Amitriptyline in neuropathic cancer pain in patients on morphine therapy: a randomized placebo-controlled, double-blind crossover study. Tumori 2002; 88: 239–242.
- [20] European Medicines Agency. Dok. č. EMEA/ 483823/2009; EMEA/H/C/959.
- [21] Nolte T, Marchesini C, Oronska A. Efficacy of intranasal fentanyl for breakthrough pain in patients with cancer: results of a phase III trial. Annals of Oncology 2008;19 (Supplement 8): viii254–viii258.
- [22] Portenoy RK, Burton AW, Gabrail N, et al. Fentanyl Pectin Nasal Spray 043 Study GroupA multicenter, placebo-controlled, double-blind, multiple-crossover study of Fentanyl Pectin Nasal Spray (FPNS) in the treatment of breakthrough cancer pain. Pain 2010; 151: 617–624.
- [23] Rokyta R, Kršiak M, Kozák J. Bolest, 1. vyd. Praha: Tigis, 2006.
- [24] Svendsen KB, Andersen S, Arnason S, et al. Breakthrough pain in malignant and non-malignant diseases: a review of prevalence, characteristics and mechanisms. Eur J Pain 2005; 9: 195–206.