Současné možnosti léčby spasticity
Spasticita je častým projevem poškození centrálního motoneuronu, které nastává po traumatu, ischemii nebo hemoragii, v důsledku zánětu, degenerativního procesu či v souvislosti s výskytem nádoru. Klinický obraz tvoří syndrom centrálního motoneuronu, jehož hlavní součástí je kromě zvýšené svalové aktivity také zkrácení svalu a paréza. Pro posouzení typu a stupně spasticity je nezbytné objektivní vyšetření, k němuž se používají různé klinické škály. Komplexní léčba spasticity vyžaduje multidisciplinární přístup a vytyčení reálných cílů, které je třeba stanovit individuálně. Cílem léčby není úplné odstranění spasticity, ale zmírnění jejího negativního vlivu, který omezuje aktivity nemocného. Rehabilitace hraje důležitou roli v organizaci péče o tyto pacienty. Nejběžnějším a také nejjednodušším způsobem léčby spasticity zůstává perorální antispastická léčba. Botulotoxin má výsadní postavení v léčbě fokální spasticity. U těžké generalizované spasticity je možné podávání intratekálního baklofenu pumpovými systémy. Chirurgické metody jsou určeny pro pacienty s extrémně těžkou spasticitou, která není ovlivnitelná jinými léčebnými metodami.
Úvod
Spasticitu řadíme ke komplexním poruchám motoriky. V angličtině se označuje termínem spastic movement disorder [1]. Spasticita je častým klinickým projevem poškození centrálního motoneuronu, k němuž dochází po traumatu mozku, ischemické nebo hemoragické cévní mozkové příhodě (CMP), při zánětu nervového systému (například u roztroušené sklerózy), při degenerativním procesu či v důsledku vzniku nádoru [2, 3]. Chronické poranění mozku je doprovázeno spasticitou u 25–30 % nemocných [4], pacienti po prodělané CMP trpí spasticitou ve 4–42,6 % [5], nemocní s roztroušenou sklerózou až v 80–85 % [6]. Kolem 40 % nemocných s chronickým míšním poraněním má středně těžký a těžký stupeň spasticity [7].
Spasticita se objevuje v různé intenzitě a v různé době od začátku poruchy, ale neumíme odhadnout, u kterého pacienta a kdy se rozvine. V prvním měsíci po CMP je popsán výskyt spasticity u 4–27 % pacientů, v následujících třech měsících jí trpí 19–27 % nemocných [8]. Rok po míšním traumatu vyžaduje až 80 % nemocných některou z forem léčby spasticity [9].
Nadměrný svalový tonus, dystonická postura končetiny a bolestivé spasmy spolu s dalšími spastickými projevy výrazně zhoršují kvalitu života nemocných, snižují jejich pohyblivost, omezují běžné denní aktivity a snižují soběstačnost [10]. Je omezen aktivní i pasivní pohyb v kloubu, dochází ke změně viskoelasticity svalů i šlach a k náhradě kolagenním vazivem. Vznikají fixované svalové kontraktury. Při omezeném pohybu končetin se objevují deformity kloubů a osteoporóza. Spasticita může být zdrojem silných bolestí, které vedou k výraznému dyskomfortu.
Spasticita a její komplikace zvyšují nároky na léčebnou i ošetřovatelskou péči, zhoršují celkový dyskomfort pacienta a výrazně snižují kvalitu života. Ovlivnění spasticity je proto důležitou součástí péče o tyto nemocné. Cílem léčby spasticity není její úplné odstranění, ale zmírnění negativního vlivu při aktivitách, které nemocného omezují. Na začátku léčby je třeba stanovit reálné cíle, kterých chce pacient a lékař dosáhnout, a to včetně úvahy, kdy a jak může být spasticita pro pacienta užitečná [10]. Může pomoci v denních aktivitách, například při jídle (držení příboru, pití ze sklenice) nebo jako opora při chůzi.
Definice spasticity
Definovat a přesně vymezit, co je spasticita, je stále problematické. V současném pojetí se pod pojem spasticita zahrnují klinické projevy, které poruchu centrálního motoneuronu doprovázejí. Hovoří se o spasticitě v širším slova smyslu, což je v rozporu s původní klasickou definicí podle Lanceho [11], podle níž je spasticita charakterizována zvýšením tonického napínacího reflexu v závislosti na rychlosti pasivního protažení. Tato definice byla podrobena kritice, protože popisuje spasticitu pouze jako nadměrný svalový tonus [1, 12]. Ten je jen jedním z příznaků, který lézi centrálního motoneuronu doprovází. Zvýšená tonická svalová odpověď je výsledkem abnormálního zpracování proprioceptivní aferentace na míšní úrovni [13]. Při přerušení descendentních inhibičních drah dochází k plastické reorganizaci neuronálních míšních okruhů a k hyperexcitabilitě periferního motoneuronu.
Rostrálně v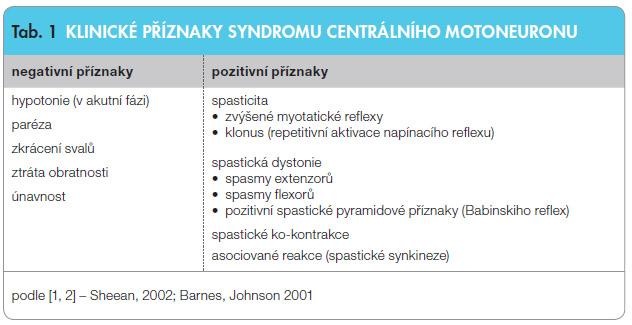 oblasti kmene jsou centra, která ovlivňují a řídí svalový tonus. Významný vliv mají vestibulospinální a retikulospinální dráhy. Důležitá je lokalizace a rozsah poruchy pyramidové dráhy, rychlost vzniku postižení, současná léze dalších centrálních descendentních drah. Je přítomna porucha pyramidové a parapyramidové dráhy, která začíná v suplementární motorické korové oblasti. Většina klinických příznaků se týká spinálních jevů (hyperreflexie, klonus, nadměrné únikové reakce), které vznikají právě kvůli poruše suprasegmentálních inhibičních mechanismů [1]. Klinický obraz je charakterizován tzv. syndromem horního motoneuronu (upper motoneuron syndrome) [2, 3, 14], jehož hlavní příznaky jsou uvedeny v tab. 1.
oblasti kmene jsou centra, která ovlivňují a řídí svalový tonus. Významný vliv mají vestibulospinální a retikulospinální dráhy. Důležitá je lokalizace a rozsah poruchy pyramidové dráhy, rychlost vzniku postižení, současná léze dalších centrálních descendentních drah. Je přítomna porucha pyramidové a parapyramidové dráhy, která začíná v suplementární motorické korové oblasti. Většina klinických příznaků se týká spinálních jevů (hyperreflexie, klonus, nadměrné únikové reakce), které vznikají právě kvůli poruše suprasegmentálních inhibičních mechanismů [1]. Klinický obraz je charakterizován tzv. syndromem horního motoneuronu (upper motoneuron syndrome) [2, 3, 14], jehož hlavní příznaky jsou uvedeny v tab. 1.
Součástí syndromu centrálního motoneuronu je kromě zvýšené svalové aktivity také zkrácení svalu a paréza. Zvýšená svalová aktivita zhoršuje parézu a přispívá ke zkracování svalu. Zkracování svalu zvýrazňuje oslabení a zesiluje nadměrnou svalovou aktivitu [15]. Jde o začarovaný kruh podmíněný řadou zpětných vazeb. V klidovém stavu vede spastická dystonie k abnormálnímu držení paretické končetiny [10, 13]. Při volním pohybu se objevují ko-kontrakce a synkineze, které nepříznivě ovlivňují zručnost a svalovou sílu. Negativní vliv mají flexorové a extenzorové spasmy.
Základním pohybovým reflexem je napínací reflex (stretch-reflex), který je vyvolán náhlým protažením svalu. Vzniká po podráždění svalového vřeténka. Vzruch se vede aferentními vlákny k alfa-motoneuronu příslušného svalu v míše. Tento reflex je nezbytný pro zajištění a řízení svalového tonu. Je základním předpokladem tvorby všech pohybů a zachování vzpřímené polohy těla. Základním pohybovým vzorcem je dvojkrok, který je naprogramován v míšních strukturách, ale podléhá supraspinálním vlivům.
Spastické dystonie si na pacientovi hned všimneme. Na rozdíl od zvýšeného svalového tonu je přítomna v klidu, kdy se žádný volní pohyb nevykonává. Dystonie je proměnlivá a zvyšuje se při protažení svalů, ale někdy se může déle trvajícím pasivním protažením snížit. Hemiplegická postura, s níž se lze často setkat u nemocných po CMP, se vyznačuje flexí v lokti, zápěstí a prstech, addukcí v rameni a pronací předloktí. Dolní končetina je extendována v kyčli a koleně, je přítomna plantární flexe s inverzí nohy a addukce stehna.
Flexorové a extenzorové spasmy jsou typickým klinickým projevem zvýšené svalové aktivity u nemocných s lézí centrálního motoneuronu. Původ mají ve zvýšených flexorových a extenzorových reflexech. Jsou provokovány zevními stimuly, ale objevují se i bez výrazného nociceptivního podnětu. Flexorové spasmy jsou častější u míšních lézí a bývají velmi bolestivé. Spasmy lze někdy využít k pohybu, např. při otočení v posteli nebo při oblékání.
Ko-kontrakce jsou důležitým mechanismem řízení hybnosti. Umožňují posturální stabilitu či fixaci určitého pohybového segmentu. Za normálních podmínek aferentní vlákna ze svalového vřeténka typu Ia inhibují alfa-motoneurony antagonisty a tím usnadňují pohyb v segmentu ve směru aktivity agonisty. U pacienta s poruchou centrálního motoneuronu dochází k poruše supraspinální kontroly této reciproční inhibice. Při volním pohybu nebo při pokusu o pohyb se objevují simultánní kontrakce agonistů a antagonistů ve stejném svalovém segmentu.
Asociované motorické reakce (synkineze) jsou asociované pohyby, které doprovázejí volní pohyb [16]. Na rozdíl od ko-kontrakcí se vyskytují v jiných svalových segmentech, než které jsou zapojeny do volního pohybu. Příkladem je nemocný s hemiparézou po CMP, u něhož se v průběhu chůze zhoršuje flexe v loketním kloubu. Asociované pohyby spastické končetiny mohou být vyvolány i volními pohyby zdravé končetiny.
Paréza je hlavním negativním projevem syndromu centrálního motoneuronu a zároveň hlavním klinickým projevem, který si pacient uvědomuje. Oslabení svalové síly kolísá od lehké parézy do plegie a je zpravidla hlavní příčinou invalidity nemocného. Je třeba rozpoznat, zda se na prohloubení parézy nepodílí zvýšená svalová aktivita. Svalovou sílu také oslabuje spastická dystonie, která se vyskytuje v klidu a ovlivňuje výchozí stav před zahájením pohybu. Zpravidla převažuje ve flexorech a tím oslabuje extenzory. Při volním pohybu ovlivňují svalovou sílu a koordinaci pohybů ko-kontrakce. Paréza je akcentována samotným zkrácením spastického svalu, který ztrácí schopnost se dále kontrahovat.
Omezený rozsah pohybu ovlivňuje kromě zvýšeného svalového tonu i změna viskoelasticity v okolních tkáních, a to ve vazech, šlachách i ve vlastním svalu. Objevují se již několik hodin po nástupu parézy a lze je pozorovat i při prosté imobilizaci končetiny u zdravých osob. Sval ztrácí objem a nové zkrácené délce se přizpůsobují okolní měkké tkáně včetně zásobujících cév. Konečným důsledkem dlouhodobě zkráceného svalu je vznik fixovaných svalových kontraktur, které nejdou pasivně mobilizovat. Postupující změny ve svalech vedou ke vzniku kloubních deformit. Může se objevit odvápnění kostí. Dochází ke zhoršování hygieny, je znesnadněno polohování a přesun a vzniká riziko dekubitů.
Spastický syndrom lze pro přehlednost rozdělit na dvě základní formy: cerebrální a míšní typ [2, 14]. U cerebrálního typu lézí je možno diferencovat léze korové, podkorové a léze v hlubokých strukturách, tj. nad úrovní kmene, a léze v úrovni mozkového kmene. Bývá výraznější podíl spasticity extenzorů, a to zejména na dolních končetinách. Typickým příkladem cerebrálního typu spasticity je hemiparetické postavení končetin při lézi v oblasti capsula interna. U spinálních lézí je přítomna spastická dystonie těžkého stupně, převažuje flekční postavení v kloubech na horních končetinách a extenční nebo flekční postavení na dolních končetinách.
Hodnocení spasticity
Pro posouzení typu a stupně spasticity je nezbytné objektivní vyšetření [17]. Důležitost má zejména na začátku léčby a je také výchozím parametrem určujícím směr další terapie. Klinické hodnotící škály vycházejí většinou z klinického vyšetření nemocného, ale lze použít i dotazníkové metody. Základním parametrem řady škál je kvantifikace odporu, který klade spastický sval vůči pasivnímu pohybu. Posuzuje se stupeň svalového hypertonu, dystonická postura končetiny, poloha části končetiny a úhel, který svírá v kloubním spojení, četnost svalových spasmů, porucha funkce jednotlivých svalů a svalových skupin.
Ke kvantifikaci svalového tonu se obecně doporučuje používání stupnice dle Ashwortha [18] nebo jeho modifikované stupnice [19]. Principem je pasivní protažení spastického svalu v průběhu jedné sekundy. Hodnotí se vždy pouze prvé provedení testu, protože opakováním dochází ke snížení tonu svalu a pohyb je volnější. Přínosem Tardieuovy škály [20] je vyšetření v různých rychlostech, což umožní rozlišit podíl neurální a biomechanické komponenty hypertonu. Často se používá škála frekvence spasmů, která stanoví počet spasmů během 24 hodin [21]. Jiná škála hodnotí svalový tonus v adduktorech kyčlí [22]. Používá se např. pro hodnocení účinku léčby (cévkování, péče o stolici, celkové zlepšení hygieny v perianogenitální oblasti apod.).
Index Barthelové hodnotí schopnost vykonávat běžné denní činnosti (ADL, Activities of Daily Living) včetně činnosti střev, močového měchýře, úpravy zevnějšku, použití WC, stravování, přesunů, pohyblivosti, oblékání, chůze a koupání [22]. Test funkční soběstačnosti (FIM, Functional Independence Measure) informuje o aktuálním stavu soběstačnosti nemocného a jeho vývoji, včetně potřeby pomoci v běžných denních činnostech. Škála dosažení cíle (GAS, Goal Attainment Scale) hodnotí výsledek léčby, ať již se jedná o rehabilitační, medikamentózní či chirurgickou terapii [23]. Svalový test informuje o síle jednotlivých svalů nebo svalových skupin [24]. Používá se dvouminutový test chůze a test vstávání a chůze na čas [25]. Je třeba kvantifikovat bolest (např. pomocí vizuální analogové škály VAS stupnicí 0–10). Velmi důležitým parametrem účinnosti léčby je dotazník kvality života. Používá se zkrácená verze (short-form) s 36 otázkami, které se týkají pacientova vlastního vnímání zdravotního stavu a z toho plynoucího funkčního omezení.
Léčba spastického syndromu
U každého nemocného je třeba si na začátku léčby stanovit reálné cíle, jichž chceme s pacientem dosáhnout. U některého nemocného snížením spasticity zmírníme obtěžující doprovodné bolesti a zlepšíme spánek, u jiného pacienta bude důležité zlepšení komunikace, polykání a řeči. Je nutné vyloučit i všechny bolestivé podněty, které by spasticitu mohly zhoršovat. Nárůst spasticity může být totiž signálem vznikající močové infekce, ledvinné koliky nebo dekubitů. Výsledkem léčby má být i ovlivnění celkové kvality života nemocného a snížení zátěže pečovatelů (zejména rodinných příslušníků).
Sp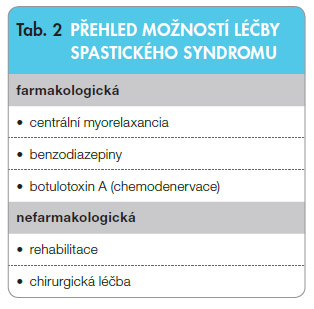 ektrum léčebných možností spasticity je široké a zahrnuje v sobě farmakologické i nefarmakologické přístupy (tab. 2). Z hlediska farmakologického je možné používat perorální léky a lokálně botulotoxin po intramuskulární aplikaci. V posledních letech se velmi úspěšně rozvinuly neuromodulační metody, které se používají k léčbě generalizovaného spastického syndromu a využívají kontinuální aplikaci léčiva intratekálně (podávání léku do mozkomíšního moku) [26, 27]. K chirurgické léčbě se řadí zákroky na šlachách, svalech a nervovém systému. Důležitá je vždy kombinace různých způsobů léčby s cílenou a dlouhodobou rehabilitací.
ektrum léčebných možností spasticity je široké a zahrnuje v sobě farmakologické i nefarmakologické přístupy (tab. 2). Z hlediska farmakologického je možné používat perorální léky a lokálně botulotoxin po intramuskulární aplikaci. V posledních letech se velmi úspěšně rozvinuly neuromodulační metody, které se používají k léčbě generalizovaného spastického syndromu a využívají kontinuální aplikaci léčiva intratekálně (podávání léku do mozkomíšního moku) [26, 27]. K chirurgické léčbě se řadí zákroky na šlachách, svalech a nervovém systému. Důležitá je vždy kombinace různých způsobů léčby s cílenou a dlouhodobou rehabilitací.
Perorální antispastické léky
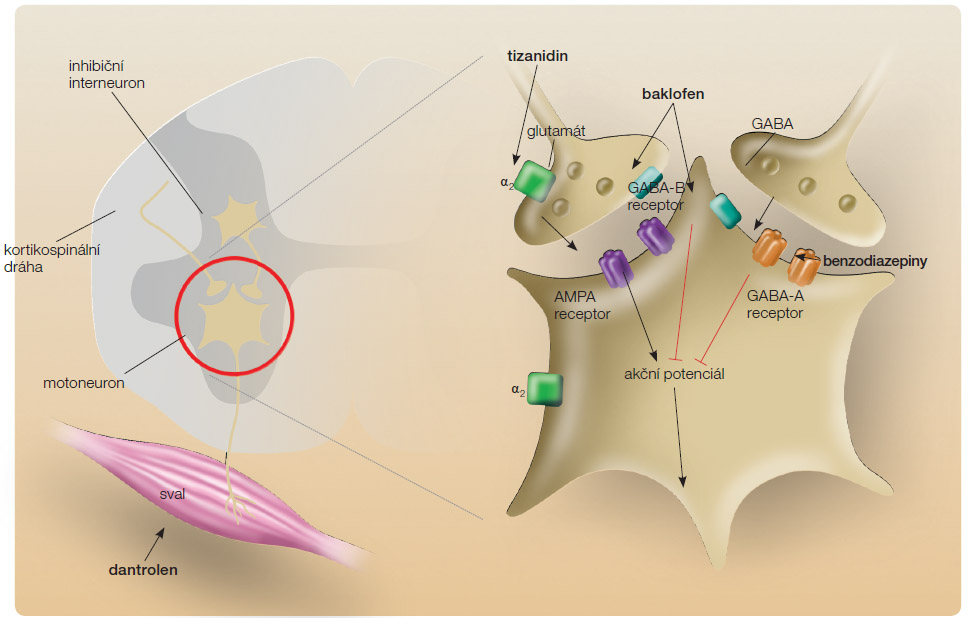 Přestože není mnoho studií EBM (evidence based medicine) potvrzujících jednoznačně účinek léčby spasticity pomocí perorálních antispastických léků, je tato cesta nejčastějším a také nejjednodušším způsobem léčby [28]. Farmakologická léčba je zaměřena na ovlivnění neuromediátorů, které hrají důležitou roli v rozvoji syndromu centrálního motoneuronu: glutamát, noradrenalin, serotonin, GABA a glycin. Místa působení některých léčiv ovlivňujících spasticitu touto cestou ilustruje obr. 1. Snahou terapie je snížit uvolňování excitačních neurotransmiterů z presynaptických zakončení Ia aferentů, zvýšit funkci inhibičních interneuronů, redukovat kontraktilní vlastnosti kosterního svalstva a snížit facilitační supraspinální vlivy.
Přestože není mnoho studií EBM (evidence based medicine) potvrzujících jednoznačně účinek léčby spasticity pomocí perorálních antispastických léků, je tato cesta nejčastějším a také nejjednodušším způsobem léčby [28]. Farmakologická léčba je zaměřena na ovlivnění neuromediátorů, které hrají důležitou roli v rozvoji syndromu centrálního motoneuronu: glutamát, noradrenalin, serotonin, GABA a glycin. Místa působení některých léčiv ovlivňujících spasticitu touto cestou ilustruje obr. 1. Snahou terapie je snížit uvolňování excitačních neurotransmiterů z presynaptických zakončení Ia aferentů, zvýšit funkci inhibičních interneuronů, redukovat kontraktilní vlastnosti kosterního svalstva a snížit facilitační supraspinální vlivy.
Perorální centrálně působící myorelaxancia je vhodné použít při lehkém stupni spastického syndromu [29]. U těžšího stupně může systémové podání léků prohloubit funkční deficit nemocného a oslabí se nepostižené svalové skupiny. Například se zhorší sed ve vozíku při oslabených zádových svalech nebo se podlomí končetiny během stání.
Léčivo se sedativním účinkem podáváme u pacienta s bolestivými nočními spasmy. Zvolíme léčivý přípravek s prodlouženým účinkem. Dávku podáme ve večerních hodinách, aby došlo k úlevě během noci. Jiný postup zvolíme u pacienta, u něhož se objevují spasmy a zvýšené svalové napětí v ranních hodinách a vadí mu například při ranní hygieně. Doporučíme mu, aby hned po probuzení užil léčivo, které se rychle vstřebává. Nižší dávky předepíšeme nemocným, kteří spasticitu využívají k chůzi, stoji a k opěrným úkonům. Výrazně vyšší dávky mohou užívat nemocní na vozíku nebo ležící v posteli.
Zásadou léčby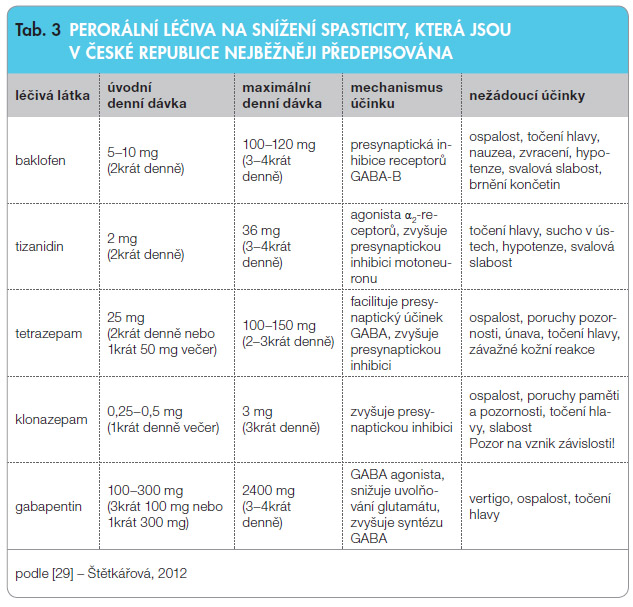 je podávat léčivý přípravek v malých dávkách a pomalu je zvyšovat do účinných hodnot. Nastavení optimální dávky může trvat i několik týdnů. Při dodržení tohoto postupu je možné včas rozpoznat výskyt nežádoucích účinků a pružně pak dávkování upravit či léčivo vyměnit za jiné. Přípravky je možné vzájemně kombinovat vzhledem k rozdílnému mechanismu působení [30], ale je třeba dodržovat určitá omezení, abychom předešli výskytu nežádoucích účinků. V tab. 3 jsou pro přehlednost uvedena léčiva nejčastěji užívaná ke snížení spasticity.
je podávat léčivý přípravek v malých dávkách a pomalu je zvyšovat do účinných hodnot. Nastavení optimální dávky může trvat i několik týdnů. Při dodržení tohoto postupu je možné včas rozpoznat výskyt nežádoucích účinků a pružně pak dávkování upravit či léčivo vyměnit za jiné. Přípravky je možné vzájemně kombinovat vzhledem k rozdílnému mechanismu působení [30], ale je třeba dodržovat určitá omezení, abychom předešli výskytu nežádoucích účinků. V tab. 3 jsou pro přehlednost uvedena léčiva nejčastěji užívaná ke snížení spasticity.
Benzodiazepiny
Benzodiazepiny patří mezi první léčiva, která byla v šedesátých a sedmdesátých letech minulého století použita k léčbě spastického syndromu, zejména u pacientů s dětskou mozkovou obrnou (DMO). Benzodiazepiny zvyšují presynaptickou inhibici zvýšením afinity receptorů GABA-A k vlastnímu mediátoru GABA (kyselina gama-aminomáselná) na kmenové a míšní úrovni a tím snižují monosynaptické i polysynaptické reflexy. Zesilují inhibiční účinek GABA v centrálním nervovém systému a snižují uvolňování excitačních neurotransmiterů z aferentních vláken. Mezi krátkodobě působící benzodiazepiny patří alprazolam, oxazepam, tetrazepam a lorazepam. Diazepam, chlordiazepoxid a klonazepam se řadí mezi dlouhodobě účinkující benzodiazepiny. Tato léčiva jsou metabolizována v játrech, prostupují placentární bariérou a vylučují se do mateřského mléka.
Benzodiazepiny jsou obecně pro léčbu spasticity nevýhodné kvůli svým četným nežádoucím účinkům, jako je zejména sedativní efekt, který se uplatňuje při vyšších dávkách. Dalším nežádoucím účinkem je snížení pozornosti a poruchy paměti, které se projeví hlavně u starších nemocných. Mohou se vyskytnout bolesti hlavy, závratě, ataxie, gastrointestinální potíže, změny chování, nízký arteriální tlak a při vysokých dávkách může nastat až kóma. Při dlouhodobém užívání se může objevit fyzická léková závislost. Náhlé přerušení léčby se projeví nepříjemnými abstinenčními příznaky, mezi něž patří úzkost, agitovanost, podráždění, motorický neklid, třes, svalové záškuby, epileptické záchvaty a psychózy. Ukončování léčby proto musí být postupné a pozvolné, ale i přesto mohou abstinenční příznaky u nemocného přetrvávat až několik měsíců.
Při podávání diazepamu bychom neměli překročit doporučené denní dávky 10–40 mg. Výhodným léčivem určeným ke snížení výskytu nočních spasmů a jejich intenzity je tetrazepam podávaný v dávce 1–2 tablety (50–100 mg) na noc, který pacientovi umožní lepší spánek. V současné době však Státní ústav pro kontrolu léčiv nedoporučuje tento lék používat dlouhodobě z důvodu výskytu vzácných, ale závažných kožních reakcí. Klonazepam se používá k tlumení záchvatovitých svalových spasmů, například u nemocných s roztroušenou sklerózou nebo u pacientů s DMO. U těchto paroxysmálních příznaků používáme klonazepam podávaný v dávce 0,5–1 mg na noc nebo jednou až dvakrát denně.
Tizanidin
Tizanidin je α2-adrenergní agonista, který snižuje polysynaptickou reflexní míšní aktivitu excitačních interneuronů na presynaptické úrovni, tlumí uvolňování substance P z nociceptivních aferentních vláken a snižuje výskyt a intenzitu bolestivých spasmů a ko-kontrakcí. Je možno ho použít jako lék první volby, ale výhodnější než zvyšování dávek v monoterapii je jeho kombinování s dalšími antispastickými léky, nejčastěji s baklofenem. Tizanidin významně snižuje svalový tonus, frekvenci svalových spasmů a redukuje klonus. Jeho účinek na snížení spasticity byl prokázán u nemocných s roztroušenou sklerózou, míšním poraněním i u nemocných s CMP [31]. Po podání ve formě tablet se rychle vstřebává gastrointestinálním traktem, takže zhruba po jedné až dvou hodinách je již v plazmě patrná jeho maximální koncentrace. Vylučuje se játry. Vzácně byly popsány případy s těžkou akutní hepatitidou, proto je vhodné před podáním léku vyšetřit jaterní funkce a kontrolu opakovat za 2–4 týdny až do doby, než se účinná dávka léku ustálí.
Biologický poločas eliminace je 2–4 hodiny, takže opět stačí lék podávat 3–4krát denně. Doporučuje se začínat denní dávkou 2 mg a pozvolna ji zvyšovat během několika dní na 8–12 mg denně. Rozmezí účinné denní dávky je individuální a pohybuje se mezi 4–24 mg. Maximální přípustná denní dávka je 36 mg tizanidinu. Nespornou výhodou tizanidinu je jeho nízký sedativní účinek. Mezi nežádoucí účinky tizanidinu patří slabost, sucho v ústech, posturální hypotenze, sedace a točení hlavy.
Baklofen
Baklofen patří k nejčastěji používaným přípravkům k léčbě spastického syndromu [32]. Je to agonista GABA-B, který působí velmi dobře na míšní úrovni na alfa-motoneuron i gama-systém. Stimulací receptorů GABA-B snižuje monosynaptické a polysynaptické reflexní přenosy v míše a zároveň inhibuje uvolňování excitačních aminokyselin (glutamát a aspartát). Působí zejména presynapticky a tím snižuje excitabilitu motoneuronu. Rychle se vstřebává gastrointestinálním traktem a již za hodinu je v plazmě patrná jeho vysoká koncentrace.
Doporučuje se podat jej půl hodiny před ranní hygienou nebo před jinou činností, která vyžaduje aktuální snížení spasticity. Biologický poločas eliminace baklofenu je 3–4 hodiny, proto je důležité dodržovat užívání perorálních léků 3–4krát denně. Baklofen se vylučuje ledvinami. U nemocných s renální insuficiencí je třeba redukovat jeho dávku dle hodnot clearance. Doporučuje se začít s dávkou 5–10 mg 1krát denně, a to nejlépe večer. Poté je výhodné pozvolna zvyšovat ranní a polední dávku. Doporučená denní dávka se pohybuje mezi 50–80 mg baklofenu, maximálně lze ještě tolerovat dávku do 120 mg.
Baklofen lze podat také intratekálně v roztoku. Perorální dávce 60 mg/24 h zhruba odpovídá 100 μg/24 h podaných intratekálně. K nežádoucím účinkům užívání baklofenu patří ospalost, hypotenze, ataxie, suchost v ústech, nauzea, zvracení, kardiovaskulární poruchy a ve vzácných případech i útlum dechových funkcí. Sedace a somnolence se více vyskytují na počátku léčby, pokud se dávka zvyšuje příliš rychle. Náhlé přerušení léčby vysokými dávkami vede k abstinenčním příznakům, jež se mohou projevit motorickým neklidem, úzkostí, psychózami, halucinacemi či zmateností.
Gabapentin
Gabapentin byl původně vyvíjen jako lék na spasticitu, ale po objevu jeho antikonvulzivních účinků získal indikaci k léčbě epilepsie. Další jeho důležitou indikací je léčba neuropatické bolesti. Je také agonistou GABA, ale terapeutický účinek není zprostředkován receptorem GABA. Je založen na vazbě k α2δ-podjednotce receptoru napětově řízeného kalciového kanálu na neuronech, což výsledně snižuje průnik kalcia do buňky. Gabapentin snižuje uvolňování glutamátu a zvyšuje syntézu GABA. Vylučuje se ledvinami. Jeho biologický poločas eliminace je 6–8 hodin. Obvykle jej stačí užívat 3krát denně. Počáteční dávka je 300 mg denně, s postupným zvyšováním do účinné dávky, obvykle v rozmezí 300–1200 mg denně. Maximální přípustná denní dávka gabapentinu je 3200 mg. Nespornou výhodou gabapentinu jsou jeho minimální vedlejší účinky ve srovnání s jinými léky [33]. K běžným nežádoucím účinkům patří somnolence, závratě, ataxie, nystagmus, bolest hlavy a nevolnost.
Pregabalin
Pregabalin je molekula velmi podobná gabapentinu a stejně jako gabapentin se také používá k léčbě neuropatické bolesti. Váže se také na α2yδ-podjednotku napěťově řízených kalciových kanálů a tím zabraňuje průniku kalcia do nitra neuronálního výběžku. Snižuje uvolnění glutamátu, substance P a noradrenalinu do synaptické štěrbiny. Ve srovnání s gabapentinem se více váže k podjednotce kalciového kanálu a tím je dán jeho silnější terapeutický účinek.
Doporučuje se začínat léčbu dávkou 75 mg 2krát denně. Ke snížení spasticity obvykle stačí dávky 150–300 mg denně. Maximální denní dávka je 600 mg. K typickým nežádoucím účinkům patří somnolence a závratě. Zatím nejsou k dispozici přesvědčivé literární údaje, které prokazují vliv gabapentinu a pregabalinu na snížení spasticity [34]. Výhodné je podávat tato léčiva u nemocných, kteří trpí současným výskytem neuropatické bolesti.
Kannabinoidy
Rostlina Cannabis sativa byla používána ke snížení bolesti, křečí, nevolnosti a zvracení již dávno. V jejím extraktu lze nalézt kannabinoidy THC (delta-9-tetrahydrokannabinol) a CBD (kannabidiol). V lidském těle se vyskytují nejméně dva typy kannabinoidních receptorů (CB1 a CB2). Receptory CB1 se nacházejí na neuronech centrálního i periferního nervového systému. Kannabinoidy působí jako antagonisté receptorů NMDA (N-methyl-D-aspartat) a glutamátu. Mají antioxidační účinky. THC působí na snížení bolesti, uvolnění svalů, zlepšuje motorické funkce a má psychoaktivní účinky [35]. CBD snižuje záchvatovou pohotovost, zmírňuje svalové napětí, má antioxidační a antipsychotické účinky. Nežádoucím účinkem léčby THC je závrať, únava, hypotenze, tachykardie, sucho v ústech, zpomalení psychomotorického tempa, sedace, poruchy paměti. Chronické užívání může vést k poruše kognitivních funkcí. V České republice je nově registrován přípravek ve formě oromukosálního spreje, jehož indikací je léčba středně těžké a těžké spasticity způsobené roztroušenou sklerózou.
Dantrolen
V zahraničí se k léčbě spasticity používá dantrolen [36], který působí přímo na svalovém vlákně, kde blokuje uvolnění kalcia ze sarkoplazmatického retikula. V České republice je k dispozici pouze v injekční formě a používá se k léčbě maligní hypertermie, akutní febrilní katatonie a maligního neuroleptického syndromu.
Botulotoxin
U pacientů s výraznou fokální spasticitou na končetinách se doporučuje použít intramuskulární aplikaci botulotoxinu do postižených svalů. Je indikován k léčbě spastického syndromu po CMP a DMO; účinnost byla opakovaně prokázána v řadě klinických studií [37–40]. Botulotoxin dokáže zmírnit především spastickou dystonii a ko-kontrakce, které pacienta invalidizují nejvíce. Sval pak lze lépe protáhnout, což příznivě potencuje následnou rehabilitační léčbu. U pacientů s těžkou spasticitou a difuzním postižením více svalů, např. na dolních končetinách, je podávání botulotoxinu méně vhodné, protože by to vyžadovalo podat extrémně vysoké dávky.
Botulotoxin se podává v roztoku intramuskulárně do vybraných svalů podle klinického záměru. Jeho účinek je zprostředkován presynaptickou blokádou uvolnění acetylcholinu na cholinergních synapsích (nervosvalová ploténka, postganglionární parasympatická zakončení a autonomní ganglia). Vzniká denervační syndrom daného svalu, tzv. chemodenervace. Klinický účinek je patrný již po několika dnech a vrcholí po 4–6 týdnech. Opakované aplikace botulotoxinu jsou nutné po 3–4 měsících, kdy dojde k regeneraci nervosvalové ploténky a obnoví se neuromuskulární přenos. Nespornou výhodu léčby botulotoxinem představuje minimální výskyt nežádoucích účinků. Může dojít k bolesti v místě vpichu, k otoku, vzácně k tvorbě hematomu.
U pacientů s roztroušenou sklerózou byl prokázán velmi dobrý klinický účinek botulotoxinu při jeho aplikaci do stehenních a lýtkových svalů, adduktorů ramene a flexorů paže. Po podání botulotoxinu je vždy nezbytné, aby následovala cílená a intenzivní fyzikální léčba s protahováním zkrácených svalů a s individuálním cvičením.
Rehabilitace
Rehabilitace má důležitou úlohu v organizaci péče o pacienty se spastickým syndromem [2, 3]. Její součástí je fyzioterapie, ergoterapie, logopedie a další disciplíny, které zvyšují kvalitu života pacienta. Zvolená metoda léčby závisí na osobnosti nemocného, na komorbiditách a na rozdílnosti funkčního omezení způsobeného jednotlivými klinickými příznaky. Pro vhodná doporučení a použití jednotlivých rehabilitačních postupů je důležitá jejich průkaznost podle studií založených na důkazech, ale těchto studií je zatím málo. Některé léčebné postupy se běžně používají, ale jejich efektivita zatím nebyla dostatečně prokázána. Používané léčebné postupy u nemocných se syndromem centrálního motoneuronu jsou souborně uvedeny v tab. 4 [41].
Základem úspěšné re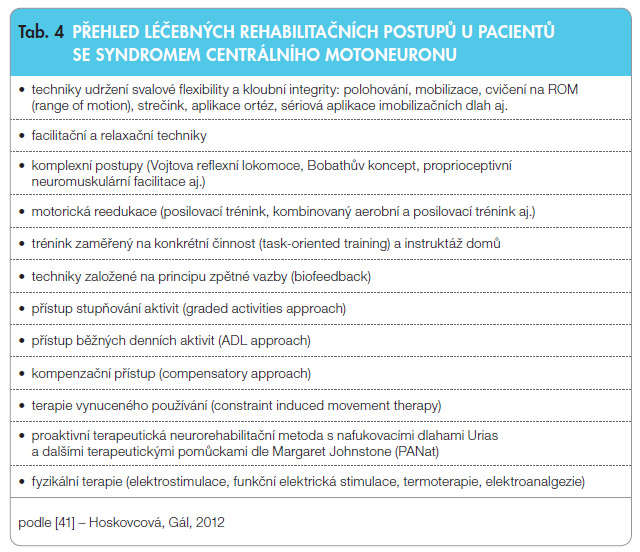 habilitace je také prevence, která má základ v kvalitní ošetřovatelské péči. Například již na jednotce intenzivní péče je třeba hned po stabilizaci vitálních funkcí začít s pasivním polohováním a strečinkem k zábraně svalových kontraktur a k omezení tvorby heterotopických osifikací.
habilitace je také prevence, která má základ v kvalitní ošetřovatelské péči. Například již na jednotce intenzivní péče je třeba hned po stabilizaci vitálních funkcí začít s pasivním polohováním a strečinkem k zábraně svalových kontraktur a k omezení tvorby heterotopických osifikací.
Důležité je postupovat pozvolna od nejméně invazivních metod k těm složitějším. Používá se strečink, dlahování, ortézy, cílený nácvik základních úkonů (stoj, chůze, přesuny, sed ve vozíku, úchopové funkce ruky apod.). Důležitá je fyzioterapie, ergoterapie a logopedie. Léčba se zaměřuje na také na hledání vhodných kompenzačních pomůcek k usnadnění běžných denních aktivit, úpravu pracovního a domácího prostředí, motivaci rodiny k aktivnímu přístupu. Přibývají další technologie a léčebné modality umožňující funkční zlepšení postižených osob a jejich kvalitní zapojení do běžného života. Patří sem například transkraniální magnetická stimulace, periferní elektrická stimulace, léčba zabráněním pohybu, trénink na chodítku s podporou váhy těla apod. [42–44]. Robotická léčba využívá elektronických pomůcek ke snížení spasticity a k návratu hybných funkcí.
Intratekální baklofen
K léčbě těžké generalizované spasticity se využívá intratekálního podávání baklofenu pumpovými systémy. Intratekální přístup umožnuje aplikaci nízkých dávek baklofenu a tím minimalizuje výskyt nežádoucích účinků baklofenu podávaného perorálně. Účinek této léčby byl prokázán v řadě studií zejména pacientů s traumatickým poraněním mozku a míchy, s DMO, roztroušenou sklerózou či s CMP [45–47]. Její indikace, testování účinku baklofenu a následná implantace pumpy s ambulantním sledováním patří do rukou odborníků, kteří se touto problematikou zabývají.
V souvislosti s léčbou se mohou vyskytnout lékové komplikace i problémy spojené s implantací a doplňováním rezervoáru. Mezi nejzávažnější komplikace patří náhlé přerušení dodávky léčiva, které vede k abstinenčnímu syndromu z odnětí baklofenu. Tento syndrom se projevuje náhlým nárůstem spasticity, motorickým neklidem, svěděním celého těla bez vyrážky, hypertermií, hypotenzí i epileptickými záchvaty. Pacient by měl být hospitalizován na JIP, kde jsou monitorovány jeho základní vitální funkce. Je nezbytné co nejdříve obnovit dodávku baklofenu (například podáním tablet). Pokud to nelze nebo je účinek nedostatečný, pak je možné parenterální podání diazepamu. Předávkování baklofenem je většinou iatrogenního původu při záměně koncentrace léku podaného do pumpy nebo při chybném naprogramování pumpy a projevuje se somnolencí, hypotonií a celkovým útlumem.
Chirurgické metody
Výkony na svalech a šlachách končetin jsou považovány za nejefektivnější z celého spektra chirurgických výkonů používaných k řešení spasticity. U pacientů s fokálními projevy by se měl chirurgický zákrok zvážit ještě před rozvojem ireverzibilních změn na svalstvu a kloubních strukturách. U těžkého spastického syndromu se v přísně indikovaných případech mohou provádět ablativní výkony, jako je selektivní periferní neurotomie, laterální longitudinální myelotomie a zadní rhizotomie [48]. Tyto operační zákroky jsou vyhrazeny pro pacienty s extrémně těžkou spasticitou, která není ovlivnitelná jinými léčebnými metodami. Indikaci je potřeba dobře zvážit, neboť jde o destruktivní výkony, po jejichž provedení se může zhoršit například funkce močového měchýře, zvýraznit svalová paréza nebo prohloubit porucha čití a v konečném důsledku se může i snížit kvalita života.
Závěr
Spasticitu není těžké klinicky poznat, ale definovat její přesné patofyziologické mechanismy je obtížné a ještě složitější je její účinná léčba. Komplexní léčba spasticity vyžaduje multidisciplinární přístup a stanovení reálných cílů, které je třeba naplňovat individuálně s přihlédnutím k potřebám každého nemocného. Výsledkem je nižší výskyt komplikací, menší zátěž pro pečovatele, snížení ekonomické náročnosti a v konečném důsledku zlepšení kvality života pacienta včetně jeho začlenění do společnosti.
Práce byla podpořena výzkumným projektem Univerzity Karlovy PRVOUK P34.
Seznam použité literatury
- [1] Sheean G. The pathophysiology of spasticity. Eur J Neurol 2002; 9: 3–9.
- [2] Barnes MP, Johnson GR. Upper motor neurone syndrome and spasticity. Cambridge: Cambridge University Press 2001.
- [3] Stevenson V, Jarrett L. Spasticity Management. A Practical Multidisciplinary Guide. Informa Healthcare 2006: 3–14.
- [4] Hinderer SR, Dixon K. Physiologic and clinical monitoring of spastic hypertonia. Phys Med Rehabil Clin N Am 2001; 12: 733–746.
- [5] Wissel J, Manack A, Brainin M. Toward an epidemiology of poststroke spasticity. Neurology 2013; 80 (Suppl. 2): S13–19.
- [6] Rizzo MA, Hadjimichael OC, Preiningerova J, Vollmer TL. Prevalence and treatment of spasticity reported by multiple sclerosis patients. Mult Scler 2004; 10: 589–595.
- [7] Noreau L, Proulx P, Gagnon L, et al. Secondary impairments after spinal cord injury: a population-based study. Am J Phys Med Rehabil 2000; 79: 526–535.
- [8] Balakrishnan S, Ward AB. The diagnosis and management of adults with spasticity. Handb Clin Neurol 2013; 110: 145–160.
- [9] Burke D, Wissel J, Donnan GA. Pathophysiology of spasticity in stroke. Neurology 2013; 80 (Suppl. 2): S20–26.
- [10] Gracies JM, Bayle N, Vinti M, et al. Five-step clinical assessment in spastic paresis. Eur J Phys Rehabil Med 2010; 46: 411–421.
- [11] Lance JW. Symposium synopsis. In: Feldman RG, Young RR, Koella WP, eds. Spasticity: disordered motor control. Chicago: Yearbook Medical, 1980: 485–549.
- [12] Brashear A, Elovic E. Spasticity. Diagnosis and Management. Demos Medical Publishing, LLC 2011: 17–31.
- [13] Pandyan AD, Gregoric M, Barnes MP, et al. Spasticity: clinical perceptions, neurological realities and meaningful measurement. Disabil Rehabil 2005; 27: 2–6.
- [14] Štětkářová I, Ehler E, Jech R. Spasticita. In: Štětkářová I, Ehler E, Jech R (Eds.): Spasticita a její léčba. Maxdorf, 2012: 13–32.
- [15] Gracies JM. Pathophysiology of spastic paresis. II: Emergence of muscle overactivity. Muscle Nerve 2005; 31: 552–571.
- [16] Bourbonnais D. Quantification of upper limb synkinesis in hemiparetic subject. Rehabilitation R D Progress Report 1994, Dept of Veteran Affairs 1995; 32: 118–119.
- [17] Biering-Sørensen F, Nielsen JB, Klinge K. Spasticity-assessment: a review. Spinal Cord 2006; 44: 708–722.
- [18] Ashworth B. Preliminary trial of carisoprodal in multiple sclerosis. Practicioner 1964; 192: 540–542.
- [19] Bohannon RW, Smith MB. Interrater reliability of a modified Ashworth scale of muslce spasticity. Phys Ther 1987; 67: 206–207.
- [20] Tardieu G, Shentoub S, Delarue R. A la recherche d´une technique de mesure de la spasticite imprime avec la periodique. Rev Neurol 1954; 81: 143–144.
- [21] Snow BJ, Tsuji JKC, Bhart MH, et al. Treatment of spasticity with botulinum toxin: a double blind study. Ann Neurol 1990; 28: 512–515.
- [22] Štětkářová I, Ehler E. Hodnocení spasticity. In: Štětkářová I, Ehler E, Jech R (Eds.): Spasticita a její léčba. Maxdorf, 2012: 33–58.
- [23] Turner-Stokes L. Goal attainment scaling (GAS) in rehabilitation: a practical guide. Clin Rehabil 2009; 23: 362–370.
- [24] Medical Research Council of the UK. Aids to the Investigation of Peripheral Nerve Injuries. Memorandum No.45. London: Pendragon House 1976: 6–7.
- [25] Podsiadlo D, Richardson S. The timed “Up & Go”: a test of basic functional mobility for frail elderly persons. J Am Geriatr Soc 1991; 39: 142–148.
- [26] Ordia JI, Fischer E, Adamski E, Spatz EL. Chronic intrathecal delivery of baclofen by a programmable pump for the treatment of severe spasticity. J Neurosurg 1996; 85: 452–457.
- [27] Zahavi A, Geertzen JHB, Staal M, Rietman JS. Long term effect (more than five years) of Intrathecal baclofen on impairment, disability and quality of life in patients with severe spasticity of spinal origin. J Neurol Neurosurg Psychiatry 2004; 75: 1553–1557.
- [28] Lapeyre E, Kuks JB, Meijler WJ. Spasticity: revisiting the role and the individual value of several pharmacological treatments. NeuroRehabilitation 2010; 27: 193–200.
- [29] Štětkářová I. Perorální léčba spasticity. In: Štětkářová I, Ehler E, Jech R (Eds): Spasticita a její léčba. Maxdorf, 2012: 59–66.
- [30] Montané E, Vallano A, Laporte JR. Oral antispastic drugs in nonprogressive neurologic diseases: a systematic review. Neurology 2004; 63: 1357–1363.
- [31] Kamen L, Henney HR 3rd, Runyan JD. A practical overview of tizanidine use for spasticity secondary to multiple sclerosis, stroke, and spinal cord injury. Curr Med Res Opin 2008; 24: 425–439.
- [32] Cendrowski W, Sobczyk W. Clonazepam, baclofen and placebo in the treatment of spasticity. Eur Neurol 1977; 16: 257–262 .
- [33] Gruenthal M, Mueller M, Olson WL, et al. Gabapentin for the treatment of spasticity in patients with spinal cord injury. Spinal Cord 1997; 35: 686–689.
- [34] Hagenbach U, Luz S, Ghafoor N, et al. The treatment of spasticity with Delta9-tetrahydrocannabinol in persons with spinal cord injury. Spinal Cord 2007; 45: 551–562.
- [35] Siddall PJ, Cousins MJ, Otte A, et al. Pregabalin in central neuropathic pain associated with spinal cord injury: a placebo-controlled trial. Neurology 2006; 67: 1792–1800.
- [36] Taricco M, Pagliacci MC, Telaro E, Adone R. Pharmacological interventions for spasticity following spinal cord injury: results of a Cochrane systematic review. Eura Medicophys 2006; 42: 5–15.
- [37] Ehler E. Vaňásková E, Štětkářová I. Standard komplexní léčby spasticity po cévní mozkové příhodě. Čes Slov Neurol Neurochir 2009; 72: 179–181
- [38] Wissel J, Müller J, Dressnandt J, et al. Management of spasticity associated pain with botulinum toxin A. J Pain Symptom Manage 2000; 20: 44–49.
- [39] Comella CL, Pullman SL. Botulinum toxins in neurological disease. Muscle Nerve 2004; 29: 628–644.
- [40] Bareš M, Kaňovský P. Praktické použití botulotoxinu A v léčbě spasticity dospělé populace. Česká a slovenská neurologie a neurochirurgie 2002; 65/98: 421–425.
- [41] Hoskovcová M, Gál O. Rehabilitace a spasticita. In: Štětkářová I, Ehler E, Jech R (Eds.): Spasticita a její léčba. Maxdorf, 2012: 177–212.
- [42] Khedr EM, Ahmed MA, Mohamed KA. Therapeutic trial of repetitive transcranial magnetic stimulation after acute ischemic stroke. Neurophysiol Clin 2006; 36: 13–18.
- [43] Fung J, Richards CL, Malouin F, et al. A treadmill and motion coupled virtual reality system for gait training post-stroke. Cyberpsychol Behav 2006; 9: 157–162.
- [44] Jaffe DL, Brown DA, Pierson-Carey CD, et al. Stepping over obstacles to improve walking in individuals with poststroke hemiplegia. J Rehabil Res Dev 2004; 41: 283–292.
- [45] Penn RD, Kroin JS. Intrathecal baclofen alleviates spinal cord spasticity. Lancet 1984; 1: 1078.
- [46] Coffey R, Cahill D, Steers W. Intrathecal baclofen for intractable spasticity of spinal origin: results of a long term multicenter study. J Neurosurg 1993; 78: 226–232.
- [47] Štětkářová I, Šroubek J, Vrba I, et al. Jednorázové intratékální podání baklofenu a následné zavedení pumpového systému v léčbě těžké spasticity u osob s roztroušenou sklerózou. Čes Slov Neurol Neurochir 2007; 70: 190–195.
- [48] Čižmář I, Poul J, Haninec P, Mencl L. Chirurgická léčba spasticity. In: Štětkářová I, Ehler E, Jech R (Eds): Spasticita a její léčba. Maxdorf, 2012: 152–176.