Současné možnosti léčby urtikarie
Urtikarie (kopřivka) je častým patologickým procesem postihujícím kůži. Může být vyvolána celou řadou příčin. V závislosti na své etiologii odpovídá rozdílně na různé léčebné postupy. Základem terapie zůstávají dodnes antihistaminika, ale objevují se i nové léčebné metody. Tento článek shrnuje současné poznatky týkající patogeneze, etiologie, klasifikace, vyšetření a léčby urtikarie.
Úvod
 Urtikarie (kopřivka) představuje heterogenní skupinu morfologicky obdobných nežádoucích projevů na kůži, velice zřídka i na sliznicích, které mohou mít zcela odlišnou etiologii. Manifestací urtikarie jsou prchavé výsevy silně svědivých pupenů (pomfů), jejichž vzhled nápadně připomíná kožní reakci vzniklou po kontaktu pokožky s kopřivou. Jednotlivé pomfy mohou být velmi drobné i gigantické a mohou být řídce roztroušené i splývající. Vznikají a zanikají v řádu několika hodin, aby se opět objevily na jiném místě tělesného povrchu. Výsevy a ústupy mohou probíhat ve vlnách, které trvají několik hodin, dní, týdnů, měsíců či let. Podle doby trvání dělíme urtikarie na akutní, kdy k
Urtikarie (kopřivka) představuje heterogenní skupinu morfologicky obdobných nežádoucích projevů na kůži, velice zřídka i na sliznicích, které mohou mít zcela odlišnou etiologii. Manifestací urtikarie jsou prchavé výsevy silně svědivých pupenů (pomfů), jejichž vzhled nápadně připomíná kožní reakci vzniklou po kontaktu pokožky s kopřivou. Jednotlivé pomfy mohou být velmi drobné i gigantické a mohou být řídce roztroušené i splývající. Vznikají a zanikají v řádu několika hodin, aby se opět objevily na jiném místě tělesného povrchu. Výsevy a ústupy mohou probíhat ve vlnách, které trvají několik hodin, dní, týdnů, měsíců či let. Podle doby trvání dělíme urtikarie na akutní, kdy k 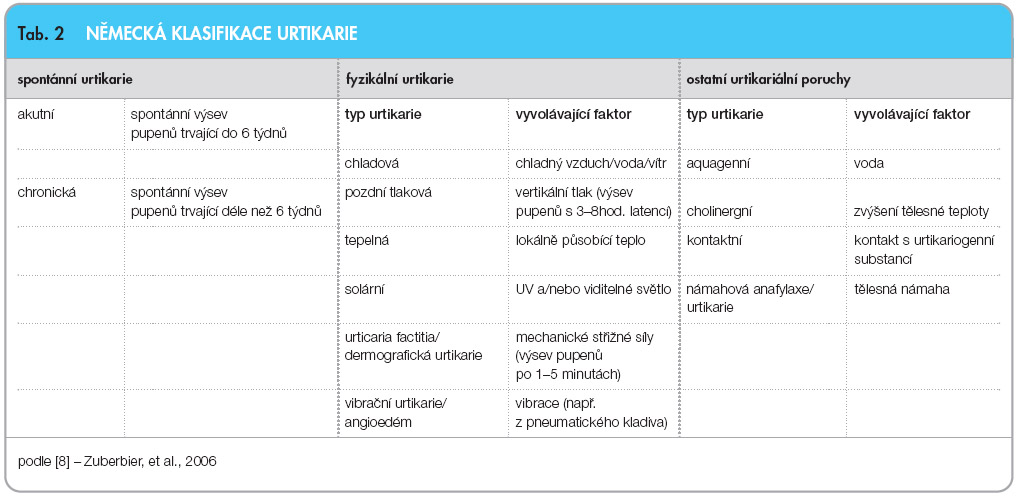 výsevům pupenů dochází po dobu kratší než 6 týdnů, a chronické, které bývají obvykle významně delší. Právě toto dělení je zatím jedinou spolehlivou, i když nedostatečnou klasifikací urtikarií. Ostatní třídění urtikarií vycházejí obvykle z jejich etiologie, kterou dodnes nedokážeme spolehlivě stanovit. Dochází tím k chybám a nepřesnostem a dodnes neexistuje jednotná, celosvětově uznávaná etiologická klasifikace (tab. 1, tab. 2).
výsevům pupenů dochází po dobu kratší než 6 týdnů, a chronické, které bývají obvykle významně delší. Právě toto dělení je zatím jedinou spolehlivou, i když nedostatečnou klasifikací urtikarií. Ostatní třídění urtikarií vycházejí obvykle z jejich etiologie, kterou dodnes nedokážeme spolehlivě stanovit. Dochází tím k chybám a nepřesnostem a dodnes neexistuje jednotná, celosvětově uznávaná etiologická klasifikace (tab. 1, tab. 2).
Incidence onemocnění
Urtikarie patří mezi nejčastější kožní choroby a alespoň jednou za život ji prodělá asi 20 % lidí. V dětství je častější urtikarie akutní, provázející obvykle infekční onemocnění či alergii na léky, na potraviny nebo na poštípání hmyzem [1]. Svědí nejvíce v období svého výsevu a často bývá provázena angioedémem. Chronická urtikarie je častější v dospělosti, obvykle svědí ve večerních hodinách a její příčiny jsou velice rozmanité. Souvisí s nimi i strategie a klinický efekt léčby [2].
Patogeneze
Kopřivkové pupeny vznikají na základě edému papilární a retikulární vrstvy koria, který je důsledkem dilatace a zvýšené permeability postkapilárních venul. Vazodilatace a průnik plazmy do hlubších vrstev koria a podkoží se projevuje nezánětlivým otokem, tzv. angioedémem. Tím jsou urtikarie provázeny přibližně ve 30 % případů. Pro urtikarii je velmi typické svědění, které nemocného nutí postiženou pokožku třít, nikoli škrábat. Povrch pomfů nebývá tudíž nikdy rozškrábaný a povrchová vrstva se nikdy neolupuje. Angioedém obvykle nesvědí, někdy pálí, píchá, bolí nebo vyvolává jiné nepříznivé pocity. Objevuje se v okolí pomfů či samostatně, v místech s řidší pojivovou tkání, jako jsou rty, víčka, genitál, sliznice a občas i kloubní výstelka [3]. Vzácností není ani edém dlaní a plosek nohou.
Pokud se angioedém objeví izolovaně, bez výsevu pomfů, je bledý a nesvědí, musíme diferenciálně diagnosticky zvážit i možný absolutní nebo funkční deficit inhibitoru C1 složky komplementu, tzv. hereditární angioedém (HEA). Jedná se o dominantně dědičnou chorobu, při níž i po minimálních stimulech dochází k aktivaci celé komplementové kaskády. Projevy HEA nejsou omezeny na kůži, ale často se manifestují též na sliznicích. Právě tato oblast postižení může vést k rozvoji chorobných stavů, které pacienta ohrožují na životě. Edém sliznice gastrointestinálního traktu často imituje náhlou příhodu břišní, postižení v urogenitální oblasti může vést k retenci moči a otok laryngu či některých jiných částí dýchacích cest může vést k dušnosti [4]. Léčba je v tomto případě zcela odlišná než u ostatních forem urtikarie a angioedému.
![Obr. 1 Mediátory aktivovaných mastocytů a bazofilů; podle [5] – Zweiman, Schwartz, 2002.](https://www.remedia.cz/photo-a-27460---.jpg) Vazodilatace a zvýšená permeabilita kožních cév jsou vyvolány vazoaktivními látkami, mediátory uskladněnými a uvolňovanými z tkáňových žírných buněk (mastocytů) a krevních bazofilů. Tyto mediátory dělíme na preformované, uložené v granulech uvedených buněk, a nově vzniklé, tvořené po jejich aktivaci. Do první skupiny patří především histamin a proteázy, do druhé faktor aktivující destičky (PAF), metabolity kyseliny arachidonové (tzv. lipidové mediátory) a cytokiny (obr. 1) [5].
Vazodilatace a zvýšená permeabilita kožních cév jsou vyvolány vazoaktivními látkami, mediátory uskladněnými a uvolňovanými z tkáňových žírných buněk (mastocytů) a krevních bazofilů. Tyto mediátory dělíme na preformované, uložené v granulech uvedených buněk, a nově vzniklé, tvořené po jejich aktivaci. Do první skupiny patří především histamin a proteázy, do druhé faktor aktivující destičky (PAF), metabolity kyseliny arachidonové (tzv. lipidové mediátory) a cytokiny (obr. 1) [5].
Všechny uvedené mediátory se mohou uvolnit do extracelulárního prostředí působením imunologických i neimunologických mechanismů a jejich hladinu, tvorbu a degradaci ovlivňují další modulující faktory [6]. Vzhledem k tomu, že důsledkem jejich působení jsou obdobné kožní změny, je velmi obtížné určit, který faktor či mediátor je příčinný, a proto zůstává anamnéza jedním z hlavních diagnostických kritérií [7]. Na jejím podkladě pak pokračujeme ve vyšetřovacím postupu indikací kožních testů (prick testy či epikutánní kožní testy), fyzikálních provokačních testů, eliminačních a případně též provokačních potravinových testů, laboratorních sérologických vyšetření a v případě potřeby i vyšetření mikrobiologických, sonografických a histologických. Určování patogenetických mechanismů má význam hlavně pro hledání nových terapeutických postupů.
Významné mediátory
Histamin
Histamin je jediný lidský biogenní amin uskladněný v sekrečních granulech žírných buněk a bazofilů v aktivní formě. Vzniká dekarboxylací aminokyseliny histidinu a po uvolnění do extracelulárního prostředí je během několika minut degradován pomocí enzymů histaminázy a histamin-metyl-transferázy (obr. 2). Má velmi výrazné vazoaktivní a spasmogenní účinky. Žírné buňky a bazofily jej obsahují velké množství. Koncentrace histaminu v jejich sekrečních granulech je přibližně 0,1 M. Plazmatická koncentrace je 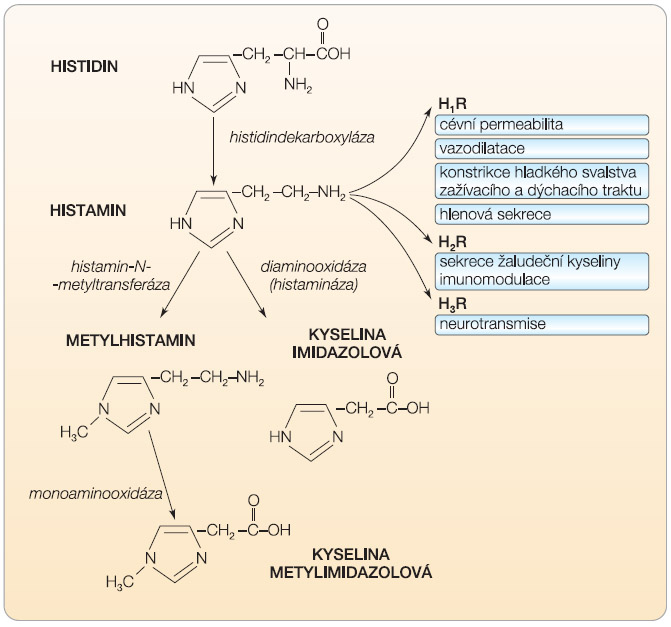 nepoměrně nižší, obvykle něco kolem 2 nM, a odráží jeho lokální tvorbu a metabolismus. Ke zvýšení celkové hladiny dochází v průběhu anafylaktických reakcí na alergen či pseudoalergických reakcí na radiokontrastní látku a trvale zvýšena bývá u osob s mastocytózou. V průběhu septického šoku či ataky hereditárního angioedému ke zvýšení plazmatické hladiny histaminu nedochází. Při laboratorním stanovení hladiny histaminu je třeba věnovat velkou pozornost zachování integrity bazofilů. Jejich poškození při odběru a zpracování krevního vzorku vede k významnému zvýšení koncentrace histaminu a ke zkreslení získaného výsledku. Účinky histaminu jsou zprostředkovány aktivací jeho buněčných receptorů, označovaných jako H1, H2 a H3. Aktivací receptorů H1 dochází k vazodilataci a ke zvýšení permeability postkapilárních venul, dále pak ke kontrakci hladkých svalů dýchacího a zažívacího traktu a ke zvýšení sekrece mukózních žláz. Zvýšená cévní permeabilita usnadní tkáňovou depozici plazmatických faktorů i cizorodého materiálu a vznikajících imunokomplexů, což vede k rozvoji zánětlivé reakce. Prostřednictvím aktivace receptorů H2 pak dochází ke zvýšení sekrece žaludeční kyseliny parietálními buňkami žaludku a současně k posílení permeability cév a bronchiálního epitelu. K plnému vyjádření vazoaktivního účinku histaminu je třeba aktivace receptorů H1 i H2 a k jejich plné inhibici pak kombinované podání antagonistů receptorů H1 i H2 [2]. Stimulace receptorů H3 vede k uvolnění neurotransmiterů a ke zvýšení tvorby histaminu v centrálním i periferním nervovém systému. Předpokládá se, že neurotransmitery ovlivňují vzájemné reakce mezi žírnými buňkami a nervovými zakončeními a že se aktivace receptorů H3 uplatňuje při vyjádření pocitu svědění. U astmatu se tyto receptory účastní vzniku bronchokonstrikce, vyvolané působením nespecifických iritačních podnětů [6].
nepoměrně nižší, obvykle něco kolem 2 nM, a odráží jeho lokální tvorbu a metabolismus. Ke zvýšení celkové hladiny dochází v průběhu anafylaktických reakcí na alergen či pseudoalergických reakcí na radiokontrastní látku a trvale zvýšena bývá u osob s mastocytózou. V průběhu septického šoku či ataky hereditárního angioedému ke zvýšení plazmatické hladiny histaminu nedochází. Při laboratorním stanovení hladiny histaminu je třeba věnovat velkou pozornost zachování integrity bazofilů. Jejich poškození při odběru a zpracování krevního vzorku vede k významnému zvýšení koncentrace histaminu a ke zkreslení získaného výsledku. Účinky histaminu jsou zprostředkovány aktivací jeho buněčných receptorů, označovaných jako H1, H2 a H3. Aktivací receptorů H1 dochází k vazodilataci a ke zvýšení permeability postkapilárních venul, dále pak ke kontrakci hladkých svalů dýchacího a zažívacího traktu a ke zvýšení sekrece mukózních žláz. Zvýšená cévní permeabilita usnadní tkáňovou depozici plazmatických faktorů i cizorodého materiálu a vznikajících imunokomplexů, což vede k rozvoji zánětlivé reakce. Prostřednictvím aktivace receptorů H2 pak dochází ke zvýšení sekrece žaludeční kyseliny parietálními buňkami žaludku a současně k posílení permeability cév a bronchiálního epitelu. K plnému vyjádření vazoaktivního účinku histaminu je třeba aktivace receptorů H1 i H2 a k jejich plné inhibici pak kombinované podání antagonistů receptorů H1 i H2 [2]. Stimulace receptorů H3 vede k uvolnění neurotransmiterů a ke zvýšení tvorby histaminu v centrálním i periferním nervovém systému. Předpokládá se, že neurotransmitery ovlivňují vzájemné reakce mezi žírnými buňkami a nervovými zakončeními a že se aktivace receptorů H3 uplatňuje při vyjádření pocitu svědění. U astmatu se tyto receptory účastní vzniku bronchokonstrikce, vyvolané působením nespecifických iritačních podnětů [6].
Lipidové mediátory
Tyto biologicky vysoce účinné látky vznikají enzymatickou oxidací membránových fosfolipidů v aktivovaných žírných buňkách a bazofilech. Pokud je uvolněná kyselina arachidonová (arachidonic acid – AA) zpracována za účasti enzymu cyklooxygenázy (COX), jsou konečnými produkty prostaglandiny (zejména PGD2), pokud je proces mediován lipoxygenázou (LO), vznikají sulfidopeptidové leukotrieny (LTC4, D4 a E4) či chemotakticky aktivní LTB4. Uvolněním AA z fosfolipidů buněčné membrány dochází k tvorbě lysofosfolipidu, jehož acetylací vzniká faktor aktivující destičky (PAF). Tento mediátor má kromě účinku podporujícího agregaci krevních destiček též prozánětlivou aktivitu. Receptory pro PAF byly nalezeny v různých orgánech (kůže, hladké svaly, trachea, bronchy, oko, srdce, aorta a další) a vzestup jejich exprese v dýchacích cestách u pacientů s bronchiálním astmatem podporuje teorii o jeho klíčové úloze v průběhu alergického zánětu [5].
Role a význam lipidových mediátorů byly odhaleny hlavně díky objevu antagonistů receptorů pro sulfidopeptidové leukotrieny (LTC4, D4 a E4), které dnes hrají významnou roli v léčbě některých alergických reakcí. Zvýšenou hladinu metabolitů PGD2 v moči nacházíme u lidí s mastocytózou, zejména u skupiny pacientů s recidivujícími epizodami hypotenze. U těchto osob dochází po podání inhibitorů COX ke klinickému zlepšení. COX-1 je zodpovědná za tvorbu PGD2 v časné fázi a COX-2 za její tvorbu v pozdní fázi alergické reakce [6].
Etiologie
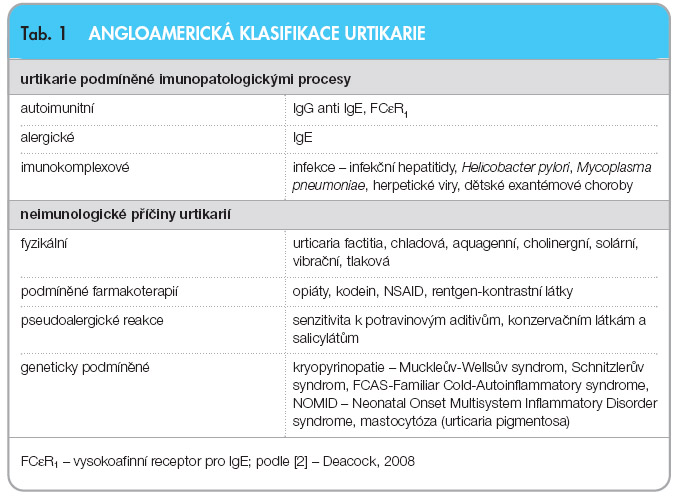
Problém v určení příčiny urtikarií vzniká tím, že vyvolávajících faktorů i modulujících procesů je celá řada a všechny vedou k obdobnému klinickému obrazu, k výsevu proměnlivých a svědících pupenů, někdy provázených angioedémem, jejichž morfologie neumožňuje jednoznačné etiopatogenetické zařazení. Klasifikace urtikarií přitom obvykle z jejich pravděpodobné etiopatogeneze vychází, a je tudíž zatím stále spíše didaktická než přínosná pro klinickou praxi (tab. 1, tab. 2). Mimo dělení uvedené v tab. 1., které je odvozeno z angloamerického pojetí problému, existují i další klasifikace. Důležité je rozdělení, které přijala Česká dermatovenerologická společnost a jehož základem je klasifikace německá, podpořená také dermatologickou sekcí EAACI (Evropská asociace pro alergologii a klinickou imunologii), viz tab. 2 [8].
Významná skupina urtikarií je zprostředkována imunopatologickými mechanismy. Často se však uplatňuje větší množství kauzálních faktorů současně, a proto musíme být v určování těchto mechanismů opatrní. Velká část imunopatologicky podmíněných chronických urtikarií bývá označována jako idiopatická urtikarie. Pokrok ve vyšetřování kauzálních mechanismů jejího vzniku vedl k objasnění příčiny části z nich. Jde o přítomnost autoprotilátek třídy IgG proti receptoru FCeR1 pro molekulu IgE na povrchu žírných buněk a bazofilů nebo méně často autoprotilátek proti samotné molekule IgE. Uvedené autoprotilátky jsou schopny spustit prostřednictvím vazby s příslušnou protilátkou IgE proces degranulace, aktivace zánětlivého procesu a výsev urtikariálních pupenů. Tato skupina urtikarií je označována jako autoimunitní urtikarie a tvoří poměrně velkou podskupinu, která se z diagnózy chronická idiopatická urtikarie oddělila. Má obvykle závažnější a protrahovaný průběh, často bývá provázena angioedémem a nedostatečně odpovídá na léčbu antihistaminiky. Kromě přítomnosti uvedených autoprotilátek u ní často nacházíme i další autoprotilátky, např. proti thyreoidální peroxidáze. K potvrzení diagnózy je doporučováno provést intradermální test autologním sérem (ASST – autologní sérový kožní test), jehož aplikace vede k vytvoření časné kopřivkové reakce [2]. Tento test zatím nebyl standardizován a je dosud praktikován pouze na některých pracovištích s dobrým laboratorním zázemím. Spolehlivost je poměrně vysoká, rozhodně však není stoprocentní.
Alergické urtikarie vyvolané prostřednictvím reakce mediované protilátkami IgE mohou vznikat po požití některých potravin či léků, někdy jen složek, které je kontaminují, dále po poštípání hmyzem, po přímém kontaktu s některými alergeny, často profesionálními (latex) či zvířecími (srst či sliny tzv. domácích mazlíčků). Reagují obvykle dobře na léčbu antihistaminiky a po správné edukaci si pacient po určité době sám často uvědomí příčinnou souvislost [7].Imunokomplexové urtikarie mohou být manifestací parainfekčního procesu, nebo projevem vaskulitidy v rámci systémových onemocnění. Z infekčních agens bývá nejčastěji popisována asociace urtikarií s onemocněním infekční hepatitidou, EB virovou infekcí, infekcí mikroorganismem Mycoplasma pneumoniae, bakterií Borrelia burgdorferi a Helicobacter pylori. Mohou provázet i další infekční choroby či fokální infekce kdekoli v organismu. Neimunologické urtikarie jsou zřejmě ještě častější a mohou být vyvolány fyzikálními faktory, farmakoterapií či podáním farmakologicky aktivních látek ve formě potravy či potravinových aditiv, ale mohou být podmíněny též geneticky [2, 3].
Z fyzikálních urtikarií vyžaduje pozornost hlavně urtikarie chladová, která může vyústit až ve třetině případů v anafylaktický šok. Její odpověď na léčbu antihistaminiky je značně variabilní. Cholinergní urtikarie má poměrně typický klinický obraz. Vzniká obvykle v důsledku změny tělesné teploty, jejíž příčinou může být fyzická zátěž, sprchování, saunování či psychický stres. Pocení není podmínkou. Jednotlivé erupce jsou drobounké a výrazně svědí. V diferenciální diagnóze musíme uvažovat o obstrukci potních žlázek při tzv. miliaria rubra, kdy z neznámé příčiny dochází u některých osob ve vlhku a teple k okluzi potních žlázek a k retenci potu v povrchových drobných vezikulách. Cholinergní urtikarie obvykle na léčbu antihistaminiky neodpovídá příznivě. V poslední době byl popsán případ úspěšné léčby velmi těžké formy cholinergní urtikarie monoklonální protilátkou anti-IgE omalizumabem [9]. Jde však pouze o kazuistické sdělení, které zatím spíše upozorňuje na možné směry dalšího vývoje léčby. Urtikarie podmíněné geneticky jsou vzácné, obvykle nesvědí a velká část jich je způsobena mutací či dysfunkcí proteinu označovaného kryopyrin. Proto hovoříme o tzv. kryopyrinopatiích [2]. Kryopyrin hraje klíčovou roli v obraně organismu proti intracelulárním parazitům a je esenciální pro aktivaci kaspázy-1 a syntézu interleukinů IL-1 a IL-18. V průběhu kryopyrinopatií dochází k zánětlivým procesům charakterizovaným obvykle horečkou, urtikarií, artralgiemi či artritidami a někdy k orgánovým postižením. Jelikož je v těchto případech zvýšená hladina IL-1, mívá příznivý terapeutický efekt podávání antagonisty receptoru pro IL-1 (anakinra) [1].
Mastocytóza představuje další vzácné geneticky podmíněné onemocnění, které se manifestuje urtikarií. Je způsobeno infiltrací dermis abnormálně zmnoženými žírnými buňkami. Mastocytóza může být ohraničena pouze na kůži, ale může zasáhnout i další orgány, zejména kosti, slezinu a játra, a vzácně může přecházet i v leukemii z žírných buněk
Uspokojivá léčba není známa. Svědění zmírňují antihistaminika.
Doporučená vyšetření
 Doporučená vyšetření jsou shrnuta v tab. 3 [3]. Základním vyšetřením zůstává podrobná anamnéza, ve které nesmí chybět dotaz na možné spouštěcí mechanismy, na frekvenci a dobu trvání jednotlivých erupcí, na doprovodné příznaky, jako jsou edémy, dechové problémy či zažívací obtíže, bolesti kloubů, únava či subfebrilie. Někdy si těchto projevů pacient není vědom a po konzultaci s lékařem je zaznamená při další atace. V některých ambulancích jsou s úspěchem používány dotazníky vypracované vždy příslušným pracovištěm [7].
Doporučená vyšetření jsou shrnuta v tab. 3 [3]. Základním vyšetřením zůstává podrobná anamnéza, ve které nesmí chybět dotaz na možné spouštěcí mechanismy, na frekvenci a dobu trvání jednotlivých erupcí, na doprovodné příznaky, jako jsou edémy, dechové problémy či zažívací obtíže, bolesti kloubů, únava či subfebrilie. Někdy si těchto projevů pacient není vědom a po konzultaci s lékařem je zaznamená při další atace. V některých ambulancích jsou s úspěchem používány dotazníky vypracované vždy příslušným pracovištěm [7].
Klinickým vyšetřením rozumíme běžné somatické vyšetření se stanovením kožní reaktivity, dermografismu, případně aktuálních kožních erupcí, pigmentací nebo hematomů. Na základě získaných poznatků pak u vybraných pacientů přistupujeme k provedení kožních testů, fyzikálních testů expozičních, případně eliminačních a nakonec indikujeme vhodné vyšetření laboratorní. Laboratorní vyšetření je vždy výsledkem analýzy informací získaných předešlým postupem [7]. FW (sedimentace červených krvinek) by měla být vyšetřena v každém případě, stejně tak i CRP a krevní obraz s diferenciálním rozpočtem. Biochemickým vyšetřením doporučujeme stanovit glykémii, funkci štítné žlázy a přítomnost protilátek proti thyreoidální peroxidáze a proti thyreoglobulinu. Imunologickým vyšetřením stanovujeme hladiny protilátek IgG, IgA, IgM a IgE, hladiny jednotlivých složek komplementu jako C3, C4 a C1 inhibitor, přítomnost antinukleárních protilátek (ANA) a protilátek proti extrahovatelnému nukleárnímu antigenu (ENA), případně přítomnost kryoglobulinů. Podrobné vyšetření specifických protilátek IgE nebývá přínosné. Alergická příčina není u chronické urtikarie příliš častá a pouze anamnestická data nás k tomuto nákladnějšímu vyšetření mohou v některých případech dovést. Provedeno by mělo být parazitologické vyšetření a sérologická vyšetření k vyloučení hepatitid, herpetických infekcí včetně EBV, infekce bakterií Helicobacter pylori, Borrelia burgdorferi a mikroorganismem Mycoplasma pneumoniae.
Kožní testy indikujeme ještě vzácněji než stanovení specifických IgE protilátek. Rozhodneme se pro ně jen na základě podezření na alergickou příčinu. Problémem je nutnost přerušit alespoň 3 dny před testováním podávání antihistaminik, což může být u těžkých forem urtikarie komplikované, a dále fakt, že řada pacientů s urtikarií má pozitivní dermografismus a hodnocení výsledku kožních prick testů je u nich velmi nesnadné [3]. Intradermální test autologním sérem (ASST) není u nás standardizovaným vyšetřením, ale při podezření na autoimunitní urtikarii jej doporučujeme provést. Obvykle jej provádějí pracoviště vybavená vlastním laboratorním zázemím. Kožní biopsie bývá indikována jen u těžkých a protrahovaných forem onemocnění a rozhodně není rutinní diagnostickou metodou. Její přínos očekáváme jen při vyšetření akutně vzniklých chronicky probíhajících procesů, u kterých máme podezření na vaskulitidu [10].
Léčba
Velice účinnou součástí léčby je edukace pacienta o tom, co vlastně urtikarie je, a o možnosti jejího protrahovaného průběhu. Je dobré upozornit jej i na to, že urtikarie nemusí být nutně důsledkem alergie a že její prognóza je navzdory nepříjemnému a zdlouhavému průběhu obvykle příznivá. Pacient se pak stává účastníkem diagnostického a léčebného procesu, a my tím redukujeme psychogenní složku, která bývá u urtikarií často velice významná.
 Dalším bodem léčby je úprava domácího i pracovního prostředí odstraněním možných spouštěcích mechanismů, které zjistíme rozborem anamnestických údajů. Mohou k tomu vést dietní opatření eliminující určité potraviny bohaté na histamin či jeho prekurzory, případně odstranění těch podnětů, které se uplatňují přímo jako alergeny. Často bývá nezbytné omezení, vynechání a náhrada určitých složek farmakoterapie. Také změny
Dalším bodem léčby je úprava domácího i pracovního prostředí odstraněním možných spouštěcích mechanismů, které zjistíme rozborem anamnestických údajů. Mohou k tomu vést dietní opatření eliminující určité potraviny bohaté na histamin či jeho prekurzory, případně odstranění těch podnětů, které se uplatňují přímo jako alergeny. Často bývá nezbytné omezení, vynechání a náhrada určitých složek farmakoterapie. Také změny 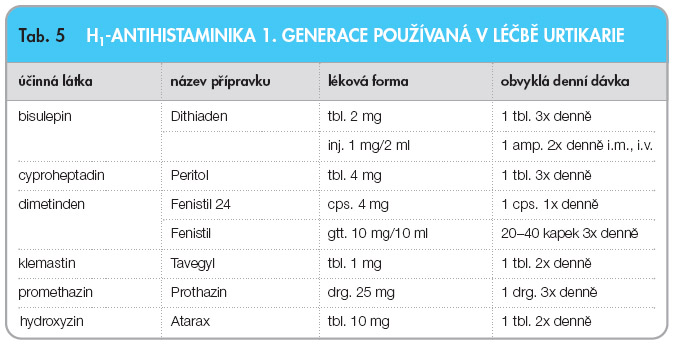 životosprávy spojené s omezenou expozicí některým fyzikálním vlivům a sanace infekčních fokusů či chronických zánětlivých onemocnění nebo endokrinopatií může občas přinést překvapivě velmi příznivé výsledky. Základem farmakoterapie zůstávají zatím stále H1-antihistaminika (tab. 4, tab. 5).
životosprávy spojené s omezenou expozicí některým fyzikálním vlivům a sanace infekčních fokusů či chronických zánětlivých onemocnění nebo endokrinopatií může občas přinést překvapivě velmi příznivé výsledky. Základem farmakoterapie zůstávají zatím stále H1-antihistaminika (tab. 4, tab. 5).
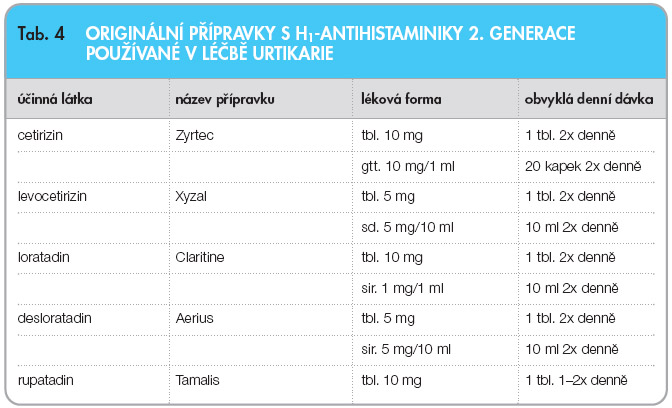
Léčbu zpravidla zahajujeme podáváním H1-antihistaminik 2. generace v obvyklých dávkách; pokud toto dávkování nestačí, zvýšíme je na dvojnásobek oproti dávkám podávaným u jiných alergických onemocnění [2]. Tyto léky prostupují hematoencefalickou bariérou méně než jejich předchůdci, H1-antihistaminika první generace, a působí proto méně nežádoucích projevů ve formě snížení pozornosti, v podobě únavy a poruch režimu spánku. Tuto léčbu doporučujeme ponechat dlouhodobě, obvykle 6 měsíců. U intermitentní urtikarie je podáváme podle potřeby. Pokud urtikarii provází výrazné svědění, osvědčuje se podávání večerní dávky antihistaminika formou obdobného farmaka první generace, např. bisulepinu či hydroxyzinu. K úplnému zamezení mnohočetného a multiorgánového biologického účinku histaminu dochází jen při kombinovaném podávání H1- a H2-antihistaminik, a proto doporučujeme při nedostatečném efektu shora uvedené léčby současné podávání H2-antihistaminik, jako je cimetidin či ranitidin. Žádný z těchto preparátů neinhibuje oxidativní procesy v játrech a nepůsobí žádné nebezpečné interakce, žádný z nich však není vhodný k léčbě urtikarií v monoterapii [11].
Alternativou k podávání kombinace H1- a H2-antihistaminik je podávání H1-antihistaminik s antileukotrieny, zejména s montelukastem či zafirlukastem [12, 13]. Také antileukotrieny jsou v léčbě urtikarií vhodné v kombinaci s antihistaminikem a neosvědčily se v monoterapii. Jejich příznivý účinek je výrazný u osob přecitlivělých na aspirin a nesteroidní antirevmatika. Jejich podávání zde doplňujeme i nízkosalicylátovou dietou, která však musí být individuálně sestavena a nesmí pacienta obtěžovat víc než samotná urtikarie [3, 14]. Někteří autoři doporučují perorální podávání sympatomimetik, která mohou vést prostřednictvím vazokonstrikce k omezení cévní permeability, tvorby pupenů a zejména edémů [7]. U nás je pro tuto možnost použití dostupný nejspíše klenbuterol. Vlastní zkušenost s jeho podáváním v této indikaci neměla žádný významný efekt. O významu psychogenních faktorů, jakými jsou stres, úzkostné stavy a deprese, není u chronické urtikarie pochyb. Některé výsevy jsou přímo vyvolány emocionálními faktory, jindy jsou opakované výsevy natolik stresující, že je zahájení léčby malými dávkami tricyklických antidepresiv často významným přínosem. I zde bývá tato léčba obvykle jen jednou součástí komplexní terapie. Při příznivém účinku je doba podávání opět dlouhá, obvykle 6 měsíců. U refrakterních forem těžké urtikarie či urtikarie provázené angioedémem nebo systémovými projevy podáváme krátkodobě kortikoidy. Dávkování závisí na hmotnosti pacienta a klinickém efektu a dobu podávání volíme pokud možno co nejkratší. Delší podávání je indikováno pouze u vaskulitid a závažných tlakových urtikarií. Pokud se pro dlouhodobé podávání kortikosteroidů rozhodneme, podáváme je alternativně či v jedné ranní dávce, současně podáváme profylakticky léky, které omezí rozvoj osteoporózy, a pacienta vybavíme lékařskou zprávou, ve které je léčba kortikosteroidy uvedena společně s doporučením její úpravy při případné operaci, úrazu či při infekčním onemocnění. V ojedinělých případech s velmi závažným průběhem a nedostatečným efektem léčby byl s úspěchem podáván cyklosporin či cyklofosfamid [4]. Zprávy o těchto léčebných postupech jsou zatím ojedinělé a indikaci musíme pečlivě zvážit ve smyslu risk/ benefit ratio. Léčbu musí indikovat příslušný specialista, který pacienta v jejím průběhu z hlediska možných nežádoucích účinků sleduje.
Totéž platí i o léčbě intravenózními imunoglobuliny [2, 10]. Jejich užití není v této indikaci rutinní metodou a zůstává vyhrazeno pro ojedinělé těžké formy, s kontraindikací jiných léčebných metod. První příznivé zprávy provázejí i podávání anti-IgE protilátky u závažných forem urtikarie [9]. U nás zatím zůstává jedinou indikací k jejímu podávání těžké alergické bronchiální astma. Používání probiotik pokládáme u urtikarií za vhodné, ale rozhodně nemůžeme očekávat významný přínos, budou-li použita v monoterapii. Za takových okolností přirozený průběh chronické urtikarie vůbec neovlivní. Význam očekáváme jen v jejich zařazení do komplexní terapie.
Závěr
Urtikarie jsou spíše příznakem mnoha zcela odlišných patologických procesů než samostatnou nozologickou jednotkou. Jejich prevalence je však velmi vysoká, a proto je jejich léčba stále aktuálním tématem. Zatím však zůstává základem terapie edukace, eliminace nepříznivě modulujících či spouštěcích faktorů a podávání antihistaminik po dostatečně dlouhou dobu a v dostatečně vysokých dávkách. V ojedinělých případech je nutné léčbu rozšířit o účinné imunomodulační látky, při jejichž podávání však musíme počítat s možnými nežádoucími účinky. Při rozhodnutí o vhodné léčbě musíme především dlouhodobě sledovat poměr rizika nežádoucích účinků léčby a jejího přínosu. Urtikarie je dosti častým patologickým procesem postihujícím kůži a její prognóza „quoad vitam“ i „quoad sanationem“ zůstává navzdory pomalým krokům v inovaci terapeutických postupů stále příznivá.
Seznam použité literatury
- [1] Bailey E, Shaker M. An update on childhood urticaria and angioedema. Curr Opin Pediatr 2008; 20: 425–430.
- [2] Deacock SJ. An approach to the patient with urticaria. Clin Exp Immunol 2008; 153: 151–161.
- [3] Viktorinová M. Kopřivka a angioedém. Praha, Galén 2001; 10–15.
- [4] Bartůňková J. Imunodeficience. Praha, Grada Publishing 2002; 117–118.
- [5] Zweiman B, Schwartz LB. Inflammatory mechanisms in allergic diseases. Marcel Dekker, Inc 2002; 12–14; 223–236.
- [6] Jaffer AM, Tilden R, Erick R, et al. Sulfasalazine in the treatment of chronic urticaria. J Allergy Clin Immunol 2002; 109(1): S127.
- [7] Wanderer AA: Hives: The road to diagnosis and treatment of urticaria. Anson Publishing, LLC 2004.
- [8] Zuberbier T, Bindslev-Jensen C, Canonica W, et al. Review article: EAACI/GA2LEN/EDF guideline: definition, classification and diagnosis of urticaria. Allergy 2006; 61: 316–320.
- [9] Metz M, Bergmann P, Zuberbier P, et al. Successful treatment of cholinergic urticaria with anti-immunoglobulin E therapy. Allergy 2008; 63: 247–249.
- [10] Bernstein JA, Garramone SM, Lower EG. Successful treatment of autoimmune chronic idiopathic urticaria with intravenous cyclophosphamide. Ann Allergy Asthma Immunol 2002; 89: 212–214.
- [11] Botta RS, Grant JA, Jain VV, et al. Role of montelukast in chronic idiopathic urticaria. Ann Allergy Asthma Immunol 2002; 88: 114 (P55).
- [12] Erbagci Z. The leukotriene receptor antagonist montelukast in the treatment of chronic idiopathic urticaria: a single-blind, placebo-controlled, crossover clinical study. J Allergy Clin Immunol 2002; 110: 484–488.
- [13] Anand MK, Nelson HS, Dreskin SC. A possible role for cyclooxygenase 2 inhibitors in the treatment of chronic urticaria. J Allergy Clin Immunol 2003; 111: 1133–1136.
- [14] Asero R. Are IVIG for chronic unremitting urticaria effective? Allergy 2000; 55:1099–1101.
- [15] Samuelsson A, Towers TL, Ravetch JV. Anti-inflammatory activity of IVIG mediated through the inhibitory Fc-receptor. Science 2001; 291: 484–486.