Současné možnosti ovlivnění chronické bolesti
Souhrn:
Chronická bolest představuje celosvětově velmi závažný zdravotní i sociální problém. Oproti akutní bolesti je onemocněním ve vlastním smyslu slova, jež je velkým léčebným problémem z důvodu své heterogenity. Vzhledem k této mnohotvárnosti chronické bolesti a k odlišnostem mezi jednotlivými pacienty je používaná léčba často neúčinná nebo má významné nežádoucí účinky. Nedostatečně léčená silná chronická bolest velmi negativně ovlivňuje kvalitu života, denní aktivity, kvalitu spánku, mezilidské vztahy, pracovní produktivitu a je spojena s velkými ekonomickými náklady na léčbu. Proto je nutné hledat další účinnější léčebné metody a přístupy. Nové terapeutické možnosti se ukazují jak v oblasti nových účinných látek a nových lékových forem, tak v oblasti dalších léčebných indikací již používaných léků a nových strategií v léčbě různých typů bolesti. Tento článek přináší základní přehled současných možností v léčbě chronické bolesti. K nejúčinnějším přístupům aktuálně patří cílené léčebné intervence, jako jsou např. duálně působící léky, dále intervenční, zejména neuromodulační analgetické přístupy a užití multimodální a zároveň na pacienta cílené léčebné strategie. Tyto nové přístupy by mohly vést k účinnější i k bezpečnější léčbě chronické nádorové i nenádorové bolesti.
Key words: chronic pain – drugs treatment – intervention treatment – neuromodulation – new treatment approaches.
Summary:
Chronic pain represents a very serious public health and social problem worldwide. Chronic pain compared to acute pain becomes a disease per se, which is challenging to treat because of the heterogeneity of its origin. Because of the heterogeneity of chronic pain origins and diversities among patients, satisfactory therapies for its treatment are often lacking or have adverse effects. Unrelieved chronic severe pain negatively impact an individuals’ quality of life, day‑to‑day functioning, sleep quality, interpersonal relationships, and work productivity, and is a associated with substantial economic burden. Thus, there is an urgent need for development of new treatment possibilities. New options in the treatment of pain affect concern not only new active substances or new formulations but also extensions of indications of already used substances and new strategies in the treatment of various types of pain. Here, we review new drugs and novel approaches to chronic intractable pain. The most important modern treatment approaches seem to be multi‑target pharmacological interventions, neuromodulation approaches, and multimodal and patient targeted treatment strategies. These treatment possibilities may lead to more efficient and safer treatment of chronic cancer and non‑cancer pain.
Úvod
Akutní bolest je bolest trvající maximálně po tři měsíce, která jako výsledek základního patologického procesu během hojení a při účinné terapii postupně slábne, až mizí. Akutní bolest většinou lze s pomocí nejrůznějších lékových metod (např. analgetika), popř. pomocí metod nelékových (např. fyzikální terapie) účinně zvládat.
Chronická bolest (CHB) na rozdíl od akutní bolesti přetrvává přes obvyklý časový rámec průběhu základního akutního onemocnění či poranění (trvá i po zhojení primárního bolestivého zdroje). Původ chr onické bolesti a zejména příčiny jejího trvání jsou často nejasné. Proto není vždy možno určit zdroj přetrvávající bolesti. Z tohoto důvodu je léčba chronické bolesti daleko problematičtější a komplikovanější než léčba bolesti akutní. Na rozdíl od akutní bolesti, která pozitivně slouží jako varování před hrozícím poškozením tkáně nebo je výrazem potřeby zůstat v klidu kvůli hojení a rekonvalescenci, chronická bolest většinou postrádá jakýkoliv biologický užitek. Je třeba ji považovat za speciální klinický syndrom a přistupovat k ní jako k onemocnění ve vlastním slova smyslu a také ji komplexně a přitom individuálně ošetřovat a léčit. Je nutné zdůraznit, že nemocné bychom měli vždy léčit dle intenzity bolesti, a ne pouze podle její etiologie [1]. Oproti bolesti akutní musí být léčba chronické bolesti vedena daleko komplexněji a multifaktoriálně (multidisciplinárně) (tab. 1).
onické bolesti a zejména příčiny jejího trvání jsou často nejasné. Proto není vždy možno určit zdroj přetrvávající bolesti. Z tohoto důvodu je léčba chronické bolesti daleko problematičtější a komplikovanější než léčba bolesti akutní. Na rozdíl od akutní bolesti, která pozitivně slouží jako varování před hrozícím poškozením tkáně nebo je výrazem potřeby zůstat v klidu kvůli hojení a rekonvalescenci, chronická bolest většinou postrádá jakýkoliv biologický užitek. Je třeba ji považovat za speciální klinický syndrom a přistupovat k ní jako k onemocnění ve vlastním slova smyslu a také ji komplexně a přitom individuálně ošetřovat a léčit. Je nutné zdůraznit, že nemocné bychom měli vždy léčit dle intenzity bolesti, a ne pouze podle její etiologie [1]. Oproti bolesti akutní musí být léčba chronické bolesti vedena daleko komplexněji a multifaktoriálně (multidisciplinárně) (tab. 1).
Medikamentózní léčba
Při medikamentózním přístupu k CHB vycházíme z modifikovaného analgetického žebříčku Světové zdravotnické organizace (World Health Organization, WHO) pro léčbu bolesti z nádorových příčin, rovněž s použitím intraspinální aplikace léků pro nejtěžší typy bolesti. Vedle klasických analgetik (analgetika antipyretika, nesteroidní antirevmatika – NSA, slabé opioidy) zde hrají velkou úlohu adjuvantní léky dle typu převládající bolesti. U nejtěžších bolestí mají nezastupitelnou indikaci silné opioidy.
Neopioidní analgetika
V případě slabších bolestí či jako pomocná analgetika se stále využívají i neopioidní analgetika. U rizikových nemocných je vhodné zahájit léčbu paracetamolem, který má sice relativně malý periferní protizánětlivý účinek, ale vykazuje dobré analgetické působení. Je však třeba užívat dostatečnou analgetickou dávku v rozmezí 650–1 000 mg (maximální denní dávka je 4 g, lépe je však u CHB nepřekračovat dávku 2 g pro riziko hepatotoxicity). Jako velmi vhodné se ukazují kombinace paracetamolu s opioidními analgetiky, s NSA, popř. s dalšími farmaky. Ve Spojených státech amerických jsou rozšířeny i kombinace paracetamolu se silnými opioidy [2]. Vedle paracetamolu je v současné době na vzestupu používání metamizolu, který dobře působí na nociceptivní bolest a pro svůj spasmolytický účinek je vhodný u viscerální bolesti. Stejně jako ostatní léky této skupiny jej lze kombinovat se slabými i silnými opioidy. Všechny léky uvedené skupiny mají stropový efekt, a proto navyšování dávky nad doporučenou hodnotu neposiluje analgetické působení, ale zvyšuje možnost vzniku nežádoucích účinků [2].
Další kombinace analgetik
Je potvrzena vhodnost kombinace farmak i bez paracetamolu. Analgeticky prospěšné jsou kombinace opioidů s ketaminem u opioidy indukované hyperalgezie, naopak kombinace opioidů s NSA se zdají být méně výhodné než kombinace opioidů s paracetamolem. Kombinace opioidů s gabapentinem se klinicky více osvědčily u neuropatické bolesti než u nádorové bolesti. Kombinace gabapentinu s antidepresivy se ukazují jako vhodné u neuropatické bolesti a možná u fibromyalgie. Vyšší analgetické účinnosti bylo docíleno při kombinaci gabapentinu s koxiby [3]. Jako nadějné se ukazují kombinace opioidů s ampakiny, nově vyvíjenými ligandy glutamátových receptorů typu AMPA, které ve studiích s dobrovolníky prokázaly antagonizování inhibičního účinku alfentanilu na dýchání, nikoliv však potlačení jeho analgetického působení. Dobrý účinek vykazují kombinace opioidů s kanabinoidy a kombinace opioidů s ligandy imidazolinových receptorů, které mají vlastní analgetický efekt a vykazují též synergický účinek při kombinaci s morfinem jako kanabinoidy [3]. Použití kombinace dvou, popř. více silných retardovaných opioidů není v klinické praxi doporučováno, ačkoliv je někdy používáno u jinak neovlivnitelných bolestí – zejména u nádorových bolestí a v terminálních stavech onemocnění se silnými bolestmi.
Nesteroidní antirevmatika
Nesteroidní antirevmatika jsou stále nedílnou součástí léčby chronické bolesti. Výběr NSA v léčbě CHB je dán jak zkušeností pacientů z předchozího užívání NSA, tak požadovanou dobou účinku a rychlostí jeho nástupu. Nesteroidní antirevmatika, která vykazují dlouhou dobu působení (např. piroxikam, naproxen, retardované formy diklofenaku), mají výraznější nežádoucí účinky, pro dlouhé setrvání v oběhu hrozí riziko kumulace při nedodržení doporučené doby užívání. U tohoto typu NSA je rovněž opožděný nástup účinku – jestliže tedy charakter bolesti vyžaduje rychlý nástup účinku (např. u bolestí hlavy, migrény a při všech akutních exacerbacích bolesti při CHB), je vhodné užít lékové formy s rychlým nástupem účinku (např. ibuprofen, nimesulid, diklofenak). Nesteroidní antirevmatika jsou stále velmi rozšířená v léčbě CHB z důvodu významné účinnosti, nízkého rizika vzniku závislosti a již dlouhodobě ověřeného klinického použití. Je třeba varovat před kombinací dvou či více druhů NSA, jež nemá větší analgetický účinek, o to větší je však riziko vzniku komplikací. Současné algoritmy v léčbě CHB zad a osteoartritidy doporučují perorální použití paracetamolu či lokálně aplikovaných NSA pro osteoartritidu v první linii léčby, ostatní perorální NSA jsou doporučována pro první či druhou linii léčby dle specifických směrnic [4]. Pro snížení nežádoucích gastrointestinálních účinků spojených s inhibicí enzymu cyklooxygenázy 1 (COX 1) byly vyvinuty selektivní inhibitory COX 2 označované jako koxiby. Avšak zvýšený výskyt infarktu myokardu a dalších trombotických komplikací vedl k omezení použití koxibů, ačkoliv se později zjistilo, že k nežádoucím kardiovaskulárním komplikacím může vést i užívání tradičních NSA, zejména ve vysokých dávkách [4]. Z tohoto důvodu i v současnosti platí, že by rozhodnutí o použití každého NSA mělo vycházet z klinických a demografických ukazatelů (např. věk), a doporučuje se podávat nejnižší účinnou dávku po nejkratší dobu použití. Nejnovějším trendem je užití terapie NSA dle individuálních potřeb na podkladě biochemických markerů, které by mohly predikovat léčebnou odpověď. Biochemické markery inhibitorů COX mohou pomoci lékařům v racionálním výběru vhodného NSA k dosažení bezpečné účinnosti. Významné rozdíly v účinnosti a toleranci mezi jednotlivými pacienty byly zjištěny na podkladě genetických faktorů (např. exprese enzymu CYP450), které ovlivňují farmakodynamiku i farmakokinetiku NSA. Současné znalosti faktorů (typ, dávka, farmakokinetika) ovlivňujících bezpečnost a toleranci NSA vedou k vývoji nových NSA. Jedná se např. o rychle se uvolňující diklofenak, který má krátký poločas rozpadu, acidický profil a COX 2 selektivitu, a tak je možné použití nízkých dávek k rychlému analgetickému účinku a současně k protrahované analgezii [4].
Slabé opioidy
Indikací slabých opioidů je středně silná a silná bolest, která nereaguje na léčbu neopioidními analgetiky, nebo případy, kdy neopioidní analgetika nelze dlouhodobě užívat z důvodu nežádoucích účinků. „Zlatým standardem“ je stále tramadol, který má široké použití a je jedním z nejčastěji užívaných analgetik v případě akutní i chronické bolesti. Je dostupný v mnoha lékových formách – v retardované (tablety) i rychle působící (kapsle, kapky). Na tramadol jsou citlivější senioři, může docházet ke kognitivním poruchám, nevhodná je kombinace s antidepresivy typu SSRI (selektivní inhibitory zpětného vychytávání serotoninu) kvůli riziku vzniku serotoninergního syndromu [5]. Dalším slabým opioidem je dihydrokodein, který je výhodným analgetikem s pomalým uvolňováním do oběhu. Dihydrokodein i tramadol – stejně jako neopioidní analgetika – mají stropový efekt (tramadol 400 mg/den, dihydrokodein 240 mg/den), takže zvyšování dávky nevede k lepšímu analgetickému účinku, nýbrž jen ke zvýraznění nežádoucích účinků. Při nedostatečném analgetickém účinku je třeba zvolit jinou terapii, popř. přejít na používání silných opioidních analgetik. U kodeinu podobně jako u tramadolu v kombinacích s paracetamolem dochází ke zvýšení analgetické účinnosti a zmírnění nežádoucích účinků [5].
Silné opioidy
Chronická bolest včetně bolesti nenádorového původu dosahuje někdy takové intenzity, že ji není možné tlumit jinými analgetiky než silnými opioidy, aby byla zachována kvalita lidského života a obnoveny funkce psychické i fyzické. V posledních dvaceti letech se s rozvojem léčby bolesti zvýšila celosvětově spotřeba opioidů (i v České republice), což svědčí o tom, že bolest – a to i chronická – se začala léčit intenzivněji a odpovědněji. Bylo prokázáno, že až 90 % nádorové bolesti lze odstranit opioidní terapií. Opioidy, pokud jsou správně použity zkušenými lékaři, jsou nejbezpečnějšími mezi běžně užívanými analgetiky, zejména s ohledem na možnost orgánového postižení. Zásadou je dávkovat opioidy v nejnižší skutečně účinné dávce, v pravidelných intervalech a nejlépe v perorální nebo v transdermální formě.
Strach ze vzniku psychické závislosti však stále často brání užití opioidů i v indikovaných případech. Navíc je zaměňována tolerance k léku a fyzická závislost za závislost psychickou. Tolerance však většinou není velkým klinickým problémem. Fyzická závislost je fyziologický fenomén charakterizovaný rozvojem příznaků z odnětí buď po přerušení kontinuálního podávání opioidů nebo po radikálním snížení dávky, po podání antagonistů opioidů (například naloxonu) či po aplikaci agonistů a antagonistů (např. pentazocin). Riziko vzniku psychické závislosti u dlouhodobého podávání opioidů pacientům s CHB je malé, pokud se jedná skutečně o léčbu somatické bolesti a nejde o pacienty se závislostí v anamnéze a o pacienty s psychickými poruchami nebo se sociálními problémy [5]. Psychická závislost je velmi komplikovaný fenomén, který je ovlivněn mnoha faktory – biochemickými, psychologickými a genetickými. Před nasazením opioidů je nutné pacienta dostatečně poučit a sepsat s ním tzv. opioidní smlouvu, zakončenou podepsáním informovaného souhlasu [6]. Silné opioidy se zdají logickou volbou jak pro chronickou nádorovou bolest (CHNB), tak pro chronickou nenádorovou bolest (CHNNB). Dlouhodobá léčba opioidy však může přinášet i řadu nežádoucích účinků a komplikací. Léčebná odpověď na opioidy je u nenádorové bolesti poněkud odlišná, než je tomu u bolesti nádorové. Ukazuje se, že překročení středních dávek silných opioidů již nepřispívá ke zlepšení kvality analgezie, ale spíše zvýrazňuje fyzickou zá vislost a toleranci. Z klinického hlediska je proto nutné považovat silné opioidy u CHNNB za látky se stropovým efektem. Fyzická závislost se může stát u nemocných užívajících silné opioidy dominantním klinickým problémem a někdy je obtížné odlišit ji od adiktivních projevů. V některých vyspělých zámořských státech (např. Spojené státy americké, Kanada, Austrálie) se používání opioidů (zejména silných) stalo v posledních letech velkým zdravotním i společenským problémem. Hovoří se přímo o epidemii, která se projevuje zvyšováním morbidity i mortality ve spojení s předepisovanými opioidy (zejména oxykodonu). V současné době se proto velmi mění přístupy k používání opioidů u CHNNB. Cílem se stala racionalita (tzv. opioid realismus) v předepisování opioidů a jsou celosvětově zaváděny algoritmy, které by měly minimalizovat použití opioidů u nevhodných nemocných. Hovoří se přímo o výběru indikovaných pacientů k léčbě opioidy, kteří splňují požadované podmínky (tab. 2). Neustále by se měl přehodnocovat poměr riziko/přínos opioidní léčby [7]. Silné opioidy mají samozřejmě dále své nezastupitelné místo v léčbě akutní (pooperační) bolesti, v léčbě nádorové bolesti a v léčbě nemocných s bolestí v paliativní péči.
vislost a toleranci. Z klinického hlediska je proto nutné považovat silné opioidy u CHNNB za látky se stropovým efektem. Fyzická závislost se může stát u nemocných užívajících silné opioidy dominantním klinickým problémem a někdy je obtížné odlišit ji od adiktivních projevů. V některých vyspělých zámořských státech (např. Spojené státy americké, Kanada, Austrálie) se používání opioidů (zejména silných) stalo v posledních letech velkým zdravotním i společenským problémem. Hovoří se přímo o epidemii, která se projevuje zvyšováním morbidity i mortality ve spojení s předepisovanými opioidy (zejména oxykodonu). V současné době se proto velmi mění přístupy k používání opioidů u CHNNB. Cílem se stala racionalita (tzv. opioid realismus) v předepisování opioidů a jsou celosvětově zaváděny algoritmy, které by měly minimalizovat použití opioidů u nevhodných nemocných. Hovoří se přímo o výběru indikovaných pacientů k léčbě opioidy, kteří splňují požadované podmínky (tab. 2). Neustále by se měl přehodnocovat poměr riziko/přínos opioidní léčby [7]. Silné opioidy mají samozřejmě dále své nezastupitelné místo v léčbě akutní (pooperační) bolesti, v léčbě nádorové bolesti a v léčbě nemocných s bolestí v paliativní péči.
V posledních letech se v portfoliu používaných silných opioidů v České republice (ČR) objevily dva nové léky s duálním mechanismem účinku. Tapendatol je silný opioid se synergickým duálním účinkem morfinu s agonistickým působením na μ opioidních receptorech a s inhibicí zpětného vychytávání noradrenalinu. Tapendatol také aktivuje α2 receptory v míše, což pravděpodobně odpovídá za velmi dobrý analgetický účinek u neuropatické bolesti (např. u diabetické neuropatie) [8]. Tapendatol nemá aktivní metabolity, má nízkou vazbu na plazmatické bílkoviny a není závislý na metabolismu CYP450. Ve srovnání s jinými silnými opioidy vykazuje i příznivý výskyt nežádoucích účinků a relativně pomalý rozvoj tolerance. Doporučovaná maximální denní dávka je 500 mg. V současné době je tapendatol k dispozici jak v retardované formě (50 mg, 100 mg, 150 mg, 200 mg, 250 mg) s dávkováním dvakrát denně, tak ve formě pro rychlé použití při vzniku průlomové bolesti [9].
Snaha o snížení výskytu nežádoucích účinků při zachování analgetické účinnosti opioidů je jedním ze směrů vývoje nových analgetických léků. K nim patří již několik let používaný duální lék obsahující fixní kombinaci (2 : 1) silného opioidu oxykodonu a antagonisty opioidních receptorů naloxonu ve formě tablet s prodlouženým účinkem [10]. Tablety jsou dostupné ve třech silách (10/5 mg, 20/10 mg, 40/20 mg). Při jeho podávání nedochází ke snížení analgetické účinnosti léčby, efekt analgezie je srovnatelný s monoterapií oxykodonem a výskyt opioidy vyvolané zácpy je významně snížen. Všechny dostupné studie prokazují, že tato fixní kombinace je ve srovnání s jinými silnými opioidy velmi vhodnou, účinnou a bezpečnou léčebnou možností pro nemocné se střední až silnou chronickou bolestí nejrůznějšího původu, zejména pak pro nemocné se zácpou vyvolanou opioidy [11].
Jsou však pacienti především s CHNNB, u nichž léčba opioidy nepřináší uspokojivý výsledek a klíčovým problémem se stává silná závislost. Za takové situace není zcela jasné, zda se léčí vlastní bolest, nebo se spíše tlumí abstinenční příznaky. Zvyšování dávek opioidů v těchto případech není řešením a může vést i k hyperalgezii, tedy k rozvoji abnormálního čití s alterací prahu bolesti. Možným řešením této situace je převedení pacientů na substituční léčbu sublinguálním buprenorfinem s naloxonem. Buprenorfin je v léčbě CHB využíván v transdermální aplikaci, zejména u nemocných s poškozenými renálními funkcemi. Jedná se o parciálního agonistu na receptoru μ a o antagonistu na receptoru κ; naloxon je antagonistou na receptoru μ. To brání zneužití lékové formy narkomany, jelikož intravenózní aplikace by způsobila silný a obávaný abstinenční syndrom. Užitý poměr buprenorfin/naloxon je 4 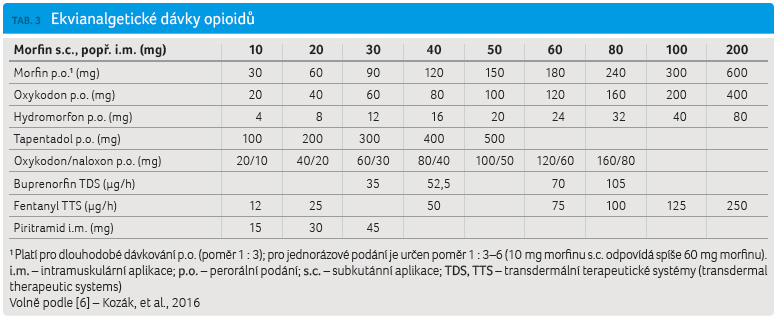 : 1 a jsou k dispozici dvě síly (2/0,5 mg a 8/2 mg). Substituční léčba je metodou volby i z hlediska kontroly vlastní bolesti. I zde – tak jako v mnoha jiných případech léčby CHB – je nezastupitelná mezioborová spolupráce. Daná léčba vyžaduje spolupráci s adiktology, kteří musejí tuto terapii indikovat a většinou i dále vést. Problémem je finanční náročnost léčby pro pacienta v ambulantní péči a nutnost získání souhlasu nemocného k této terapii [7].
: 1 a jsou k dispozici dvě síly (2/0,5 mg a 8/2 mg). Substituční léčba je metodou volby i z hlediska kontroly vlastní bolesti. I zde – tak jako v mnoha jiných případech léčby CHB – je nezastupitelná mezioborová spolupráce. Daná léčba vyžaduje spolupráci s adiktology, kteří musejí tuto terapii indikovat a většinou i dále vést. Problémem je finanční náročnost léčby pro pacienta v ambulantní péči a nutnost získání souhlasu nemocného k této terapii [7].
Jednou z dalších možností, jak zlepšit nedostatečný léčebný účinek terapie opioidy, je jejich výměna (rotace). Výhodné je výměnu u nového opioidu začít nižší dávkou, než je dávka doporučovaná. Přehled ekvipotentních dávek opioidů je uveden v tab. 3 [6].
Kanabinoidy
Dalšími novými léky, které se v současné době dostávají do portfolia analgetické léčby i v ČR, jsou kanabinoidy. Jsou to přírodní léky vyrobené z léčebného konopí, jež se vážou na endokanabinoidní receptory. Kromě nejdůležitější oblasti terapie, jíž je roztroušená skleróza, jsou tyto léky indikovány v léčbě nádorové a některých typů neuropatické bolesti (např. HIV neuropatie). Výhodou je i jejich antiemetický účinek, zlepšení chuti k jídlu a úprava spánku. Nežádoucí účinky nebývají závažné, jsou individuálně podmíněné. Kanabinoidy se používají již v mnoha zemích v tzv. formě smoked cannabis, herbálního konopí nebo ve formě oromukózního spreje (užívá se kombinace dvou hlavních kanabinoidů – tetrahydrokanabinolu a kanabidiolu) [6]. Aktuálně jsou v ČR kanabinoidy dostupné předepsáním na elektronické recepty s omezením a užívají se ve formě upravených kapslí nebo prostřednictvím aplikace ze speciálního vaporizéru. Vzhledem k povolení pěstování léčebného konopí v ČR se tato léčba stává pro pacienty finančně dostupnější.
Léčba průlomové bolesti
V posledních letech se do popředí zájmu dostala a velkou změnu v kvalitě léčby zaznamenala terapie průlomové bolesti. S průlomovou bolestí se setkáváme u pacientů s dostatečně pokrytou základní CHB, u kterých se občas (maximálně čtyřikrát denně) objeví krátkodobá ataka velmi silné bolesti. Jestliže se ataky objevují častěji, je vhodné navýšení základní analgetické terapie [12]. Průlomová bolest postihuje až 85 % pacientů většinou s CHNB a je charakterizována nástupem během několika vteřin až minut a krátkou dobou trvání, je většinou obtížně předvídatelná. Optimální lék pro léčbu průlomové bolesti má mít rychlý a relativně krátkodobý účinek, minimum nežádoucích účinků a malé riziko lékových interakcí. V minulosti se k této léčbě používal zejména morfin v tekuté formě (kapky), aktuálně máme k dispozici morfin v rychle působících tabletách (síly 10 mg a 20 mg). Pro slabší průlomovou bolest se mohou využít i rychle působící neopioidní analgetika, neretardované formy slabých opioidů (např. tramadol ve formě kapslí či kapek) nebo kombinace slabých opioidů s paracetamolem. V nedávné době se do klinického použití v léčbě průlomové bolesti dostaly i další formy silných opioidů. Pro využití u CHNNB je možno použít tapendatol s rychlým nástupem účinku (IR forma v sílách 50 mg, 75 mg, 100 mg). Jako nejvhodnější možnost léčby průlomové bolesti se ukazuje transmukózně aplikovaný fentanyl. Jedná se o syntetický lipofilní opioid, který rychle proniká do krevního oběhu a v algeziologii se již dlouhodobě a úspěšně používá v náplasťové formě pro transdermální aplikaci. Fentanyl je asi 80–100× silnější než hydrofilní morfin a má výraznou selektivitu k μ opioidním receptorům [13]. Je k dispozici v několika formách – nosní sprej (jeden přípravek v síle 50 µg, 100 µg, 200 µg), efervescentní tablety k bukální a sublinguální aplikaci (dva přípravky v síle 100 µg, 200 µg, 400 µg, 600 µg, 800 µg) a bukální film (jeden přípravek v síle 200 µg, 400 µg, 600 µg, 800 µg). Tyto formy jsou určeny zatím jen pro léčbu průlomové bolesti u CHNB se zavedenou trvalou léčbou opioidy. Terapie je bezpečná, dobře tolerovaná, s minimálními nežádoucími účinky. Léčebný účinek nastupuje v několika minutách a přetrvává pouze po dobu 90 minut, proto uvedené přípravky s obsahem fentanylu splňují všechna kritéria k okamžité a bezpečné léčbě intenzivních epizod průlomové bolesti [14].
Léčba neuropatické bolesti
Velkým terapeutickým problémem je stále léčba chronické neuropatické bolesti, což je bolest způsobená poškozením nebo onemocněním somatosenzorického nervového systému. Léčba neuropatické bolesti je často velmi obtížná, terapeutická odpověď na jednotlivé léky je těžko předvídatelná a velmi individuální [15]. Mezi léky první linie léčby se řadí modulátory kalciových kanálů gabapentin (v denních dávkách až 3 600 mg) a pregabalin (v denních dávkách až 600 mg), tricyklická antidepresiva (často s výraznými nežádoucími účinky) a antidepresiva ze skupiny inhibitorů zpětného vychytávání serotoninu a noradrenalinu (duloxetin, venlafaxin). K lékům druhé volby patří náplasti s obsahem 5% lidokainu, středně silný opioid tramadol a koncentrovaný kapsaicin [16]. V případě léčby postherpetické neuralgie řadíme 8% kapsaicin již do první linie léčby [17]. Někdy jsou do druhé linie léčby počítány i některé silné opioidy a kanabinoidy [6]. Do třetí léčebné linie se řadí silné opioidy, botulotoxin A [16] a inhibitory receptorů N methyl D asparagové kyseliny, kyselina thiooktová a některá další antiepileptika [18].
Adjuvantní a pomocné léky
Podle druhu bolesti (nociceptivní vs. neuropatická) je vhodné kombinovat vlastní analgetika s adjuvantními analgetiky (koanalgetika), tedy léky, které primárně nejsou využívány k léčbě bolesti. Tyto kombinace jsou výhodné zejména u neuropatické bolesti. Protože tento typ chronických bolestí má horší či špatně předvídatelnou odpověď na opioidy a slabší analgetika jsou u těchto bolestí prokazatelně neúčinná, je právě užití adjuvantní terapie velmi přínosné. Jedná se zejména o antiepileptika pro převládající křečovitý typ bolesti a antidepresiva pro převládající pálivý typ bolesti a depresivní stavy. Ale používají se i další druhy léků, např. kortikoidy, místní anestetika, benzodiazepiny. Často tyto léky představují hlavní a nejdůležitější přístupy pro analgetické ovlivnění zejména neuropatické bolesti. Paradoxně se tak klasická analgetika při léčbě této bolesti stávají léky spíše adjuvantními [6].
Při léčbě CHB jsou stále potřebná takzvaná pomocná léčiva, jež zahrnují velkou skupinu léků, popř. metod, které se používají k ovlivnění nebo k prevenci nežádoucích účinků a komplikací způsobených vlastními analgetiky či adjuvantními léky. K nejpoužívanějším lékovým skupinám pomocných léčiv patří laxativa, antiemetika, psychostimulancia a gastroprotektiva [6].
Lokální léčba bolesti
Lokální terapie měla dlouho v léčbě CHB dosti zanedbatelnou roli. Používaly se například nízkokoncentrované kapsaicinové náplasti či masti, krémy a masti s obsahem místních anestetik (např. mesokain a lidokain) a s obsahem NSA. Avšak v posledních letech se situace pozitivně změnila. Z lokálních přípravků je používán 5% lidokain v náplasti s velmi dobrou tolerancí pacientem. Léčebným mechanismem je blokace natriových kanálů v oblasti aplikace [6]. Náplast je nalepena na postiženou oblast po 12 hodin a následuje stejná doba bez náplasti, výhodou je snadná aplikace samotným pacientem. Vysokokoncentrovaný 8% kapsaicin je selektivní agonista vaniloidních receptorů (TRPV1) a nalepením náplasti dochází až ke kompletní blokádě nociceptorů v oblasti aplikace přípravku s následnou dlouhodobou úlevou od bolesti [19]. Náplast je nalepena po dobu jedné hodiny prostřednictvím zaškoleného personálu speciálním přístupem eliminujícím lokální postižení zejména sliznic a očí. Po odstranění náplasti přetrvává analgetický účinek až tři měsíce. Indikací aplikace obou náplastí jsou intenzivní periferní neuropatické bolesti, zejména postherpetická neuralgie a neuropatie spojené s infekcí HIV a s postoperačním či s posttraumatickým neuropatickým postižením [20]. Výhodou této léčby je minimalizace systémových nežádoucích účinků, lokální nežádoucí účinky jsou většinou dobře zvladatelné samotným pacientem. Vhodné a hodně používané jsou kombinace lokální analgetické léčby se systémovou léčbou, např. u bolestí zad s radikulární složkou [21].
Fyzikální, psychologická a alternativní léčba
K možnostem fyzikální terapie u CHB patří celá šíře rehabilitačních metod, použití imobilizačních a stabilizačních pomůcek (fixátory, podpěry a korzety, dlahy), transkutánní elektrické nervové stimulace (TENS) a mnoha dalších metod a opatření vedoucích k úpravě pohybového systému a k pozitivní změně životního stylu. Nejdůležitější je však vhodné a pravidelné cvičení i v domácích podmínkách, velmi vhodné je plavání a zejména cvičení ve vodě. K modernějším metodám patří např. biofeedback a metoda mirror, kde se za pomoci kontroly zrcadlem mohou pozitivně ovlivňovat např. fantomové bolesti. Komplexní rehabilitační přístupy souvisejí i s možnostmi psychologického ovlivnění nemocného a jeho okolí, např. prostřednictvím kognitivně behaviorální terapie. Spolupráce s klinickým psychologem, popř. s psychiatrem je v mnoha případech potřebná, v některých případech (např. při indikacích k užití neuromodulačních metod) naprosto nezbytná. Psychorehabilitační přístupy mohou vést k navození psychosociálně stabilizovanějšího stavu a ke zlepšení kontroly nad bolestí [6]. V některých situacích lze využít i některé z metod „alternativní“ medicíny, například akupunkturu.
Intervenční analgetické metody
Významné postavení v léčbě mnoha stavů CHB v současné době získávají invazivní (intervenční) algeziologické přístupy. Tyto metody jsou někdy upřednostňovány i před farmakologickou léčbou zejména silnými opioidy. Intervenční léčba je používána samostatně nebo v kombinacích s další léčbou včetně nefarmakologické [22]. Intervenční terapie se stává rozšířenější z důvodů své vyšší bezpečnosti (např. používání ultrazvuku při navigaci), zvýšení rozsahu diagnostických a léčebných indikací a i kvůli lepšímu proplácení jejích výkonů z prostředků zdravotního pojištění od roku 2017. K jednodušším intervenčním metodám můžeme řadit reflexní obstřiky, např. spoušťových bodů (trigger points) a hyperalgických zón, zejména pomocí místních anestetik. K základním přístupům patří regionální nervové blokády a neuroaxiální bloky (epidurální, kaudální a subarachnoidální). Velmi užitečné mohou být opakované blokády senzorických nervů (např. kořenových) a pletení nebo sympatických plexů (například plexus stellatum a plexus coeliacus), kontinuální či intermitentní aplikace léků se zavedeným katétrem, popř. s použitím více či méně sofistikovaného dávkovacího systému. Stále indikované jsou též epidurální aplikace kortikoidů v kombinaci s místními anestetiky u některých páteřních bolestí. Mezi novější metody v léčbě bolesti v oblasti páteře patří např. blokády facetových kloubů a následné radiofrekvenční (RF) denervace mediálního raménka dorsálního kořene, provokační diskografie s následnou RF léčbou či s manuální dekompresí, bloky dorsal root ganglion a epiduroskopie [23]. Tyto metody patří do rukou zkušených intervenčních algeziologů, popř. radiologů, a jsou prováděny s pomocí zobrazovacích metod (skiaskopie, počítačová tomografie), neurostimulace a ultrazvuku. Užívají se často jako metody diagnostické a následně rovněž terapeutické prostřednictvím aplikace léků (nejčastěji kortikoid s místním anestetikem) či pomocí RF ošetření. Indikacemi jsou zejména velmi časté diskogenní bolesti. Používají se např. intradiskální elektrotermická terapie (IDET), intradiskální RF termokoagulace a bloky ramus communicans zejména v oblasti obratle L2. U jinak neovlivnitelné kořenové bolesti se kromě oblíbené a stále hojně používané periradikulární terapie (PRT) začíná používat epiduroskopie, při níž se mohou rozrušit srůsty a fibrózy v epidurálním prostoru za vizuální kontroly. Využívá se RF nebo laserové rozrušení adhezí, popř. cílené podání léků [23]. K invazivním metodám počítáme i neurodestruktivní a neurolytické metody, k nimž patří chemická neurolýza (pomocí ethylalkoholu, fenolu a 10% NaCl) a neurolýza tepelná (kryoanalgezie, RF neurolýza). Výjimečně se neurodestruktivní metody využívají v oblasti míchy (např. senzorická a chemická RF rizotomie) u jinak neztišitelných nádorových bolestí. Neurochirurgické (operační) metody mají zejména v léčbě CHNNB daleko menší úlohu než v minulosti. Ke stále využívaným přístupům patří dorsal root entry zone (DREZ) termokoagulace u částečné avulze brachiálního plexu a mikrovaskulární dekomprese při indikovaných neuralgiích n. trigeminus. Větší uplatnění naopak získávají stereotaktické analgetické metody v oblasti mozku a mozkových nervů, především u jinak neovlivnitelných neuropatických bolestí, např. v obličejové části.
Neuromodulační analgetické metody
K ovlivnění nejobtížnějších stavů CHB, zejména nenádorové etiologie, se v ČR využívají již déle než patnáct let neuromodulační analgetické metody. K neuromodulačním metodám řadíme dlouhodobé intraspinální aplikace léků pomocí různě sofistikovaných podkožních pumpových systémů, jež se používají zej ména u indikované CHB s převahou nociceptivních bolestí v oblasti dolní bederní páteře (obr. 1). Druhou skupinou neuromodulačních metod jsou tzv. neurostimulační metody, u nichž aplikací jasně definovaného proudu dochází k analgetickému ovlivnění nervových struktur, především u neuropatických bolestí. K nim počítáme stimulace periferního nervu (peripheral nerve stimulation, PNS), stimulace mozkových struktur, buď hlubokých (deep brain stimulation, DBS), nebo korových (cortical stimulation, CS), a stimulaci míchy (spinal cord stimulation, SCS) (obr. 2). Tyto metody vyžadují vysoké náklady, a proto rozhodnutí o jejich použití je prováděno za přísných výběrových kritérií. Mezi neuromodulační metody patří rovněž nedestruktivní pulsní RF metody ovlivňující nervy či nervové pleteně za pomoci speciálních přístrojů [24]. V současné době jsou neuromodulační metody velmi rozšířené a celosvětově počet těchto výkonů narůstá Cílem této léčby je snížení intenzity bolesti, omezení analgetické medikace, zlepšení funkčnosti a kvality života [25]. Do popředí se v posledních letech dostávají i neinvazivní neuromodulační metody.
ména u indikované CHB s převahou nociceptivních bolestí v oblasti dolní bederní páteře (obr. 1). Druhou skupinou neuromodulačních metod jsou tzv. neurostimulační metody, u nichž aplikací jasně definovaného proudu dochází k analgetickému ovlivnění nervových struktur, především u neuropatických bolestí. K nim počítáme stimulace periferního nervu (peripheral nerve stimulation, PNS), stimulace mozkových struktur, buď hlubokých (deep brain stimulation, DBS), nebo korových (cortical stimulation, CS), a stimulaci míchy (spinal cord stimulation, SCS) (obr. 2). Tyto metody vyžadují vysoké náklady, a proto rozhodnutí o jejich použití je prováděno za přísných výběrových kritérií. Mezi neuromodulační metody patří rovněž nedestruktivní pulsní RF metody ovlivňující nervy či nervové pleteně za pomoci speciálních přístrojů [24]. V současné době jsou neuromodulační metody velmi rozšířené a celosvětově počet těchto výkonů narůstá Cílem této léčby je snížení intenzity bolesti, omezení analgetické medikace, zlepšení funkčnosti a kvality života [25]. Do popředí se v posledních letech dostávají i neinvazivní neuromodulační metody.
Neinvazivní neuromodulační metody
Kromě již dlouhodobě používané transkutánní elektrické nervové stimulace (TENS) patří k těmto metodám repetitivní transkraniální magnetická stimulace (rTMS) a transkraniální stimulace stejnosměrným proudem (tDCS) [25]. Me toda rTMS se používá od roku 2000 v léčbě různých neurologických poruch včetně léčby chronických bolestivých stavů. Je založena na použití dvou cívek na kůži v oblasti prefrontální mozkové kůry většinou s opakujícími se pulsy s využitím vysokofrekvenční stimulace kolem 5 Hz na oblast primárního motorického kortexu (M1) kontralaterálně k oblasti bolesti [26]. Užívá se jako testovací metoda pro zavádění korové mozkové stimulace, ale v poslední době nachází využití především v léčbě farmakorezistentní CHB, jako jsou atypické obličejové bolesti, různé typy neuropatických bolestí (např. postherpetická neuralgie a trigeminální neuralgie), bolesti po iktech nebo deaferentační a thalamické bolesti. Metoda tDCS používá systém katody a anody k transkraniální aplikaci stejnosměrného proudu opět se stimulací přímo na povrchu lebky. Analgetické indikace jsou podobné jako u rTMS. V současné době se tyto metody rozšiřují (v zahraničí se již používají i v domácích podmínkách), vznikají nové neinvazivní stimulační přístupy, což dává těmto snadno ovladatelným a relativně levným metodám velkou léčebnou perspektivu [25].
toda rTMS se používá od roku 2000 v léčbě různých neurologických poruch včetně léčby chronických bolestivých stavů. Je založena na použití dvou cívek na kůži v oblasti prefrontální mozkové kůry většinou s opakujícími se pulsy s využitím vysokofrekvenční stimulace kolem 5 Hz na oblast primárního motorického kortexu (M1) kontralaterálně k oblasti bolesti [26]. Užívá se jako testovací metoda pro zavádění korové mozkové stimulace, ale v poslední době nachází využití především v léčbě farmakorezistentní CHB, jako jsou atypické obličejové bolesti, různé typy neuropatických bolestí (např. postherpetická neuralgie a trigeminální neuralgie), bolesti po iktech nebo deaferentační a thalamické bolesti. Metoda tDCS používá systém katody a anody k transkraniální aplikaci stejnosměrného proudu opět se stimulací přímo na povrchu lebky. Analgetické indikace jsou podobné jako u rTMS. V současné době se tyto metody rozšiřují (v zahraničí se již používají i v domácích podmínkách), vznikají nové neinvazivní stimulační přístupy, což dává těmto snadno ovladatelným a relativně levným metodám velkou léčebnou perspektivu [25].
Neurostimulace
Neurostimulace znamená ovlivnění přenosu bolesti stimulací nervových tkání či struktur definovaným elektrickým proudem. Je využívána nízkonapěťová elektrická stimulace nervů, mozku a zvláště dorsálních míšních provazců (SCS), kde se blokuje přenos nervových signálů bolesti do mozku. Používá se u chronických bolestivých stavů nenádorového původu, jen zcela výjimečně se provádí u onkologických diagnóz. Neurostimulační metody v oblasti míchy zaznamenaly i nové technické trendy, rozšiřují se jejich indikace i možnosti použití. Technické novinky se uplatňují hlavně v oblasti stimulačních elektrod, v jejich tvaru, v počtu kontaktů i v jejich miniaturizaci [27]. V případě generátorů se zvyšuje jejich výkon, možnosti dobíjení i schopnosti reagovat na změněné podmínky ke stimulaci; používají se konvenční nízkofrekvenční i novější vysokofrekvenční stimulace. V distribuci jsou k dispozici rovněž generátory, které snímají polohu těla, a tak mohou monitorovat i úroveň stimulace a upravovat její výkyvy závislé na změně polohy elektrody v epidurálním prostoru. Další technickou novinkou u SCS je možnost implantovat systémy, u nichž je povoleno vyšetření magnetickou rezonancí. Konvenční systémy stimulují frekvencí v rozmezí 25–120 Hz. V posledních pěti letech se prosazují i vysokofrekvenční systémy. Je zde vyšší energetické spotřeba, a je tedy nutné pravidelně dobíjet generátor z elektrické sítě. Oproti konvenční SCS jsou stimulační frekvence řádově vyšší (10 kHz), a tím je charakter stimulace zcela změněn [28].
V budoucnosti lze počítat s dalším rozvíjením postupů elektrické stimulace na jiných nervových strukturách. Aktuálně se používají nejvíce analgetické stimulace míšní, méně mozkové, narůstá počet stimulačních výkonů na periferních nervech i v oblasti periradikulární. Díky postupujícímu vývoji miniaturizovaných neurostimulačních systémů je umožněno cílené ovlivnění neuropatických bolestí i u mononeuropatických bolestí malého rozsahu. Generátor je implantován do bezprostřední blízkosti elektrody, např. přímo na postižené končetině. V zahraničí se již používají i malé elektrody sdružené s generátorem v malém systému, který se jednoduše zavádí perkutánním vpichem (all in one). V oblasti navigace elektrody k nervovým strukturám na periferii dochází také k pokrokům – nepoužívají se už pouze rentgenové přístroje, ale i sonografie v kombinaci se stimulačními přístroji ke správnému umístění elektrody k nervové struktuře. Nejčastější indikací k neuromodulační léčbě je nadále failed back surgery syndrome (syndrom přetrvávající bolesti zad, FBSS), dále komplexní regionální bolestivý syndrom zejména I. typu, angina pectoris, ischemická choroba dolních končetin a chronické bolestivé mononeuropatie. Rozšiřuje se použití těchto metod u jinak neztišitelných bolestí hlavy zejména neuropatické etiologie a u viscerálních bolestí [24].
Kontinuální aplikace léků do subarachnoidálního prostoru
Kontinuální aplikace léků, zejména opioidů, do subarachnoidálního (s.a.) prostoru různě sofistikovanými systémy jak zevními, tak zejména podkožně umístěnými je druhou nejpoužívanější neuromodulační analgetickou možností léčby chronických bolestí [29]. Nejčastější indikací k této léčbě je opět FBSS s převahou nociceptivní složky bolesti (axiální bolest). Méně sofistikované (levnější) systémy se používají i v léčbě nádorové bolesti. K aplikaci do s.a. prostoru jsou schváleny pouze tři léky: morfin, zikonotid a baklofen, který se používá v léčbě chronických spastických stavů. Tyto léky se musejí podávat kontinuálně pomocí systému (většinou podkožně umístěná pumpa) s rezervoárem pro lék, který je v určitých intervalech doplňován. Pacient může mít k dispozici ovládací systém pro možnost aplikace léku dle potřeby, tzv. pacientem kontrolovanou analgezii (PCA), jíž si zlepšuje kvalitu analgezie a řeší i případné průlomové bolesti. Problémem je, že stále chybějí léky pro aplikaci do subarachnoidálního prostoru s dlouhodobým (protrahovaným) účinkem. Proto je stále nutné léky podávat opakovaně nebo kontinuálně pomocí nelevných dávkovacích systémů. Požadavky na ideální lék pro s.a. aplikaci jsou dva – prolongovaná nebo permanentní aktivita po jediné aplikaci a cílená a bezpečná lokální aplikace. Byly zkoumány různé možnosti jednorázové aplikace léčebných partikulí do s.a. prostoru pro dosažení protrahovaného účinku, ale zatím bez možnosti klinického použití.
Další vývoj analgetik
Jednou z možností vývoje nových molekulárně selektivních léků se ukazuje být genová terapie. Chronická bolest je velmi heterogenní onemocnění i na podkladě rozdílné molekulární výbavy, a proto existuje vysoká interindividuální variabilita ve farmakokinetických a farmakodynamických vlastnostech použitých analgetik. Výzkumy prokazují, že na základě genetických studií se mohou identifikovat klíčové molekulární markery, a tím je možné dosáhnout kvalitnější individualizace a personalizace léčby CHB [30]. Snahou je nalezení nových generací analgetik i pro využití v tradičních lékových aplikacích. Při vývoji nových sloučenin se hodně využívají napětím ovládané kanály (sodíkové, draslíkové i kalciové). Výsledkem těchto výzkumů bylo i objevení zikonotidu, selektivního blokátoru typu N kalciového kanálu, neurotoxinu z mořského šneka rodu Conus, který se postupně dostal až do první linie používaných léků pro s.a. aplikaci u silné CHB [29]. Zatím pouze na zvířecích modelech se podařilo využít analgetických účinků protizánětlivých cytokinů. Subarachnoidální aplikace rekombinantního interleukinu 10 (IL 10) vedla ke zmírnění neurozánětu a alodynie u modelu neuropatické bolesti. Problémem je zatím vysoká cena, neprůchodnost hematoencefalickou bariérou a pouze krátký (dvouhodinový) biologický poločas v mozkomíšním moku. Jako další možnost se ukazuje využití bolest modulujících neurotransmiterů. Ačkoliv jsou již dlouhodobě klinicky používány dvě třídy GABA ergních léků – baklofen a benzodiazepiny –, novější a více selektivní analgetika využívající GABA ergní dráhu nejsou stále k dispozici ke klinickému využití. Velmi nadějným se jevil jiný neurotransmiter – neurokininový receptor typu 1 (NK1). Avšak studie prokázaly jeho analgetickou neúčinnost u lidí. Největší možnosti vývoje nových analgetik se v budoucnosti očekávají zejména pro potřeby s.a. aplikace (např. použití gabapentinu), v oblasti výzkumu protizánětlivých cytokinů, iontových kanálů a neurotrofického růstového faktoru [31].
Důležitou alternativou ve vývoji nových léků je cílenější farmakologická intervence, protože se ukázalo, že duálně působící léky jsou účinnější než dva léky působící na jediný cíl, mají též lepší bezpečnostní profil, a tedy menší pravděpodobnost farmakologických a farmakokinetických interakcí. Jako perspektivní se zdá duální využití endokanabinoidního a endovaniloidního systému, kde by mohl být analgetický účinek aktivován jak zvýšenou produkcí endogenních endokanabinoidů, tak snížením produkce prozánětlivých prostaglandinů [32].
Závěr
Chronická bolest je velmi složitý proces vyvíjející se v kontextu mnoha faktorů. Její léčba se odvíjí od patofyziologie vzniku a udržování bolesti. Správně léčit CHB znamená nejen rozumět patofyziologii a farmakologii, ale zejména samotnému pacientovi – tzn. navázat s ním vhodný kontakt, vzbudit jeho důvěru a vhodně ho motivovat ke společnému úsilí zmírnit jeho CHB. Nejen úleva od bolesti, ale i zvýšení funkčnosti a zlepšení kvality života jsou měřítkem úspěšnosti analgetické léčby. Základem léčby CHB jsou stále farmakologické přístupy. Avšak v poslední době se zejména díky změněnému (realistickému) pohledu na použití opioidů dostávají do popředí i další metody léčby, zejména intervenční a neuromodulační. V případě tak komplexního syndromu, jakým CHB je, není vhodné ani účinné používat pouze monoterapii, ale je nutné upřednostňovat multidisciplinární a multifaktoriální přístup a současně individualizovat terapii dle potřeb každého jednotlivého nemocného. K tomuto cíli, který míří k zefektivnění a k větší bezpečnosti léčby CHB, by mělo přispět i použití nových léků, jejich kombinací a nových léčebných (analgetických) přístupů a metod.
Seznam použité literatury
- [1] Vrba I. Nové přístupy v léčbě chronických neuropatických bolestí. Remedia 2011; 21: 244–249.
- [2] Kršiak M. Průkazy zlepšení terapie bolesti kombinacemi farmak I. Kombinace s paracetamolem. Bolest 2013; 16: 60–64.
- [3] Kršiak M. Průkazy zlepšení terapie bolesti kombinacemi farmak II. Kombinace bez paracetamolu. Bolest 2013; 16: 107–110.
- [4] Brune K, Patrignani P. New insights into use of currently avaible non‑steroidal anti‑inflammatory drugs. J Pain Res 2015; 8: 105–118.
- [5] Becker WC, Merlin JS, Manhapra A, et al. Management of patients with issues related to opioid safety, efficacy and/or misuse: a case series from integrated, interdisciplinary clinic. Addict Sci Clin Pract 2016; 11: 1–9.
- [6] Kozák J, Lejčko J, Kršiak M, et al. Metodické pokyny pro farmakoterapii bolesti. Bolest 2016; 19 (Supl. 1): 4–28.
- [7] Lejčko J. Chronická bolest, opioidy a závislost – jdeme správným směrem? Bolest 2015; 18: 186–193.
- [8] Fricová J, Hakl M. Možnosti tapentadolu ve farmakoterapii průlomové bolesti u pacientů s nádorovou a chronickou nenádorovou bolestí. Bolest 2015; 18: 194–197.
- [9] Vadivelu N, Kai A, Maslin B, et al. Tapentadol extended release in the management of peripheral diabetic neuropathic pain. Ther Clin Risk Manag 2015; 11: 95–105.
- [10] Vrba I. Fixní kombinace oxykodonu s naloxonem – nový silný opioid s prevencí vzniku zácpy vyvolané opioidy. Remedia 2014; 24: 279–284.
- [11] Hesselbarth S, Löwenstein O, Cegla T. Effects of prolonged‑release oxycodone/naloxone on pain control, bowel function and quality of life: a prospective observational study. Scan J Pain 2014; 5: 75–81.
- [12] Fricová J. Bukální tablety fentanylu v léčbě průlomové bolesti. Bolest 2014; 17: 47–51.
- [13] Hakl M. Novinky v terapii bolesti. Klin Farmakol Farm 2012; 26: 102–105.
- [14] Fricová J. Léčba průlomové bolesti u onkologických pacientů. Bolest 2013; 16: 111–115.
- [15] Bednařík J. Farmakoterapie neuropatické bolesti ve světle medicíny založené na důkazech. Bolest 2014; 17: 41–46.
- [16] Finnerup NB, Attal N, Haroutounian S, et al. Pharmacotherapy for neuropathic pain in adults: a systematic review and meta‑analysis. Lancet Neurol 2015: 162–173.
- [17] Mou J, Paillard F, Turnbul B, et al. Efficacy of Qutenza (capsaicin) 8% patch for neuropathic pain: A meta‑analysis of the Qutenza clinical trils database. Pain 2013; 154: 1632–1639.
- [18] Hakl M, Neudertová H. Neuropatická bolest, její vznik a léčba. Remedia 2015; 25: 265–268.
- [19] Wagner T, Roth‑Daniek A, Sell A, et al. Capsaicin 8% patch for peripheral neuropathic pain: review of treatment best practice from real‑world clinical experience. Pain Manag 2012; 2: 239–250.
- [20] Wagner T, Poole Ch, Roth‑Daniek. The capsaicin 8% patch for neuropathic pain in clinical practice: a retrospective analysis. Pain Med 2013; 14: 1202–1211.
- [21] Baron R, Binder A, Attal N, et al. Neuropathic low back pain in clinical practice. Eur J Pain 2016; 20:
- [22] Dworkin HR, O’Connor AB, Kent J, et al. Interventional management of neuropathic pain: NeuPSIG recommendations. Pain 2013; 154: 2249–2261.
- [23] Rapčan R, Gajdoš M, Griger M, et al. Klinický algoritmus u pacienta pred implantáciou miechového stimulátora. Bolest 2016; 19: 54–59.
- [24] Kozák J, Vrba I, Masopust V, et al. Neuromodulace v léčbě chronické bolesti. In Bolest. Kršiak M, Kozák J, Rokyta R (eds.). Praha: Tigis, 2012; 595–621.
- [25] Rokyta R. Neinvazivní neuromodulační metody v léčbě zejména chronické bolesti. Bolest 2013; 16: 101–106.
- [26] Raja SN, Wallace M. Neurostimulation for neuropathic pain: outcomes a new paradigms. Pain: Clinical updates 2015; 5: 1–8.
- [27] Gharibo Ch, Laux G, Forzani BR, et al. State of the field survey: Spinal cord stimulator use by academic pain medicine practices. Pain Med 2014; 15: 188–195.
- [28] Russo M, Van‑Buyten JP. 10‑kHz‑frequency SCS therapy: A clinical summary. Pain Med 2015; 16: 934–942.
- [29] Vrba I. Ziconotid – nová možnost v subarachnoidální analgetické léčbě, naše zkušenosti. Bolest 2012; 15: 62–73.
- [30] Zorina‑Lichtenwalter K, Melota CB, Khoury S, et al. Genetic predictors of human chronic pain conditions. Review. Neuroscience 2016. http://dx.doi.org/
- [31] Pleticha J, Maus TP, Beutler AS. Future directions in pain management: integrating anatomicallly selective delivery techniques with novel molecularly selective agents. Mayo Clin Proc 2016; 91: 522–533.
- [32] Malek N, Starowicz K. Dual‑acting compounds targeting endocannabinoid and endovanilloid systems – a novel treatment option for chronic pain management. Front Pharmacol 2016; 7: 1–9.