Současné postavení nesteroidních antirevmatik v terapii revmatických onemocnění
Nesteroidní antirevmatika (NSA) jsou využívána moderní medicínou již více než sto let. Osvědčila se a rozšířila zejména díky svému silnému analgetickému účinku, zejména v léčbě akutní bolesti, a díky antiflogistickému efektu. V současné době je k dispozici řada přípravků různého chemického složení s odlišnými farmakokinetickými vlastnostmi, ale se společným mechanismem účinku. NSA byla do objevu imunomodulačních léků a imunosupresiv základem terapie zánětlivých revmatických onemocnění. S rozvojem účinných léčiv, zejména biologické terapie, se spektrum indikací NSA mění. U revmatoidní artritidy nemají NSA žádný vliv na progresi choroby, působí zde jen jako léčba symptomatická. U spondylartritid jsou NSA stále základem léčby a ukazuje se, že mají v této indikaci nejen symptomatický účinek, ale při pravidelném užívání pravděpodobně zpomalují i progresi spondylitidy. V léčbě bolesti u pacientů s osteoartrózou (OA) jsou NSA lékem druhé volby při nedostatečném efektu či kontraindikacích paracetamolu, který je v případě OA analgetikem první volby. NSA jsou nadále doporučována v léčbě krystalových artritid, zejména k terapii akutního dnavého záchvatu a také akutních forem mimokloubního revmatismu, kde lze využít i jejich lokální aplikace. Zejména dlouhodobé systémové podávání NSA může být provázeno řadou závažných nežádoucích účinků, které významně limitují možnosti dlouhodobé terapie NSA. Jedná se zejména o zažívací nežádoucí účinky (žaludeční vředy a jejich komplikace aj.), kardiovaskulární (hypertenze, progrese ICHS) a renální (otoky, renální insuficience aj.). Díky poznatkům prospektivních a postmarketingových studií se jeví potenciální toxicita NSA jako klinicky závažná, zejména u starší populace, jež představuje většinu konzumentů NSA.
Nesteroidní antirevmatika (NSA) tvoří velmi heterogenní skupinu léčiv, která mají v závislosti na dávkování antipyretický, analgetický, antiflogistický a některá i antiagregační účinek. Moderní medicína využívá NSA již více než sto let prakticky ve všech svých oborech, zejména díky jejich silnému analgetickému působení. V léčbě akutní bolesti se NSA řadí na první příčky žebříčku analgetik. Antiflogistický účinek je využíván v léčbě různých zánětlivých onemocnění, zejména pohybového ústrojí. V současné době jsou NSA dostupná v řadě galenických forem perorálních i parenterálních, rektálních či lokálních. NSA patří k nejčastěji předepisovaným lékům, podle některých observačních studií užívá ve vyspělých zemích tyto léky až 30 % starších lidí, okolo 70 % pak udává příležitostné užití NSA alespoň jedenkrát týdně [1].
Z hlediska chemického složení je možné NSA rozdělit na deriváty kyseliny salicylové, kyseliny propionové (ibuprofen, ketoprofen, kyselina tiaprofenová), kyseliny indoloctové (diklofenak, indometacin), oxikamy (piroxikam, meloxikam, lornoxikam) a koxiby. Odlišnou chemickou strukturu má nimesulid, oxaprozin a nabumeton.
Mechanismus účinku
Hl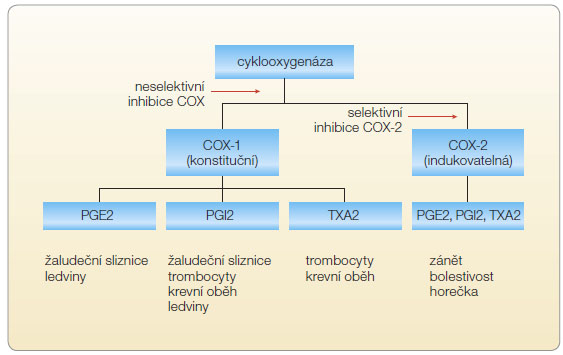 avní mechanismus účinku NSA je i přes chemickou heterogenitu všem přípravkům víceméně společný a spočívá v inhibici izoenzymů cyklooxygenázy (COX-1, COX-2) v různém poměru, s čímž souvisí hlavní terapeutický účinek i výskyt nežádoucích účinků (obr. 1). Z hlediska afinity k cyklooxygenázám lze NSA rozdělit do dvou skupin, na antirevmatika neselektivní, která inhibují oba izoenzymy v různém poměru, a na selektivní či specifické inhibitory COX-2 (koxiby), které inhibují téměř výhradně COX-2 (tab. 1). Dříve uváděná kategorie tzv. preferenčních inhibitorů COX-2 se již neužívá, neboť se neprokázalo, že by jejich bezpečnostní profil byl oproti neselektivním NSA lepší. Klinická účinnost jednotlivých antirevmatik však nekoreluje pouze se schopností inhibovat cyklooxygenázu in vitro. Při jejich antiflogistickém působení se nepochybně uplatňují i další mechanismy, např. inhibice tvorby volných kyslíkových radikálů a stimulace jejich eliminace z místa zánětu, inhibice lyzozomální aktivity neutrofilů aj.
avní mechanismus účinku NSA je i přes chemickou heterogenitu všem přípravkům víceméně společný a spočívá v inhibici izoenzymů cyklooxygenázy (COX-1, COX-2) v různém poměru, s čímž souvisí hlavní terapeutický účinek i výskyt nežádoucích účinků (obr. 1). Z hlediska afinity k cyklooxygenázám lze NSA rozdělit do dvou skupin, na antirevmatika neselektivní, která inhibují oba izoenzymy v různém poměru, a na selektivní či specifické inhibitory COX-2 (koxiby), které inhibují téměř výhradně COX-2 (tab. 1). Dříve uváděná kategorie tzv. preferenčních inhibitorů COX-2 se již neužívá, neboť se neprokázalo, že by jejich bezpečnostní profil byl oproti neselektivním NSA lepší. Klinická účinnost jednotlivých antirevmatik však nekoreluje pouze se schopností inhibovat cyklooxygenázu in vitro. Při jejich antiflogistickém působení se nepochybně uplatňují i další mechanismy, např. inhibice tvorby volných kyslíkových radikálů a stimulace jejich eliminace z místa zánětu, inhibice lyzozomální aktivity neutrofilů aj.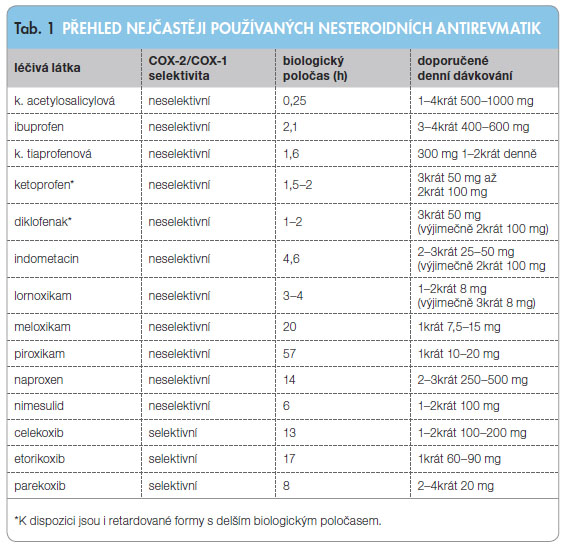
Farmakokinetika
Jednotlivá NSA se liší nejen svou chemickou strukturou, ale i svými farmakokinetickými parametry (rychlost vstřebávání, enterohepatální oběh, biologický poločas aj.). NSA se ze zažívacího traktu vstřebávají dobře, ale většinou relativně pomalu, přičemž přítomnost potravy absorpci léku zpomaluje, ale absolutní množství vstřebané látky nesnižuje. Vstřebávání NSA je možné do jisté míry urychlit chemickou modifikací – jinou solí dané účinné látky (např. draselná sůl diklofenaku se vstřebává rychleji než sůl sodná), vazbou na hostitelskou molekulu (beta-cyklodextrin piroxikam).NSA mají silnou afinitu k plazmatickým bílkovinám a mohou z této vazby některá další léčiva vytěsnit a tak zvyšovat jejich účinnost. Tím je dáno i široké spektrum potenciálních lékových interakcí.Podle biologického poločasu rozlišujeme NSA s krátkým, středně dlouhým a dlouhým biologickým poločasem eliminace (tab. 1). V současné době jsou k dispozici i retardované formy antirevmatik s krátkým biologickým poločasem, např. diklofenaku nebo ibuprofenu, které umožňují podávání v 1–2 denních dávkách.
Nežádoucí účinky
Nežádoucí účinky představují závažný problém zejména dlouhodobé léčby NSA. U neselektivních NSA je hlavním problémem gastrotoxicita, nefrotoxicita a krvácivé projevy. Bezpečnost léčby koxiby je v oblasti zažívacího traktu vyšší, ale ostatní nežádoucí účinky – zvýšené kardiovaskulární riziko, dekompenzace hypertenze, zhoršení srdeční insuficience či bronchiálního astmatu – se popisují při léčbě selektivními i neselektivními NSA. Vzácněji se mohou objevit také kožní alergické exantémy a fotosenzitivita, neurologické obtíže (bolesti hlavy, závratě, únava), hepatotoxicita aj.
Nejčastějším a klinicky nejvýznamnějším nežádoucím účinkem je však gastropatie indukovaná těmito léčivy, tzv. NSA gastropatie. Klinické příznaky NSA gastropatie se vyskytují u více než třetiny pacientů dlouhodobě užívajících NSA, žaludeční vředy bývají zjištěny přibližně u 20 % pacientů s revmatoidní artritidou (RA) nebo osteoartrózou (OA) léčených NSA. Avšak podle endoskopických studií se gastroduodenální eroze vyskytují u 40–60 % pacientů dlouhodobě užívajících NSA [2].
NSA gastropatie vzniká dvojím mechanismem, nejprve přímou iritací žaludeční sliznice při průchodu účinné látky žaludkem, což je pro rozvoj gastropatie méně významné, rozhodující je systémová inhibice protektivních prostaglandinů. Parenterální či rektální aplikace NSA proto bezpečnost léčby významně nezvyšuje, zlepšuje pouze její toleranci ze strany pacienta. Až 80 % žaludečních vředů navíc probíhá asymptomaticky a jejich prvním projevem může být až krvácení do zažívacího traktu nebo jiná komplikace. Enterohepatální oběh může nežádoucí působení NSA ještě prodloužit.
NSA gastropatie postihuje častěji starší, polymorbidní nemocné, riziko dále stoupá při souběžné terapii glukokortikoidy, antikoagulancii a antidepresivy typu selektivních inhibitorů zpětného vychytávání serotoninu, SSRI (fluoxetin). Riziko je dále zvýšeno u osob s vředovou chorobou či s projevy NSA gastropatie v anamnéze. Riziko výskytu NSA gastropatie při podávání neselektivních NSA je snižováno současným podáváním misoprostolu a inhibitorů protonové pumpy [3]. Riziko gastropatie při podávání koxibů je výrazně nižší [4–6].
Neselektivní NSA mohou zvyšovat riziko slizničních erozí a krvácení i v distálnějších partiích zažívacího traktu, výskyt ulcerací v oblasti tenkého střeva byl popsán u více než 8 % léčených NSA [2]. Eroze v dolní části zažívacího traktu mohou být i např. příčinou pozitivity testu na okultní krvácení.
NSA (neselektivní i selektivní inhibitory COX-2) vedou k retenci sodíku a draslíku a ovlivňují mikrocirkulaci v ledvinách, čímž mohou vést k otokům, rozvoji renální insuficience nebo intersticiální nefritidy. Rizikovými faktory vzniku renální insuficience indukované NSA jsou vyšší věk, dehydratace, preexistující onemocnění ledvin, jaterní onemocnění s ascitem, městnavá srdeční slabost, současná léčba diuretiky, inhibitory ACE (angiotenzin konvertující enzym) a antagonisty angiotenzinu I.
Na možné kardiovaskulární nežádoucí účinky NSA upozornila poprvé studie VIGOR s rofekoxibem, která popsala pětinásobný výskyt infarktu myokardu u pacientů léčených rofekoxibem oproti naproxenu [4]. Rofekoxib byl nakonec z tohoto důvodu stažen z trhu. Ukázalo se však, že ke zvýšení kardiovaskulárního rizika vedou v různé míře i neselektivní NSA. Recentní metaanalýza z roku 2011 hodnotila údaje celkem 116 429 pacientů z 31 studií. V porovnání s placebem bylo nejvyšší kardiovaskulární riziko pozorováno u rofekoxibu (relative risk, RR = 2,12) a lumirakoxibu (RR = 2,0). Nejvyšší riziko vzniku cerebrovaskulárních příhod měl ibuprofen (RR = 3,36) a diklofenak (RR = 2,86). Etorikoxib a diklofenak byly asociovány s nejvyšším výskytem úmrtí z kardiovaskulárních příčin (RR = 4,07, resp. 3,98) [7]. Z hlediska kardiovaskulární morbidity je z neselektivních NSA nejbezpečnější zřejmě naproxen, který v dávce 500 mg dvakrát denně inhibuje syntézu tromboxanu podobně jako nízké dávky kyseliny acetylosalicylové. Překvapivé je ale i zjištění, že riziko kardiovaskulárních příhod zvyšuje také pravidelná konzumace paracetamolu [8].
NSA (selektivní i neselektivní) mohou zvyšovat krevní tlak. Na jeho zvýšení se může u pacientů s léčenou hypertenzí podílet i snížení účinku některých antihypertenziv antirevmatikem. V epidemiologických studiích bylo prokázáno, že užívání jakéhokoliv NSA zvyšuje v populaci dvojnásobně počet hospitalizací pro srdeční selhání. Vliv NSA je samozřejmě vyšší u pacientů s preexistujícím srdečním onemocněním [9]. Riziko je závislé na dávce podávaného NSA a je poněkud vyšší během prvního měsíce podávání.
U predisponovaných osob nebo pacientů s chronickou bronchitidou, astmatem a chronickou obstrukční plicní nemocí mohou NSA vyvolat astmatický záchvat nebo zhoršení dušnosti. Dochází k tomu v důsledku zvýšené produkce leukotrienů, na které je ve zvýšené míře metabolizována kyselina arachidonová při inhibici cyklooxygenázy.
Některá NSA mohou mít i hepatotoxické nežádoucí účinky, zvláště u osob s preexistujícím onemocněním jater nebo při souběžném podávání více potenciálně hepatotoxických léků. Zvýšení aktivity jaterních enzymů bylo popsáno např. v souvislosti s podáváním nimesulidu, který je z tohoto důvodu doporučován v současné době jen pro krátkodobou léčbu, nebo diklofenaku.
Kontraindikace léčby NSA
Léčba selektivními i neselektivními NSA je kontraindikována u pacientů s aktivní vředovou chorobou, recidivující vředovou chorobou nebo při jejích závažných komplikacích v anamnéze (krvácení, perforace), u pacientů s akutní srdeční nedostatečností a s těžšími formami městnavé srdeční slabosti, při přecitlivělosti a dále v graviditě ve třetím trimestru (riziko předčasného uzávěru Botalovy dučeje). Koxiby a diklofenak jsou též kontraindikovány u ischemické choroby srdeční a nekontrolované hypertenze.
Lékové interakce NSA
Lékové interakce NSA jsou poměrně časté a mohou být klinicky významné. Gastrotoxicitu zvyšují glukokortikoidy, SSRI, souběžná terapie salicyláty nebo současné podávání dvou různých NSA. Díky své vysoké vazbě na plazmatické bílkoviny vytěsňují NSA z této vazby perorální antikoagulancia a perorální antidiabetika typu derivátů sulfonylurey a zvyšují tak jejich účinnost. NSA mohou dále potencovat nefrotoxicitu cyklosporinu, toxicitu methotrexátu (zejména při vyšších dávkách), fenytoinu, lithia a snižovat účinnost antihypertenziv (diuretika, inhibitory ACE).
Zvláštní problematiku představuje interakce NSA s kyselinou acetylosalicylovou. O většině léčiv ze skupiny NSA platí, že pokud je kyselina acetylosalicylová v antiagregačních dávkách užívána současně s nimi, působí kardioprotektivně. Antiagregační účinek kyseliny acetylosalicylové však inhibuje ibuprofen a naproxen [10]. K eliminaci této interakce je třeba užívat ibuprofen nejpozději 8 hodin před podáním kyseliny acetylosalicylové nebo nejdříve 30 minut po jejím užití, naproxen by měl být podáván až za 2 hodiny po podání kyseliny acetylosalicylové.
NSA v léčbě revmatoidní artritidy
NSA byla po řadu desetiletí spolu s glukokortikoidy jediným prostředkem pro léčbu revmatoidní artritidy. Jejich analgetický i antiflogistický účinek zmírňuje kloubní obtíže, jako je bolest a ztuhlost, nicméně NSA působí u nemocných s RA čistě symptomaticky, nevedou ke snížení celkové zánětlivé aktivity ani ke zpomalení progrese onemocnění. K dosažení antiflogistického účinku je navíc třeba podávat NSA kontinuálně v plných dávkách, což již může být zatíženo závažnými nežádoucími účinky, zvláště u pacientů současně léčených glukokortikoidy. Základem moderní léčby RA jsou podle současných doporučení EULAR (European League Against Rheumatism) [11, 12] tzv. chorobu modifikující léky RA (DMARDs) – syntetické, jako je methotrexát, sulfasalazin, leflunomid, soli zlata, antimalarika aj., nebo biologické, jež se podávají pacientům s intolerancí, kontraindikacemi nebo nedostatečnou účinností syntetických DMARDs.
V současné době jsou NSA indikována jako symptomatická léčba bolesti u aktivní RA, např. na začátku onemocnění nebo při vzplanutí již stabilizované choroby. Po zmírnění obtíží dávky NSA snižujeme a lék vysadíme nebo jej pacienti užívají nepravidelně, jen podle potřeby. Opatrnosti je třeba u pacientů současně léčených glukokortikoidy, v této situaci je třeba zvolit koxib nebo podávat neselektivní NSA současně s inhibitorem protonové pumpy. Polymorbidní pacienti s těžkou RA jsou velmi rizikovou populací z hlediska NSA gastropatie, nicméně v návaznosti na důsledné dodržování doporučení pro prevenci NSA gastropatie v praxi byl v poslední době zaznamenán v různých zemích trend ke snížení výskytu symptomatických vředů a jejich komplikací u pacientů s RA [13].
NSA v léčbě spondylartritid
Odlišné postavení mají NSA v léčbě spondylartritid. U ankylozující spondylitidy (AS) jsou NSA lékem první volby, příznivě působí na ![Graf 1 Vývoj intenzity celkové bolesti u ankylozující spondylitidy během jednoho roku terapie meloxikamem; podle [27] – Dougados, et al., 1999. VAS – vizuální analogová stupnice pro hodnocení bolesti](https://www.remedia.cz/photo-a-29552---.jpg) zánětlivou bolest zad, která pacienty s aktivní chorobou často budí v noci nebo v časných ranních hodinách. Terapie NSA tak snižuje bolest, ztuhlost, usnadňuje cvičení a rehabilitaci a zlepšuje kvalitu života nemocných (graf 1). Ukazuje se však, že kontinuální, dlouhodobá léčba NSA zpomaluje i rentgenovou progresi onemocnění (graf 2) [14]. Je ale třeba důsledně zajistit prevenci NSA gastropatie.
zánětlivou bolest zad, která pacienty s aktivní chorobou často budí v noci nebo v časných ranních hodinách. Terapie NSA tak snižuje bolest, ztuhlost, usnadňuje cvičení a rehabilitaci a zlepšuje kvalitu života nemocných (graf 1). Ukazuje se však, že kontinuální, dlouhodobá léčba NSA zpomaluje i rentgenovou progresi onemocnění (graf 2) [14]. Je ale třeba důsledně zajistit prevenci NSA gastropatie.
![Graf 2 Rentgenová progrese pacientů s AS (skóre mSASSS u podskupiny s přítomnými syndesmofyty a zvýšením CRP) při terapii nízkými a vysokými dávkami NSA; podle [14] – Poddubnyy, et al., 2012. AS – ankylozující spondylitida; CRP – C-reaktivní protein; mSASSS – modified Stoke Ankylosing Spondylitis Spinal Score; NSA – nesteroidní antirevmatika](https://www.remedia.cz/photo-a-29553---.jpg)
Pokud tedy nejsou přítomny kontraindikace, měli by být pacienti s aktivním onemocněním léčeni kontinuálně plnými dávkami NSA [15]. S ohledem na charakter obtíží jsou v této indikaci vhodnější NSA se středně dlouhým nebo dlouhým biologickým poločasem (např. naproxen, meloxikam nebo celekoxib). Při jejich neúčinnosti nebo kontraindikacích je možné u vysoce aktivních forem onemocnění zvážit léčbu biologickou. Léky ze skupiny DMARDs se v případě AS podávají velmi omezeně (sulfasalazin, eventuálně methotrexát), a to pouze u periferních forem; axiální postižení žádný z těchto léků neovlivňuje ani symptomaticky ani morfologicky ve smyslu zpomalení rentgenové progrese.
NSA jsou vhodná i pro část pacientů s psoriatickou artritidou (PsA), kteří trpí monoartikulární nebo oligoartikulární formou onemocnění, kde může monoterapie NSA vést k úlevě od obtíží i ke zklidnění artritidy. U aktivních forem PsA a při polyartikulárním postižení jsou podávány DMARDs (nejčastěji methotrexát, leflunomid nebo sulfasalazin) a při jejich nedostatečném efektu je zvažována biologická léčba [16]. Častým subjektivním steskem pacientů s PsA jsou entezitidy – bolesti úponů šlach vyvolané zánětem v místě inzerce šlachy. Zde mohou pomoci i lokální lékové formy NSA
(masti, gely).
NSA v léčbě systémových autoimunitních onemocnění
Většina systémových autoimunitních onemocnění, mezi něž patří systémový lupus erythematodes, systémová sklerodermie, Sjögrenův syndrom aj., je provázena různými muskuloskeletálními projevy od nespecifických bolestí kloubů přes aktivní záněty kloubů až po rozvoj kloubních deformit. NSA užíváme u pacientů s těmito onemocněními k symptomatické léčbě uvedených příznaků, rozhodující je však v těchto případech podobně jako u RA celková imunosupresivní léčba. Dále lze NSA užít pro léčbu nespecifických obtíží, jako jsou subfebrilie, artralgie, myalgie, únava. NSA jsou rovněž indikována v léčbě serozitid provázejících systémový lupus erythematodes (perikarditidy, pleuritidy) [17]. Většina pacientů se systémovými autoimunitními chorobami je současně léčena i glukokortikoidy, je proto třeba zajistit u všech takto léčených důslednou profylaxi NSA gastropatie.
NSA v léčbě osteoartrózy
Nejča![Graf 3 Diklofenak epolamin vs. placebo u symptomatické gonartrózy (n = 235); podle [28] – Brühlman, et al., 2006. NNT – Number Needed to Treat](https://www.remedia.cz/photo-a-29554---.jpg) stější indikací NSA v revmatologii je osteoartróza (OA), jejímž pravidelným příznakem je bolest. Bolest u OA může mít řadu příčin – zánětlivých i nezánětlivých – a může vycházet z různých kloubních tkání – ze synoviální membrány, ligament, subchondrální kosti, ale i z periartikulárních struktur, jako jsou svalové úpony, burzy aj. NSA jsou velmi účinným prostředkem na tlumení bolesti provázející OA (graf 3), ale jelikož se jedná o chronické onemocnění, vyžadující dlouhodobou léčbu, které postihuje zejména starší populaci, je jejich užívání u pacientů s OA omezeno potenciálními závažnými nežádoucími účinky.
stější indikací NSA v revmatologii je osteoartróza (OA), jejímž pravidelným příznakem je bolest. Bolest u OA může mít řadu příčin – zánětlivých i nezánětlivých – a může vycházet z různých kloubních tkání – ze synoviální membrány, ligament, subchondrální kosti, ale i z periartikulárních struktur, jako jsou svalové úpony, burzy aj. NSA jsou velmi účinným prostředkem na tlumení bolesti provázející OA (graf 3), ale jelikož se jedná o chronické onemocnění, vyžadující dlouhodobou léčbu, které postihuje zejména starší populaci, je jejich užívání u pacientů s OA omezeno potenciálními závažnými nežádoucími účinky.
NSA jsou proto v současné době doporučována u nemocných s OA jako analgetikum druhé volby. Podle evropských doporučení pro léčbu OA kolen, kyčlí a kloubů rukou [18–20] i podle mezinárodních doporučení OARSI (Osteoarthritis Research Society International) [21–23] jsou NSA indikována v léčbě bolesti teprve při neúčinnosti, intoleranci nebo kontraindikacích paracetamolu. Vhodné je jejich podávání rovněž při akutní zánětlivé dekompenzaci OA, kdy svým antiflogistickým efektem převyšují účinek paracetamolu. Léčba NSA by však měla být pacientům s OA podávána po dobu co nejkratší a v co nejnižších dávkách. Při nedostatečném efektu je možné NSA kombinovat s jinými analgetiky (paracetamol, opioidy) a potencovat tak jejich analgetický efekt bez zvýšení rizika nežádoucích účinků. Vyhnout bychom se však měli kombinaci dvou či více NSA, která zvyšuje toxicitu, nikoli však analgetickou účinnost.
V léčbě OA je též diskutována otázka negativního působení NSA na metabolis-
mus chrupavky. Některá NSA, např. indometacin, salicyláty nebo diklofenak, snižují v experimentu syntézu proteoglykanů a kyseliny hyaluronové v chondrocytech. Tento účinek nebyl prokázán u kyseliny tiaprofenové, meloxikamu, nimesulidů a koxibů. Studie hodnotící vliv NSA na chondrocyty jsou v humánní medicíně stále ojedinělé. Ve studii LINK byla pozorována rychlejší progrese gonartrózy u pacientů léčených indometacinem oproti skupině nemocných užívajících kyselinu tiaprofenovou [24].
NSA v léčbě dny a chondrokalcinózy
Nesteroidní antirevmatika se užívají též k léčbě zánětlivých epizod krystalových artropatií (dnavá artritida, pyrofosfátová artropatie), zejména jeji![Graf 4 Počet pacientů s dobrou nebo výbornou odpovědí na léčbu akutního dnavého záchvatu různými nesteroidními antirevmatiky; podle [29] – Cheng, et al., 2004.](https://www.remedia.cz/photo-a-29555---.jpg) ch akutních forem. Nejčastější manifestací dnavé artritidy je akutní dnavý záchvat, při kterém je třeba podat razantní protizánětlivou léčbu. Lékem volby je kolchicin v dávce 1 mg nárazově a dále 500 µg po dvou hodinách do ústupu obtíží nebo manifestace nežádoucích účinků. Účinnou alternativou jsou v této indikaci NSA v plné protizánětlivé dávce (graf 4). Antirevmatikum můžeme první dny podat v maximální dávce, kterou po ústupu záchvatu redukujeme, a lék po odeznění obtíží vysadíme. Lze podat kolchicin i NSA současně. Pacientům s chronickou dnavou artritidou podáváme NSA kontinuálně při respektování kontraindikací léčby [25].Podobně lze podat NSA také u pyrofosfátové artropatie, zejména nemocným s akutní artritidou (tzv. pseudodna), rovněž v plných protizánětlivých dávkách. U chronické pyrofosfátové artropatie podáváme NSA obdobně jako při léčbě OA.
ch akutních forem. Nejčastější manifestací dnavé artritidy je akutní dnavý záchvat, při kterém je třeba podat razantní protizánětlivou léčbu. Lékem volby je kolchicin v dávce 1 mg nárazově a dále 500 µg po dvou hodinách do ústupu obtíží nebo manifestace nežádoucích účinků. Účinnou alternativou jsou v této indikaci NSA v plné protizánětlivé dávce (graf 4). Antirevmatikum můžeme první dny podat v maximální dávce, kterou po ústupu záchvatu redukujeme, a lék po odeznění obtíží vysadíme. Lze podat kolchicin i NSA současně. Pacientům s chronickou dnavou artritidou podáváme NSA kontinuálně při respektování kontraindikací léčby [25].Podobně lze podat NSA také u pyrofosfátové artropatie, zejména nemocným s akutní artritidou (tzv. pseudodna), rovněž v plných protizánětlivých dávkách. U chronické pyrofosfátové artropatie podáváme NSA obdobně jako při léčbě OA.
NSA v léčbě mimokloubního revmatismu
Mimokloubní revmatismus je nepřesně definovaná skupina onemocnění zánětlivého i nezánětlivého původu, která postihují extraartikulární struktury. NSA se osvědčila empiricky např. v léčbě syndromu bolestivého ramene, lze je užít též v případě fibromyalgie. Pro léčbu tendinitid, burzitid a entezitid jsou vhodná i lokální NSA ve formě masti, gelu apod., která teprve při nedostatečném efektu nahradíme léčbou systémovou. Účinnost lokálních NSA byla ověřena u pacientů s chronickou muskuloskeletální bolestí v řadě klinických studií, jejichž metaanalýza (34 studií) prokázala větší úlevu od bolesti v porovnání s placebem [26].
Volba vhodného antirevmatika
Léčba NSA v běžné klinické praxi by měla být velmi uvážlivá, nelze ji chápat jako rutinní léčbu bolesti. Výběr NSA není jednoduchý; ideální či nejvýhodnější antirevmatikum není známo, lze pouze vybrat nejvhodnější antirevmatikum pro určitého pacienta.
Z hlediska účinnosti nejsou mezi jednotlivými léčivy větší rozdíly, analgetický efekt většiny z nich je silný, zejména při akutní bolesti. Pro akutní bolest jsou vhodné formy s rychlým nástupem účinku, jako je např. draselná sůl diklofenaku, dexketoprofen nebo lornoxikam s rychlým nástupem účinku. V případě trvalé a chronické bolesti jsou vhodnější NSA s delším biologickým poločasem, která lze podávat 1–2krát denně, např. meloxikam, retardované formy diklofenaku nebo naproxen. U starších nemocných jsou naopak vhodnější antirevmatika s kratším biologickým poločasem (ibuprofen apod.). Je třeba důsledně respektovat všechny kontraindikace, řádně pacienta poučit o dávkování a možných nežádoucích účincích a při klinických kontrolách aktivně pátrat po jejich projevech.V běžné praxi by lékaři měli předepisovat NSA v co nejnižší dávce a po dobu do nejkratší. Pacienty s anamnézou vředové choroby je vhodné před dlouhodobou léčbou vyšetřit na přítomnost infekce Helicobacter pylori a případnou infekci eradikovat.
Při výběru antirevmatika je nutné uvážit u každého pacienta individuální kardiovaskulární a gastrointestinální riziko. Pacientům s nízkým kardiovaskulárním i gastrointestinálním rizikem můžeme podávat neselektivní NSA, pacienti se středně vysokým gastrointestinálním rizikem by měli dostávat neselektivní NSA v kombinaci s inhibitory protonové pumpy nebo koxiby. Pacienti s vysokým gastrointestinálním rizikem mohou být léčeni koxiby současně s inhibitory protonové pumpy. Pokud však má pacient současně vysoké i kardiovaskulární riziko, podávání NSA není vhodné vůbec a je třeba je nahradit analgetikem s jiným mechanismem účinku.
Závěr
Nesteroidní antirevmatika se v léčbě zánětlivých revmatických onemocnění užívají v posledních letech méně často, a to díky účinnějším prostředkům léčby a dále z důvodu potenciálních závažných nežádoucích účinků. Kvůli svému silnému analgetickému efektu však budou i dále patřit k nejčastěji užívaným analgetikům zejména v léčbě akutní bolesti. Při výběru antirevmatika v praxi je třeba zohlednit nejen indikaci, ale i věk pacienta, přidružená onemocnění, současně užívané léky a individuální gastrointestinální a kardiovaskulární riziko.
Seznam použité literatury
- [1] Singh H, Triadafilopoulos G. Epidemiology of NSA-induced GI complications. J Rheumatol 1999; 26: 18–24.
- [2] Allison MC, Howatson AG, Torrance CJ, et al. Gastrointestinal damage associated with the use of non-steroidal anti-inflammatory drugs. N Engl J Med 1992; 327: 749–754.
- [3] Rostom A, Dube C, Wells GA, et al. Prevention of NSAID-induced gastroduodenal ulcers (Review). Cochrane Database Syst Rev 2002; (4): CD002296.
- [4] Bombardier C, Laine L, Reicin, A et al. Comparison of upper gastrointestinal toxicity of rofecoxib and naproxen in patients with rheumatoid arthritis. VIGOR Study Group. N Engl J Med 2000; 343: 1520–1528.
- [5] Silverstein FE, Faich G, Goldstein JL, et al. Gastrointestinal toxicity with celecoxib vs. non-steroidal anti-inflammatory drugs for osteoarthritis and rheumatoid arthritis; the CLASS study: a randomized controlled trial. Celecoxib long-therm arthritis safety study. JAMA 2000; 284: 1247–1255.
- [6] Schnitzer T, Burmester GR, Mysler E, et al. Comparison of lumiracoxib with naproxen and ibuprofen in the Therapeutic Arthritis Research and Gastrointestinal Event Trial (TARGET), reduction in ulcer complications: randomised controlled trial. Lancet 2004; 364: 665–674.
- [7] Trelle S, Reichenbach S, Wandel S, et al. Cardiovascular safety of non-steroidal anti-inflammatory drugs: network meta-analysis. BMJ 2011; 342: c7086. doi: 10.1136/bmj.c7086.
- [8] Chan AT, Manson JE, Albert CHM, et al. Nonsteroidal Antiinflammatory Drugs, Acetaminophen, and the risk of cardiovascular events. Circulation 2006; 113: 1578–1590.
- [9] Hudson M, Hugues R, Pilote L. Differences in outcomes of patients with congestive heart failure prescribed celecoxib, rofecoxib, or non-steroidal anti-inflammatory drug: population based study. BMJ 2005; 330: 1365–1370.
- [10] Strand V. Are COX-2 inhibitors preferable to non-selective non-steroidal anti-inflammatory drugs in patients with risk of cardiovascular events taking low-dose aspirin? Lancet 2008; 370: 2138–2151.
- [11] Smolen JS, Landewé R, Breedveld FC, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying drugs. Ann Rheum Dis 2010; 69: 964–975.
- [12] Smolen JS, Landewé R, Breedveld FC, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2013 update. Ann Rheum Dis 2013; doi:10.1136/annrheumdis-2013-204573.
- [13] Fries JF, Williams Ca, Bloch DA, et al. Nonsteroidal anti-inflammatory drugs associated gastropathy: incidence and risk factor model. Am J Med 1991: 91: 213–222.
- [14] Poddubnyy D, Rudwaleit M, Haibel H, et al. Effect of non-steroidal anti-inflammatory drugs on radiographic spinal progression in patients with axial spondyloarthritis: results from the German Spondyloarthritis Inception Cohort. Ann Rheum Dis 2012; 71: 1616–1622.
- [15] Pavelka K. Doporučení České revmatologické společnosti pro léčbu ankylozující spondylitidy. Čes Revmatol 2012; 20: 4–11.
- [16] Štolfa J, Vencovský J, Pavelka K. Doporučení České revmatologické společnosti pro léčbu psoriatické artritidy. Čes Revmatol 2012; 20: 13–16.
- [17] Horák P, Tegzová D, Závada J, et al. Doporučení ČRS pro léčbu nemocných se SLE. Čes Revmatol 2013; 21: 110–122.
- [18] Jordan KM, Arden NK, Doherty M, et al. EULAR recommendations 2003: an evidence based approach to the management of the knee osteoarthritis: Report of a task force of the Standing Comittee for International Clinical Studies Including Therapeutic Trials (ESCISIT). Ann Rheum Dis 2003; 62: 1145–1155.
- [19] Zhang W, Doherty M, Arden N, et al. EULAR evidence based recommendations for the management of hip osteoarthritis: report of a task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis 2005; 64: 669–681.
- [20] Zhang W, Doherty M, Leeb BF, et al. EULAR evidence based recommendations for the management of hand osteoarthritis: report of a task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis 2007; 66: 377–388.
- [21] Zhang W, Moskowitz RW, Nuki G, et al. OARSI recommendations for the management of hip and knee osteoarthritis, part I: critical appraisal of existing treatment guidelines and systematic review of current research evidence. Osteoarthritis Cartilage 2007; 15: 981–1000.
- [22] Zhang W, Moskowitz RW, Nuki G, et al. OARSI recommendations for the management of hip and knee osteoarthritis, Part II: OARSI evidence-based, expert consensus guidelines. Osteoarthritis Cartilage 2008; 16: 137–162.
- [23] Zhang W, Moskowitz RW, Nuki G, et al. OARSI recommendations for the management of hip and knee osteoarthritis: part III: Changes in evidence following systematic cumulative update of research published through January 2009. Osteoarthritis Cartilage 2010; 18: 476–499.
- [24] Huskisson EC, Berry H, Gishen P, et al. Effects of antiinflammatory drugs on the progression of osteoarthritis of the knee. LINK Study Group. Longitudinal Investigation of Nonsteroidal Antiinflammatory Drugs in Knee Osteoarthritis. J Rheumatol 1995; 22: 1941–1946.
- [25] Zhang W, Roberty M, Bardin T, et al. EULAR evidence based recommendations for gout. Part II: Management. Report of a task force of the EULAR Standing Committee For International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis 2006; 65: 1312–1324.
- [26] Derry S, Moore RA, Rabbie R. Topical NSAIDs for chronic musculoskeletal pain in adults. Cochrane Database Syst Rev 2012; 9: CD007400. doi: 002/14651858. CD007400. pub2.
- [27] Dougados M, Guaguan A, Nakache JP, et al. What is the optimum duration of a clinical trial? A one year versus 6 weeks non-steroidal anti-inflammatory drug trial. Rheumatology 1999; 38: 235–244.
- [28] Brühlman P, de Vathaire F, Dreiser RL, Michel BA. Short-term treatment with topical diclofenac epolamine plaster in patients with symptomatic knee osteoarthritis: pooled analysis of two randomised clinical studies. Curr Med Res Opin 2006; 22: 2429–2438.
- [29] Cheng TT, Lai HM, Chiu CK, Chem YC. A single-blind, randomized, controlled trial to assess the efficacy and tolerability of rofecoxib, diclofenac sodium, and meloxicam in patients with acute gouty arthritis. Clin Ther 2004; 26: 399–406.