Současný stav a novinky v léčbě psoriatické artritidy
Psoriatická artritida je mnohotvárné zánětlivé onemocnění charakterizované zánětem periferních kloubů, entezí, axiálního skeletu, kůže, nehtů a daktylitidami. Tradiční léčba tzv. chorobu modifikujícími léčivy zahrnuje sulfasalazin, methotrexát, leflunomid a cyklosporin A. Tato léčiva jsou sice schopna výrazně potlačit synovialitidu, nikoliv však ostatní tkáňové manifestace, jako jsou entezitida, daktylitida nebo axiální postižení. Ovlivnění rentgenové progrese je nejisté, rovněž postižení kůže je ovlivnitelné jen částečně, postižení nehtů pak vůbec ne.
Biologická léčba intervenuje humorální, respektive celulární komponenty imunitního systému, které se podílejí na imunopatogenezi onemocnění. Zahrnuje především léčbu anticytokinovou zaměřenou na tumor nekrotizující faktor alfa (infliximab, adalimumab, etanercept, golimumab, certolizumab), na interleukiny IL-12/23 (ustekinumab, briakinumab) a IL-17 (secukinumab, ixekizumab) a léčbu zaměřenou na blokádu kostimulačních molekul (alefacept, abatacept). Nově pak je biologická léčba zaměřena na inhibici vybraných signálních molekul, jako je orální inhibitor signální molekuly JAK3 (tofacitinib), a na inhibici fosfodiesterázy 4 (apremilast). Poslední vývoj je nesen snahou působit na kloubní destrukce selektivní inhibicí osteoklastogeneze denosumabem, plně humánní monoklonální protilátkou, která se váže na ligand RANKL (Receptor Activator of Nuclear factor κB ligand) a tím ho inhibuje. Biologická léčiva jsou v různé míře schopna příznivě ovlivnit, na rozdíl od „tradičních“ přípravků, i ostatní tkáňové manifestace psoriatické nemoci.
Úvod
Léčba psoriatické artritidy (PsA) se tradičně odvozuje od léčby revmatoidní artritidy (RA). Klinické studie s novými farmaky jsou zpravidla prováděny u RA, a pokud je dosaženo žádaného efektu, rozšíří se zkoušení těchto léčiv i na PsA. Dnes lze ale považovat za prokázané, že PsA není pouhou kombinací artritidy a psoriázy, ale že jde o svébytné on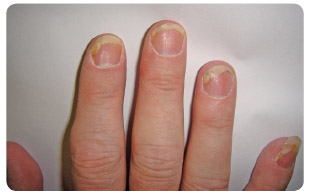 emocnění s poněkud odlišnou imunopatogenezí, klinickou symptomatologií i odpovědí na léčbu.
emocnění s poněkud odlišnou imunopatogenezí, klinickou symptomatologií i odpovědí na léčbu.
Hlavním klinickým problémem PsA jsou vícečetné tkáňové manifestace, kdy kromě postižení kloubní synovialis (synovialitida) mohou být zánětem postiženy i další tkáně, typicky úpony (entezitida), měkké tkáně celého prstu – kloubní synovialis, šlachová pochva flexoru a podkoží prstu (daktylitida), axiální skelet (spondylitida, sakroiliitida) a samozřejmě kůže (psoriáza) se specifickým postižením nehtů (psoriatická onychodystrofie), viz obr. 1. Lytické změny patrné z rentgenového snímku ukazuje obr. 2. Samostatnou problematiku představují tzv. komorbidity asociované s PsA; v současné době je to zejména hojně diskutovaný metabolický syndrom.
Od farmakote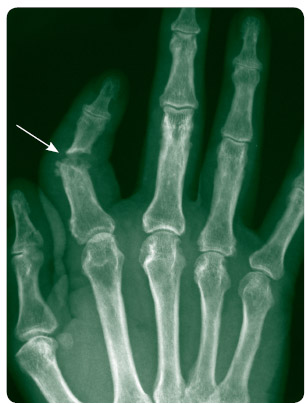 rapie PsA tedy očekáváme nejen ovlivnění kloubního syndromu (včetně zástavy nebo alespoň zpomalení vývoje kostních destrukcí), ale i příznivé ovlivnění entezitid, daktylitid, axiálního postižení a současně i kůže a nehtů. Otevřenou, byť dosud ne zcela objasněnou problematiku představuje ovlivnění komorbidit.
rapie PsA tedy očekáváme nejen ovlivnění kloubního syndromu (včetně zástavy nebo alespoň zpomalení vývoje kostních destrukcí), ale i příznivé ovlivnění entezitid, daktylitid, axiálního postižení a současně i kůže a nehtů. Otevřenou, byť dosud ne zcela objasněnou problematiku představuje ovlivnění komorbidit.
Farmakoterapii PsA lze rozdělit na tzv. tradiční léčbu a v poslední době rychle se rozvíjející biologickou léčbu, která intervenuje humorální, resp. celulární komponenty imunitního systému podílející se na imunopatogenezi onemocnění. Hlavním problémem „tradiční“ léčby je skutečnost, že tyto přípravky sice dokážou výrazně potlačit synovialitidu, nikoliv však ostatní tkáňové manifestace, jako jsou entezitida, daktylitida nebo axiální postižení. Rovněž postižení kůže je jen zčásti ovlivnitelné; postižení nehtů pak nelze ovlivnit vůbec.
Tradiční léčba PsA
Tradiční léčebné možnosti u PsA představují nesteroidní antiflogistika, chorobu modifikující léky a glukokortikoidy.Nesteroidní antiflogistika
Nesteroidní antiflogistika (NSA) jsou základem léčby všech forem PsA, i když přímé doklady jejich účinnosti u pacientů s tímto onemocněním chybějí. Jejich použití v léčbě PsA je založeno na studiích u RA, ankylozující spondylitidy a na klinické zkušenosti. NSA pozitivně ovlivňují počet bolestivých i oteklých kloubů a skóre bolesti, nejsou ale schopna dlouhodobě příznivě působit na vývoj onemocnění. Teoreticky mohou zhoršovat kožní syndrom (přesměrováním metabolismu kyseliny arachidonové směrem k leukotrienům), nicméně v praxi nebyla zvláštní kožní toxicita potvrzena [1].NSA by mělo být v období aktivity onemocnění podáváno v plné dávce odpovídající příslušnému přípravku. Pokud není dosaženo požadovaného efektu během 3–4 týdnů, měl by být vyzkoušen jiný přípravek, než bude tato skupina léčiv označena za neúčinnou. Po odeznění aktivity je možno pokračovat s podáváním NSA dle potřeby. Koxiby jsou v této indikaci stejně účinné jako neselektivní NSA. Tato léčba spolu s příležitostnou intraartikulární aplikací glukokortikoidu může být dostačující u lehkých, nedestruktivních forem onemocnění. Není nezbytné podávat NSA paušálně všem pacientům; v některých případech lze vystačit s prostými analgetiky a někteří pacienti nevyžadují žádnou symptomatickou terapii.
Chorobu modifikující léky
Chorobu modifikující léky (DMARDs, disease modifying antirheumatic drugs) se indikují při neúspěchu léčby NSA. Existuje jen velmi málo dvojitě slepých studií kontrolovaných placebem s DMARDs podávanými v terapii PsA, a pokud byla tato sledování provedena, zahrnula jen poměrně malý počet pacientů a statistická významnost proti placebu byla v těchto studiích spíše hraniční. Do této skupiny léčiv patří sulfasalazin, methotrexát, leflunomid a cyklosporin. Žádné z uvedených farmak ale neprokázalo schopnost zpomalit, nebo dokonce zastavit rentgenovou progresi. Podobně nebyla prokázána schopnost těchto léčiv ovlivnit daktylitidy, entezitidy či axiální syndrom. U všech je třeba zohlednit jejich toxicitu.
Příznivá odpověď na léčbu sulfasalazinem byla prokázána ve dvojitě slepých studiích a byla vyjádřena výrazněji u polyartikulárních forem. I když ve studiích byla signifikantní odpověď obsažena v kompozitním skóre (Psoriatic Arthritis Response Criteria, PsARC), jediným parametrem tohoto kompozitního indexu, který takto odpověděl, bylo globální hodnocení pacientem, což naznačuje, že účinnost není příliš velká. Kožní syndrom nereagoval na léčbu vůbec [2–4].
Dávkování sulfasalazinu je stejné jako u revmatoidní artritidy, tj. 2–3 g denně podávané ve dvou denních dávkách. Dávka se titruje od 1 tbl. (500 mg) denně a po týdnu se zvyšuje o další 1 tbl., až je dosaženo uvedené účinné dávky. Klinickou odpověď lze očekávat u 40–50 % pacientů s periferní formou PsA po 6–8 týdnech léčby. Hlavním problémem léčby sulfasalazinem je gastrointestinální intolerance, je potřeba sledovat jaterní testy a krevní obraz (riziko zejména granulocytopenie).
Účinnost methotrexátu (MTX) podávaného perorálně v obvyklých (nízkých) dávkách nebyla jednoznačně prokázána v jediné dvojitě slepé studii kontrolované placebem [5]; v jedné retrospektivní studii [6] však byla odpověď kloubního i kožního syndromu velmi dobrá. Ani poslední, multicentrická, kontrolovaná, randomizovaná studie, uskutečněná ve Velké Británii v letech 2009–2010, nepřinesla přesvědčivé výsledky [7]. Přesto je v současné době MTX zlatým standardem v léčbě PsA a u velké části pacientů tato léčba umožňuje dostatečně kontrolovat aktivitu onemocnění.
Dávkování MTX začíná startovací dávkou, která zpravidla představuje 10 mg podávaných jeden den v týdnu a postupně stoupá dle odpovědi až na 20–25 mg podávaných jeden den v týdnu. Podle některých zdrojů činí minimální účinná dávka 15 mg/týden [8]. Podává se spolu s kyselinou listovou (acidum follicum) v dávce 10 mg týdně užité zpravidla 1–2 dny po podání MTX. Léčba ovlivňuje periferní kloubní syndrom, příznivě působí i na kožní syndrom. Pro účinnost u daktylitid, entezitid a u axiálního syndromu nejsou dostatečné důkazy, podobně jako pro ovlivnění rentgenové progrese. Jediná dvouletá, retrospektivní studie, která srovnávala rentgenovou progresi u pacientů s PsA léčených MTX a bez MTX, neprokázala žádný rozdíl v rentgenové progresi mezi oběma skupinami [9].
Během léčby MTX je nezbytné pravidelné sledování laboratorních hodnot jaterních testů, krevního obrazu a renální funkce. Zvláštní pozornost zaslouží hepatotoxicita tohoto léčiva. I když přímé důkazy chybějí, zdá se, že pacienti s psoriázou mají zvýšený hepatotoxický potenciál. To se v současné době vysvětluje zvýšeným sklonem pacientů s psoriázou k obezitě a k nealkoholické jaterní steatóze v rámci komorbidit. Podílet se může i zvýšená konzumace alkoholu.
Cyklosporin rychle a významně zmírňuje kožní psoriatické léze. U periferního kloubního syndromu nebyl jeho efekt soustavně sledován, k dispozici jsou jen relativně malé otevřené studie, ve kterých bylo prokázáno určité zlepšení. Přidání cyklosporinu k MTX vedlo k signifikantnímu poklesu počtu oteklých a bolestivých kloubů, k poklesu CRP (C-reaktivní protein), zlepšení hodnot PASI (Psoriasis Area and Severity Index) a ultrazvukového skóre, ale statisticky významného rozdílu mezi monoterapií MTX a léčbou kombinací bylo dosaženo pouze ve skupině s kombinovanou léčbou. Léčba cyklosporinem je zatížena závažnými nežádoucími účinky (hypertenze, renální insuficience), detrakcí, a její přerušení či ukončení může vést ke zhoršení kožního syndromu ( tzv. rebound fenomén).
Relativně novým přípravkem pro léčbu psoriázy a PsA je leflunomid, jehož účinnost byla prokázána u periferní formy PsA ve dvojitě slepé studii kontrolované placebem [10]. Je zpravidla ordinován jako lék druhé volby tam, kde pacient neodpověděl na léčbu MTX nebo bylo podávání MTX spojeno s nežádoucími účinky. Příznivě ovlivňuje i kožní syndrom. V průběhu léčby je třeba (podobně jako u MTX) sledovat jaterní testy, krevní obraz a krevní tlak. Dávkování je stejně jako u RA 20 mg denně.
U PsA s výrazným kožním syndromem je žádoucí ovlivnit farmakoterapií oba syndromy – kloubní i kožní. Mezi léčiva, která jsou schopna současně příznivě ovlivnit oba syndromy, patří MTX, cyklosporin a leflunomid.
Glukokortikoidy
Glukokortikoidy (GK) v lokálním podání intraartikulárně, do šlachových pochev nebo k bolestivým entezím jsou u PsA plně indikovány, u oligoartikulárních forem PsA mohou být spolu s NSA jedinými léčivy, která dostačují pro kontrolu aktivity lehčích forem onemocnění.
Systémové podávání GK je spojeno s rizikem vzplanutí kožního syndromu při pokusu o jejich detrakci, i když pro to není opora v klinických studiích. Současně chybějí jednoznačné doklady o dlouhodobé účinnosti GK u PsA. Podle současného názoru expertů by měly být GK užity se zvláštní opatrností zejména u pacientů s těžkou nebo rozsáhlou psoriázou anebo u těch, kteří nejsou současně léčeni DMARDs [11].
Biologická léčba PsA
Neúčinnost DMARDs u části pacientů s PsA a nepřesvědčivé výsledky studií sledujících radiologickou progresi urychlily snahu o vývoj nových, účinnějších léčiv s cílem ovlivnit nejen klinickou aktivitu, ale i radiologickou progresi. Vývoj těchto nových léčiv vychází ze znalostí klíčové role T lymfocytů a cytokinů produkovaných aktivovanými imunokompetentními buňkami v patogenezi PsA. Mezi nejvýznamnější cytokiny patří tumor nekrotizující faktor alfa (TNFα, tumor necrosis factor α) a nově i interleukiny (IL) 12, 23, 17 a 22. Tyto poznatky vedly k vývoji látek specificky zaměřených na neutralizaci těchto cytokinů, v prvé řadě TNFα. Léčba těmito přípravky se ukázala být vysoce účinná u RA rezistentní na léčbu standardními DMARDs, a to při sledování prakticky všech dostupných parametrů.
Zájem o tuto léčbu právě u spondylartritid byl podnícen průkazem přítomnosti TNFα a nově i IL-17 nejen v psoria-
tických kožních lézích, ale i v synovialis kloubu postiženého artritidou a zejména v místě zánětlivě změněných úponů šlach a kloubního pouzdra do kosti (entezitida) [12]. Právě entezitida je v současné době pokládána za primární zánětlivou afekci v patogenezi jak periferních artritid, tak sakroiliitidy a spondylitidy u spondylartritid. Léčba zaměřená proti TNFα, respektive proti IL-17, by tedy měla příznivě ovlivnit jak periferní kloubní, tak axiální syndrom u spondylartritid, což se nepodařilo při podávání žádného z tradičních DMARDs. Tento předpoklad byl později potvrzen v řadě otevřených i randomizovaných studií kontrolovaných placebem.
Jiný přístup k biologické léčbě představuje snaha ovlivnit aktivaci T buněk na úrovni kostimulačních molekul. Zcela nově se testují tzv. malé molekuly k perorálnímu použití. Jde o inhibitor signální molekuly JAK3 (Janusova kináza) tofacitinib a inhibitor fosfodiesterázy 4 apremilast. Další cestou je snaha o ovlivnění destruktivního vývoje inhibicí osteoklastogeneze (inhibitory RANKL).
Inhibitory TNFα
V současné době je nejvíce zkušeností s anticytokinovou léčbou zaměřenou proti TNFα: s infliximabem, etanerceptem, adalimumabem a nově s golimumabem. Tyto preparáty jsou v ČR registrovány i kategorizovány. Před registrací je certolizumab. Všechny tyto látky vykazují intenzivní protizánětlivý účinek tím, že vážou a inaktivují volný, respektive vázaný TNFα [13]. V současné době není dostatek důkazů pro potenciaci účinku anti-TNFα
methotrexátem (na rozdíl od RA). Ve studii srovnávající účinek inhibitorů TNFα (etanerceptu, infliximabu a adalimumabu) v monoterapii a v kombinaci s MTX byl statisticky významný rozdíl pouze v globálním hodnocení aktivity onemocnění lékařem. Přežívání pacientů „na léčbě“ se statisticky významně lišilo pouze u infliximabu (delší přežívání ve skupině, která dostávala léčbu kombinovanou s MTX), u adalimumabu byl zaznamenán trend k delšímu přežívání, u etanerceptu bylo přežívání „na léčbě“ stejné v obou skupinách [14].
Společnou vlastností těchto farmak je schopnost příznivě ovlivnit i ty klinické parametry PsA, které nereagují na tradiční léčbu. Jde zejména o ovlivnění entezitid, daktylitid, axiálního syndromu a kromě kožního syndromu i psoriatického postižení nehtů. Hlavním přínosem těchto farmak je (na rozdíl od „tradičních“) zpomalení, nebo i zastavení rentgenové progrese. Limitaci biologické léčby představuje zvýšený sklon k infekcím, zejména intracelulárním, alergické reakce a v neposlední řadě i cena terapie.
Infliximab
Infliximab je chimérická monoklonální protilátka proti TNFα. Molekula infliximabu je tvořena ze 75 % humánní a z 25 % myší komponentou (variabilní část imunoglobulinové molekuly – Fab, antigen binding fragment). Vytváří vazbu jak na solubilní, tak na transmembránovou formu TNFα v pikomolárních koncentracích. Tento komplex váže komplement a vede k lýze buňky [15]. Infliximab (na rozdíl od etanerceptu) neváže TNFβ (lymfotoxin). Eliminační poločas infliximabu je přibližně 10 dnů. Podává se v nitrožilních infuzích v dávce 3–5 mg/kg hmotnosti v šesti- až osmitýdenních intervalech. Na úvod léčby se podávají tyto infuze v týdnech 0, 2 a 6. Kombinace s MTX je vhodná vzhledem k omezení tvorby antichimérických protilátek (HACA, human anti-chimeric antibodies).
Etanercept
Etanercept je solubilní dimerický fúzovaný protein, který sestává ze dvou extracelulárních částí humánního receptoru pro TNFα – p75 a konstantní části humánního imunoglobulinu IgG1.Po parenterálním podání váže volný TNFα, tím blokuje jeho interakci s membránovým receptorem a oslabuje tak jeho prozánětlivý efekt. Komplex TNFα s etanerceptem neváže komplement; nevede proto k lýze buňky [15]. Eliminační poločas etanerceptu je přibližně 4 dny. Pacientům s PsA se podává v subkutánních injekcích v dávce 50 mg 1krát týdně nebo 25 mg 2krát týdně.
Adalimumab
Adalimumab je rekombinantní humánní monoklonální protilátka IgG1 specifická proti TNFα. Váže se na TNFα s vysokou afinitou a specifitou a tím neutralizuje biologickou funkci solubilního i membránově vázaného TNFα blokádou interakce s oběma buněčnými receptory p55 a p75. Nevytváří vazbu na TNFβ (lymfotoxin) [16]. Eliminační poločas adalimumabu je přibližně 14 dnů.Podává se v subkutánních injekcích v dávce 40 mg jedenkrát za dva týdny. Podobně jako etanercept jej lze podávat samostatně, bez MTX, ale kombinované podávání může v některých případech potencovat jeho účinnost [15].
Golimumab
Golimumab je plně humánní monoklonální protilátka proti TNFα. Váže se jak na solubilní, tak na transmembránovou formu TNFα, váže komplement a vede k lýze buňky [15]. Eliminační poločas golimumabu je 14 dnů. Podává se subkutánně 1krát měsíčně v dávce 50 mg, u pacientů s hmotností nad 100 kg v dávce 100 mg. Studie fáze III ukázala přetrvávající zlepšení všech sledovaných parametrů včetně kvality života, produktivity a rentgenové progrese [17, 18]. Extenze je plánována na dobu pěti let.
Certolizumab
Certolizumab je PEGylovaný Fab fragment monoklonální protilátky proti TNFα. Váže se na TNFα a zabraňuje tak jeho vazbě na membránový receptor. Protože neobsahuje Fc oblast protilátky, neváže komplement ani nenavozuje protilátkami zprostředkovanou cytotoxicitu in vitro. Eliminační poločas certolizumabu je 14 dnů. Jeho účinnost je podobná jako u infliximabu a adalimumabu. Schválenou indikací tohoto léčiva je RA a Crohnova choroba [19].
V současné době probíhá u PsA klinická multicentrická mezinárodní dvojitě slepá studie plánovaná na 158 týdnů. K dispozici jsou výsledky z 24. týdne, kdy skončila placebová fáze. Účinnost hodnocená jako odpověď dle Americké revmatologické společnosti ACR20, 50 a 70 byla 58 %; 3 %, respektive 2 % proti placebu (24 %; 1 %, resp. 3 %). Výsledky nebyly ovlivněny předchozí léčbou anti-TNFα (cca 20 % pacientů). To činí z certolizumabu vhodnou alternativu biologické léčby po selhání jiného inhibitoru TNFα [20].
Ustekinumab
Ustekinumab je antagonista IL-12/23. Jde o monoklonální, plně humánní protilátku proti společné podjednotce (p40) IL-12/23, která zabraňuje jejich vazbě na příslušné receptory. Kvůli této vazbě nedojde k navázání cytokinů na povrchové buněčné receptory Th lymfocytů, čímž je blokována aktivace T lymfocytů a následně jejich diferenciace v podtypy Th1, respektive Th17. Eliminační poločas ustekinumabu je kolem 20 dnů, klinický efekt ve studiích ale přetrvává déle.
Ustekinumab je schválen pro léčbu psoriázy v USA (FDA, Food and Drug Administration) i v Evropě (EMA, European Medicines Agency). Podává se subkutánně v dávce 45 mg v týdnu 0, pak po 4 týdnech a dále po 12 týdnech. Je účinný v léčbě psoriázy [21]. Ve studii ACCEPT porovnávající účinnost etanerceptu v dávce 50 mg 2krát týdně s ustekinumabem v dávce 45 mg, respektive 90 mg s.c. 1krát týdně dosáhlo zmírnění kožního syndromu hodnocené dle PASI-75 signifikantně více pacientů léčených ustekinumabem podávaným v obou dávkách.
U PsA byla jeho účinnost prokázána ve dvojitě slepých studiích fáze III kontrolovaných placebem (PSUMMIT I a II). Kromě příznivého účinku na kloubní syndrom, který byl srovnatelný s inhibicí TNFα, prokázal vysokou účinnost i v ovlivnění entezitidy a daktylitidy. Jeho účinnost nebyla ovlivněna komedikací MTX a zůstala zachována i u pacientů, u nichž selhala léčba až dvěma inhibitory TNFα [18, 22]. Ustekinumab, samostatně nebo v kombinaci s MTX, je v České republice nově schválen také pro léčbu PsA u dospělých pacientů, u nichž odpověď na předchozí léčbu DMARDs nebyla dostatečná. Doporučené dávkování v této indikaci je 45 mg v počáteční dávce, podaných subkutánně, poté v dávce 45 mg za 4 týdny a dále pak každých 12 týdnů.
Briakinumab
Briakinumab je jiným antagonistou IL-12/23 produkovaným jinou technologií. Jde o rekombinantní, plně humánní IgG1 monoklonální protilátku proti společné podjednotce p40 těchto interleukinů. Váže se na solubilní formu IL-12 a IL-23 s následným snížením sekrece IL-12, IL-6, interferonu gama (IFNγ) a TNFα. Briakinumab byl dosud zkoušen ve studiích fáze I a II u pacientů s psoriázou v různých dávkovacích schématech. Odpověď dle PASI-75 se pohybovala mezi 63 % a 93 % ve srovnání s placebem (odpověď 3 %). Z hlediska nežádoucích účinků se briakinumab podstatně nelišil od jiných biologických léků, vyskytly se především lokální alergické reakce a infekce [23]. Žádost, aby FDA a EMA schválily zavedení briakinumabu na trh, byla pozastavena vzhledem k nejasnostem o bezpečnosti přípravku
Inhibitory interleukinu 17
V současné době jsou v klinickém zkoušení dva přímé inhibitory IL-l7: secukinumab a ixekizumab a dále inhibitor receptoru pro IL-17 brodalumab [24]. Secukinumab je plně humánní protilátka IgG1, ixekizumab je humanizovaná protilátka IgG4, brodalumab je plně humánní monoklonální protilátka IgG4 proti receptoru pro IL-17 (IL-17RA). Obecně lze říct, že uvedené inhibitory IL-17 jeví vysokou účinnost u pacientů s psoriázou s odpovědí dosahující dle PASI-75 přibližně 80 %. Pilotní studie se secukinumabem v intravenózním podání u pacientů s PsA ukázala trend ke zlepšení ve skupině léčené secukinumabem ve srovnání s placebem dle ACR v 6. týdnu sledování [9].
V současné době probíhají randomizované studie fáze III kontrolované placebem, ve studii se secukinumabem je zařazena i větev s pacienty, kteří neodpověděli na léčbu anti-TNFα, ve studii s ixekizumabem se v jedné větvi srovnává ixekizumab s adalimumabem.
Inhibitor interleukinu 6
Inhibitor IL-6 je humanizovaná monoklonální protilátka, která váže volný IL-6 a solubilní komplex. V současné době probíhá dvojitě slepá randomizovaná dávková multicentrická studie fáze IIb kontrolovaná placebem. Ve studii se látka aplikuje subkutánně po čtyřech týdnech (nepublikovaná data).
Abatacept(fúzovaná molekula CTLA4-Ig)
Abatacept je blokátor kostimulačních molekul, blokuje interakci CD80/86 s CD28 (kostimulační signál). Za fyziologických okolností blokuje tuto kostimulaci přirozený CTLA-4 (Cytotoxic T-Lymphocyte Antigen 4), označovaný také jako CD152, přítomný na povrchu T lymfocytů. Abatacept je fúzní protein připravený rekombinantní technologií, který je složen z extracelulární části lidského CTLA-4 a fragmentu Fc domény lidského IgG1.
Je registrovaný i kategorizovaný u RA. V humánních studiích zmírňuje projevy psoriázy o více než padesát procent. Pilotní studie u pacientů s psoriázou prokázala dobrý účinek abataceptu [25]. Studie fáze II prokázala účinnost abataceptu u periferní formy PsA, i když poněkud nižší, než je účinnost inhibitorů TNFα (odpověď dle ACR20 dle dávky přítomna u 33–42 % pacientů vs. placebo s odpovědí u 19 % pacientů). Odpověď byla lepší u těch pacientů, kteří předtím nebyli léčeni inhibitory TNFα (56 %). Klinická odpověď byla doprovázena i zlepšením skóre MRI (magnetic resonance imaging). Zmírnění kožních projevů bylo méně výrazné než u projevů kloubních. V této studii se abatacept podával v intravenózní infuzi ve třech různých dávkách ve dnech 1, 15 a 29, dále pak po 28 dnech [26]. Připravuje se studie u PsA se subkutánní aplikací abataceptu.
Alefacept
Alefacept je blokátor kostimulačních molekul. Jedná se o rekombinantní protein vzniklý fúzí lidského LFA-3 (leukocyte-function-associated antigen type 3) a IgG1, který blokuje interakci LFA-3 na antigen prezentující buňce (APC) a CD2 T lymfocytech. Pro léčbu psoriázy je schválen v USA. Podává se v intramuskulárních injekcích po 15 mg v týdenních intervalech vždy po 12 týdnů s následnou 12týdenní pauzou (z důvodu restaurace depletovaných CD4 lymfocytů). U pacientů s PsA vedlo přidání alefaceptu k MTX k signifikantnímu zmírnění kloubního syndromu ve srovnání s monoterapií MTX (54 % vs. 23 %; p < 0,001). Se zavedením alefaceptu v této indikaci se zatím nepočítá, s výjimkou selhání nebo intolerance jiných biologických léků [9].
Tofacitinib
Tofacitinib, inhibitor JAK kinázy 1/3, se v současné době nachází v pokročilé fázi klinického zkoušení u RA s dobrými výsledky v monoterapii i v kombinaci s jinými DMARDs. Účinnost byla prokázána i u pacientů s psoriázou ve studii fáze II; studie fáze III probíhá. Určité riziko léčby představují infekce, malignity, hyperlipidemie, leukopenie a anémie [9]. U PsA se připravuje multicentrická randomizovaná studie fáze III kontrolovaná placebem.
Apremilast
Apremilast je specifický inhibitor fosfodiesterázy 4; jedná se o novou, malou molekulu pro perorální použití. Byla zkoušena u PsA v randomizované dvojitě slepé studii fáze II kontrolované placebem, která trvala 12 týdnů. Pacienti dostávali apremilast v dávce 20 mg 2krát denně, nebo 40 mg 1krát denně. Na konci studie dosáhlo odpovědi dle ACR20 43,5 % pacientů ve skupině s dávkou 20 mg 2krát denně (p < 0,001) a 35,8 % s dávkou 40 mg 1 krát denně (p = 0,002) proti placebu (11,8 %). Nejčastějšími nežádoucími účinky byly průjem, bolesti hlavy, nauzea, únava a katary horních cest dýchacích. Nebyly hlášeny žádné významné laboratorní nebo elektrokardiografické abnormality
[27].
Denosumab
Denosu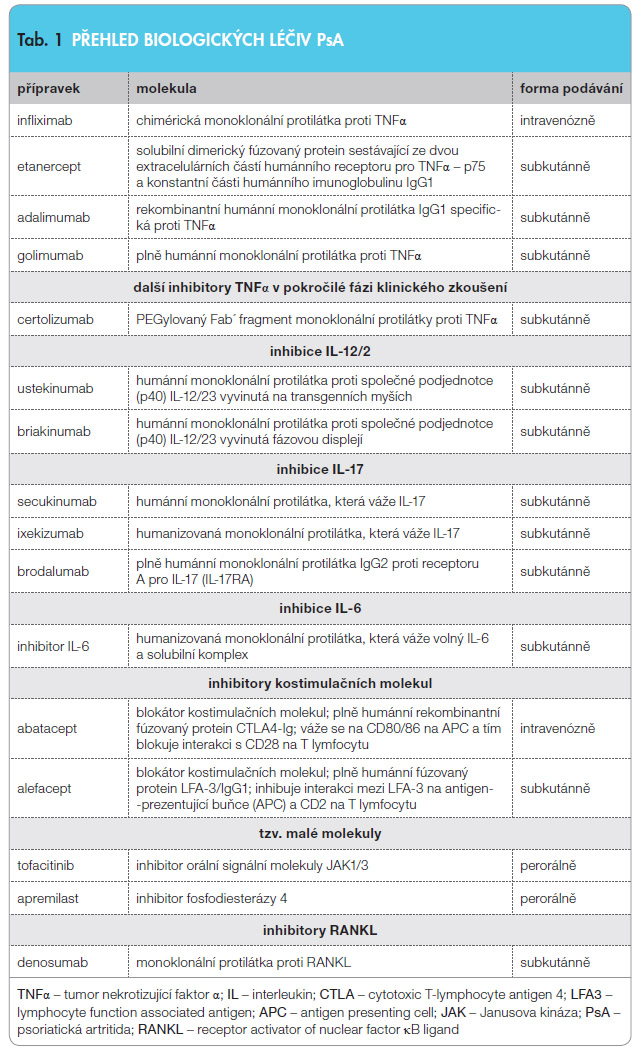 mab je protilátka proti RANKL, která selektivně potlačuje osteoklastogenezi tím, že tento ligand inhibuje. Ligand RANKL se váže na receptor RANK (Receptor Activator of Nuclear factor κB) a je primárním mediátorem diferenciace, aktivace a přežívání osteoklastů. Denosumab představuje poslední trend ve snaze ovlivnit vývoj destrukcí u zánětlivých artropatií. Studie probíhají u RA a lze je očekávat i u PsA [28].Přehled biologických farmak pro léčbu PsA je uveden v tab. 1.
mab je protilátka proti RANKL, která selektivně potlačuje osteoklastogenezi tím, že tento ligand inhibuje. Ligand RANKL se váže na receptor RANK (Receptor Activator of Nuclear factor κB) a je primárním mediátorem diferenciace, aktivace a přežívání osteoklastů. Denosumab představuje poslední trend ve snaze ovlivnit vývoj destrukcí u zánětlivých artropatií. Studie probíhají u RA a lze je očekávat i u PsA [28].Přehled biologických farmak pro léčbu PsA je uveden v tab. 1.
Závěr
Léčba PsA se v současné době rychle vyvíjí. I nadále předchází testování nových léčiv určených pro pacienty s PsA průkaz jejich účinnosti u psoriázy nebo RA. Některé biologické přípravky, jako je antagonista IL-1 (anakinra) nebo anti-CD20 (rituximab), prokázaly svoji účinnost v léčbě RA, u PsA však byly neúčinné. Současný trend směřuje k vývoji malých molekul podávaných perorálně, které ovlivňují postreceptorový přenos signálu, a k selektivní inhibici kostní destrukce.
Tato práce vznikla za podpory Výzkumných záměrů MZ ČR č. 000 000 23728.
Seznam použité literatury
- [1] Sarzi-Puttiny P, Santandrea S, Boccassiny L, et al. The role of NSAIDs in psoriatic arthritis: evidence from a controlled study with nimesulide. Clin Exp Rheumatol 2001; 19: S17–S20.
- [2] Gupta AK, Grober JS, Hamilton TA, et al. Sulfasalazine therapy for psoriatic arthritis: a double blind, placebo controlled trial. J Rheumatol 1995; 22: 894–898.
- [3] Dougados M, van der Linden S, Leirisalo-Repo M, et al. Sulfasalazine in the treatment of spondylarthropathy. A randomized, multicentre, double blind, placebo-controlled study. Arthritis Rheum 1995; 38: 618–627.
- [4] Clegg DO, Reda DJ, Mejias J, et al. Comparison of sulfasalazine and placebo in the treatment of psoriatic arthritis. A department of Veterans Affairs. Arthritis Rheum 1996; 39: 2013–2020.
- [5] Willkens RF, Williams HJ, Ward J, et al. Randomized, double-blind, placebo controlled trial of low-dose pulse methotrexate in psoriatic arthritis. Arthritis Rheum 1984; 27: 376–381.
- [6] Espinoza LR, Zakraoui L, Espinoza CG, et al. Psoriatic arthritis: clinical response and side effects to methotrexate therapy. J Rheumatol 1992; 19: 872–877.
- [7] Kingsley G, Kowalczyk A, Taylor H, et al. Methotrexate is not disease modifying in psoriatic arthritis: The MIPA trial. Arthritis Rheum 2010; 62 (suppl 10): S277.
- [8] Ceponis A, Kavanaugh A. Use of methotrexate in patients with psoriatic arthritis. Clin Exp Rheumatol 2010; 28 (Suppl. 61): S132–S137.
- [9] Mease PJ. Psoriatic arthritis: update on pathophysiology, assessment and management. Ann Rheum Dis 2011; 70 (Suppl 1): i77–i84.
- [10] Kaltwasser JP, Nash P, Gladman DD, et al. Treatment of Psoriatic Arthritis Study Group. Efficacy and safety of leflunomide in the treatment of psoriatic arthritis and psoriasis: a multinational, double-blind, randomized, placebo-controlled clinical trial. Arthritis Rheum 2004; 50: 1939–1950.
- [11] Štolfa J, Vencovský J., Pavelka K. Doporučené postupy České revmatologické společnosti pro léčbu psoriatické artritidy. Česká revmatologie 2012.
- [12] Ritchlin C, Haas-Smith SA, Hicks D, et al. Patterns of cytokine production in psoriatic synovium. J Rheumatol 1998; 25: 1544–1552.
- [13] Braun J, Sieper J. Anti-TNFalpha: a new dimension in the pharmacotherapy of the spondyloarthropathies? Ann Rheum Dis 2000; 59: 404–407.
- [14] 3rd. World Congress of Psoriasis and Psoriatic Arthritis 2012; Stockholm.
- [15] Braun J., Sieper J. Role of novel biological therapies in psoriatic arthritis. Therapy review. Biodrugs 2003; 17: 187–199.
- [16] Baker DE. Adalimumab: Human recombinant imunoglobulin G1 anti-tumour necrosis factor monoclonal antibody. Rev Gastroenterol Disord 2004; 4: 196–210.
- [17] Kavanaugh A, McInnes I, Mease P, et al. Golimumab, a new human tumor necrosis factor alpha antibody, administered every four weeks as a subcutaneous injection in psoriatic arthritis: Twenty-four-week efficacy and safety results of a randomized, placebo-controlled study. Arthritis Rheum 2009; 60: 976–986.
- [18] Kavanaugh A, Mease P, Krueger GG, et al. Golimumab, a new, human, TNF alpha antibody, administered subcutaneously every 4 weeks in psoriatic arthritis patients: 104-week efficacy and safety results of the randomized, placebo-controlled GOREVEAL study. Ann Rheum Dis 2009; 68: S136–137.
- [19] Rozenblit M, Lebwohl M. New biologics for psoriasis and psoriatic arthritis. Dermatolog Therapy 2009; 22: 56–60.
- [20] Mease PJ, Fleischmann R, Deodhar AA, et al. Effect of certolizumab pegol on signs and symptoms in patients with psoriatic arthritis: 24-week results of a Phase 3 double-blind randomised placebo-controlled study (RAPID-PsA). Ann Rheum Dis 2012; 71: S150.
- [21] Gottlieb AB, Mendelsohn A, Shen YT, et al. Randomized-placebo-controlled phase 2 study of ustekinumab, a human interleukin-12/23 monoclonal antibody in psoriatic arthritis. Ann Rheum Dis 2008; 67: 99.
- [22] McInnes IB, Kavanaugh A, Gottlieb AB, et al.; PSUMMIT 1 Study Group. Efficacy and safety of ustekinumab in patients with active psoriatic arthritis: 1 year results of the phase 3, multicentre, double-blind, placebo-controlled PSUMMIT 1 trial. Lancet 2013; 382: 780–789.
- [23] Kimball AB, Gordon KB, Langely KB, et al. Safety and efficacy of ABT-874, a fully human interleukin 12/23 monoconal antibody in the treatment of moderate to severe chronic plaque psoriasis. Arch Dermatol 2008; 144: 200–207.
- [24] Leonardi C, Matheson R, Zacharia C, et al. Anti-interleukin-17 monoclonal antibody ixekizumab in chronic plaque psoriasis. N Engl J Med 2012; 366: 1190–1199.
- [25] Abrams JR, Lebwohl MG, Guzzo CA, et al. CTLA-4Ig mediated blockade of T-cell costimulation in patients with psoriasis vulgaris. J Clin Invest 1999; 103: 1243–1252.
- [26] Mease P, et al. Abatacept in the treatment of patients with psoriatic arthtitis: results of a six-month, multicenter, randomized, double blind, placebo-controlled trial. Arthritis Rheum 2011; 63: 939–948.
- [27] Schett G, Wollenhaupt J, Papp K, et al. Oral apremiast in the treatment of active psoriatic arthritis: Results of a multicentre, randomized, double-blind, placebo controlled study. Arthritis Rheum 2012; Epub ahead of print. doi: 10.1002/art. 34580.
- [28] Cohen SB, Dore RK, Lane NE, et al. Denosumab treatment effects on structural damage, bone mineral density, and bone turnover in rheumatoid arthritis: a twelve-month, multicentre, randomized, double-blind, placebo-controlled, phase II clinical trial. Arthritis Rheum 2008; 58: 1299–1309.