Specifická alergenová imunoterapie – jediná kauzální léčba alergických chorob
Souhrn:
Přibližně jedna třetina světové populace trpí některou formou alergického onemocnění. Nejčastější je alergické postižení dýchacích cest vznikající na podkladě přecitlivělosti na inhalované alergeny ‒ pylová zrna, roztoče, plísně a alergeny domácích zvířat. Běžná farmakoterapie spolu s režimovými opatřeními tlumí alergické příznaky u většiny pacientů, ale jedinou léčbou, která je schopna ovlivnit dlouhodobě průběh nemoci, je specifická alergenová imunoterapie. Kvalitní terapeutické extrakty nejvýznamnějších kauzálních alergenů jsou nyní k dispozici ve formě subkutánních injekcí, sublinguálních tablet nebo roztoků. Přestože alergenovou imunoterapii u nás aplikuje výhradně alergolog, je velmi důležité, aby se s ní seznámili i lékaři v první linii kontaktu s pacientem a byli schopni vytipovat pacienty indikované k této léčbě.
Summary:
About one third of the world population suffers from allergy. Most prevalent are the diseases of respiratory tract which develop on the base of allergy to pollen grains, hous dust mites, molds and pets. The conventional pharmacotherapy together with avoidance strategies help to control allergic symptoms in the majority of patiens, but allergen immunotherapy is the only approach that has the potential to alter the natural course of allergic disease. All the most important therapeutic extracts are now available in good quality ether in the form of subcutaneous injections or sublingual tablets or solutions. Though the allergen immunotherapy is introduced only by allergists, it is important that also primary care providers have the knowledge about it and are able to select the patiens convenient to this type of therapy.
Key words: specific allergen immunotherapy, causal therapy, prevention, cooperation with primary care providers and specialists.
Úvod
Alergická onemocnění bývají někdy
souhrnně nazývána „epidemií moderní doby“. Prevalence
alergií v posledních desetiletích neustále vzrůstá ‒
odhaduje se, že jednou nebo více formami alergického onemocnění
trpí asi třetina světové populace (obr. 1). Na vzestupném
trendu se nesporně podílejí vymoženosti civilizace ‒ komfortní
vybavení bytů, složení stravy a také nedostatek pohybu,
které v dlouhodobém důsledku negativně ovlivňují
odpovídavost imunitního systému.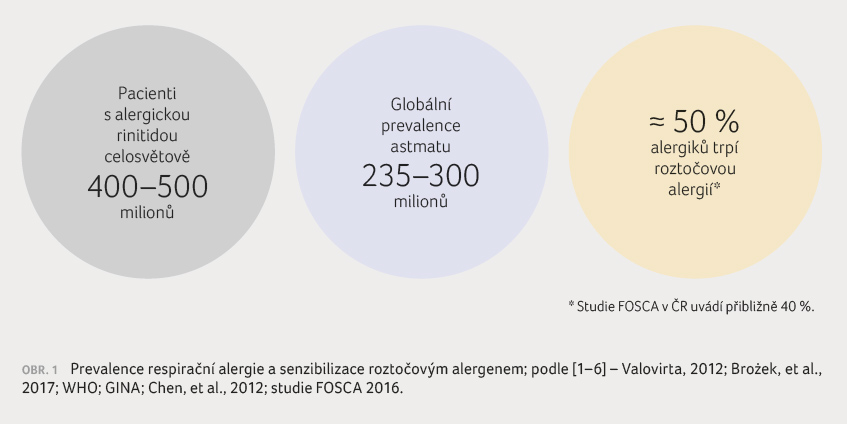
První příznaky alergie se mohou objevit v každém věku, ale nejvíce postižena je populace dětí a adolescentů. Pro každé věkové období jsou přitom typické různé projevy alergického onemocnění (tzv. atopický pochod). U kojenců a batolat se setkáváme nejčastěji s atopickou dermatitidou a bronchiálním astmatem, které jsou úzce spojené s alergií na potraviny. Tyto časné příznaky alergie se v průběhu dozrávání imunitního systému mění a současně s rozvíjející se tolerancí potravinových alergenů mohou zcela ustoupit nebo dále pokračovat jako tzv. dermo respirační syndrom. U řady atopiků se však už v předškolním věku nebo v průběhu raného školního věku začíná objevovat alergické postižení horních dýchacích cest ‒ rinitida nebo rinokonjunktivitida. Ta už obvykle přetrvává do adolescence a dospělosti a až u 40 % pacientů se dříve nebo později komplikuje alergickým astmatem. Chronický alergický zánět v dýchacích cestách alergiků je způsoben přecitlivělostí na inhalované vzdušné alergeny, jejichž zdrojem u nás jsou především pylová zrna, roztoči bytového prachu, plísně a alergeny domácích zvířat. Přibývá důkazů o tom, že pro rozvoj bronchiálního astmatu u alergiků je významná především alergie na roztoče.
V pozdějším věku pak přibývají
také jiné formy alergického postižení ‒ např. alergie
na léky, na potraviny (zpravidla na jiné druhy
potravin a s odlišnými projevy než v kojeneckém
věku), různé typy kontaktní alergie a alergie na jed
blanokřídlého hmyzu. Průběh alergického onemocnění je
u každého pacienta zcela individuální (v závislosti
na jeho genetické dispozici a variabilních vlivech
prostředí, v němž se pohybuje). Důkladná osobní i rodinná
anamnéza je při vyšetření alergického pacienta velmi důležitá,
protože na základě získaných údajů lze často odhadnout
další průběh onemocnění, případně vytipovat možná rizika
pro pacienta.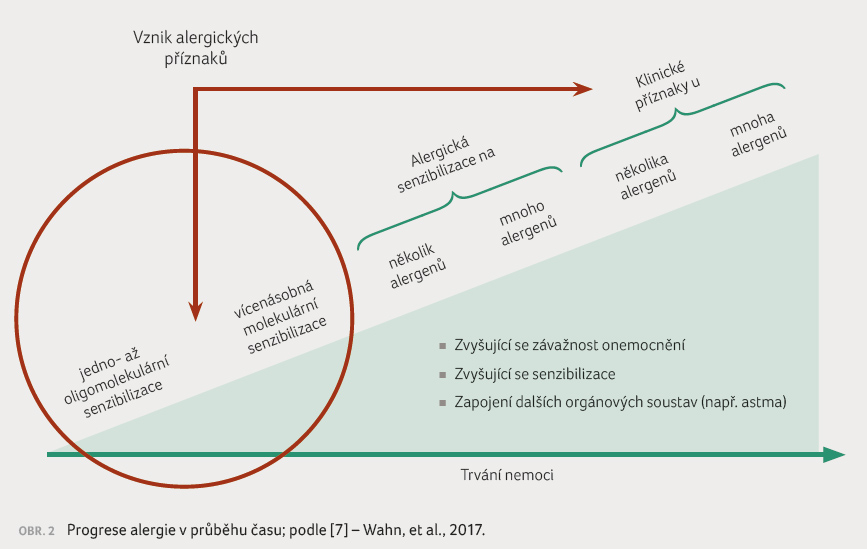
Cílem vyšetření alergika je prokázat alergickou diatézu, a především určit kauzální alergen, který je zodpovědný za vznik jeho obtíží. Velmi často je takových alergenů více, zejména u dospělých pacientů nebo starších dětí. Alergická senzibilizace má tendenci se v průběhu času rozšiřovat na více alergenů ‒ z původně monovalentního se stává polyvalentní alergik. Chronická alergická onemocnění mají současně tendenci progredovat od méně závažných k závažnějším. Typickým příkladem je rozvoj astmatu u pacientů trpících původně pouze alergickou rýmou (obr. 2).
Ne všechny alergeny, jimiž je pacient senzibilizován, musejí vyvolávat alergické obtíže. Rozlišujeme tedy stav mono nebo polyvalentní senzibilizace (bez klinických projevů) a mono nebo polyvalentní alergie (s klinickými projevy alergického onemocnění). Klinické projevy alergie se mohou objevit brzy po senzibilizaci alergenem nebo třeba i po mnoha letech.
Někdy je senzibilizace (prokázaná kožními testy nebo přítomností zvýšené koncentrace specifických IgE [imunoglobulin E] protilátek) trvale klinicky němá. Rozlišení pouhé senzibilizace a klinicky významné alergie a průkaz kauzálního (nebo při polyvalentní alergii dominantního) alergenu jsou velmi důležité pro správný postup při léčbě alergického onemocnění. Pouhý průkaz polyvalentní senzibilizace (např. pomocí vyšetření širokého spektra specifických IgE protilátek v séru) bez správného zhodnocení kauzality nálezu může vést ke zcela chybným režimovým a terapeutickým doporučením.
Mechanismus vzniku alergických chorob
U většiny chronických alergických chorob vznikají potíže na základě I. typu alergické reakce, při níž se uplatňují specifické protilátky třídy IgE přítomné u atopika ve velkém množství. Mechanismus IgE mediované alergické reakce je u všech chorob obdobný. Na počátku je vazba alergenu na IgE protilátky v těle senzibilizovaného jedince zakotvené v membráně efektorových buněk (především žírných buněk a bazofilních leukocytů) umístěných ve velkém počtu na strategicky významných místech vstupu alergenu do organismu. Vazba alergenu a IgE protilátky vede k aktivaci efektorových buněk s uvolněním celé řady cytokinů a mediátorů. Jejich působením na lokální receptory ve tkáních se rozvíjejí typické časné příznaky alergické reakce. Působením uvolněných mediátorů dochází k vazodilataci a ke zvýšené propustnosti kapilár, k podráždění nervových zakončení, hypersekreci žláz a spasmu hladkých svalových vláken. Současně jsou do místa reakce atrahovány i další buňky, které jsou základem alergického (eozinofilního) zánětu. Právě zánět s převahou zastoupení eozinofilních buněk je podstatou chronických alergických chorob zejména v respiračním traktu (alergická rinitida, rinokonjunktivitida, rinosinusitida, bronchiální astma). Podle toho, v kterém orgánu alergická reakce a alergický zánět probíhají, vznikají různé příznaky alergických chorob. Ve skutečnosti alergická reakce není nikdy omezena pouze na jeden (tzv. šokový) orgán, ale postihuje vždy více nebo méně celý organismus. Proto se například u pacientů s prostou alergickou rýmou setkáváme i s celkovými příznaky ‒ např. s bolestmi hlavy, únavou, poruchou koncentrace, někdy i s kloubními potížemi apod. O převažující symptomatologii rozhoduje typ alergenu a cesta jeho vstupu do organismu. Nejvíce postiženy jsou obvykle bariérové orgány (horní a dolní dýchací cesty, oční spojivka, zažívací trakt, kůže). Při průniku alergenu do krevního oběhu může dojít k nejzávažnější celkové alergické reakci s vícečetným orgánovým postižením až anafylaktickým šokem (typickým příkladem je celková alergická reakce na jed blanokřídlého hmyzu nebo reakce na injekčně aplikovaný alergen).
Možnosti terapie
Cílem léčby je samozřejmě potlačení symptomů alergického onemocnění, ale současně je třeba hledat cesty, jak zabránit jeho vzniku. K úlevě od alergických příznaků máme dnes k dispozici celou řadu velmi účinných léků, k nimž patří v první řadě systémová a topická nesedativní antihistaminika, topické inhalační, intranazální a kožní kortikosteroidy, antagonisté leukotrienů, kromony a další lékové skupiny. Podáváme je intermitentně pacientům s občasnými alergickými příznaky, většinou však chronicky nemocnému alergikovi, který je v trvalém nebo časném kontaktu s alergenem, doporučujeme dlouhodobé užívání profylakticky působící léčby s protizánětlivým účinkem. Významným přínosem bylo zavedení kvalitních a bezpečných topických inhalačních a intranazálních kortikosteroidů na počátku devadesátých let minulého století. Na rozdíl od antihistaminik, která působí převážně symptomaticky, vedou k potlačení alergického zánětu a tím ke snížení hyperaktivity orgánů, v nichž dochází k alergické reakci. Dlouhodobé (většinou trvalé) užívání potentních a přitom bezpečných protizánětlivých léků přineslo významné změny v kvalitě života pacientů s chronickými respiračními alergiemi.
Při znalosti mechanismu alergických chorob je však třeba si uvědomit, že sebeúčinnější konvenční farmakoterapie nevede k vyléčení alergického onemocnění, protože nepostihuje jeho podstatu – to znamená změněnou reaktivitu imunitního systému alergika.
Velmi účinným způsobem, jak
zabránit rozvoji alergické reakce, je úplné zamezení kontaktu
s alergenem ‒ proto také součástí komplexní terapie má
být vždy i doporučení různých režimových opatření.
Úplná eliminace alergenu z prostředí je však v praxi
nerealizovatelná. Protilátky IgE se vytvářejí nejčastěji proti
zcela běžným alergenům, jimž se v běžném životě
vyhnout nelze. Graf 1 ukazuje frekvenci nejčastějších
senzibilizací u 7 020 alergických pacientů léčených ve
117 alergologických pracovištích na Slovensku,
situace u nás je velmi podobná. Nemůžeme li zamezit
kontaktu s alergeny, je třeba hledat cestu, jak „opravit“
nežádoucí reakci imunitního systému alergika na setkání
s nimi neboli navodit jejich toleranci.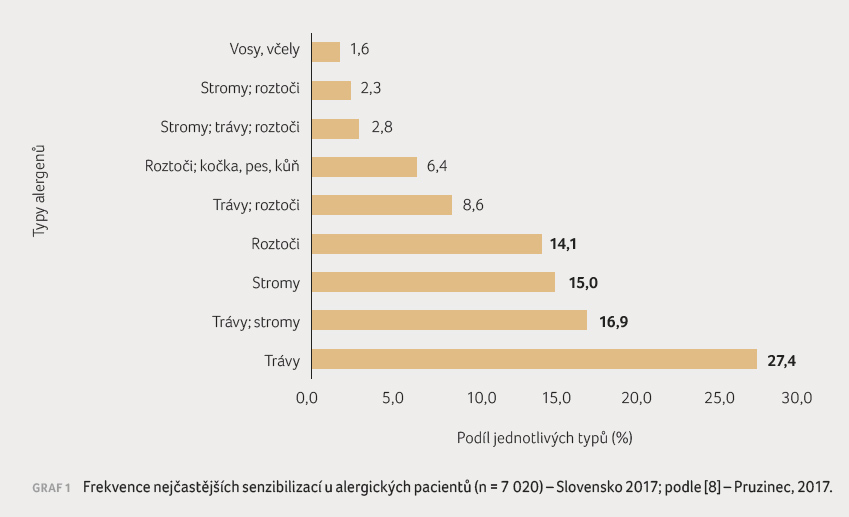
Jedinou kauzální léčbou alergických onemocnění, která vede k potlačení alergických projevů a současně dlouhodobě ovlivňuje vývoj a průběh alergického onemocnění, je specifická alergenová imunoterapie (specific allergen immunotherapy, SAIT). Její podstatou je dlouhodobé podávání přesně stanovených dávek alergenu, na který je pacient přecitlivělý, do organismu s cílem nastavit specifickou toleranci tohoto alergenu [9]. SAIT není léčbou konkrétního onemocnění (např. rýmy, bronchiálního astmatu nebo anafylaktické reakce), ale léčbou poruchy odpovídavosti imunitního systému na alergen, který tato onemocnění vyvolává.
SAIT je užívána už více než sto let – zpočátku čistě empiricky u pacientů s alergií na pyly, u nichž opakovaná podkožní aplikace extraktu z pylů vedla ke zmírnění projevů pylové alergie. V současné době na základě našeho poznání komplexnosti a funkce imunitního systému na jedné straně a rozpoznání podrobné struktury alergenů na straně druhé provádíme kvalitní alergenovou imunoterapii způsobem odpovídajícím požadavkům medicíny založené na důkazech [10].
Mechanismus účinku SAIT
V průběhu SAIT je potlačena pro alergika typická Th2 (subpopulace pomocných Th lymfocytů) imunitní odpověď s převažující produkcí interleukinů (IL) 4, IL 5, IL 13, syntézou IgE protilátek a aktivací eozinofilního zánětu. Toho je dosaženo zřejmě působením na více úrovních složitého procesu počínaje prezentací alergenu paměťovým buňkám imunitního systému a konče aktivací efektorových buněk [11]. Za nejvýznamnější je považován vliv na regulační Treg lymfocyty, jejichž počet je u alergiků snížen a v důsledku SAIT se zvyšuje. Uvažuje se i o vlivu SAIT na aktivitu dalších buněk účastnících se alergické reakce, především na antigen prezentující buňky, dále na mastocyty a eozinofily. Důležité jsou změny v produkci alergen specifických protilátek ‒ v průběhu SAIT dochází k přechodnému vzestupu a následně k poklesu třídy IgE a k postupnému zvýšení tzv. blokujících protilátek IgG4. Tyto (a četné další) laboratorní změny byly prokázány systémově především u subkutánní formy imunoterapie, která je zkoumána déle, k podobným změnám, probíhajícím zřejmě více na lokální úrovni, dochází i u formy sublinguální [12]. S rozvojem laboratorních metod poznatky o mechanismu SAIT přibývají, je však zřejmé, že všechny detaily procesu navození tolerance zatím plně objasněny nejsou.
Přestože je moderní SAIT z hlediska medicíny založené na důkazech postavena na roveň ostatní farmakoterapii, má určitá specifika, jimiž se od ní liší. Odlišnost je dána především velkou variabilitou v senzibilizaci a reaktivitě každého pacienta. Terapeutický přínos SAIT je individuální a závisí na mnoha faktorech spojených se stavem pacienta (diagnóza a tíže alergického onemocnění, doba jeho trvání, případné komorbidity nebo současně podávaná další léčba), s typem alergie (mono nebo polysenzibilizace) a s dostupností kvalitního terapeutického alergenu. V neposlední řadě je třeba zdůraznit, že pro zajištění účinku a bezpečnosti léčby je nutná i dobrá compliance pacienta, který musí být ochoten a schopen spolupracovat při dlouhodobé (prakticky vždy několik let trvající) terapii. Indikace alergenové imunoterapie a její provedení tedy představuje individuální léčbu „šitou na míru“ pro každého jednotlivce a plně za ni zodpovídá alergolog na základě znalostí a vyhodnocení všech uvedených faktorů.
Základní podmínky pro indikaci SAIT
- Přítomnost alergického onemocnění vhodného k tomuto způsobu léčby, jehož příznaky jsou prokazatelně vázané na expozici konkrétnímu alergenu. Indikací k podávání SAIT jsou alergická onemocnění respiračního traktu ‒ alergická rinokonjunktivitida a alergické bronchiální astma a závažná celkové reakce na jed blanokřídlého hmyzu.
- Je prokázána přecitlivělost I. typu (IgE mediovaná) na tento kauzální alergen (přítomnost specifických IgE protilátek v séru a/nebo pozitivní kožní test). Pozn.: V posledních letech je možno přecitlivělost na některé alergeny laboratorně blíže specifikovat s pomocí tzv. komponentové diagnostiky. V indikaci imunoterapie ji využíváme zatím především u pylových alergiků.
- Je k dispozici kvalitní standardizovaný terapeutický alergenový extrakt s účinností prokázanou v klinických studiích. Tomuto požadavku odpovídají extrakty některých pylů (travin, stromů a plevelů), dále extrakty roztočů, alergeny kočky, psa a extrakty jedu blanokřídlého hmyzu.
- Pacient je seznámen se zásadami alergenové imunoterapie a lze očekávat jeho dlouhodobou spolupráci [13].
Doporučení týkající se indikace
SAIT v léčbě respiračních alergií procházejí neustálým
vývojem. Podle původních a dlouhá léta platných
mezinárodních konsenzů [14] byla SAIT v léčbě alergických
projevů na dýchacích cestách doporučována jako další
volba v případě nedostatečného efektu farmakoterapie, tj.
především u pacientů s těžkou formou alergické rýmy
a lehčí formou alergického astmatu. V současné době
je naopak zdůrazňován význam včasného zahájení co nejdříve
po rozvoji prvních projevů alergie na dýchacích
cestách, aby se uplatnil preventivní efekt tohoto způsobu léčby –
u alergické rýmy jako prevence rozvoje astmatu [15] a současně
jako prevence další senzibilizace [16‒18], (obr. 3).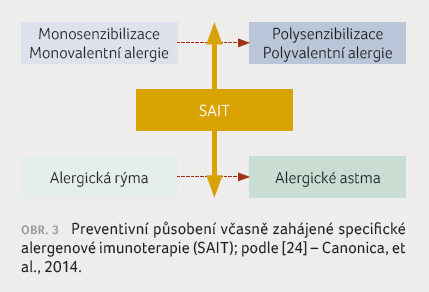
U astmatu stále užíváme SAIT především u pacientů s lehčí formou onemocnění s jednoznačně prokázaným alergickým fenotypem, obvykle při současném onemocnění astmatem a alergickou rýmou. Podmínkou je trvalá kontrola astmatu (hodnota usilovného výdechového objemu za jednu sekundu [FEV1] nad 70 %) v celém průběhu provádění SAIT [14], která je u pacientů s perzistující formou astmatu zajišťována současným podáváním inhalačních preventivních antiastmatik. Recentně byly publikovány i studie prokazující efekt SAIT roztočovými tabletami v léčbě těžké formy alergického astmatu s nedostatečnou kontrolou [19,20]. Na základě jejich výsledků byla sublinguální SAIT roztočovými tabletami včleněna do mezinárodního doporučení stupňovité léčby astmatu [21].
Nejčastější příčinou váhání při indikaci SAIT je při splnění všech ostatních předpokladů typ a rozsah senzibilizace. Většina pacientů se závažnějším průběhem alergického onemocnění trpí polyvalentní alergií. Klinické studie však v naprosté většině prokazují efekt při podávání monovalentní alergenové imunoterapie [22]. Polyvalentní alergie není kontraindikací alergenové imunoterapie, je však třeba stanovit dominantní alergen. U polyvalentních alergiků se zřejmou dominancí několika alergenů nemusí být SAIT jedním alergenem úspěšná. Chceme li SAIT provést, je vhodné léčbu dalším alergenem zahájit po ukončení první série. Výjimečně lze podávat i dva alergeny současně (např. jeden v subkutánní a druhý v sublinguální formě).
Kontraindikace SAIT
SAIT nepodáváme pacientům se závažnými celkovými onemocněními (imunologická, kardiovaskulární, maligní, psychická, endokrinní, metabolická a chronické infekce). Kontraindikací je i současně podávaná terapie inhibitory angiotenzin konvertujícího enzymu a betablokátory, včetně topické oční formy (důvodem u poslední skupiny je obtížné zvládnutí případné anafylaxe v průběhu léčby). SAIT obvykle nepodáváme dětem mladším pěti let a pacientům ve věku nad 60 let. Těhotenství není důvodem k přerušení léčby, pokud bylo dosaženo udržovací dávky. Terapii však v průběhu těhotenství nezahajujeme. U každého pacienta posuzujeme individuálně přínos a rizika imunoterapie, absolutní kontraindikace prakticky neexistují. Pacientům s alergií na jed blanokřídlého hmyzu například podáváme léčbu i po překročení horního věkového limitu, protože jsou ohroženi závažnou anafylaktickou reakcí někdy až s fatálním koncem [14].
Formy a provedení alergenové
imunoterapie
V léčbě (stejně jako v diagnostice) jsou u nás užívány pouze rutinně vyráběné standardizované alergeny, které jsou připravovány jako extrakt z přírodních nebo uměle kultivovaných alergenních zdrojů. Standardizována je jednak celková alergenní potence extraktu (biologická aktivita), jednak množství hlavního alergenu ve hmotnostních jednotkách. Užíváme dvojí způsob aplikace terapeutických alergenů ‒ injekční subkutánní a sublinguální.
K subkutánní léčbě užíváme depotní alergeny vázané na adjuvans, někdy tzv. alergoidy zpracované tak, aby bylo redukováno riziko vyvolání nežádoucích účinků. Alergen je aplikován injekčně do podkoží na zevní straně paže. Schéma aplikace je doporučeno výrobcem, většinou zahajujeme v úvodní vzestupné fázi 1× za týden, po dosažení udržovací dávky (tj. zhruba za 4 měsíce) pokračujeme 1× za 4‒6 týdnů. Celá léčebná kúra trvá 3‒5 let. Pro pylové alergeny jsou k dispozici také zkrácené předsezonní série, které rovněž opakujeme několik let po sobě. Subkutánní SAIT je podávána výhradně školeným personálem na alergologických pracovištích vybavených protišokovou terapií. Riziko závažných nežádoucích reakcí při správném provedení a dobré spolupráci pacienta je minimální, nelze je však vyloučit, proto je každá aplikace injekce vždy následována půlhodinovou observací pacienta. Riziko nežádoucí reakce se poněkud zvyšuje při užití zrychleného schématu (cluster a rush formy aplikace), kdy je potřebná celková dávka alergenu podána během několika týdnů nebo i dní.
Pravidelné návštěvy alergologických ambulancí k aplikaci SAIT jsou pro pacienta zatěžující, v některých případech organizačně zcela nemožné. Oblíbenější a v současné době postupně stále více užívaná je proto sublinguální alergenová imunoterapie, při níž je alergen aplikován pod jazyk a vstřebáván ústní sliznicí. Extrakt pylů travin a od letošního roku u nás nově i extrakt roztočů jsou k dispozici také v tabletové podobě. Sublinguální imunoterapii užívá pacient sám doma, pod dozorem lékaře je podávána pouze první dávka, aby byla zajištěna správná technika podání a potvrzena dobrá snášenlivost. Velmi důležitá je edukace pacienta, který musí léčbu přerušit v případě akutního infekčního onemocnění nebo při poranění ústní sliznice. Také sublinguální imunoterapie se užívá dlouhodobě, většinou denně, a léčba tak vyžaduje od pacienta velmi dobrou spolupráci. Nejlepšího efektu je dosaženo při kontinuálním celoročním podávání, ale v případě sezonní pylové alergie byla i zde zavedena možnost podávat alergen pouze ve zkrácené sérii (před pylovou sezonou a v jejím průběhu). Sublinguální forma léčby je považována obecně za bezpečnější [23,24]. U většiny pacientů se na počátku objevuje lokální reakce v ústech, která do dvou týdnů obvykle zcela ustupuje. Naopak závažné celkové reakce byly popsány zcela výjimečně.
Dostatečný a po ukončení přetrvávající terapeutický efekt SAIT je u jakékoliv formy léčby podmíněn vpravením dostatečně vysoké kumulativní dávky hlavního alergenu do organismu. Toho je dosaženo prakticky vždy až při dlouhodobé terapii – doporučená celková doba léčby je pro většinu alergenů 3‒5 let. Celkovou dobu podávání, frekvenci aplikace a velikost dávek doporučují výrobci u každého alergenového extraktu různě, protože doporučená kumulativní dávka je pro každý alergen jiná. Navíc každý výrobce označuje alergeny vlastními jednotkami, které nejsou vzájemně srovnatelné ‒ terapeutické alergeny od různých výrobců jsou proto nezaměnitelné. Alergolog může v případě potřeby doporučované léčebné schéma upravovat individuálně na míru každému pacientovi podle jeho reaktivity na počátku nebo v průběhu léčby.
Hodnocení efektu SAIT
Výsledkem úspěšné alergenové imunoterapie je navození dlouhodobé tolerance alergenu. SAIT nepředstavuje pouze terapii konkrétního onemocnění, ale ovlivňuje stav přecitlivělosti organismu, na jehož podkladě alergická onemocnění vznikají. Na rozdíl od konvenční farmakoterapie přetrvává efekt léčby alergenovou imunoterapií řadu let po jejím ukončení [25‒27]. Z tohoto důvodu představuje jedinou kauzální léčbu alergika, kterou máme v současné době k dispozici [28].
Efekt SAIT je sledován odděleně pro
různé diagnózy, pro různé typy alergenů a pro různé
formy terapie. Z toho důvodu je velmi obtížné uvést
souhrnné hodnocení. Určitým východiskem jsou metaanalýzy
výsledků provedených studií, u nichž je však problémem
nejednotnost zadání [29,30]. U pacientů s alergickou
rýmou a astmatem byl v četných kvalitních placebem
kontrolovaných studiích prokázán pokles intenzity a frekvence
nosních, očních a průduškových symptomů provázený
zlepšením kvality života a snížením potřeby úlevové
medikace, a to jak při subkutánním, tak i při
sublinguálním podávání (graf 2). Velmi důležité je
preventivní působení SAIT ‒ bylo pozorováno snížení rizika
rozvoje astmatu u dětí s alergickou rýmou [15]
a v některých studiích i snížení rizika
rozšíření alergie na další alergeny [16‒18].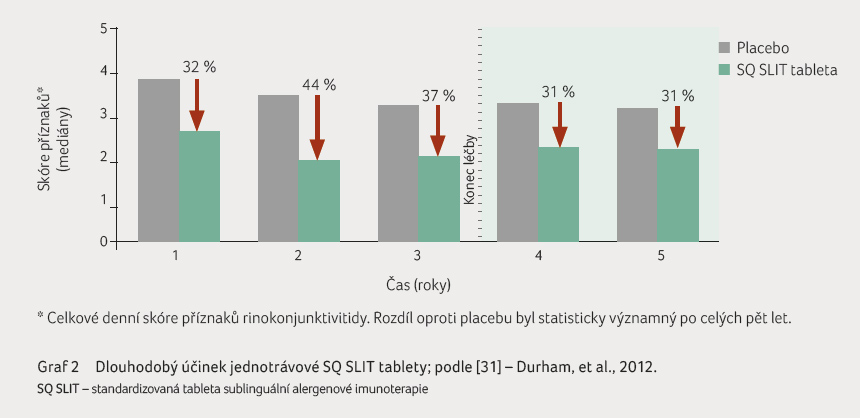
V denní praxi užíváme k vyhodnocení účinku SAIT měření skóre symptomů a spotřebu úlevové medikace ve sledovaném období. Jednoduchým znázorněním je vizuální analogová škála nebo sledování počtu bezpříznakových dní. Pozorované laboratorní změny nekorelují s klinickou účinností SAIT a nelze je v praxi využívat k jejímu hodnocení [13]. Spolehlivým měřítkem efektu SAIT není ani pokles kožní reakce na daný alergen. Hodnocení účinnosti SAIT je doporučeno provádět 1× ročně vždy ve stejném období. Pokud ani po dvou letech nedojde ke zlepšení zdravotního stavu pacienta a ke snížení spotřeby úlevové medikace, léčbu SAIT ukončujeme.
Závěr
Specifická alergenová imunoterapie, její indikace a provedení jsou u nás striktně vázány na obor alergologie a klinická imunologie. Největší část pacientů, kteří mohou mít z této léčby prospěch (tj. pacientů s alergickou rýmou a s alergickým astmatem), trpí přecitlivělostí na pyly travin, pyly stromů a alergeny roztočů domácího prachu. Právě pro tyto indikace jsou dostupné kvalitní standardizované terapeutické alergenové extrakty v subkutánní i sublinguální formě. Přesto je ve skutečnosti většina chronicky nemocných alergiků léčena pouze symptomatickou nebo protizánětlivě působící konvenční farmakoterapií v ordinacích praktických lékařů nebo specialistů (nejčastěji pneumologů a otorinolaryngologů). Nemalé (a ne zcela přesně známé) procento alergické populace není dokonce ani řádně vyšetřeno. Řada nemocných užívá dlouhodobě pouze symptomaticky působící volně prodejné léky a k lékaři se mnohdy dostaví teprve při rozvoji závažných zdravotních komplikací. Kauzálně působící alergenovou imunoterapii zahajuje celosvětově jen necelé 1 % pacientů, u nichž je tato léčba indikována. Pozdní zahájení navíc neumožňuje plně využít preventivního působení terapie. Rozsáhlé sledování napříč evropskými zeměmi ukázalo, že v důsledku opožděného odeslání pacienta na alergologické pracoviště dochází ke zbytečnému prodlení v zahájení indikované SAIT v průměru o 7‒8 let [32].
Organizační problémy (obdobné po celém světě, přestože důvody jsou v různých zdravotních systémech různé) jsou způsobeny především nedostatečnou informovaností laické veřejnosti i většiny zdravotníků o možnostech moderní alergenové imunoterapie, o jejím vývoji, začlenění do komplexní péče o alergika a o praktickém provedení. Současná situace, kdy alergenová imunoterapie v sublinguální formě je podávána mimo alergologické pracoviště a značná část odpovědnosti za její správné užívání je přenesena na samotného pacienta, bezpodmínečně vyžaduje, aby se základní informace o této léčbě rozšířily i mimo obor alergologie. Na základě fungující mezioborové spolupráce je pak možné pacientům včas poskytnout terapii, která jako jediná je schopna ovlivnit dlouhodobě průběh alergického onemocnění.
Seznam použité literatury
- [1] Valovirta E. EFA Book on Respiratory Allergies ‒ Raise Awareness, Relieve the Burden. 2012: p. 21. Dostupné na: http://www.efanet.org
- [2] Brożek JL, Bousquet J, Agache I, et al. Allergic Rhinitis and its Impact on Asthma (ARIA) guidelines ‒ 2016 revision. J Allergy Clin Immunol 2017; 140: 950‒958.
- [3] WHO (World Health Organization) Asthma fact sheet no. 37. Dostupné na: http://www.who.int
- [4] GINA (Global Initiative for Asthma). Pocket Guide for Asthma Management and Prevention. Dostupné na: http://www.ginasthma.org
- [5] Chen KW, Blatt K, Thomas WR, et al. Hypoallergenic Der p 1/Der p 2 combination vaccines for immunotherapy of house dust mite allergy. J Allergy Clin Immunol 2012; 130: 435‒443.
- [6] Studie FOSCA, prezentovaná 25. 11. 2016, Respiratory Forum, Praha.
- [7] Wahn U, Calderon MA, Demoly P. Real‑life clinical practice and management of polysensitized patients with respiratory allergies: a large, global survey of clinicians prescribing allergen immunotherapy. Expert Rev Clin Immunol 2017; 13: 283–289.
- [8] Pruzinec P. Overview of allergic rhinitis incidence and treatment in Slovak Republic in 2015: results from nationwide prospective study. EAACI Helsinky 2017, poster 0640.
- [9] Zuberbier T, Bachert C, Bousquet PJ, et al. GA2LEN/EAACI pocketguide for allergen‑specific immunotherapy for allergic rhinitis and asthma. Allergy 2010; 65: 1525–1530.
- [10] Focke M, Swoboda I, Marth K, et al. Developments in allergen specific immunotherapy: from allergen extracts to allergy vaccines bypassing allergen‑specific immunoglobulin E and T cell reactivity. Clin Exp Allergy 2010; 40: 385–397.
- [11] Passalacqua G, Ledford D, Cox L, et al. Allergen specific immunotherapy in White Book on Allergy 2011. Dostupné na: http://www.worldallergy.org/UserFiles/file/WAO‑White‑Book‑on‑Allergy_web.pdf
- [12] Calderon MA, Simons FE, Malling HJ, et al. Sublingual alergen immunotherapy: mode of action and its relationship with the safety profile. Allergy 2012; 67: 302–311.
- [13] Rybníček O, Seberová E, et al. Průvodce specifickou alergenovou imunoterapií, Doporučení výboru ČSAKI. Praha: Tigis, 2009.
- [14] Bousquet J, Lockey R, Malling HJ. WHO position paper. Allergen immunotherapy: therapeutic vaccines for allergic diseases. Allergy 1998; 53(Suppl 54): 1–42.
- [15] Jacobsen L, Niggemann B, Dreborg S, et al. Specific immunotherapy has long‑term preventive effect of seasonal and perennial asthma: 10‑year follow‑up on the PAT study. Allergy 2007; 62: 943–948.
- [16] Des Roches A, Paradis L, Menardo JL, et al. Immunotherapy with a standardized Dermatophagoides pteronyssinus extract. VI. Specific immunotherapy prevents the onset of new sensitizations in children. J Allergy Clin Immunol 1997; 99: 450–453.
- [17] Pajno GB, Barberio G, De Luca F, et al. Prevention of new sensitizations in asthmatic children monosensitized to house dust mite by specific immunotherapy. A six‑year follow‑up study. Clin Exp Allergy 2001; 31: 1392–1397.
- [18] Purello‑D’Ambrosio F, Gangemi S, Merendino RA, et al. Prevention of new sensitizations in monosensitized subjects submitted to specific immunotherapy or not. A retrospective study. Clin Exp Allergy 2001; 31: 1295–1302.
- [19] Mosbech H, Deckelmann R, de Blay F, et al. Standardized quality (SQ) house dustmite sublingual immunotherapy tablet (ALK) reduces inhaled corticosteroid use while maintaining asthma control: a randomized, double‑blind, placebo‑controlled trial. J Allerg Clin Immunol 2014; 134: 568‒575.
- [20] Virchow JC, Backer V, Kuna P, et al. Efficacy of a House Dust Mite Sublingual Allergen Immunotherapy Tablet in Adults With Allergic Asthma A Randomized Clinical Trial. JAMA 2016; 315: 1715‒1725.
- [21] Global Initiative for Asthma (GINA). Dostupné na: http://ginasthma.org [navštíveno 1. 3. 2016]
- [22] Demoly P, Passalacqua G, Pfaar O, et al. Management of the polyallergic patient with allergy immunotherapy: a practice‑based approach. Allergy Asthma Clin Immunol 2016; 12: 2.
- [23] Canonica GW, Bousquet J, Casale T, et al. Sub‑lingual immunotherapy: World Allergy Organization position paper. Allergy 2009; 64: 1‒59.
- [24] Canonica GW, Cox L, Pawankar R, et al. Sublingual immunotherapy: world allergy organization position paper 2013 update. World Allergy Organ J 2014; 7: 6.
- [25] Durham SR, Emminger W, Kapp A, et al. Long‑term clinical efficacy in grass polleninduced rhinoconjunctivitis after treatment with SQ‑standardized grass allergy immunotherapy tablet. J Allergy Clin Immunol 2010; 125: 131–138.
- [26] Jacobsen L, Niggemann B, Dreborg S, et al. Specific immunotherapy has long‑term preventive effect of seasonal and perennial asthma: 10‑year follow‑up on the PAT study. Allergy 2007; 62: 943–948.
- [27] Cools M, Van Bever HP, Weyler JJ, Stevens WJ. Long‑term effects of specific immunotherapy, administered during childhood, in asthmatic patients allergic to either house dust mite or to both house dust mite and grass pollen. Allergy 2000; 55: 69–73.
- [28] Incorvaia C. Preventive capacity of allergen immunotherapy on the natural history of allergy. J Prev Med Hyg 2013; 54: 71–74.
- [29] Compalati E, Penagos M, Tarantini F, et al. Specific immunotherapy for respiratory allergy: state of the artaccording to current meta‑analyses. Ann Allergy Asthma Immunol 2009; 102: 22‒28.
- [30] Abramson MJ, Puy RM, Weiner JM. Is alergen imunotherapy effective in asthma? A metaanalysis of randomised controlled trials. Am J Respir Crit Care Med 1995; 151: 969‒974.
- [31] Durham SR, Emminger W, Kapp A, et al. SQ‑standardized sublingual grass immunotherapy: confirmation of disease modification 2 years after 3 years of treatment in a randomized trial. J Allergy Clin Immunol 2012; 129: 717‒725.
- [32] Valero A, Chivato T, Justicia JL, et al. Diagnosis and treatment of grass pollen‑induced allergic rhinitis in specialized current clinical practice in Spain. Allergy Asthma Proc 2011; 32: 384‒389.