Statiny a srdeční transplantace
Autoři podávají přehled problematiky podávání statinů u nemocných po srdeční transplantaci, uvádějí stručnou charakteristiku jednotlivých statinů, imunosupresiv a přehled možných nežádoucích účinků hypolipidemické léčby v kontextu příznivého působení léčby statiny. Zamýšlejí se nad vhodnou léčebnou strategií při výběru jednotlivých statinů.
Hyperlipoproteinémie po srdeční transplantaci, vliv imunosuprese
Hyperlipoproteinémie se popisuje u 60–80 % nemocných po srdeční transplantaci (STL). Podílí se na ní řada faktorů, jako je předchozí anamnéza ICHS, předchozí lipidové abnormality, body mass index více než 25 kg/m2, vysoká dávka kortikoidů a užívání ciclosporinu nebo sirolimu. Ciclosporin zvyšuje hladiny cholesterolu, zejména jeho LDL frakce [1]. Jedním z možných mechanismů je poškození buněčné membrány, která zvláště ovlivňuje clearance LDL cholesterolu v hepatocytech, což vede ke zvýšení sérové hladiny LDL [2]. Vyšší plazmatická koncentrace ciclosporinu snižuje aktivitu lipoproteinové lipázy, která může způsobit zvýšení hladiny triglyceridů.
Změny lipidového metabolismu lze pozorovat již v prvních 3–6 měsících po transplantaci [3]. Ciclosporin snižuje clearance prednisonu, což může vést k inzulinové rezistenci, zvýšené syntéze volných mastných kyselin a ke zvýšené produkci VLDL [4].
Nově užívaný inhibitor kalcineurinu – tacrolimus – má menší negativní vliv na lipidové spektrum než ciclosporin. V retrospektivním hodnocení 194 pacientů po srdeční transplantaci, kteří byli převedeni z ciclosporinu na tacrolimus, se snížily hladiny celkového a LDL cholesterolu a signifikantně se zvýšily hladiny HDL cholesterolu [5].
U sirolimu (rapamycin) je rovněž popisován negativní vliv na hladiny lipidů. Údaje jsou získány především od nemocných po transplantaci ledvin. V souboru pacientů po transplantaci ledvin, kde byl k ciclosporinu a kortikoidům přidán sirolimus, došlo ke zvýšení jak koncentrací cholesterolu, tak triglyceridů. Zvýšení bylo závislé na dávce sirolimu [6].
Při podávání mykofenolátu mofetilu po transplantaci orgánů není dostatek dat, která by hodnotila jeho vliv na hladiny lipidů.
Statiny – inhibitory HMG-CoA reduktázy
Blokováním reduktázy HMG (hydroxymethylglutaryl) koenzymu A v hepatocytech dochází k útlumu syntézy cholesterolu, a tím k indukci tvorby LDL receptorů. Zvýšením exprese LDL receptorů na povrchu hepatocytů dochází ke zvýšení vychytávání lipoproteinů LDL z krve, a tím ke snížení LDL cholesterolu. Základní dávka statinů snižuje LDL cholesterol asi o 27 %, její zdvojnásobení vždy o dalších asi 7 %. Statiny také mírně snižují TG (v závislosti na jejich dávce) a mírně zvyšují HDL cholesterol (nezávisle na dávce). Statiny mají i další nelipidové (pleiotropní) účinky: tlumí zánětlivou a imunitní reakci v cévní stěně a ovlivňují proliferaci hladkých svalových buněk a extracelulární matrix. To přispívá ke stabilizaci aterosklerotického plátu, i když pro stabilizaci plátu je nepochybně zásadní snížení LDL cholesterolu v krvi, a tím i v aterosklerotickém ložisku. Některé statiny omezují i riziko trombogeneze – tlumí syntézu PAI-1, trombomodulinu a tromboxanu B2. Zlepšují funkci cévního endotelu tím, že zvyšují syntézu oxidu dusnatého (NO) a snižují expresi endotelinu.
Imunomodulační účinek je způsoben inhibicí cytotoxických T lymfocytů – „přirozených zabíječů". Je zajímavé, že tento účinek statinů nebyl prokázán u nemocných, kteří nebyli transplantováni. Vysvětlením může být nutnost současného podávání ciclosporinu [7].
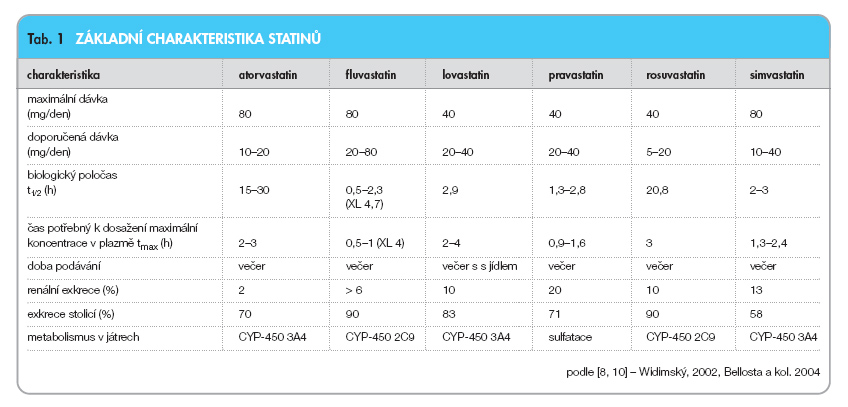
Kromě lovastatinu, který se lépe vstřebává při jídle, je vhodnější užívat ostatní statiny na lačno. Vzhledem k tomu, že syntéza endogenního cholesterolu je nejvyšší v noci, bývá doporučováno brát statiny na noc. Statiny jsou vylučovány převážně žlučí (70–95 %), lze je proto podávat i u nemocných s renální insuficiencí. Výjimkou je pravastatin, který je asi z 20 % vylučován ledvinami [8].
Atorvastatin
Je po perorálním užití rychle absorbován, maximální plazmatické koncentrace je dosaženo po 1–2 hodinách. Je metabolizován cytochromem P-450 (CYP-450) – izoenzym 3A4, z velké části na biologicky aktivní metabolity. Je vylučován žlučí po hepatální a extrahepatální metabolizaci. Při jaterní nedostatečnosti je plazmatická koncentrace atorvastatinu výrazně zvýšena.
Fluvastatin
Po požití téměř úplně absorbován (98 %), poté podléhá zřetelnému „first-pass" efektu (první průchod játry). Absolutní systémová biologická dostupnost je proto relativně nízká (24 %). Při dávkách vyšších než 20 mg není farmakokinetika lineární. Je metabolizován CYP-450 – izoenzym 2C9.
Lovastatin
Je to lakton, který se in vivo rychle hydrolyzuje přes CYP-450 – izoenzym 3A4 na příslušnou hydroxykyselinu. Přibližně 10 % lovastatinu se vyloučí močí a 83 % stolicí. Při podání lovastatinu na lačno dosahuje plazmatická koncentrace aktivních inhibitorů 2/3 hodnoty ve srovnání s podáním léku ihned po jídle, proto podáváme lovastatin nejlépe po jídle.
Pravastatin
Na rozdíl od ostatních statinů je hydrofilní a není metabolizován systémem CYP-450. Neinterferuje proto s léky, které jsou tímto cytochromem metabolizovány. Významně snižuje adhezi krevních destiček a leukocytů. Je považován za „antitrombofilní statin". Po několikaměsíční léčbě dochází k výrazné redukci destičkových trombů, snižuje se koncentrace PAI-1 a fibrinogenu, zvyšuje se syntéza NO endoteliemi [8]. Snižuje v plátech počet zánětlivých buněk i makrofágů a je pravděpodobné, že také moduluje imunitní systém organismu.
Simvastatin
Je vychytáván v játrech, podléhá významnému „first-pass" efektu. Je metabolizován přes CYP-450 – izoenzym 3A4, vylučován je především do žluči, a plazmatická koncentrace aktivní látky je proto nízká. Maximální koncentrace v plazmě je dosažena mezi 1–3 hodinami. Vazba na plazmatické proteiny je 95% [9].
Rosuvastatin
Je relativně hydrofilní a metabolizován je systémem CYP-450 – izoenzym 2C9 a méně 2C19. Prakticky nemá aktivní metabolity, asi z 10 % je vylučován močí, z 90 % játry. Má vysokou selektivitu k jaterní tkáni, je minimálně vychytáván periferními buňkami. Jde o zatím nejúčinnější statin (co se týče snížení LDL cholesterolu), který se jeví jako účinnější než atorvastatin [9–11].
Přehled základních vlastností statinů viz tab. 1.
Za „základní dávku" u pacientů, kteří nejsou transplantováni, lze považovat 5 mg rosuvastatinu, 10 mg atorvastatinu, 10 mg simvastatinu, 20 mg lovastatinu a pravastatinu, 40 mg fluvastatinu. Násobení dávky statinů tedy nevede k násobení účinku na LDL cholesterol, naproti tomu riziko vedlejších účinků se zvyšuje a cena léčby se násobí. V současnosti je nedosažení cílové koncentrace LDL pod 3,0 (2,5) mmol/l indikací k přidání ezetimibu, nového hypolipidemika, které zabraňuje vstřebávání cholesterolu ve střevě [9].
Nežádoucí účinky statinů
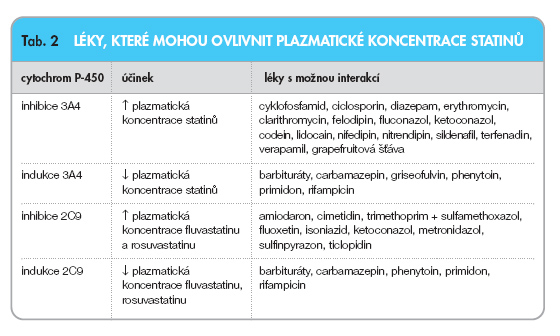
Kromě pravastatinu jsou ostatní statiny metabolizovány přes cytochrom P-450 (systém 3A4 nebo 2C9). Mnohé léky tento enzymový systém inhibují (tab. 2) a může dojít k nežádoucímu zvýšení plazmatických hladin statinů s rizikem myopatie až rabdomyolýzy. Podle údajů z ohlášených případů myotoxicity v USA byla incidence rabdomyolýzy na 1 milion obyvatel následující: fluvastatin 0, pravastatin 0,04, atorvastatin 0,04, simvastatin 0,12 a lovastatin 0,19. Riziko je zvýšené u pacientů po srdeční transplantaci, protože 8 % případů z uvedeného počtu tvořili pacienti současně užívající ciclosporin [12].
Naopak léky, které indukují CYP-450 3A4 (barbituráty, třezalka tečkovaná atd.), hladiny statinů snižují. Je proto důležité znát léky, které tyto enzymy inhibují (zvýšení hladin) nebo indukují (snížení hladin). Některé příklady viz tab. 2. Také kombinace statinů s fibráty může zvyšovat riziko myopatie až rabdomyolýzy, zvláště při vyšších dávkách statinů. Další rizikové stavy pro vznik myopatie jsou současný diabetes mellitus, hypothyreóza, ledvinné a jaterní postižení, věk nad 70 let a vysoké dávky statinů (např. > 40 mg/den simvastatinu).
Z dalších vedlejších účinků statinů se mohou vyskytnout zažívací potíže, alergické reakce, poruchy usínání až nespavost. Bylo publikováno i zvýšené riziko periferní neuropatie. Hepatotoxicita se vyskytuje v méně než 1 % při vyšších dávkách statinů, může se projevit únavou, nechutenstvím, úbytkem na váze. Klinicky významné je zvýšení aminotransferáz 2–3x nad normu (AST, ALT). Symptomy odezní po vysazení statinu. V graviditě (a také u žen ve fertilním věku bez bezpečné antikoncepce) jsou statiny pro možný teratogenní účinek na plod kontraindikovány. Statiny zvyšují účinek perorálních antikoagulancií, u těchto nemocných je proto při nasazení statinů nutné monitorovat INR a upravit dávku warfarinu.
Klinické zkušenosti s podáváním statinů u pacientů po transplantaci
O prospěchu statinů u nemocných po srdeční transplantaci (STL) není pochybností a je řada důkazů, že jejich příznivý účinek je dán nejen snížením plazmatické koncentrace celkového a LDL cholesterolu, ale také zpomalením rozvoje progrese koronární vaskulopatie a snížením hemodynamicky závažných rejekcí [13–15]. Při rozsáhlé analýze z amerického registru srdečních transplantací (Heart Transplant Lipid Registry), kde bylo zavzato 1 186 nemocných z 12 center, se ukázalo, že pacienti léčení statiny mají nižší mortalitu a nižší výskyt rejekcí a tento výsledek byl nezávislý na hladině lipidů [16].
Co však zůstává stále problémem, je výskyt nežádoucích účinků, hlavně poškození svalů, od myalgie přes myositidu až po rabdomyolýzu. Rizikoví nemocní jsou: ženy s nízkou hmotností, polymorbiditou (zvláště renální selhání na podkladě diabetes mellitus), v pooperačním období, a hlavně při současném podávání řady léků (interakce na CYP-450 3A4) – fibráty, ciclosporin, tacrolimus, azolová antimykotika (ketoconazol, itraconazol), makrolidová ATB, amiodaron, verapamil, diltiazem, nefazodonthymoleptikum, a v neposlední řadě pravidelné pití grapefruitové šťávy či abúzus alkoholu, který přispívá k rozvoji myopatie [17, 18].
Je známo, že ciclosporin i tacrolimus se metabolizuji cestou CYP-450 3A4 stejně jako atorvastatin, lovastatin, simvastatin a na základě lékové interakce dochází ke zvýšení plazmatických koncentrací těchto statinů s následným nebezpečím myopatií. Naproti tomu pravastatin, který se přes systém CYP-450 nemetabolizuje, fluvastatin či rosuvastatin, které se metabolizují cestou CYP-450 2C9, se jeví farmakologicky vhodné u nemocných po TL, protože nebezpečí lékových interakcí na CYP-450 3A4 je minimální. Naopak podávání ostatních statinů – atorvastatinu, lovastatinu, simvastatinu – by nemělo být z farmakologického hlediska indikované, neboť všechny jsou metabolizovány cestou CYP-450 3A4. Při současném podávání induktoru tohoto enzymu – ciclosporinu či tacrolimu – dochází k zvýšení jejich plazmatické koncentrace s možným vznikem myopatie či rabdomyolýzy [19].
Přesto vznikla řada studií i s „méně vhodnými" statiny u nemocných po STL, a to navzdory tomu, že např. po užití 80 mg lovastatinu byla popsána závažná rabdomyolýza [20]. Ve studii Wenkeho a spol. bylo sledováno podávání simvastatinu časně po srdeční transplantaci ve srovnání s placebem. Po čtyřech letech bylo lepší přežívání u pacientů se simvastatinem, 89 % vs 70 % s placebem, p < 0,05 [21]. Pro tyto povzbuzující výsledky byl všem pacientům dále podán simvastatin a hodnocení bylo provedeno po 8 letech od zahájení studie. Ve skupině primárně léčené statinem bylo po 8 letech 97 % pacientů stále léčeno statinem, v původně placebové skupině statin dostávalo 82 % nemocných. Při srovnání obou skupin byly patrné významné rozdíly v přežívání (89 % vs 60 %, p < 0,006) a výskytu vaskulopatie štěpu (24 % vs 55 %, p < 0,02) ve prospěch nemocných léčených časně statinem po transplantaci srdce. Přitom hladiny LDL cholesterolu se u obou skupin po osmi letech nelišily [22]. Simvastatin byl podáván v nízké dávce 5–20 mg, u níž nebyla pozorována žádná rabdomyolýza, pouze zvýšení kreatinkinázy nad 100 IU/l bylo u 12 aktivně léčených ve srovnání s 10 nemocnými na dietě [22].
Obdobně ve studii Patela a spol. s atorvastatinem nebyl pozorován větší výskyt myopatií. Byla zde však opět podávána nižší dávka atorvastatinu, 10–20 mg denně [23]. Ve srovnávací studii Keogha a spol., kdy byl po dobu jednoho roku srovnáván pravastatin v dávce 20–40 mg denně a simvastatin v dávce 10–20 mg denně, však již byl rozdíl ve výskytu myopatií významný. Po simvastatinu mělo 13,3 % pacientů výskyt myositidy a 1 nemocný měl klinicky významnou rabdomyolýzu. Po pravastatinu nebyl žádný výskyt myopatie, ale u 2 nemocných byl pravastatin pro bolesti hlavy zaměněn za simvastatin. Podávání pravastatinu bylo také spojeno s lepším přežíváním pacientů [24]. V randomizované 12měsíční studii Mehry a spol. byly dávky obou statinů poloviční: pravastatin 20 mg a simvastatin 10 mg. Na rozdíl od předcházející studie zde nebyly rozdíly v přežívání, počtu rejekcí, ale ani ve výskytu rabdomyolýzy [25]. Vyplývá z toho, že oba statiny v nižších dávkách byly ve svém působení srovnatelné. Vyšší výskyt rabdomyolýzy u simvastatinu v první studii byl zřejmě způsoben jeho vyšší dávkou. Obdobné závěry podává Kobashigawa a spol. jak po ročním, tak po desetiletém sledování léčby pravastatinem po STL, kdy pokles mortality či snížení koronární vaskulopatie nebyly provázeny výskytem myopatie [26, 27].
Zajímavé je, že při provedení metaanalýzy s léčbou simvastatinem nebo pravastatinem u pacientů po transplantaci srdce byla průměrná hladina LDL cholesterolu mezi 100–130 mg/dl (2,58–3,36 mmol/l). Přitom bylo dosaženo významného snížení mortality a vaskulopatie [28].
Zatím existuje limitované množství prací, které se zabývají podáváním rosuvastatinu u pacientů po STL. Pilotní studii představuje práce Sammana, která byla prospektivní, trvala 12 týdnů a zahrnula 21 nemocných po STL, kteří nedosáhli cílových hodnot cholesterolu při léčbě pravastatinem, atorvastatinem, simvastatinem nebo fluvastatinem. Po léčbě rosuvastatinem v dávce 10 mg dosáhlo 70 % pacientů hodnot LDL pod 100 mg/dl (2,58 mmol/l). Nedošlo ke zvýšení jaterních testů, nicméně 1 pacient měl myalgii a 2 pacienti byli vyřazeni ze studie pro mírné zvýšení CK [29].
S fluvastatinem po transplantaci srdce či ledvin bylo provedeno několik studií. Ve studii z našeho pracoviště po podání 20 mg fluvastatinu u pacientů po transplantaci srdce nebyla myopatie ani zvýšení kreatinkinázy pozorováno [30]. Vyšší dávky fluvastatinu po transplantaci srdce byly podávány v práci Hoškové. Autoři u nemocných, kteří po STL měli nedostatečně kontrolovanou hladinu celkového a LDL cholesterolu (nad 6 mmol/l, resp. 3,4 mmol/l), při léčbě pravastatinem v dávce 40 mg nebo fluvastatinem 40 mg podali 80 mg fluvastatinu v retardované formě XL. Plazmatické koncentrace celkového i LDL cholesterolu a triglyceridů významně poklesly a HDL cholesterol se zvýšil. Přitom autoři nepozorovali ani u jednoho nemocného myalgii či myopatii [31].
Holdaas a spol. nejprve provedli pilotní studii u 14 nemocných po transplantaci ledvin s fluvastatinem v dávce 20 mg s titrací na 40 mg fluvastatinu, kde nedošlo k vzestupu kreatinkinázy či jaterních transamináz, myopatie nebyla uvedena [32]. V Lancetu 2004 pak byla publikována největší multicentrická, randomizovaná, dvojitě slepá, placebem kontrolovaná studie u nemocných po transplantaci ledvin (studie ALERT). Bylo sledováno 2 102 nemocných, kteří dostávali buď 40 mg fluvastatinu, nebo placebo. Po průměrné době sledování 5,1 let fluvastatin snížil LDL cholesterol o 32 %, snížení rizika na kombinovaný cíl (srdeční smrt, nefatální IM nebo koronární intervence) nebylo signifikantní, ale bylo méně srdečních úmrtí a nefatálních IM. Rabdomyolýza byla pouze u 2 nemocných, jeden ve fluvastatinové a druhý v placebové větvi [32]. Fluvastatin se jeví jako bezpečný po transplantaci srdce či ledvin.
Praktické použití statinů po transplantaci srdce
Jaký praktický závěr můžeme na základě výše uvedených studií učinit?
Částečně se ztotožníme s Christie M. Ballantyne, který ve svém editorialu z roku 2000 doporučuje, že u nemocných je možno začít co nejdříve po transplantaci s nízkými dávkami jakéhokoliv statinu (atorvastatin 10 mg, lovastatin 20 mg, simvastatin 10 mg, rosuvastatin 5 mg, pravastatin 20–40 mg a fluvastatin 40 mg). Autor však nedoporučuje v případě, kdy nebude léčba nízkými dávkami statinů účinná, podávání vysokých dávek statinů či kombinace s fibráty, protože pro tuto léčbu nejsou data z prospektivních studií [34, 15].
Na základě těchto údajů byl americkými kardiologickými společnostmi (ACC/AHA) navržen doporučený postup k bezpečnému používání statinů, který byl modifikován pro pacienty po transplantaci. Když si pacient po transplantaci stěžuje na svalovou slabost či bolest, měla by být zkontrolována hladina kreatinkinázy (CK). Jinak by hladina CK měla být kontrolována každý 2. či 3. měsíc během prvního roku po transplantaci, zvláště během titrace dávky. Pokud je pacient na stabilní dávce 9–12 měsíců bez zvýšení hladin CK, není rutinní kontrola CK při absenci příznaků pravděpodobně potřebná. Když se hladiny CK zvýší 3–5x nad horní hranici referenční hodnoty, měly by být hladiny CK kontrolovány každý týden. Prakticky by se měla snížit dávka statinu nebo zaměnit za fluvastatin či pravastatin, o rosuvastatinu zatím nemáme potřebná data. Pokud užívá pacient mimo imunosupresivní medikaci další léky, které zvyšují statinovou myotoxicitu, měly by být zaměněny za jiné. Pokud se hladina CK zvýší více než 5x nad horní limit referenční hodnoty, měly by být statiny na určitou dobu vysazeny a po normalizaci hladin CK a odeznění symptomů lze zvážit užití jiného statinu nebo stejného statinu v nižší dávce [17].
Co však dále, je-li přes léčbu nízkými dávkami statinů nedostatečně kontrolovaná plazmatická koncentrace celkového cholesterolu nad 6 mmol/l a LDL nad 3,5 mmol/l? Změníme imunosupresivní strategii z ciclosporinu na tacrolimus, protože při imunosupresi tacrolimem je ve srovnání s ciclosporinem lepší lipidový profil [35]. Dále se snažíme o snížení dávky kortikoidů nebo o jejich úplné vysazení [13]. A je-li nutno přesto kontrolovat zvýšený cholesterol, zvolíme hydrofilní fluvastatin v retardované formě, ev. pravastatin v dávce 80 mg, které mají farmakologické předpoklady mít nižší výskyt myopatií. Tito nemocní však budou vyžadovat pečlivé sledování výskytu bolestí svalů, zvýšení plazmatických koncentrací kreatinkinázy, jaterních transamináz a hladin imunosupresiv. A zatím nemáme data o kombinační léčbě statiny s ezetimibem. Proto se jako velmi potřebné jeví provedení multicentrické, srovnávací, dvojitě slepé studie s dostatečným počtem nemocných s jednotlivými statiny, a event. kombinace statinu s ezetimibem.
Seznam použité literatury
- [1] Ballantyne CM, Radovancevic B, Farmer JA, et al. Hyperlipidemia after heart transplantation: report of a 6-year experience with treatment recommendation. J Am Coll Cardiol 1992; 19: 1315–1321.
- [2] Stamler JS, Vaughan DE, Loscalzo J. Immunosuppressive therapy and lipoprotein abnormalities after cardiac transplantation. Am J Cardiol 1991; 68: 389–391.
- [3] Superko H, Haskell W, DiRicco C. Lipoprotein and hepatic lipase activity and high density lipoprotein subclasses after cardiac transplantation. Am J Cardiol 1990; 66: 1131–1134.
- [4] Gebauerová M, Jandová R, Málek I, et al. Obraz nemocného po srdeční transplantaci. Cor Vasa 1993;35: 258–262.
- [5] Akhlaghi F, Jackson CH, Parameshwar J, et al. Risk factors for the development and progression of dyslipidemia after heart transplantation. Transplantation 2002; 73: 1258–1264.
- [6] MacDonald AS. A world-wide, phase III, randomised, controlled, safety and efficacy study of a sirolimus/cyclosporine regimen for prevention of acute rejection in recipients of primary mismatched reanl allografts.Transplantation 2001; 71: 271–280.
- [7] Katznelson S, Wang XM, Chia D, et al. The inhibitory effects of pravastatin on natural killer cell activity in vivo and on cytotoxic T lymphocyte activity in vitro. J Heart Lung Transpl 1998; 17: 335–340.
- [8] Widimský J. Léčba dyslipidémií. Praha, Triton, 2002.
- [9] Vítovec J, Špinar J, et al. Farmakoterapie kardiovaskulárních onemocnění. Praha, Grada Publishing, 2004.
- [10] Bellosta S , Paolleti R, Corsiny A. Safety of Statins. Focus on Clinical Pharmakokinetics and Drug Interactions. Circulation 2004; 109 (Suppl III): 50–57.
- [11] Schwartz GG, Bolognese MA, Tremblay BP, et al. Efficacy and safety of rosuvastatin in patients with hypercholesterolemia and a high risk of coronary heart disease: A randomized, controlled trial. Amer Heart J 2004; 148: 105.
- [12] Thompson PD, Clarkson P, Karas RH, et al. Statin-associated myopathy. JAMA 2003; 289: 1681–1690.
- [13] Špinarová L, Toman J. Pharmacotherapy after heart transplatation. Cor Vasa 2000; 42: 335–340.
- [14] Shimizu K, Aikawa M, Takayama K, et al. Direct Anti-Inflamatory Mechanisms Contribute to Attenuation of Experimental Allograft Arteriosclerosis by Statins. Circulation 2003; 108: 2113–2120.
- [15] Vítovec J, Špinarová J. Jaký statin po srdeční transplantaci? Farmakologický předpoklad a klinická praxe. Cor Vasa 2004; 46: 463–464.
- [16] Wu AH, Ballantyne ChM, Short BC, et al. Statin use and risks of death or fatal rejection in the Heart Transplant Lipid Registry. Amer J Cardiol 2005; 93: 367–372.
- [17] Pasternak RC, Smith SC, Bairey-Merz NB, et al. ACC/AHA/NHLBI Clinical Advisory on the Use and Safety of Statins. Circulation 2002; 106: 1024–1028.
- [18] Widimský J. Poškození svalů při léčbě inhibitory HMG CoA reduktázy statiny. Cor Vasa 2003; 45: 376–386.
- [19] Clark LT. Treating dyslipidemia with statin: The risk-benefit profile. Am Heart J 2003; 145: 387–396.
- [20] East C, Alivizatos PA, Grundy SM, et al. Rhabdomyolysis in patients receving lovastatin after cardiac transplantation (letter). N Engl J Med 1988; 318: 47–48.
- [21] Wenke K, Meiser B, Thiery, J et al. Simvastatin reduces graft vessel disease and mortality after heart transplantation: a four year randomised trial. Circulation 1997; 96: 1398–1402.
- [22] Wenke K, Meiser B, Thiery J, et al. Simvastatin Initiated Early After Heart Transplantation. 8-Year Prospective Experience.Circulation 2003; 107: 93–97.
- [23] Patel DN, Pagani FD, Koelling (tm), et al. Efficacy and Safety of Atorvastatin in Heart Transplant Recipients. J Heart Lung Transplant 2002; 21: 204–210.
- [24] Keogh A, MacDonald P, Kaan A, et al. Efficacy and Safety of Pravastatin vs Simvastatin After Cardiac Transplantation J Heart Lung Transplant 2000; 19: 529–537.
- [25] Mehra MR, Uber PA, Vivekananthan K, et al. Comparative beneficial effects of simvastatin and pravastatin on cardiac allograft rejection and survival. J Am Coll Cardiol 2002; 40: 1609–1614.
- [26] Kobashigawa JA, Katznelson S, Laks H, et al. Effect of pravastatin on outcomes after cardiac transplantation. N Engl J Med 1995; 333: 621–627.
- [27] Kobashigawa JA, Moriguchi JD, Cogert G, et al. 10-year results of the pravastatin randomized trial in heart transplant recipients. ISHLT April 21–24, 2004 San Francisco, USA. Abstr. 218.
- [28] Bilchick KC, Henrikson CA, Skojec D, et al. Treatment of hyperlipidemia in cardiac transplant recipients. Am Heart J 2004; 148: 200–210.
- [29] Samman AM, Imai C, Straatman J, et al. Safety and efficacy of rosuvastatin therapy for the prevention of hyperlipidemia in adult cardiac transplant recipients. ISHLT April 21–24, 2004, San Francisco, USA. Abstr. 148.
- [30] Špinarová L, Toman J. Fluvastatin u pacientů po transplantaci srdce. Vnitřní lék 1998; 44: 13–16.
- [31] Hošková L, Podzimková M, Málek I. Bezpečnost a účinnost fluvastatinu po transplantaci srdce. Cor Vasa 2004; 46: 473–437.
- [32] Holdaas H, Hartmann A, Stenstr_m J, et al. Effect of Fluvastatin for Safety Lowering Atherogenic Lipids in Renal Transplant Patients Receiving Cyclosporine. Am J Cardiol 1995; 76: 102A–106A.
- [33] Holdaas H, Fellström B, Jardine AG, et al. Effect of fluvastatin on cardiac outcomes in renal transplant recipients: a multicentre, randomised, placebo-controlled trial. Lancet 2003; 361: 2024–2031.
- [34] Ballantyne CM. Statins after Cardiac Transplantation: Which Statin, What Dose, and How Low Should We Go? J Heart Lung Transplant 2000; 19: 515–517.
- [35] Fellström B. Impact and management of hyperlipidemia posttransplantation. Transplantation 2000; 70 (Suppl.): S51–S57.