Stimulátory kostní novotvorby ve světle nových poznatků
Výsledky genetického výzkumu zdůraznily významnou úlohu signální cesty Wnt při novotvorbě kostní hmoty. Tato signální cesta se proto stala cílem vývoje nových způsobů osteoanabolické léčby zaměřených na diferenciaci osteoblastů, prodloužení jejich životnosti a zvýšení novotvorby kosti. Tato koncepce vysvětlila osteoanabolické účinky intermitentně podávaného parathormonu a umožnila vývoj analog parathormonu, PTHrP (parathormon-related peptide) a kalcilytik. Další možnosti představují monoklonální protilátky proti významným inhibitorům signální cesty Wnt, zejména proti sclerostinu (produktu genu SOST tvořenému v osteocytech) a dalším inhibičním proteinům.
Životnost a výkonnost kostních buněk se zhoršuje už od třetího decennia. Kosti tak postupně s věkem řídnou a zhoršuje se jejich kvalita a mechanická odolnost. Úbytek kostní hmoty se ještě zrychluje při nadměrné osteoresorpci. Obě uvedené příčiny nakonec vedou ke zlomeninám, které vznikají spontánně nebo po nepřiměřeně malém úrazu. Osteoporóza je (vedle pádů) rizikovým faktorem zlomenin, podobně jako je hypertenze (hodnocená měřením krevního tlaku) rizikovým faktorem iktu. V České republice je osteoporózou postiženo kolem 400 000 žen a 200 000 mužů; v roce 2005 v České republice utrpělo per-trochanterickou zlomeninu a zlomeninu krčku femoru 11 195 osob starších 50 let (4755 mužů a 6640 žen). Osteoporotické zlomeniny obratlů a proximálního femoru vedou k výraznému zhoršení kvality života, k závislosti postižených osob na dopomoci, invalidizaci a k předčasnému úmrtí [1]. Řídnutí kostí je tedy jedním z mnoha projevů stárnutí, není však projevem neodvratitelným. Osteoporózu lze rozpoznat už v jejích bezpříznakových začátcích, lze jí předcházet a lze ji léčit dříve, než se projeví zlomeninami. Terapeuticky lze ovlivnit nejen příčiny a projevy vysokoobratové osteoporózy (nadměrné osteoresorpce navozené nejčastěji nedostatkem sexagenů, sekundární hyperparatyreózou, chronickými zánětlivými chorobami, případně kouřením), ale i příčiny a projevy nízkoobratové osteoporózy (zpomalené novotvorby kostní hmoty navozené nejčastěji stárnutím a léčbou glukokortikoidy).
Cílem léčby osteoporózy je udržet nebo zlepšit množství a kvalitu kostní hmoty, snížit riziko zlomenin, zmírnit bolest a další klinické důsledky fraktur a deformit skeletu, snížit riziko pádů a zachovat nebo zlepšit tělesnou zdatnost a kvalitu života. Podle způsobu účinku na kostní buňky lze léčebná opatření rozdělit na antiosteokatabolická (antiresorpční), která zpomalují úbytek kostní hmoty, a opatření osteoanabolická, která navozují zvýšenou tvorbu nové zdravé kostní hmoty. Rozhodování o vhodném způsobu léčby u daného pacienta se řídí informací o individuálním absolutním riziku zlomeniny během dalších 10 let (http: //www.shef.ac.uk/FRAX/). Pro dlouhodobou strategii léčby je nutné využití obou terapeutických přístupů s důrazem na obnovu množství a mechanické odolnosti kostí a pak udržení tohoto efektu.
Převahu novotvorby kosti nad osteoresorpcí je možno navodit jednak inovací postupů navozujících útlum kostní resorpce (m.j. inhibitory katepsinu K) [2], jednak objevováním a ověřováním nových molekulárních cílů pro anabolickou léčbu.
Osteoanabolická léčba má, na rozdíl od antiosteokatabolické terapie, za cíl dosáhnout převahy novotvorby nad odbouráváním kostní hmoty nikoli utlumením osteoresorpce, ale 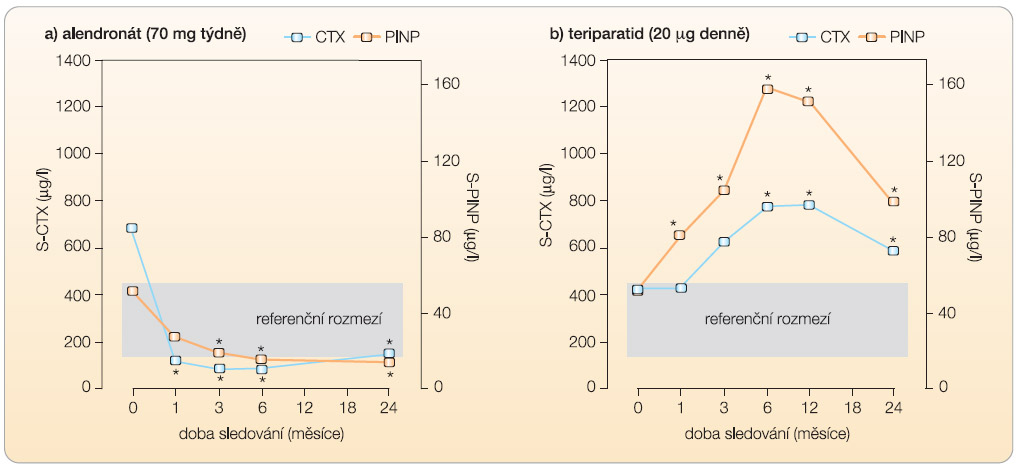 stimulováním novotvorby (graf 1). To může probíhat při celkově zvýšené remodelaci, pokud se resorpční kavity plní větším množstvím kostní hmoty, než jaké bylo odbouráno, anebo navozením modelace, kdy se tvoří nová kostní hmota z prekurzorových buněk osteoblastů na kostních površích, které dosud nevstoupily do remodelačního cyklu [3]. Pokud se tento léčebný účinek podaří dlouhodobě udržet, klesá absolutní riziko zlomenin více než při antikatabolické léčbě.
stimulováním novotvorby (graf 1). To může probíhat při celkově zvýšené remodelaci, pokud se resorpční kavity plní větším množstvím kostní hmoty, než jaké bylo odbouráno, anebo navozením modelace, kdy se tvoří nová kostní hmota z prekurzorových buněk osteoblastů na kostních površích, které dosud nevstoupily do remodelačního cyklu [3]. Pokud se tento léčebný účinek podaří dlouhodobě udržet, klesá absolutní riziko zlomenin více než při antikatabolické léčbě.
Aby bylo možné zdůvodnit nové molekulární cíle pro osteoanabolickou léčbu, je nezbytné detailněji popsat hlavní známé cesty, kterými jsou osteoblasty rekrutovány a programovány k diferenciaci a produkci organické kostní matrix. Osteoblasty přitom mohou vznikat nejenom z mezenchymálních a prekurzorových buněk v kostní dřeni, ale také z prekurzorů (osteoprogenitorů a preosteoklastů), které cirkulují v krvi a dostávají se kapilárami přes tzv. lining cells do remodelačního prostoru [4–6]. Obecně lze říci, že pokud je nedostatek prekurzorů osteoblastů nebo je porušena diferenciace osteoblastů či osteoblasty podléhají předčasně apoptóze, ztenčují se kostní trámce, kost řídne a klesá její mechanická odolnost. Pokud se naopak zvýší počet prekurzorů a zlepší se diferenciace osteoblastů nebo se prodlouží jejich životnost, vytvoří se více organické kostní hmoty a sníží se riziko fraktur.
V regulaci proliferace, diferenciace a apoptózy osteoblastů se uplatňují zejména lokálně tvořené růstové faktory (IGF-1, kostní morfogenní proteiny, fibroblastové růstové faktory a TGF-β), které jsou regulovány cytokiny a hormonálně. Klíčovým místem pro vytvoření poolu funkčních osteoblastů, resp. pro regulaci jejich přežívání, jsou signální cesty Wnt (Wingless and INT-1, secernované modifikované glykoproteiny). Zatím méně je známa nekanonická Wnt cesta, kde Wnt aktivují prostřednictvím G proteinů fosfatidylinositolovou signální cestu a proteinkinázu C. Konečným výsledkem této cesty je represe PPAR-g (peroxisome proliferator-activated receptor g) a diferenciace mezenchymálních buněk do linie osteoblastů místo do adipogeneze [7, 8].
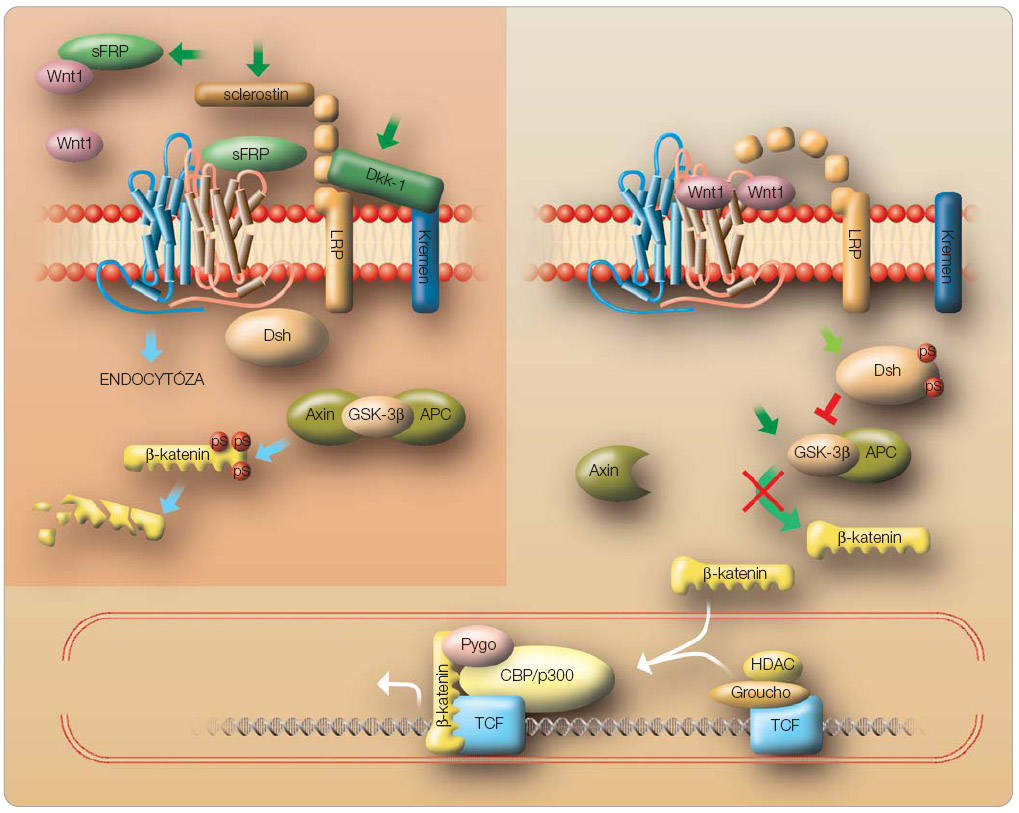 V kanonické Wnt signální cestě se Wnt ligand váže na svůj transmembránový receptor (označovaný jako Frizzled), ale jen pokud to dovolí extracelulární a membránové inhibitory a pokud je současně přítomen potřebný koreceptor. K inhibitorům patří zejména sFRP, WIF, Dkk-1 a sclerostin (viz níže). Koreceptorem jsou LRP5 nebo LRP6 (lipoprotein-receptor related protein) [9]. Vytvořeným komplexem Wnt-Frizzled-LRP5 je inhibována aktivita GSK-3β (glykogen syntáza kináza 3β). GSK-3β pak nemůže fosforylovat β-katenin (obr. 1). Pokud β-katenin není fosforylován, nemůže být ani proteozomálně degradován, akumuluje se v cytoplazmě a může se translokovat z cytoplazmy do buněčného jádra. V jádře se interakcí mezi β-kateninem a transkripčními faktory (TCF/LEF) aktivuje specifická transkripce a exprese cílových genů. Mezenchymální buňky pak diferencují do linie osteoblastů. Naopak, pokud se vytvoření komplexu Wnt-Frizzled-LRP5 zabrání a nedojde k inaktivaci GSK-3β, pak se β-katenin proteozomálně degraduje a netranslokuje se do jádra. LRP5 tak reguluje produkci organické kostní matrix, ale také expresi osteoprotegerinu a RANKL (receptor activator of nuclear factor-kappa B ligand), a tím zase osteoklastogenezi. Jednotlivé metabolické stupně signální cesty Wnt jsou možným cílem pro terapeutickou intervenci [10].
V kanonické Wnt signální cestě se Wnt ligand váže na svůj transmembránový receptor (označovaný jako Frizzled), ale jen pokud to dovolí extracelulární a membránové inhibitory a pokud je současně přítomen potřebný koreceptor. K inhibitorům patří zejména sFRP, WIF, Dkk-1 a sclerostin (viz níže). Koreceptorem jsou LRP5 nebo LRP6 (lipoprotein-receptor related protein) [9]. Vytvořeným komplexem Wnt-Frizzled-LRP5 je inhibována aktivita GSK-3β (glykogen syntáza kináza 3β). GSK-3β pak nemůže fosforylovat β-katenin (obr. 1). Pokud β-katenin není fosforylován, nemůže být ani proteozomálně degradován, akumuluje se v cytoplazmě a může se translokovat z cytoplazmy do buněčného jádra. V jádře se interakcí mezi β-kateninem a transkripčními faktory (TCF/LEF) aktivuje specifická transkripce a exprese cílových genů. Mezenchymální buňky pak diferencují do linie osteoblastů. Naopak, pokud se vytvoření komplexu Wnt-Frizzled-LRP5 zabrání a nedojde k inaktivaci GSK-3β, pak se β-katenin proteozomálně degraduje a netranslokuje se do jádra. LRP5 tak reguluje produkci organické kostní matrix, ale také expresi osteoprotegerinu a RANKL (receptor activator of nuclear factor-kappa B ligand), a tím zase osteoklastogenezi. Jednotlivé metabolické stupně signální cesty Wnt jsou možným cílem pro terapeutickou intervenci [10].
GSK-3β jako terapeutický cíl
Jedním z možných cílů farmakologické intervence může být zmíněná GSK-3β, která má v kanonické signální cestě Wnt klíčovou roli. Inhibice tohoto enzymu by zabránila fosforylaci β-kateninu. Stabilizovaný β-katenin by pak měl očekávaný efekt na další stupně této signální cesty bez ohledu na stav inhibice nebo aktivace komplexu Wnt-Frizzled-LRP5 (obr. 1). Tuto hypotézu podporuje řada experimentálních studií. Lithium chlorid, růstové faktory, inzulin a některé další inhibitory GSK-3β navozují zvýšení kostní hmoty v experimentu na zvířatech [11, 12]. Podávání inhibitoru GSK-3β (LY603281-31-8) i parathormonu mělo u ovarektomovaných krys obdobný vliv na osteogenezi, chondrogenezi a adipogenezi [13]. Po dvouměsíčním perorálním podávání LY603281-31-8 ovarektomovaným krysám se zvýšila exprese mRNA pro kostní sialoprotein, kolagen I, osteokalcin, ALP a runx2 a současně s tím se zlepšila mikroarchitektura kosti a zvýšila se hmota i mechanická síla kosti. Výsledky však nesvědčily pro zvýšenou produkci osteoprotegerinu, zatímco přímo aktivace nebo inaktivace β-kateninu u myšek měla na produkci osteoprotegerinu prokazatelný vliv [14, 15]. Protože GSK-3β je významným stupněm v celé řadě dalších signálních cest, může mít její inhibice za následek zvýšené riziko nádorového onemocnění [10].
Extracelulární a membránové stupně kaskády Wnt jako terapeutický cíl
Extracelulární a membránové stupně kaskády Wnt se pro farmakologickou manipulaci zatím jeví jako bezpečnější než inhibice GSK-3β. Patří sem různé způsoby tlumení účinku jednotlivých inhibitorů Wnt na tvorbu komplexu Wnt-Frizzled-LRP5. Vytvoření tohoto komplexu kompetitivně inhibují vyvázáním Wnt jednak solubilní frizzled related protein (sFRP) a jednak faktory inhibující Wnt (WIF). Tyto proteiny by mohly být cílem pro farmakologickou intervenci. K útlumu účinků sFRP se experimentálně osvědčily deriváty sulfonamidu.
Dále je pro vytvoření komplexu Wnt-Frizzled-LRP5 důležitá dostupnost LRP5. Inaktivující mutace genu pro LRP5 je příčinou těžké osteoporózy (osteoporosis pseudoglioma syndrome). Naopak aktivující mutace téhož genu je příčinou vzácného syndromu vysoké kostní hmoty nebo autozomální dominantní osteoporózy typu I, kdy nemůže dojít k navázání Dkk-1 na LRP5 [16, 17]. Dostupnost LRP5 blokují sclerostin, extracelulární komplex Kremen-Dkk-1 a farmakologicky lze těmto jejich účinkům zabránit.
Dkk-1
Dkk-1 (Dickkopf-1, 266 aminokyselin, 35 kD) je secernovaný protein, který vazbou na LRP5 inhibuje cestu Wnt. Myšky s inaktivací genu pro Dkk-1 mají vysokou kostní hmotu [18] a naopak transgenní myšky s nadměrnou expresí Dkk-1 mají kostní hmotu nízkou [19, 20]. Tvorba Dkk-1 v buňkách mnohočetného myelomu je jedním z vysvětlení lytických kostních lézí u pacientů s tímto onemocněním [21]. Logicky je jednou z terapeutických možností zabránit interakci mezi komplexem Kremen-Dkk-1 a LRP5, a umožnit tak účast LRP5 na aktivaci Wnt. V modelu mnohočetného myelomu u myšek se po podání protilátky proti Dkk-1 zvýšil počet osteoblastů, ubylo osteoklastů a zmenšil se rozsah postižení [22].
Sclerostin
Sclerostin je extracelulární inhibující protein cesty Wnt, který se uplatňuje kompeticí o LRP5. Pro vývoj nových léků mělo zásadní význam zjištění, že nadbytek sclerostinu navozuje osteopenii [19, 20]. Sclerostin je produktem genu SOST (SclerOSTeosis) a může se uplatňovat v regulaci funkce tzv. lining cells a množství nové kostní hmoty. Příkladem je sklerosteóza a van Buchemova nemoc, vzácné autozomálně recesivní kostní dysplazie, při kterých je výrazně vyšší kostní hmota. Příčinou sklerosteózy jsou různé inaktivující mutace SOST a i heterozygoti mohou mít větší kostní hmotu [23, 24]. Defekt při van Buchemově chorobě se nachází v místech regulujících SOST. Modelově byly tyto klinické situace ověřeny u SOST -/- myšek (vysoká kostní hmota) a u transgenních myší s nadměrnou expresí sclerostinu (velmi nízká kostní hmota). Sclerostin je vytvářen výlučně v osteocytech a jeho exprese významně klesá po podání PTH (parathormon) nebo PTHrP (parathormone-related peptide) nebo při mechanickém zatížení kosti [25, 26]. V preklinických studiích u ovarektomovaných krys a u makaků navodila monoklonální protilátka proti sclerostinu rychlé a významné zvýšení kostní hmoty a zlepšení její mikroarchitektury, aniž by se zvýšily ukazatele osteoresorpce [19, 27]. V klinické studii u žen po menopauze se již 28. den po jediném injekčním podání 10 mg monoklonální protilátky AMG785 zvýšila koncentrace markeru syntézy kolagenu (PINP) o 180 %, zatímco koncentrace markeru osteoresorpce CTX klesala (nejvíce po 14 dnech, o 50 %). Po 84 dnech se kostní denzita (BMD) v bederní páteři zvýšila o 5,4 % a v proximálním femoru o 2,9 %.
Parathormon 1-34 (teriparatid) a parathormon 1-84
Snížení tvorby sclerostinu v osteocytech je jedním z důležitých vysvětlení účinku intermitentně podávaného teriparatidu nebo parathormonu (PTH) na zvýšení novotvorby kosti a zpomalení apoptózy osteoblastů u pacientů s osteoporózou [28, 29]. Po podání PTH rychle klesá mRNA i produkce sclerostinu v kostních buňkách in vitro i in vivo [25, 30]. Ze stimulátorů novotvorby kostní hmoty se dnes v klinické praxi užívají teriparatid (PTH 1-34, N-terminální fragment 34 aminokyselin lidského parathormonu) a PTH 1-84 (plná molekula parathormonu, 84 aminokyselin). Obě látky se specificky vážou na receptor PTH-R1 spřažený s G proteinem [31]. Anabolické i katabolické účinky obou látek jsou podmíněny jejich intermitentním podáváním, které zvyšuje expresi transkripčního faktoru runx2, diferenciaci prekurzorů osteoblastů a oddaluje apoptózu osteoblastů [32–34].
PTH 1-34 i PTH 1-84 se připravují rekombinantní DNA technologií za použití E. coli a nemocným se podávají denně subkutánně injekčním perem. Vyvíjejí se však i další způsoby podání teriparatidu (např. transdermálně). Léčba stimuluje novou modelaci i remodelaci kosti především na endokortikálních površích a v trámčité kosti [35] a zlepšuje mechanické vlastnosti kostní hmoty. U žen s postmenopauzální osteoporózou se při denní aplikaci 20 mg teriparatidu po dobu 18 měsíců oproti kontrolám statisticky významně snížilo riziko radiologicky ověřených zlomenin obratlů (o 65 %) i klinických zlomenin obratlů (o 90 %). Neméně významný byl průkaz snížení rizika neobratlových zlomenin (o 35 %), u žen s vysokým rizikem fraktury (se zlomeninou v anamnéze) dokonce o 53 % [36]. Při léčbě se významně zmírnila bolest zad. U mužů se BMD zvyšovala obdobně jako u žen. Při léčbě osteoporózy indukované kortikoidy se potvrdila oprávněnost osteoanabolické léčby teriparatidem v této indikaci a prokázala se vyšší účinnost teriparatidu v porovnání s antiresorpční léčbou [37]. Riziko fraktur obratlů se snižuje také při podávání PTH 1-84 (o 61 %), ale snížení rizika neobratlových zlomenin ani snížení bolestí zad zatím nebylo prokázáno [38].
Jiné cesty k dosažení anabolického účinku parathormonu
V regulaci diferenciace osteoblastů se uplatňují systémové hormony a lokálně tvořené a hormonálně regulované cytokiny a růstové faktory. Zvýšení exprese IGF-1 (insulin-like growth factor 1) účinkem PTH je nutné pro osteoanabolické účinky PTH. Systémové podání IGF-1 však má nežádoucí účinky. Kostní morfogenní proteiny, fibroblastové růstové faktory a TGF-b (transforming growth factor β) také zlepšují hojení zlomenin a kostních defektů, ale ani jejich systémové podávání není bezpečné. Na základě nových poznatků o účinku PTH na signální cestu Wnt se hledání nových léků na osteoporózu a zejména osteoporózu indukovanou kortikoidy zaměřilo na výše zmíněné blokování sclerostinu nebo Dkk-1 specifickými monoklonálními protilátkami, na užití PTHrP nebo analog místo PTH a na ovlivnění produkce PTH kalcilytiky.
PTHrP
PTHrP (parathormone-related peptide) se tvoří v kosti a zde má fyziologický význam jako parakrinní regulátor vývoje kostních buněk [39]. V porovnání s podáním PTH trvá po injekci PTHrP (1-36) vzestup jeho sérové koncentrace kratší dobu, osteoanabolický efekt je obdobný a osteoresorpce je méně stimulovaná [40]. Kromě toho se studují různá analoga PTHrP, která se také vážou na receptor PTH-R1, např. N-terminální analog PTHrP (BA058) a cyklický peptidový analog Ostabolin C™ [41, 42].
Kalcilytika
Parathormon, PTHrP a jejich analoga jsou účinnými osteoanaboliky, ale zatím je nutná jejich parenterální aplikace a především jsou to drahé léky. Alternativou pro osteoanabolickou léčbu osteoporózy by mohly být malé molekuly podávané perorálně, které přímo nebo nepřímo aktivují sekreci endogenního PTH, a tím PTH-R1. Jako nejnadějnější se zatím jeví kalcilytika. Jsou to antagonisté CaSR (calcium-sensing receptor), mj. v membráně hlavních buněk příštítných tělísek. Kalcilytika po perorálním podání obsadí v receptoru místo pro vápník a receptor na to reaguje jako při hypokalcemii a prudce se zvýší nejenom sekrece, ale i syntéza PTH [43]. Vývoj kalcilytik začal od sloučeniny NPS-2143, která však navozovala zvýšení PTH po dobu 5 hodin, a proto stimulovala nejenom novotvorbu, ale také resorpci kosti. Důležitým zjištěním bylo, že dlouhodobé podávání kalcilytika (resp. samotná hypokalcemie) nestimuluje proliferaci buněk příštítných tělísek a nenavodí hyperparatyreózu. I když počet receptorů při dlouhodobém podávání kalcilytik klesá, nevede to ke snížení sekreční odpovědi PTH. Dostatečně krátkodobého vzestupu koncentrace PTH v séru bylo u lidí dosaženo látkou SB-423557, která se jako ester výborně vstřebává ve střevě a hned se hydrolyzuje na aktivní látku SB-423562. Po úspěšných preklinických testech se podobná sloučenina (SB-751689, ronacaleret) neosvědčila v klinické studii 2. fáze u žen s postmenopauzální osteoporózou. Kalcilytika však jen neimitují účinek PTH. Po jejich podání se do oběhu dostane obsah sekrečních vezikul, tedy nejen PTH, ale také jeho C-terminální fragmenty, proteázy a chromogranin A. CaSR jsou přítomny ve tkáních v celém těle, zejména v parafolikulárních C buňkách ve štítné žláze, v ledvinách, v žaludku, ve střevě a ve skeletu. O ovlivnění těchto dalších tkání kalcilytiky zatím nejsou informace [44]. Je proto nutné v klinických studiích ověřit a vyloučit i nežádoucí reakce, které zatím neznáme.
Závěr
Účinnost a bezpečnost léčby teriparatidem a parathormonem byla již dostatečně ověřena. Další způsoby manipulace kaskádou Wnt vyžadují opatrnost a ověření v preklinických a klinických studiích, aby se zajistila modulace signálních cest selektivně jen v osteoblastech a vyloučily se možné nežádoucí účinky [45, 46].
Práce byla podpořena Záměrem MZd ČR 000237280.
Seznam použité literatury
- [1] Johnell O, Kanis JA. An estimate of the worldwide prevalence and disability associated with osteoporotic fractures. Osteoporos Int 2006; 17: 1726–1733.
- [2] McClung M, Bone H, Cosman F, et al. A randomized, double-blind, placebo-controlled study of odanacatib (MK-822) in the treatment of postmenopausal women with low bone mineral density: 24-month results. J Bone Miner Res 2008; 23: S 82.
- [3] Seeman E, Delmas PD. Bone quality – the material and structural basis of bone strength and fragility. N Engl J Med 2006; 354: 2250–2261.
- [4] Eriksen EF, Eghbali-Fatourechi GZ, Khosla S. Remodeling and vascular spaces in bone. J Bone Miner Res 2007; 22: 1–6.
- [5] Eghbali-Fatourechi GZ, Modder UI, Charatcharoenwitthaya N, et al. Characterization of circulating osteoblast lineage cells in humans. Bone 2007; 40: 1370–1377.
- [6] Modder UI, Khosla S. Skeletal stem/osteoprogenitor cells: current concepts, alternate hypotheses, and relationship to the bone remodeling compartment. J Cell Biochem 2008; 103: 393–400.
- [7] Tu X, Joeng KS, Nakayama KI, et al. Noncanonical Wnt signaling through G protein-linked PKC-delta activation promotes bone formation. Developmental cell 2007; 12: 113–127.
- [8] Takada I, Mihara M, Suzawa M, et al. A histone lysine methyltransferase activated by non-canonical Wnt signalling suppresses PPAR-g transactivation. Nat Cell Biol 2007; 9: 1273–1285.
- [9] Mao J, Wang J, Liu B, et al. Low-density lipoprotein receptor-related protein-5 binds to Axin and regulates the canonical Wnt signaling pathway. Mol Cell 2001; 7: 801–809.
- [10] Clevers H. Wnt/b-catenin signaling in development and disease. Cell 2006; 127: 469–480.
- [11] Clement-Lacroix P, Ai M, Morvan F, et al. Lrp5-independent activation of Wnt signaling by lithium chloride increases bone formation and bone mass in mice. Proc Natl Acad Sci USA 2005; 102: 17406–17411.
- [12] Cohen P, Frame S. The renaissance of GSK3. Nat Rev Mol Cell Biol 2001; 2: 769–776.
- [13] Kulkarni NH, Wei T, Kumar A, et al. Changes in osteoblast, chondrocyte, and adipocyte lineages mediate the bone anabolic actions of PTH and small molecule GSK-3 inhibitor. J Cell Biochem 2007; 102: 1504–1518.
- [14] Glass DA 2nd, Bialek P, Ahn JD, et al. Canonical Wnt signaling in differentiated osteoblasts controls osteoclast differentiation. Developmental cell 2005; 8: 751–764.
- [15] Holmen SL, Zylstra CR, Mukherjee A, et al. Essential role of b-catenin in postnatal bone acquisition. J Biol Chem 2005; 280: 21162–21168.
- [16] Gong Y, Slee RB, Fukai N, et al. LDL receptor-related protein 5 (LRP5) affects bone accrual and eye development. Cell 2001; 107: 513–523.
- [17] Boyden LM, Mao J, Belsky J, et al. High bone density due to a mutation in LDL-receptor-related protein 5. N Engl J Med 2002; 346: 1513–1521.
- [18] Morvan F, Boulukos K, Clement-Lacroix P, et al. Deletion of a single allele of the Dkk1 gene leads to an increase in bone formation and bone mass. J Bone Miner Res 2006; 21: 934–945.
- [19] Li J, Sarosi I, Cattley RC, et al. Dkk1-mediated inhibition of Wnt signaling in bone results in osteopenia. Bone 2006; 39: 754–766.
- [20] Li X, Zhang Y, Kang H, et al. Sclerostin binds to LRP5/6 and antagonizes canonical Wnt signaling. J Biol Chem 2005; 280: 19883–19887.
- [21] Tian E, Zhan F, Walker R, et al. The role of the Wnt-signaling antagonist DKK1 in the development of osteolytic lesions in multiple myeloma. N Engl J Med 2003; 349: 2483–2494.
- [22] Yaccoby S, Ling W, Zhan F, et al. Antibody-based inhibition of DKK1 suppresses tumor-induced bone resorption and multiple myeloma growth in vivo. Blood 2007; 109: 2106–2111.
- [23] Balemans W, Ebeling M, Patel N, et al. Increased bone density in sclerosteosis is due to the deficiency of a novel secreted protein (SOST). Hum Mol Genet 2001; 10: 537–543.
- [24] Ott SM. Sclerostin and Wnt signaling–the pathway to bone strength. J Clin Endocrinol Metab 2005; 90: 6741–6743.
- [25] Keller H, Kneissel M. SOST is a target gene for PTH in bone. Bone 2005; 37: 148–158.
- [26] Robling AG, Bellido T, Turner CH. Mechanical stimulation in vivo reduces osteocyte expression of sclerostin. J Musculoskelet Neuronal Interact 2006; 6: 354.
- [27] Li X, Ominsky MS, Warmington KS, et al. Sclerostin antibody treatment increases bone formation, bone mass, and bone strength in a rat model of postmenopausal osteoporosis. J Bone Miner Res 2009; 24: 578–588.
- [28] van Bezooijen RL, ten Dijke P, Papapoulos SE, Lowik CW. SOST/sclerostin, an osteocyte-derived negative regulator of bone formation. Cytokine Growth Factor Rev 2005; 16: 319–327.
- [29] Sutherland MK, Geoghegan JC, Yu C, et al. Sclerostin promotes the apoptosis of human osteoblastic cells: a novel regulation of bone formation. Bone 2004; 35: 828–835.
- [30] Silvestrini G, Ballanti P, Leopizzi M, et al. Effects of intermittent parathyroid hormone (PTH) administration on SOST mRNA and protein in rat bone. J Mol Histol 2007; 38: 261–269.
- [31] Gensure RC, Gardella TJ, Juppner H. Parathyroid hormone and parathyroid hormone-related peptide, and their receptors. Biochem Biophys Res Commun 2005; 328: 666–678.
- [32] Frolik CA, Black EC, Cain RL, et al. Anabolic and catabolic bone effects of human parathyroid hormone (1-34) are predicted by duration of hormone exposure. Bone 2003; 33: 372–379.
- [33] Krishnan V, Moore TL, Ma YL, et al. Parathyroid hormone bone anabolic action requires Cbfa1/ Runx2-dependent signaling. Mol Endocrinol 2003; 17: 423–435.
- [34] Bellido T, Ali AA, Plotkin LI, et al. Proteasomal degradation of Runx2 shortens parathyroid hormone-induced anti-apoptotic signaling in osteoblasts. A putative explanation for why intermittent administration is needed for bone anabolism. J Biol Chem 2003; 278: 50259–50272.
- [35] Lindsay R, Cosman F, Zhou H, et al. A novel tetracycline labeling schedule for longitudinal evaluation of the short-term effects of anabolic therapy with a single iliac crest bone biopsy: early actions of teriparatide. J Bone Miner Res 2006; 21: 366–373.
- [36] Neer RM, Arnaud CD, Zanchetta JR, et al. Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med 2001; 344: 1434–1441.
- [37] Saag KG, Shane E, Boonen S, et al. Teriparatide or alendronate in glucocorticoid-induced osteoporosis. N Engl J Med 2007; 357: 2028–2039.
- [38] Greenspan SL, Bone HG, Ettinger MP, et al. Effect of recombinant human parathyroid hormone (1-84) on vertebral fracture and bone mineral density in postmenopausal women with osteoporosis: a randomized trial. Ann Intern Med 2007; 146: 326–339.
- [39] Miao D, He B, Jiang Y, et al. Osteoblast-derived PTHrP is a potent endogenous bone anabolic agent that modifies the therapeutic efficacy of administered PTH 1-34. J Clin Invest 2005; 115: 2402–2411.
- [40] Horwitz MJ, Tedesco MB, Gundberg C, et al. Short-term, high-dose parathyroid hormone-related protein as a skeletal anabolic agent for the treatment of postmenopausal osteoporosis. J Clin Endocrinol Metab 2003; 88: 569–575.
- [41] Whitfield J, Morley P, Willick G. The parathyroid hormone, its fragments and analogues–potent bone-builders for treating osteoporosis. Expert Opin Investig Drugs 2000; 9: 1293–1315.
- [42] O'Dea L, Lyttle CR, Rosen CJ. BA058, a novel analog of human parathyroid hormone-related peptide (PTHrP), induces evidence of bone formativ without evidence of bone resorption over 7 days of exposure. Annual Meeting of the Endocrine Society, 2007: Abstract P2–137.
- [43] Ethgen D, Danoff T, Schultz M, et al. Antagonism of calcium sensing receptor stimulates dose-related release of endogenous parathyroid hormone in normal volunteers: A proof of concept study. J Bone Miner Res 2007; 22: S128.
- [44] Brown EM, MacLeod RJ. Extracellular calcium sensing and extracellular calcium signaling. Physiol Rev 2001; 81: 239–297.
- [45] Brack AS, Conboy MJ, Roy S, et al. Increased Wnt signaling during aging alters muscle stem cell fate and increases fibrosis. Science 2007; 317: 807–810.
- [46] Liu H, Fergusson MM, Castilho RM, et al. Augmented Wnt signaling in a mammalian model of accelerated aging. Science 2007; 317: 803–806.