„Studie z Barcelony 2017“ kritickým pohledem
Souhrn:
Z řady klinických studií, které byly prezentovány na kongresu Evropské kardiologické společnosti v Barceloně v srpnu 2017, jsou blíže probrány tři megastudie. První z nich, studie REVEAL, prověřuje efekt inhibitoru CETP – anacetrapibu – na snížení výskytu koronárních příhod, druhá studie COMPASS porovnává účinek léčby rivaroxabanem, kyselinou acetylsalicylovou a jejich kombinací na pokles výskytu velkých vaskulárních příhod a CANTOS, třetí studie, hodnotí efekt canakinumabu (monoklonální protilátky proti interleukinu 1β) na reziduální kardiovaskulární riziko u nemocných s optimálně kontrolovanou dyslipidemií.
Key words: anacetrapib – rivaroxaban – acetylsalicylic acid – canakinumab – clinical trial.
Summary:
Three large studies are reviewed in detail from the number of studies presented at the European Society of Cardiology congress in Barcelona, August 2017. The first REVEAL study evaluates the effect of CETP inhibitor – anacetrapib – on the decrease in coronary events occurrence, the second COMPASS study compares the effect of the treatment with rivaroxaban, acetylsalicylic acid and their combination on the decrease in major vascular events occurrence, and the third CANTOS study assesses the effect of canakinumab (a monoclonal antibody against interleukin 1β) on the residual risk in patients with optimally controlled dyslipidaemia.
Letošní kongres Evropské kardiologické společnosti v Barceloně proběhl ve znamení prezentace výsledků řady „pozitivních“ klinických studií, resp. v řadě případů megastudií. Gratulacemi autorům studií, přednesených v rámci několika bloků Hot lines, se nešetřilo. Sám nestor americké kardiologie Eugene Braunwald, oponent studie COMPASS, pronesl slova o „převratné události“. Je však takový entuziasmus namístě? Podrobme dané studie kritickému pohledu zaměřenému nejen na praktickou využitelnost výsledků.
Studie REVEAL
Největší studií z „velké trojky“ byla studie HPS 3/TIMI 55 REVEAL (Randomized EValuation of the Effects of Anacetrapib through Lipid modification) s inhibitorem CETP (cholesteryl ester transfer protein) – anacetrapibem [1]. Cílem studie porovnávající jeho efekt s placebem bylo zodpovězení otázky, zda zvýšení plazmatické koncentrace cholesterolu v HDL (high density lipoprotein; HDL C) navozené inhibicí transportního proteinu CETP sníží výskyt koronárních příhod. Do více než čtyřletého sledování bylo zařazeno 30 000 nemocných s vaskulárním postižením (koronárním, cerebrálním či periferního řečiště). V iniciální otevřené fázi studie byli všichni nemocní léčeni atorvastatinem k cílovým hodnotám. Tomuto požadavku odpovídaly vstupní hodnoty lipidogramu, průměrná koncentrace LDL cholesterolu (low density lipoprotein; LDL C) byla 1,6 mmol/l. Dosažení cílových hodnot LDL C již před podáním anacetrapibu mělo snížit vliv případného poklesu LDL C. Plazmatické koncentrace HDL C byly v průměru 1,0 mmol/l, tedy u velké části nemocných suboptimální, což vyhovovalo zodpovězení položené otázky.
Toto sledování mělo vysoké ambice navzdory tomu, že předchozí prognostické studie s inhibitory CETP se neukázaly být přínosné, kardiovaskulární riziko se paradoxně významně zvyšovalo (u torcetrapibu) či nebyl pozorován žádný dopad na výskyt aterotrombotických příhod (u dalcetrapibu a evacetrapibu) [2‒4]. Realizace takovéto megastudie s dalším inhibitorem CETP, deset let po negativním sledování ILLUMINATE s torcetrapibem, tedy byla překvapením.
Též mechanismus účinku, tj.
inhibice CETP, neskýtal záruky pozitivního efektu. Blokáda
přesunu esterů cholesterolu z lipoproteinu HDL do aterogenních
lipoproteinů (VLDL [very low density lipoprotein] i LDL)
je provázena též zpomaleným předáváním cholesterolu z HDL
do jater (obr. 1).
Obsah cholesterolu v těchto lipoproteinech se zvyšuje, a tím
klesá influxní kapacita pro reverzní transport cholesterolu
lipoproteinem HDL z tkání či z makrofágů do jater.
Inhibicí odsunu cholesterolu z HDL dochází k výraznému
zvýšení koncentrace cholesterolu v těchto částicích
(zvýšení HDL C). Koncentrace HDL C se zhruba
zdvojnásobuje, vlastní počet cirkulujících částic HDL (měřeno
koncentrací apolipoproteinu A I, apoA I) se však zvyšuje
výrazně méně. Vzhledem k tomu, že antiaterogenní efekt
není dán množstvím cholesterolu v HDL, ale transportní
kapacitou tohoto lipoproteinu pro cholesterol, pak mechanismus účinku
na podkladě zvýšení HDL C nemusí vést
k antiaterogennímu efektu.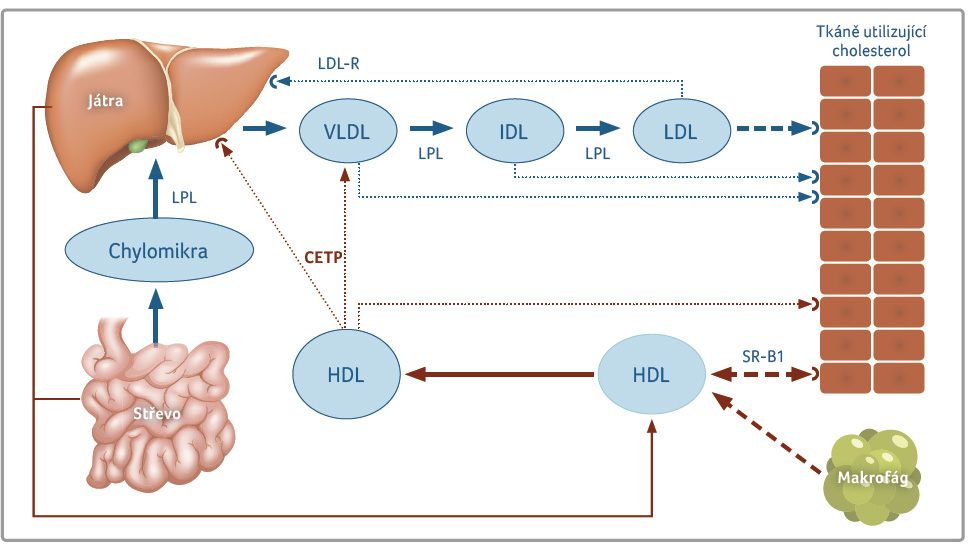
Jaké byly výsledky studie REVEAL? Efekt na snížení koncentrace LDL C, hodnoceno klasickými parametry, byl velmi dobrý (pokles o 41 %), nicméně počet LDL částic (měřeno koncentrací apolipoproteinu B, apoB) klesl jen o 18 %, tedy velikost nízkodenzitního lipoproteinu se zvětšila a posunula do méně aterogenní oblasti. Vzestup koncentrace HDL C byl více než dvojnásobný (o 104 %) a odpovídal výsledkům dosaženým s ostatními inhibitory CETP [2‒4]. Počet HDL částic stoupl daleko méně, zvýšení HDL C bylo dáno kumulací cholesterolu v HDL částicích, tj. posunem spektra od diskoidních forem HDL k formám sférickým, cholesterolem již naplněným.
Primárním cílovým ukazatelem
účinnosti studie REVEAL byl výskyt velkých koronárních příhod
(infarktu myokardu, úmrtí z koronárních příčin či
nutnost koronární revaskularizace). Doložen byl statisticky
významný pokles těchto příhod o relativních 9 %, redukce
rizika RR (relative risk) 0,91 (95% CI [interval spolehlivosti]
0,85‒0,97; p = 0,004)
(graf 1). Absolutní
pokles počtu příhod během čtyř let l![ývoj primárního cílového ukazatele účinnosti (koronární mortalita, infarkt myokardu, koronární revaskularizace) ve studii rEvEAl; podle [1] – HpS 3/TiMi 55‑rEvEAl Collaborative Group, 2017. Je patrné, že k separaci obou mortalitně/morbiditních křivek dochází až po dvou letech léčby. Ci – interval spolehlivosti; rr – relativní riziko](https://www.remedia.cz/photo-a-31338---.jpg) éčby však byl klinicky
málo významný, pouze 1 % (v anacetrapibové větvi byl
výskyt 10,8 % a v placebové 11,8 %). Jinak řečeno,
budeme léčit 100 pacientů po dobu 4 let, abychom předešli
jedné koronární příhodě. Konkrétně poklesl výskyt příhod
typu koronární revaskularizace, méně již infarktu myokardu.
Samotná koronární mortalita neklesla, stejně tak mortalita
celková či výskyt ischemického iktu. Potěšující byl mírný
pokles výskytu nově se manifestujícího diabetu (o 0,6 %),
potěšující proto, že nabourává představu, že snížení
koncentrace LDL C s sebou zákonitě přináší snížení
citlivosti k inzulinu. Naopak renální nedostatečnost byla
v intervenované větvi častější.
éčby však byl klinicky
málo významný, pouze 1 % (v anacetrapibové větvi byl
výskyt 10,8 % a v placebové 11,8 %). Jinak řečeno,
budeme léčit 100 pacientů po dobu 4 let, abychom předešli
jedné koronární příhodě. Konkrétně poklesl výskyt příhod
typu koronární revaskularizace, méně již infarktu myokardu.
Samotná koronární mortalita neklesla, stejně tak mortalita
celková či výskyt ischemického iktu. Potěšující byl mírný
pokles výskytu nově se manifestujícího diabetu (o 0,6 %),
potěšující proto, že nabourává představu, že snížení
koncentrace LDL C s sebou zákonitě přináší snížení
citlivosti k inzulinu. Naopak renální nedostatečnost byla
v intervenované větvi častější.
Shrneme li, pak ze čtyř prognostických studií s inhibitory CETP měla tato jediná příznivý efekt na pokles morbidity. Z klinického hlediska je zlepšení na hranici významnosti. Je tak málo pravděpodobné, že by závěry této práce měly odezvu v praxi. Otevřenou otázkou však zůstává efekt u populace s rizikovějším lipidovým spektrem, zejména s vyšší hodnotou LDL C. Vstupní hodnota LDL C při randomizaci, tj. při léčbě 20‒80 mg atorvastatinu, byla totiž v průměru pouze 1,6 mmol/l, tj. pod nejpřísnější cílovou hranicí. Z praktického aspektu by daleko zajímavější byla studie sledující efekt anacetrapibu u nemocných indikovaných k léčbě z důvodu vyšší koncentrace LDL C, např. v populaci netolerující terapii statiny.
Hlavní přínos studie lze spatřovat v upřesnění strategie léčby dyslipidemie. Podíváme li se na předpoklad, že zvýšení hodnoty HDL C inhibicí CETP povede k poklesu výskytu velkých vaskulárních příhod, odpověď je negativní. Dosažený pokles počtu koronárních příhod odpovídá poklesu koncentrace cholesterolu v aterogenních lipoproteinech, tj. odpovídá zejména poklesu hodnoty LDL C, resp. poklesu plazmatické koncentrace částic LDL, tedy snížení koncentrace apoB. Tento závěr, tj. minimální uplatnění zvýšení koncentrace HDL C, podporuje i neutrální výsledek prognostické studie s dalcetrapibem (dal OUTCOMES), v níž došlo k významnému vzestupu koncentrace HDL C, ale nikoliv k poklesu hodnoty LDL C [3]. Studie ACCELERATE s evacetrapibem není z tohoto pohledu použitelná pro své relativně kratší trvání (méně než 2 roky), pozitivní účinek anacetrapibu se totiž projevil až ve třetím roce léčby [4] (graf 1).
Studie COMPASS
Druhou velkou a velmi diskutovanou studií bylo klinické hodnocení COMPASS (Rivaroxaban with or without Aspirin in Stable Cardiovascular Disease) [5].
Cílem této studie bylo ověřit, zda přímé perorální antikoagulans rivaroxaban (2× denně 5 mg) či kombinace rivaroxabanu (2× 2,5 mg) s kyselinou acetylsalicylovou (ASA; 1× 100 mg) sníží výskyt velkých vaskulárních příhod typu MACE (major adverse cardiovascular event) ‒ úmrtí z kardiovaskulárních příčin, iktus či infarkt myokardu. Studie byla realizována u více než 27 000 nemocných se stabilizovaným aterosklerotickým postižením v koronárním řečišti či v povodí dolních končetin. Nemocných s přítomností ischemické choroby dolních končetin (ICHDK) bylo více než čtvrtina. Předpokládaná délka studie byla 3‒4 roky, její síla byla proponována na výskyt 2 200 příhod. Kyselina acetylsalicylová byla podávána v enterosolventní formě.
Na základě dosažení
statistické významnosti p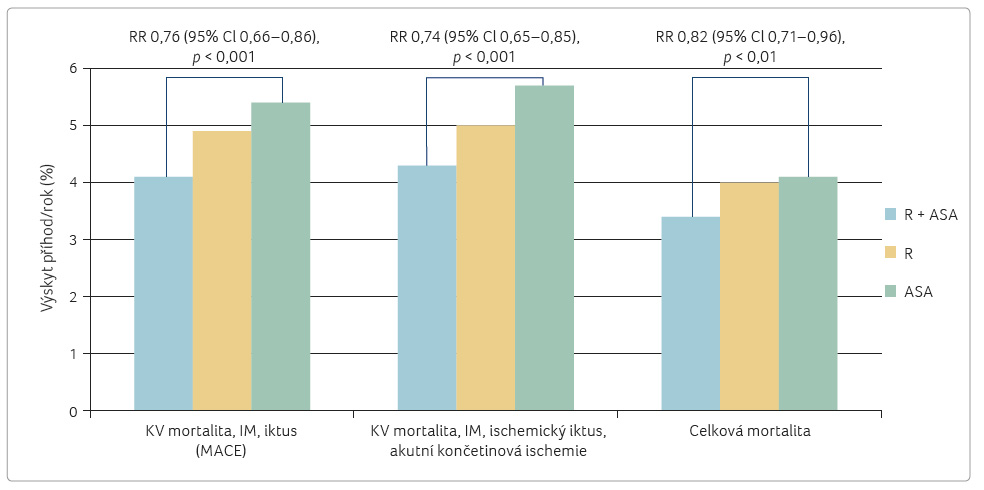 oklesu výskytu velkých vaskulárních
příhod mezi větví léčenou kombinací (rivaroxaban s ASA,
R + ASA) proti větvi s ASA byla studie předčasně
po téměř dvou letech ukončena (průměrná délka sledování
byla 23 měsíců). Ve větvi kombinované (R + ASA)
se velké vaskulární příhody objevily v 4,1 %,
v rivaroxabanové v 4,9 % a ve větvi léčené
ASA v 5,4 %. Rozdíl 24 % (RR 0,76; 95% CI
0,66‒0,86; p = 0,0001)
mezi větví kombinovanou a ASA byl vysoce významný, rozdíl
mezi větví rivaroxabanovou versus větví kombinovanou (R + ASA)
byl nevýznamný (graf 2).
Přínos kombinační léčby byl dán poklesem výskytu mozkových
příhod s následujícími hodnotami: RR 0,58; 95% CI 0,44‒0,76;
p < 0,0001.
Při sledování efektu terapie v podskupinách s ischemickou
chorobou srdeční (ICHS) a s ICHDK byl příznivý
účinek patrný v obou podskupinách – v první
(ICHS) klesl významně výskyt velkých cévních příhod
o čtvrtinu při kombinační léčbě (R + ASA vs.
ASA) neboli hodnota redukce rizika byla 0,74 (95% CI 0,65‒0,86;
p = 0,001),
ve druhé skupině (ICHDK) byl rozdíl 28 % ‒
RR 0,72 (95% CI 0,57‒0,90; p = 0,001).
Tolik k relativnímu snížení rizika. V absolutním počtu
byl pozorován v celé kohortě při léčbě rivaroxabanem
v kombinaci s ASA pokles o 1,3 velkých cévních
příhod, resp. o 0,5 úmrtí z kardiovaskulárních
příčin na každých 100 léčených po dobu téměř dvou let
v porovnání s léčbou ASA.
oklesu výskytu velkých vaskulárních
příhod mezi větví léčenou kombinací (rivaroxaban s ASA,
R + ASA) proti větvi s ASA byla studie předčasně
po téměř dvou letech ukončena (průměrná délka sledování
byla 23 měsíců). Ve větvi kombinované (R + ASA)
se velké vaskulární příhody objevily v 4,1 %,
v rivaroxabanové v 4,9 % a ve větvi léčené
ASA v 5,4 %. Rozdíl 24 % (RR 0,76; 95% CI
0,66‒0,86; p = 0,0001)
mezi větví kombinovanou a ASA byl vysoce významný, rozdíl
mezi větví rivaroxabanovou versus větví kombinovanou (R + ASA)
byl nevýznamný (graf 2).
Přínos kombinační léčby byl dán poklesem výskytu mozkových
příhod s následujícími hodnotami: RR 0,58; 95% CI 0,44‒0,76;
p < 0,0001.
Při sledování efektu terapie v podskupinách s ischemickou
chorobou srdeční (ICHS) a s ICHDK byl příznivý
účinek patrný v obou podskupinách – v první
(ICHS) klesl významně výskyt velkých cévních příhod
o čtvrtinu při kombinační léčbě (R + ASA vs.
ASA) neboli hodnota redukce rizika byla 0,74 (95% CI 0,65‒0,86;
p = 0,001),
ve druhé skupině (ICHDK) byl rozdíl 28 % ‒
RR 0,72 (95% CI 0,57‒0,90; p = 0,001).
Tolik k relativnímu snížení rizika. V absolutním počtu
byl pozorován v celé kohortě při léčbě rivaroxabanem
v kombinaci s ASA pokles o 1,3 velkých cévních
příhod, resp. o 0,5 úmrtí z kardiovaskulárních
příčin na každých 100 léčených po dobu téměř dvou let
v porovnání s léčbou ASA.
Primárním cílovým ukazatelem
bezpečnosti studie byl (obdobně jako v podobných sledováních)
výskyt velkých krvácivých příhod. Ty se objevily ve 3,1 %
ve větvi s kombinovanou léčbou (R + ASA),
ve 2,8 % ve větvi rivaroxabanové a v 1,9 %
ve větvi léčené ASA. V porovnání s ASA se velká
krvácení objevila o 70 % častěji, tj. RR 1,70 (95% CI
1,40‒2,05; p < 0,0001)
při léčbě rivaroxabanem s ASA, resp. o polovinu častěji
při léčbě rivaroxabanem samotným ‒ RR 1,51 (95% CI 1,25‒1,84;
p < 0,0001).
V absolutních číslech se tedy na 100 ![Výskyt primárního cílového ukazatele účinnosti (KV mortalita, infarkt myokardu, iktus), dále primárního cílového ukazatele bezpečnosti (velká krvácení) a celkového klinického přínosu (KV mortalita, infarkt myokardu, iktus a velká krvácení) ve studii COMPASS; podle [5] – Eikelboom, et al., 2017. ASA – kyselina acetylsalicylová; CI – interval spolehlivosti; IM – infarkt myokardu; KV – kardiovaskulární; NS – statisticky nevýznamný rozdíl; R – rivaroxaban; RR – relativní riziko](https://www.remedia.cz/photo-a-31340---.jpg) léčených po dobu
téměř dvou let objevilo o 1,2 velkých krvácivých
komplikací více při léčbě kombinované, resp. o 0,9 % více
při léčbě rivaroxabanem v porovnání s léčbou ASA.
Fatálních krvácení bylo málo a rozdíly nebyly významné
(graf 3).
léčených po dobu
téměř dvou let objevilo o 1,2 velkých krvácivých
komplikací více při léčbě kombinované, resp. o 0,9 % více
při léčbě rivaroxabanem v porovnání s léčbou ASA.
Fatálních krvácení bylo málo a rozdíly nebyly významné
(graf 3).
Porovnáme li standardním přístupem klinický přínos (net clinical benefit), tj. sečteme li primární cílový ukazatel účinnosti (výskyt velkých cévních příhod) s primárním cílovým ukazatelem rizika (velká krvácení), dostaneme pro kombinovanou léčbu hodnotu 7,2 % (4,1 % + 3,1 %), pro rivaroxabanovou větev hodnotu 7,7 % (4,9 % + 2,8 %) a pro větev léčenou pouze ASA hodnotu 7,3 % (5,4 % + 1,9 %). Tedy absolutní klinický přínos se v jednotlivých větvích neliší (graf 3). Zahrneme li místo velkých krvácení pouze fatální a přímo život ohrožující krvácení, pak však určitý přínos zachován je: absolutní výskyt cévních příhod a fatálních a život ohrožujících krvácení klesl během téměř dvou let léčby o 1 %, resp. o relativních 20 %.
Porovnejme výsledek s podobnými studiemi. Nabízí se mi srovnání se studií CHARISMA, kdy v obdobné populaci s přítomností aterotrombotického postižení byl přínos duální protidestičkové léčby (ASA + klopidogrel) proti samotné ASA rovněž omezen vyšším výskytem velkých krvácivých příhod [6]. Jiná byla situace při porovnání ASA s klopidogrelem ve studii CAPRIE [7]. V ní byl v subpopulaci s přítomností ICHDK pozorován významný 22% pokles počtu velkých vaskulárních příhod – RR 0,78 (95% CI 0,65–0,93), tedy efekt zcela srovnatelný s kombinací rivaroxaban a ASA ve stejné subpopulaci. Na rozdíl od studie COMPASS však velká krvácení při léčbě klopidogrelem nebyla častější. Při nepřímém porovnání efektu ASA v subpopulaci nemocných s ICHDK tak klopidogrel vychází v porovnání s kombinací rivaroxaban a ASA stran účinnosti stejně výhodný a stran bezpečnosti výhodnější. Z tohoto pohledu je škoda, že ve studii COMPASS u nemocných s ICHDK nebyl porovnáván efekt rivaroxabanu se zlatým standardem protidestičkové léčby, tj. s klopidogrelem.
Jaké jsou metodické výhrady ke studii COMPASS? Zazněly kritiky k předčasnému ukončení studie z důvodu dosažení signifikantního efektu v jedné větvi. Studie byla navržena statisticky s cílem hodnotit 2 200 cévních příhod. Celkem bylo analyzováno 1 323 příhod, tedy o více než třetinu menší počet, než na jaký bylo sledování navrženo. Nedomnívám se, že by tento rozdíl významně ovlivnil získaná data, ta by byla pravděpodobně pouze silnější.
Co však pokládám za významný nedostatek, je použití komparátoru, který nemá doložený efekt. Ve všech prezentacích i ve vlastním článku v New England Journal of Medicine se mluví o „aspirinu“, tedy obecně o kyselině acetylsalicylové. V metodice však je uvedeno, že „study aspirin was enteric coated“, tedy byla užita enterosolventní léková forma. Vedle výhrad k biologické dostupnosti této lékové formy je zásadním nedostatkem naprostá absence dokladu o účinnosti. Máme výsledky dvou studií provedených s enterosolventní ASA jak v primární prevenci – Japanese Primary Prevention Project [8], tak u nemocných s asymptomatickou formou aterosklerotického postižení dolních končetin – studie Aspirin for Asymptomatic Atherosclerosis [7]. Obě práce doložily naprosto stejný efekt léčby enterosolventní ASA a placeba. Výsledek studie ASPREE, bohužel opět v indikaci primární prevence, nebyl zatím zveřejněn [10]. Jediná „pozitivní“ studie ISIS 2, trvající však jen čtyři týdny, sice deklarovala užití enterosolventní ASA, ale dle metodiky byly tablety před užitím rozkousány. Výsledkem byla forma rychle rozpustná. Blíže je problematika enterosolventní formy ASA rozebrána jak z pohledu farmakologa/kardiologa, tak z pohledu farmakologa/farmaceuta ve 2. a 4. čísle časopisu Remedia z letošního roku [11,12]. Není li věrohodně doložena účinnost ASA v enterosolventní formě (na rozdíl od formy rychle rozpustné), může být zpochybněn i závěr studie COMPASS, tj. superiorita kombinace rivaroxabanu v kombinaci s ASA proti samotné ASA. Závěry platí pouze pro danou lékovou formu.
Studie CANTOS
Autoři třetí studie s označením CANTOS (Canakinumab Anti inflammatory Thrombosis Outcomes Study) si položili otázku, zda u stabilizovaných nemocných po infarktu myokardu s optimální koncentrací LDL C, ale se suboptimální koncentrací C reaktivního proteinu (CRP) povede protizánětlivá léčba ke snížení reziduálního kardiovaskulárního rizika [13]. Tedy práce především prověřovala platnost „zánětlivé teorie aterotrombózy“. Do studie CANTOS bylo zařazeno více než 10 000 nemocných, kteří byli léčeni třemi různými dávkami canakinumabu či jim bylo podáváno placebo. Vstupní hodnota LDL C se blížila hodnotám optimálním (byla v průměru 2,1 mmol/l), naopak hodnota vysoce senzitivního CRP (high sensitive CRP, hsCRP) byla vyšší (v průměru 4,1 mg/l).
Canakinumab, jak naznačuje přípona umab, je plně humánní monoklonální protilátka proti interleukinu 1β (IL 1β), která neutralizuje jeho aktivitu. Interleukin 1β, součást komplexu prozánětlivých proteinů (NLRP3 inflamazomu), stojí na vrcholu kaskády spouštějící defenzivní a reparační pochody označované jako zánět. Přímým výsledkem nízké aktivity IL 1β je pokles počtu řady zánětlivých cytokinů, zejména interleukinu 6 (IL 6) a CRP s výsledným útlumem celého procesu. Na jedné straně tak snížíme obranyschopnost organismu např. proti infekci, na straně druhé však můžeme inhibovat chronické procesy, kde se významněji zánět účastní (např. u revmatických chorob či v aterogenezi, kde interakce inflamazomu s krystaly cholesterolu hraje v celém procesu významnou úlohu).
Poločas plazmatické eliminace
canakinumabu je dlouhý (4‒8 týdnů), proto je aplikován
podkožně každé tři měsíce. Použití canakinumabu je
schváleno v několika indikacích v rámci
zánětlivých neurologických či kloubních onemocnění (např.
dny). Širší uplatnění je omezeno velmi vysokými náklady.![Vývoj plazmatické koncentrace hsCRP a lipoproteinů v průběhu studie CANTOS; podle [13] – Ridker, et al., 2017. HDL‑C – HDL cholesterol; hsCRP – vysoce senzitivní C‑reaktivní protein; LDL‑C – LDL cholesterol; s.c. – subkutánní aplikace; TG – triglyceridy](https://www.remedia.cz/photo-a-31341---.jpg)
Během čtyřletého sledování
(průměr 3,7 roku) byl pozorován významný pokles koncentrace
hsCRP, po adjustaci na efekt placeba klesla hodnota téměř
o 40 %. Obdobně byla snížena koncentrace IL 6. Naopak
lipidogram se během studie neměnil (graf 4). Primární cílový ukazatel účinnosti typu MACE
(kardiovaskulární mortalita, infarkt myokardu a iktus) se při
léčbě vyšší dávkou canakinumabu významně snížil o 15 %
(RR 0,85; 95% CI 0,74‒0,98; p = 0,02)
(graf 5). Podíváme li
se na výsledky z pohledu absolutních čísel, pak při
podávání placeba se primární cílový ukazatel účinnosti
(MACE) objevil ve 4,5 % ročně a v 3,9 % ročně
při podávání vyšších dávek canakinumabu. Absolutní přínos
nebyl významný, výskyt velkých kardiovaskulárních příhod
poklesl o 0,6 % ročně. Výskyt příhod za celou dobu
studie uveden nebyl. Léčba canakinumabem neovlivnila celkovou ani
kardiovaskulární mortalitu.![Výskyt primárního cílového ukazatele účinnosti (KV mortalita, infarkt myokardu, iktus) i sekundárních cílových ukazatelů (infarkt myokardu či koronární revaskularizace) ve studii CANTOS; podle [13] – Ridker, et al., 2017. CI – interval spolehlivosti; IM – infarkt myokardu; KV – kardiovaskulární; MACE – velká nepříznivá kardiovaskulární příhoda, major adverse cardiovascular event; RR – relativní riziko](https://www.remedia.cz/photo-a-31342---.jpg)
Při sledování bezpečnosti nebyl zjištěn rozdíl mezi aktivní léčbou či placebem ve výskytu všech vážných nežádoucích účinků. Statisticky významně se však zvýšil (asi o 70 %) výskyt úmrtí na infekce (v absolutních číslech o 0,1 %). Naopak poklesl počet úmrtí na nádorová onemocnění (o 0,1‒0,3 %).
Shrneme li výsledek studie, pak z klinického pohledu není přínos velký. Pokles MACE o relativních 15 %, resp. absolutních 0,6 %, se odvíjel zejména od snížení incidence infarktu myokardu, mortalita ovlivněna nebyla. Uvědomíme li si současnou cenu canakinumabu, která se pohybuje kolem 200 000 dolarů/rok, pak se o farmakoekonomické únosnosti rozhodně mluvit nedá.
Na straně druhé je nutno tuto studii velmi ocenit z hlediska nové koncepce léčby. Vynecháme li „protizánětlivé“ působení hypolipidemik (zejména statinů), pak se jedná o první prognostickou kontrolovanou studii, která ukázala, že léčba cílená na zánětlivé cytokiny může být přínosná. Konkrétně bylo doloženo snížení incidence aterotrombotických příhod, jmenovitě příhod koronárních. Rýsuje se tak nová strategie. Bude však nutno počkat na výsledky obdobné Ridkerovy studie CIRT (Cardiovascular Inflammation Reduction Trial) s metotrexátem, jejíž výsledek se očekává v roce 2020 [14]. Možná, že budeme přehodnocovat též význam pleiotropního efektu statinů. U řady inhibitorů 3 hydroxy 3 metyl glutaryl CoA (HMG CoA) reduktázy je doložen útlum aktivity zánětlivých cytokinů. Například ve studii DUAAL (DoUble blind Atorvastatin AmLodipine trial) klesla koncentrace hsCRP o 40 %, zde však prognostický účinek primárně odvíjíme od efektu hypolipidemického [15]. Primární je dyslipidemie, která umožní akumulaci krystalů cholesterolu v subendoteliálním prostoru, teprve tímto dějem je aktivován inflamazom. Je tak pravděpodobné, že strategie cílená na prevenci aterotrombotických příhod se ‒ vedle léčby rizikových faktorů a trombotické aktivace ‒ rozšíří též na léčbu protizánětlivou.
Podpořeno Kardiovaskulárním výzkumným programem Univerzity Karlovy – Progres Q38.
Seznam použité literatury
- [1] The HPS 3/TIMI 55‑REVEAL Collaborative Group. Effects of Anacetrapib in Patients with Atherosclerotic Vascular Disease. N Engl J Med 2017; 377: 1217‑1227.
- [2] Barter PJ, Caulfield M, Eriksson M, et al. Effects of Torcetrapib in Patients at High Risk for Coronary Events. N Engl J Med 2007; 357: 2109–2122.
- [3] Schwartz GG, Olsson AG, Abt M, et al. Effects of Dalcetrapib in Patients with a Recent Acute Coronary Syndrome. N Engl J Med 2012; 367: 2089–2099.
- [4] Lincoff MA, Nicholls SJ, Riesmeyer JS, et al. Evacetrapib and Cardiovascular Outcomes in High‑Risk Vascular Disease. N Engl J Med 2017; 376: 1933–1942.
- [5] Eikelboom JW, Connolly SJ, Bosch J, et al. Rivaroxaban with or without Aspirin in Stable Cardiovascular Disease. N Engl J Med 2017 Aug 27. doi: 10.1056/NEJMoa1709118
- [6] CHARISMA Investigators: Clopidogrel and Aspirin versus Aspirin Alone for the Prevention of Atherothrombotic Events. N Engl J Med 2006; 354: 1706–1717.
- [7] CAPRIE Steering Committee: A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). Lancet 1996; 348: 1329–1339.
- [8] Ikeda Y, Shimada K, Teramoto T, et al. Low‑dose aspirin for primary prevention of cardiovascular events in Japanese patients 60 years or older with atherosclerotic risk factors: a randomized clinical trial. JAMA 2014; 312: 2510–2520.
- [9] Fowkes FG, Price JF, Stewart MC, et al. Aspirin for Asymptomatic Atherosclerosis Trialists, Aspirin for prevention of cardiovascular events in a general population screened for a low ankle brachial index: a randomized controlled trial. J Am Med Assoc 2010; 303: 841–848.
- [10] McNeil JJ, Woods RL, Nelson MR, et al. Baseline Characteristics of Participants in the ASPREE (ASPirin in Reducing Events in the Elderly) Study. J Gerontol A Biol Sci Med Sci 2017 Jan 20. doi: 10.1093/gerona/glw342
- [11] Bultas J, Karetová D. Enterosolventní forma kyseliny acetylsalicylové – ano, či ne? Remedia 2017; 27: 145–151.
- [12] Juřica J. Kyselina acetylsalicylová – galenické faktory ovlivňující antiagregační účinek. Remedia 2017; 27: 377–382.
- [13] Ridker PM, Everett BM, Thuren T, et al. Anti‑inflammatory Therapy with Canakinumab for Atherosclerotic Disease. N Engl J Med 2017 Aug 27. doi: 10.1056/NEJMoa1707914
- [14] Everett BM, Pradhan AD, Solomon DH, et al. Rationale and design of the Cardiovascular Inflammation Reduction Trial: a test of the inflammatory hypothesis of atherothrombosis. Am Heart J 2013; 166: 199–207.
- [15] Deanfield JE, Sellier P, Thaulow E, et al. Potent anti‑ischaemic effects of statins in chronic stable angina: incremental benefit beyond lipid lowering? Eur Heart J 2010; 31: 2650–2659.