Těžké eozinofilní astma
Souhrn:
Článek pojednává o problematice těžkého eozinofilního astmatu a jeho postavení v diagnostice, fenotypizaci a léčbě. Většina pacientů s astmatem dnes může být poměrně snadno léčena díky dostupnosti vysoce efektivní terapie. Ukazuje se, že přibližně 5 % astmatiků trpí takovou formou onemocnění, u níž tato léčba selhává. Astma pak označujeme jako těžké, někdy také jako tzv. na terapii rezistentní. Sku-tečná praxe je však jiná ‒ víme, že více než polovina astmatiků má potíže a asi jedna třetina potíže těžké. Proto je důležité odlišovat skutečné těžké rezistentní astma od astmatu obtížně léčitelného, na němž se podílejí rovněž jiné faktory (problematika chybné inhalační techniky, nepoznané komorbidity, trvající abúzus cigaret ad.).
Summary:
The article reviews the issue of severe eosinophilic asthma and its status in diagnostics, phenotyping, and treatment. Most patients with asthma can be treated quite easily with available effective therapy. It has been shown that approximately 5% of asthma patients suffer from a disease type for which this treatment fails. As a result, such asthma is described as severe, sometimes as treatment resistant asthma as well. However, common practice shows otherwise – we know that more than half asthma patients experience difficulty, and around one third severe problems. Therefore, it is important to discern between true severe resistant asthma and asthma that is diffi-cult to treat which is influenced by other factors as well (improper inhalation technique, unrecognized comorbidities, concurrent to-bacco abuse, etc.).
Key words: asthma, severe asthma, eosinophilia, asthma diagnostics and treatment.
Úvod
Cíle formulované v dokumentu Globální strategie péče
o astma a jeho prevenci se nijak zásadně nemění. Stále je
v popředí zájmu dosažení kontroly nad astmatem, tedy omezení výskytu
denních a nočních symptomů, minimalizace rizika budoucích exacerbací,
fixní obstrukce dýchacích cest a redukce výskytu nežádoucích účinků léčby [1].
Naprostá většina pacientů může dosáhnout kontroly nad astmatem na základě
pětistupňové léčby astmatu (obr. 1) dle doporučení Globální iniciativy pro
astma (Global Initiative for Asthma, GINA), pokud je správně stanovena
diagnóza, dodržena adherence k léčbě a správná inhalační technika
a pokud jsou léčeny komorbidity, které mohou zhoršovat příznaky astmatu.
Existuje skupina nemocných s těžkým astmatem (někdy zvaným refrakterní
astma), kteří i přes adekvátní terapii trpí každodenními příznaky astmatu.
Jedná se v zásadě o pacienty, kteří nevykazují dostatečnou odezvu
na komplexní léčbu astmatu [2]. U takových nemocných nepostačují
kroky 1–4 doporučené léčby dle GINA ke kontrole nad astmatem. Takové astma
vyžaduje speciální přístup ve vyšetřování a terapii, jež probíhají
ideálně v ambulanci centra pro těžké astma nebo alespoň ve spolupráci
s ním.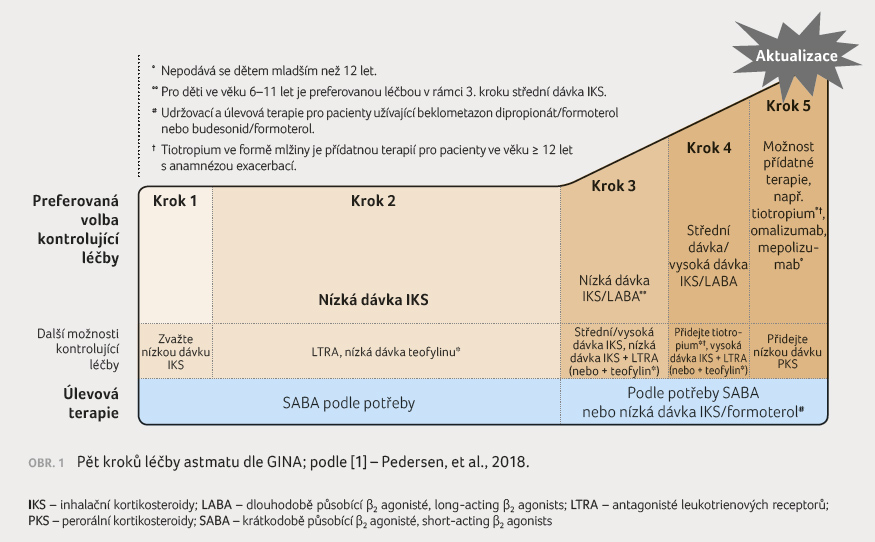
Definice fenotypů
Podle českých doporučených postupů pro diagnostiku
a léčbu astmatu rozeznáváme tři základní fenotypy astmatu
v závislosti na přítomnosti či nepřítomnosti klinicky významné
alergie a na typu endobronchiálního zánětu. Jedná se
o eozinofilní alergické astma, eozinofilní nealergické astma a non‑eozinofilní
nealergické astma. Těžké eozinofilní astma je tedy charakterizováno fenotypem
a tíží astmatu. Jedná se o astma, nad nímž nelze dosáhnout plné
kontroly navzdory užívání vysoké dávky inhalačních kortikosteroidů
a dalších astma kontrolujících léků, s přítomností eozinofilního
zánětu v dýchacích cestách (přesná kritéria Evropské respirační
společnosti/Americké hrudní společnosti [European Respiratory Society/American
Thoracic Society, ERS/ATS] viz tab. 1) [3].
Diagnostika
Správná diagnóza těžkého eozinofilního astmatu spočívá ve dvou
fázích. Nejprve je nutné zjistit, zda se opravdu jedná o těžké
perzistující astma podle doporučených postupů pro diagnostiku a léčbu
obtížně léčitelného asthma bronchiale nebo o těžké astma dle doporučení
ERS/ATS, a poté následuje určení konkrétního fenotypu průkazem klinicky
významné alergie a typu endobronchiálního zánětu [2].
Diagnóza průduškového astmatu je stanovena na základě
typických příznaků, průběhu a výsledků funkčního vyšetření plic
s pozitivním bronchomotorickým testem. Typickými příznaky jsou dušnost,
kašel, nepříjemné pocity na hrudníku, pískavé dýchání, především
ve výdechu, a výskyt těchto symptomů i v noci. Průběh
těchto obtíží bývá epizodický s obdobími bez jakýchkoliv příznaků. Obtíže
mohou být vázané na konkrétní místo, expozici určité noxe či alergenu nebo
na určitou denní dobu. Bronchiální hyperreaktivitu pak prokážeme
pozitivním bronchodilatačním testem. V případě, že bronchodilatační test
je negativní, ale symptomy odpovídají diagnóze astmatu, provedeme bronchokonstrikční
test [5].
Těžké perzistující astma je pak definováno podle kritérií
Pracovní skupiny pro těžké astma ERS/ATS, jak je uvedeno v tabulce 1.
Dokument obsahuje hlavní kritéria a poté definici špatné kontroly nad
astmatem. Ta vychází z předpokladu, že je astma správně diagnostikováno,
jsou dodržována režimová opatření, pacient si osvojil správnou inhalační
techniku a léky užívá pravidelně, jsou léčeny též komorbidity, které mohou
zhoršovat symptomy, a jsou identifikovány a omezeny případné alergeny
či noxy pracovního prostředí, jež mohou ovlivňovat astma [4].
Průkaz eozinofilního typu zánětu
Vyšetřování typu endobronchiálního zánětu můžeme rozdělit
na invazivní a neinvazivní metody. K invazivním metodám patří
bioptické vyšetření sliznice nebo semiinvazivní bronchoalveolární laváž,
případně vyšetření indukovaného sputa. Ve sputu svědčí pro eozinofilii
podíl eozinofilů v celkové populaci leukocytů v množství 2 %
a více. Mezi neinvazivní metody pak řadíme vyšetření vydechovaného
vzduchu, a to především stanovení koncentrace oxidu dusnatého
a leukotrienů [6]. Pro endobronchiální eozinofilii dále může svědčit
zvýšená hodnota eozinofilního kationického proteinu (ECP) v periferní krvi
a eozinofilie v diferenciálním rozpočtu krevního obrazu [3]. Eozinofilní
typ zánětu dokládá též polypózní postižení vedlejších nosních dutin.
Vyšetření vydechovaného vzduchu
Oxid dusnatý (NO) vzniká v dýchacích cestách
v epiteliálních buňkách pomocí indukovatelné NO syntázy. Bylo prokázáno,
že u pacientů s asthma bronchiale je produkován ve větší míře
[7,9]. V dýchacích cestách působí NO na hladké svaly, cévy
a bronchy a má relaxační a vazodilatační účinky. Oxid dusnatý
rovněž působí na imunitní systém a má protizánětlivý
i prozánětlivý efekt. Způsobuje zvýšenou infiltraci dýchacích cest eozinofily
a zárověn snižuje jejich apoptózu, zvyšuje permeabilitu cév. Může však
také snižovat jejich chemotaxi leukocytů a aktivaci mastocytů [7].
Oxid dusnatý ve vydechovaném vzduchu můžeme měřit
chemiluminiscenční reakcí s ozonem nebo pro praxi jednodušší metodou
elektrochemické detekce. Pacient při vyšetření vydechuje do přístroje
konstantním proudem vzduch dle indikátoru na tomto přístroji. Vysoké
hodnoty měření NO ve vydechovaném vzduchu (FeNO > 50 ppb) svědčí pro
eozinofilní typ zánětu před léčbou kortikosteroidy a zároveň predikují
odpověď na terapii kortikosteroidy. Při léčbě astmatu může kolísání
koncentrace FeNO, resp. její nárůst predikovat exacerbace astmatu [7].
Periostin
Periostin je protein extracelulární matrix tvořený
epiteliálními buňkami dýchacích cest. Jeho produkce je stimulována interleukiny
4 a 13. V klinických studiích bylo prokázáno, že periostin může být
prediktivním markerem eozinofilního typu zánětu dýchacích cest u pacientů
s astmatem [10].
Léčba těžkého eozinofilního astmatu
Inhalační kortikosteroidy
Inhalační kortikosteroidy (IKS) jsou stále považovány
za lék první volby při léčbě astmatu. Udržují astma pod kontrolou
u převážné většiny pacientů [5]. Nemocní s tímto typem astmatu jsou
vždy léčeni vysokými dávkami IKS (tab. 2) a často užívají trvale
i perorální kortikosteroidy (PKS). Používání fixních kombinací IKS
a β2 agonistů s dlouhodobým účinkem je doporučeno. U části
nemocných je možné zlepšit kontrolu astmatu zvýšením dávky kortikosteroidů
(> 2 mg u IKS, na 40–60 mg prednizolonu u PKS) nebo prováděním
pulzní léčby kortikosteroidy (125–500 mg metylprednizolonu zhruba
1× měsíčně) obvykle po dobu šesti měsíců. Pacienti s trvalou
perorální kortikoterapií musejí být sledováni s ohledem na časté
nežádoucí účinky [2].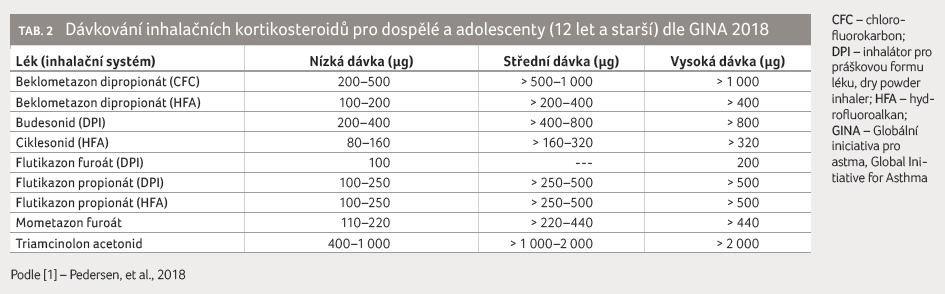
Agonisté β2 receptoru
Pokud není dosaženo kontroly nad astmatem nízkou dávkou IKS,
přidáváme do terapie inhalační β2 agonisty, ideálně ve fixní
kombinaci s IKS. Bylo prokázáno, že tato kombinace zlepšuje kontrolu nad
astmatem, zlepšuje plicní funkce a redukuje počet exacerbací
v porovnání s monoterapií [5].
Inhalační β2 agonisté s krátkodobým účinkem (short‑acting
β2 agonists, SABA) se užívají jako záchranná medikace při zhoršování
dušnosti. Není vhodné pravidelné užívání SABA, vzhledem k pozorovanému
snížení počtu β2 receptorů (down‑regulace) při pravidelné terapii mohou rovněž
zhoršovat refluxní nemoc jícnu. Inhalační β2 agonisté s dlouhodobým
účinkem (long‑acting β2 agonists, LABA) ‒ např. formoterol a salbutamol ‒
jsou dle mezinárodních doporučení vhodní v léčbě astmatu pouze
v kombinaci s IKS.
Inhalační β2 agonisté s ultradlouhodobým účinkem (ultra‑long‑acting
β2 agonists, U‑LABA), mezi něž patří indakaterol, olodaterol a vilanterol,
jsou schváleni pro léčbu chronické obstrukční plicní nemoci (CHOPN). Indikaci
pro terapii astmatu má pouze vilanterol (v kombinaci s flutikazonem).
Teofyliny
Bronchodilatační účinek je ve srovnání se SABA
i LABA podstatně menší, přesto podávání dlouhodobě působících teofylinů
u některých nemocných s těžkým astmatem výrazně sníží jejich
morbiditu, zvláště u těch s neutrofilním typem zánětu dýchacích cest.
Je prokázán imunomodulační a kortikosenzitizující vliv teofylinu
i v malých dávkách [8]. Nevýhodou je možnost zhoršení refluxní nemoci
jícnu, lékových interakcí či rizika předávkování teofyliny při opakované
parenterální aplikaci, např. při akutní exacerbaci astmatu [2].
Antileukotrieny
Některé studie potvrdily příznivý účinek inhibitorů
receptorů CysLT1 na průběh astmatu, včetně těžkých forem. Podávání
antileukotrienů umožnilo u těchto nemocných snížit dávku systémových
kortikosteroidů, aniž by došlo ke zhoršení kontroly nad onemocněním.
Rovněž je prokázán jejich příznivý efekt u aspirin senzitivního astmatu,
resp. u pacientů s nosní polypózou [2].
Tiotropium
Tiotropium je dlouhodobě působící muskarinový antagonista
(long‑acting muscarinic antagonist, LAMA) používaný v inhalační formě
ke zmírnění příznaků CHOPN. Bylo pozorováno, že přidání tiotropia
v inhalační formě k IKS má podobný efekt na výskyt exacerbací astmatu
jako přídatná léčba dlouhodobě působícími β2 agonisty s IKS. Kombinace
všech tří látek (tzv. triple terapie užívaná u některých fenotypů CHOPN)
však už významný přínos v redukci exacerbací astmatu proti kombinované
léčbě IKS + LABA nemá [11].
Biologická léčba astmatu
Biologická léčba astmatu se soustředí na konkrétní
části kaskády zánětu probíhajícího v dýchacích cestách. Podávání
biologické léčby je v České republice vázáno na ambulance
v programu Národního centra pro těžké astma (NCTA).
Omalizumab
Od roku 2005 GINA doporučuje podávání monoklonální
protilátky proti IgE (omalizumabu) u pacientů s nekontrolovaným
těžkým perzistujícím astmatem s alergickým IgE mediovaným fenotypem,
a to u dospělých, mladistvých a u dětí ve věku
od 6 let. Omalizumab je rekombinantní humanizovaná monoklonální
protilátka, která váže volný IgE (imunoglobulin E). Patří do skupiny
preventivních antiastmatik, protože zlepšuje dlouhodobou kontrolu nad astmatem
společně se snížením spotřeby záchranné medikace a perorálních kortikosteroidů
[12]. Omalizumab se doporučuje jako doplňková léčba ke zlepšení kontroly
nad astmatem u pacientů s těžkým perzistujícím alergickým astmatem,
kteří mají pozitivní kožní test nebo reaktivitu in vitro na celoroční
vzdušný alergen, dále sníženou funkci plic (usilovný výdechový objem
za jednu sekundu [FEV1] < 80 %) a trpí častými symptomy
během dne nebo v noci. Tito nemocní mají též dokumentované dvě těžké
exacerbace astmatu navzdory vysokým každodenním dávkám IKS a LABA nebo
navzdory trvalé či intermitentní léčbě PKS v posledním roce a dodržují
zákaz kouření [2,13]. Za celoroční (a neodstranitelné) alergeny jsou
považovány především alergeny roztočů a plísní. V klinických studiích
bylo prokázáno, že dlouhodobé podávání omalizumabu u pacientů
s těžkým perzistujícím astmatem zlepšuje kvalitu života, snižuje počet
exacerbací i množství užívané úlevové medikace a systémových
kortikosteroidů. Podává se v subkutánních injekcích podle dávkovací
tabulky každé dva nebo čtyři týdny [12].
Mepolizumab
Dalším důležitým mediátorem eozinofilního astmatu je
interleukin 5 (IL‑5), který je produkován Th2 lymfocyty a hraje důležitou
roli v aktivaci a chemotaxi eozinofilů v místě zánětu. Pro léčbu
eozinofilního zánětu u těžkého astmatu byly již schváleny dva léky
zaměřující se na mechanismus působení IL‑5. Jsou jimi mepolizumab,
humanizovaná monoklonální protilátka s vysokou afinitou vůči IL‑5,
a reslizumab s podobným mechanismem účinku. V místě receptoru
pro lidský IL‑5 se pak váže benralizumab, který též tímto mechanismem potlačuje
roli IL‑5 v eozinofilním zánětu [14].
Mepolizumab je indikován jako přídatná léčba těžkého
refrakterního eozinofilního astmatu u dospělých pacientů, nově ale
i u mladistvých a dětí od šesti let věku a je hrazen
z prostředků veřejného zdravotnictví na základě úhradových kritérií.
Tato kritéria zahrnují především průkaz těžkého astmatu s eozinofilií
v periferní krvi (více než 300 buněk eozinofilů v mikrolitru
krve) a dokumentované čtyři těžké exacerbace v průběhu posledních 12
měsíců navzdory léčbě vysokými dávkami IKS v kombinaci s β2 agonisty.
Podmínka častých exacerbací nemusí být splněna, pokud je kontrola nad astmatem
udržována za cenu systémové kortikoterapie v dávce alespoň 5 mg
prednizonu nebo ekvivalentu po dobu šesti měsíců. V případě dlouhodobé
systémové kortikoterapie je třeba doložit eozinofilii v době posledního
půlroku před jejím zahájením [15]. Jedná se o humanizovanou monoklonální
protilátku (IgG1κ), která je s vysokou afinitou a specificitou cílena
k IL‑5. Interleukin 5 je významný cytokin odpovědný za růst
a diferenciaci, nábor, aktivaci a přežití eozinofilů. Mepolizumab
inhibuje biologickou aktivitu IL‑5 s nanomolární potencí blokováním vazby
tohoto cytokinu na alfa řetězec receptoru IL‑5 umístěného na povrchu
eozinofilní buňky. Tím inhibuje signalizační funkci IL‑5 a snižuje
produkci a přežití eozinofilů. Mepolizumab se podává též
v subkutánních injekcích s výrazně jednodušším dávkovacím schématem
[16,17].
Reslizumab
Reslizumab je humanizovaná monoklonální protilátka proti IL‑5.
Jde o antagonistu IL‑5, jehož indikací je léčba pacientů s těžkým
eozinofilním astmatem, které dostatečně nereaguje na terapii IKS
a dalšími přípravky používanými v dlouhodobé terapii eozinofilního
astmatu. Celkem pět klinických studií kontrolovaných placebem prokázalo pokles
počtu exacerbací o 50‒60 % u pacientů s těžkým eozinofilním
astmatem, kteří měli astmatické obtíže navzdory vysoké dávce IKS. Podává se
v intravenózní infuzi jednou za čtyři týdny [18].
Benralizumab
Benralizumab je humanizovaná monoklonální protilátka
produkovaná buňkami vaječníků čínských křečíků technologií rekombinace DNA.
Od ledna letošního roku získal schválení Evropskou komisí pro léčbu
těžkého eozinofilního astmatu jako přídatná udržovací léčba dospělých pacientů
s těžkým eozinofilním astmatem, kteří nejsou adekvátně kontrolováni
vysokými dávkami IKS a LABA. Léčba benralizumabem vede k téměř
úplné depleci eozinofilů v krvi během 24 hodin po první dávce
a je udržována po celou dobu užívání. Při terapii došlo
i k výraznému poklesu počtu eozinofilů v dýchacích cestách.
Ve studiích bylo prokázáno snížení roční míry exacerbací a celkové
snížení výskytu astmatických příznaků u pacientů s těžkým
eozinofilním astmatem [19].
Další léčivé látky
V léčbě těžkého eozinofilního astmatu jsou zkoumány
další účinné látky, které mají za cíl ovlivnit další část zánětlivého
procesu. Patří mezi ně především monoklonální protilátky proti IL‑4 a IL‑13.
Lebrikizumab a tralokinumab jako monoklonální protilátky proti IL‑13 mají
slibné výsledky ve studiích u pacientů s těžkým eozinofilním
astmatem, a to především v souvislosti s výskytem vyšších
koncentrací konkrétních biomarkerů. To by mohlo v budoucnu vést
k cílenější biologické léčbě. Dupilumab, monoklonální protilátka proti
receptoru alfa pro IL‑4, působí na oba mediátory (IL‑4 a IL‑13)
současně. V minulém roce byl schválen americkým Úřadem pro kontrolu
potravin a léčiv (FDA) k terapii atopické dermatitidy
a ve studiích u pacientů s těžkým astmatem se ukazuje, že
dochází ke zlepšení hodnoty FEV1 i k poklesu roční míry
exacerbací [14].
Antimykotická a antibakteriální terapie
U některých těžkých astmatiků je vyvolávající noxou
obtíží senzibilizace vůči plísním, které kolonizují sliznice průdušek.
Nejčastěji se jedná o kolonizaci houbami rodu Aspergillus, je pak tedy
možno mluvit o tzv. alergické bronchopulmonální aspergilóze. Pokud jde
o jiný rod plicních hub, nazýváme onemocnění alergickou bronchopulmonální
mykózou. U těchto forem těžkého astmatu se ukázala být efektivní léčba
itrakonazolem podávaným v dávkách 100‒400 mg denně po dobu dvou až
tří měsíců.
Terapie makrolidy je doporučována pouze u pacientů
s potvrzenou kolonizací dolních cest dýchacích atypickými agens (Mycoplasma
pneumoniae a Chlamydia pneumoniae) [8].
Bronchiální termoplastika
U pacientů s těžkým astmatem lze ireverzibilní
složku bronchiální obstrukce ovlivnit nefarmakologickou léčbou, tzv.
bronchiální termoplastikou. Jedná se o bronchologickou metodu, při níž je
do průduškového stromu až do průdušek s průměrem 3 mm zaveden
katétr, který působením termické energie redukuje množství hladké svaloviny
ve stěně průdušky. K výkonu jsou indikováni pacienti s těžkým
astmatem, kteří mají postbronchodilatační hodnotu FEV1 větší než 50 % nebo
rovnu 50 % predikované hodnoty a trvá u nich výrazná bronchiální
hyperreaktivita v období posledních 12 měsíců před výkonem (pozitivní
bronchodilatační test zvýšený o více než 15 % nebo 400 ml, či pozitivní
bronchoprovokační test s metacholinem při současné léčbě). Výkon se
provádí pouze u pacientů starších 18 let, kteří již nekouří déle než
12 měsíců (a anamnesticky udávají méně než 10 balíčkoroků kouření),
užívají maximální dávky systémové kortikoterapie do 20 mg ekvivalentu
prednizonu denně a nejsou u nich přítomny závažné komorbidity
zvyšující riziko provedení bronchoskopie v celkové anestezii. Cílem této
terapie je stabilizace onemocnění, snížení počtu exacerbací, zlepšení plicních
funkcí a snížení množství medikace potřebné k udržení kontroly nad
astmatem, což bylo prokázáno v klinických studiích [20,21].
Závěr
V diagnostice těžkého eozinofilního astmatu postupujeme
v několika krocích. Nejprve je nutné správně stanovit diagnózu astmatu,
poté klasifikovat tíži onemocnění a určit míru kontroly nad astmatem.
Důležité je opakovaně kontrolovat správné užívání předepsané medikace včetně
inhalační techniky, vyloučit či minimalizovat vliv komorbidit
a psychosociálních faktorů. Pacienti by měli být léčeni vysokými dávkami
IKS v kombinaci s LABA a s alespoň jedním dalším astma
kontrolujícím lékem (antileukotrien, perorální teofylin, případně PKS).
V případě, že přes veškerou správně užívanou terapii není dosaženo plné
kontroly astmatu, snažíme se o kompromisní kontrolu nad onemocněním. Zde
je též vhodné referovat pacienta do ambulance NCTA k posouzení nemoci
a k případnému podávání biologické léčby. Z postupně se
rozšiřující palety biologických přípravků má však nyní schválenu úhradu
zdravotními pojišťovnami pouze omalizumab a mepolizumab. Pro reslizumab
a benralizumab jsou úhradová kritéria teprve ve schvalovacím procesu
Státním ústavem pro kontrolu léčiv, proto jsou tyto přípravky hrazeny
ve výjimečných případech (po schválení revizním lékařem dle paragrafu
16 páté části zákona č. 48/1997 Sb., o veřejném zdravotním pojištění).
Dále máme k dispozici i nefarmakologickou terapii, kam řadíme mj.
bronchiální termoplastiku.
Seznam použité literatury
- [1] Pedersen SE, Bateman ED, Boulet LP. Global strategy for astma management and prevention ‒ update 2018, GINA. Dostupné na: http://www.ginasthma.org
- [2] Sedlák V, Chlumský J, Teřl M, et al. Doporučený postup diagnostiky a léčby obtížně léčitelného bronchiálního astmatu, NCTA 2014. Dostupné na: http://www.tezke astma.cz
- [3] Teřl M, Čáp P, Dvořáková R, et al. Doporučený postup diagnostiky a léčby bronchiálního astmatu, ČSAKI 2015. Dostupné na: http:// http://www.csaki.cz/dokumenty/DP_diagnostiky_a_lecby_astmatu_2015.pdf
- [4] Chung KF, Wenzel SE, Brozek JL, et al. International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma. Eur Respir J 2014; 43: 343‒373.
- [5] Kašák V. Asthma bronchiale. Praha: Maxdorf, 2013, 2. vydání, 262 s.
- [6] Čáp P, Brezina M. Neinvazivní vyšetřování zánětu u astmatu u dětí a dospělých. Praha: Mladá fronta, 2009, 150 s.
- [7] Čáp P, Benčová A, Jeseňák M. Vyšetřování vydechovaného oxidu dusnatého u asthma bronchiale. Praha: Mladá fronta, 2014, 141 s.
- [8] Teřl M. Současné možnosti léčby těžkého astmatu v ČR. Remedia 2012; 22: 248‒253.
- [9] Jones SL, Kittelson J, Cowan JO, et al. The predictive value of exhaled nitric oxide levels correlate with measures of disease control in asthma. J Allergy Clin Immunol 2000; 106: 645‒650.
- [10] Jia G, Erickson RW, Choy DF, et al. Periostin is a systemic biomarker of eosinophilic airway inflammation in asthmatic patients. J Allergy Clin Immunol 2012; 130: 647‒654.
- [11] Sobieraj DM, Baker WL, Nguyen E, et al. Association of Inhaled Corticosteroids and Long Acting Muscarinic Antagonists With Asthma Control in Patients With Uncontrolled, Persistent Asthma: A Systematic Review and Meta analysis. JAMA 2018; 319: 1473.
- [12] Busse W, Corren J, Lanier BQ, et al. Omalizumab, anti IgE recombinant humanized monoclonal antibody, for the treatment of sever allergic asthma. J Allergy Clin Immunol 2001; 108: 184‒190.
- [13] Product information: Xolair® subcutaneous injection powder, omalizumab subcutaneous injection powder, Genentech Inc. South San Francisco CA, 2016.
- [14] Stephenson L. Monoclonal Antibody Therapy for Asthma. Clin Pul Medicine 2017; 24: 250‒257.
- [15] Úhradová kritéria léku Nucala 100MG INJ. PLV. SOL. (mepolizumab); http://www.sukl.cz.
- [16] Haldar P, Brightling CE, Hargadon B, et al., Mepolizumab for severe eosinophilic asthma (DREAM): a multicentre, double blind placebo controlled trial. Lancet 2012; 380: 651‒659.
- [17] Product information: mepolizumab for subcutaneous use. GlaxoSmithKline Research, Triangle Park NC 27709.
- [18] Castro M, Zangrilli J, Wechsler ME, et al. Reslizumab for inadequately controlled asthma with elevated blood eosinophil counts: results from two multicentre, parallel, double blind, randomised, placebo controlled, phase 3 trials. Lancet Respir Med 2015; 3: 355‒366.
- [19] Souhrn údajů o přípravku. Fasenra 30 mg injekční roztok v předplněné injekční stříkačce. Dostupné na: http://www.ema.europa.eu
- [20] Pavord ID, Cox G, Thomson NC, et al. Safety and Efficacy of Bronchial Thermoplasty in Symptomatic, Severe Asthma. Am J Respir Crit Care Med 2007; 176: 1185–1191.
- [21] Indikační kritéria k provádění bronchiální termoplastiky v léčbě astmatu v České republice. Kritéria dohodnuta na jednání lékařů center pro léčbu těžkého astmatu v Hradci Králové dne 25. 3. 2014. Dostupné na: http://www.tezke astma.cz