Transmukózní fentanyl v léčbě průlomové bolesti
Průlomová bolest je tranzitorní exacerbace bolesti, která se objevuje u jinak dobře kontrolované základní bolesti. Rozlišuje se průlomová bolest epizodická a incidentální, která může být navíc předvídatelná a nepředvídatelná. Průlomová bolest zhoršuje fyzické funkce, vyvolává psychický stres, snižuje odpověď na opioidy a zvyšuje náklady na léčbu. Měla by být hodnocena a léčena nezávisle na základní bolesti. Charakter této bolesti vyžaduje rychle a krátce působící opioidy. Tyto vlastnosti má transmukózní aplikace fentanylu. V současné době je k dispozici fentanyl v nosním spreji, bukálních a sublinguálních tabletách. Každá z těchto lékových forem má určité přednosti, a proto je možno dát pacientovi vybrat to, co mu vyhovuje nejlépe.
Úvod
Nádorová bolest je téma často diskutované v literatuře, ale v praxi je bolest stále léčena nedostatečně nebo nekvalitně. Provází maligní onemocnění v jeho různých fázích. Asi dvě třetiny pacientů s pokročilým nádorovým onemocněním trpí bolestí. Ve většině případů dosahuje bolest velmi silné intenzity. Pokud je kontinuální, s malými výkyvy intenzity, relativně dobře odpovídá na analgetickou léčbu silnými opioidy. Více než polovina pacientů s nádorovým onemocněním však trpí špatně kontrolovanou průlomovou bolestí (PB). Její léčení je obtížné pro její rychlý nástup, relativně krátké trvání a velkou intenzitu.
![Graf 1 Typy průlomové bolesti a jejich výskyt; podle [3] – Zeppetella, et al., 2000.](https://www.remedia.cz/photo-a-28700---.jpg) Z patofyziologického pohledu může být nádorová bolest nociceptivní, neuropatická, smíšená, méně často s psychickou nadstavbou, jako ji známe u nenádorové bolesti. Patofyziologie PB může být různá, ale charakter bolesti bývá stejný jako u základní bolesti (viz graf 1). Náhlý vznik a velká intenzita PB podporuje úzkost a depresi pacientů, zhoršuje kvalitu života, omezuje jejich pohyblivost i soběstačnost, spánek i sociální kontakty. Podle různých zdrojů se uvádí, že 40–90 % pacientů s nádorovou bolestí trpí PB [1–4]. Relativně méně informací máme o PB u nenádorové bolesti. Zeppetella [5] uvádí výskyt až u 63 % pa-cientů s nenádorovým onemocněním v terminálním stavu. Rozptyl výskytu PB je dán nejednotnou definicí průlomové bolesti. Podle poslední definice dle Haugena [6] je PB definována jako přechodné vzplanutí velmi intenzivní bolesti u pacientů, kteří mají základní bolest stabilní, relativně dobře kontrolovanou opioidní terapií. PB vzniká buď spontánně (epizodická), kdy nebývá jasná vyvolávající příčina, nebo se může jednat o incidentální PB, která má vztah k vyvolávající příčině. Je vyvolána předvídatelným (volní aktivitou – chůze, vertikalizace) nebo nepředvídatelným podnětem (např. kašel, kýchání). K průlomové bolesti je možné počítat i některé typy procedurální bolesti (např. opakované bolestivé převazy) [2, 6, 7, 8]. V České republice byla léčba PB sledována v rámci projektu PARMA. Výsledky ukázaly, že PB trpělo 75 % pacientů, z toho u pacientů s intenzitou základní bolesti do VAS 4 byla PB zjištěna v 71 % případů a při intenzitě bazální bolesti VAS 5–10 byla frekvence výskytu již 86 % [9].
Z patofyziologického pohledu může být nádorová bolest nociceptivní, neuropatická, smíšená, méně často s psychickou nadstavbou, jako ji známe u nenádorové bolesti. Patofyziologie PB může být různá, ale charakter bolesti bývá stejný jako u základní bolesti (viz graf 1). Náhlý vznik a velká intenzita PB podporuje úzkost a depresi pacientů, zhoršuje kvalitu života, omezuje jejich pohyblivost i soběstačnost, spánek i sociální kontakty. Podle různých zdrojů se uvádí, že 40–90 % pacientů s nádorovou bolestí trpí PB [1–4]. Relativně méně informací máme o PB u nenádorové bolesti. Zeppetella [5] uvádí výskyt až u 63 % pa-cientů s nenádorovým onemocněním v terminálním stavu. Rozptyl výskytu PB je dán nejednotnou definicí průlomové bolesti. Podle poslední definice dle Haugena [6] je PB definována jako přechodné vzplanutí velmi intenzivní bolesti u pacientů, kteří mají základní bolest stabilní, relativně dobře kontrolovanou opioidní terapií. PB vzniká buď spontánně (epizodická), kdy nebývá jasná vyvolávající příčina, nebo se může jednat o incidentální PB, která má vztah k vyvolávající příčině. Je vyvolána předvídatelným (volní aktivitou – chůze, vertikalizace) nebo nepředvídatelným podnětem (např. kašel, kýchání). K průlomové bolesti je možné počítat i některé typy procedurální bolesti (např. opakované bolestivé převazy) [2, 6, 7, 8]. V České republice byla léčba PB sledována v rámci projektu PARMA. Výsledky ukázaly, že PB trpělo 75 % pacientů, z toho u pacientů s intenzitou základní bolesti do VAS 4 byla PB zjištěna v 71 % případů a při intenzitě bazální bolesti VAS 5–10 byla frekvence výskytu již 86 % [9].
Pojem základní bolest (background pain) představuje konstantní nebo pokračující bolest dlouhého trvání – nejméně 12 hodin denně [2, 8]. Pro základní bolest, která se v mírně kolísavé intenzitě vyskytuje v souvislosti s nádorovým onemocněním, je indikována pravidelná léčba. PB je příznak, který zhoršuje situaci nemocného. Je velmi intenzivní, na stupnici VAS 0–10 se často pohybuje v rozmezí od 6 do 10. Je prudká, rychle nastupuje a většinou netrvá déle než půl hodiny, vzácněji 1–2 hodiny. Experti hodnotí PB v pěti dimenzích. Posuzují intenzitu, časové souvislosti, úlevové nebo spouštěcí faktory, kvalitu bolesti a lokalizaci [10]. Většina publikací upozorňuje na PB jako na samostatný fenomén nádorové bolesti. WHO a EAPC (European Association of Palliative Care) doporučovaly pro bez-prostřední úlevu od PB morfin jako standardní léčbu, ale vstupem nových léků na trh se toto doporučení mění a vyžaduje revizi.
Léky pro průlomovou bolest
Morfin, který je standardně užíván jako záchranná (rescue) medikace pro pacienty trpící PB, není lékem ideálním. Nemůže postihnout prudký nástup intenzivní bolesti, která relativně rychle odezní, zatímco účinek morfinu přetrvává i o několik hodin déle než PB. Při perorálním podání je nástup účinku pomalý, trvá 30–60 minut a vrchol analgezie nastupuje nejdříve po 60 minutách. Účinek přetrvává průměrně 4–6 hodin. Jeho opakované užití pak má za následek řadu nežádoucích účinků [2]. Pokusy o slizniční aplikaci morfinu v kombinaci s chitosanem, který by zlepšil a urychlil vstřebávání morfinu, zatím nevedly k většímu rozšíření [11].
Fentanyl je na rozdíl od morfinu jako liposolubilní semisyntetický opioid vhodnějším lékem pro rychlé utlumení PB. V roce 1986 byl uveden do klinické praxe fentanyl citrát jako „lízátko“ (Oral Transmucosal Fentanyl Citrate, OTFC) [12]. Vkládá se na bukální sliznici, která musí být k uvolnění fentanylu dostatečně vlhká. K analgetickému efektu dochází do 15 minut. Dalším výsledkem snahy o transmukózní transport fentanylu byl roztok podávaný pod jazyk [13]. Analgetický efekt se projevil rovněž do 15 minut. Stejně jako u lízátka docházelo k polykání větší části podaného fentanylu, a protože se fentanyl ze zažívacího traktu málo vstřebává, výsledný účinek nebyl takový, jak se očekávalo. Nové technologie pro slizniční podání fentanylu odstraňují většinu nedostatků uvedených přípravků. Sliznice dutiny nosní nebo ústní je pro potřebu rychlého analgetického působení vhodnou aplikační cestou. Fentanyl jako liposolubilní látka s malou molekulou dobře prostupuje buňkami sliznice přímo do krevního oběhu. Slizniční aplikace není novým přístupem, je známa z podávání mnoha jiných léků, kde je nutný rychlý účinek. Přímý průchod fentanylu do oběhu přes sliznici jak dutiny ústní, tak nosní eliminuje první průchod játry, což snižuje riziko interakcí a nežádoucích účinků [14].
Sublinguální tablety
Speciální technologií je opatřen fentanyl citrát pro sublinguální podávání [15]. Tableta je tvořena nosným médiem, na něž je navázána účinná látka obalená adhezivní vrstvou. Po vložení pod jazyk se tableta velmi rychle rozpadne a uvolní mikrogranule fentanylu obalené přilnavou vrstvou, která umožní delší setrvání opioidu na sliznici a tím vstřebání dostatečného množství látky. Jako bioadhezivní nosič je použit kollidon CL, který má velmi dobré adhezivní vlastnosti. Účinné plazmatické koncentrace je tímto systémem dosaženo za 10 minut, bez sekundárního vrcholu gastrointestinální absorpce. To znamená, že kollidon dokáže udržet fentanyl pod jazykem dostatečně dlouhou dobu, aby se vstřebal a nebyl spolykán. Do oběhu se dostává více než 70 % účinné látky. Lennernäs [16] prokázal ve studii s 11 pacienty, že plazmatická koncentrace stoupá lineárně v závislosti na podané dávce (100, 200, 400 mg) a první měřitelné koncentrace v plazmě bylo dosaženo za 8–11 minut. Rauck [17] provedl studii u 121 pacientů a prokazatelného poklesu intenzity bolesti bylo dosaženo rovněž během 10 minut. S rostoucí dávkou se nezvyšuje riziko nežádoucích účinků a analgetický efekt stoupá. To prokázal také Lennernäs v další studii [18], kde vyšší vytitrované dávky vedly k rychlejšímu nástupu účinku – už za 5 minut došlo k prokazatelné úlevě. Dlouhodobou efektivitu potvrdila otevřená studie Nalamachua [19]: onkologičtí pa-cienti užívali k léčbě PB sublinguální fentanyl déle než 3 měsíce a průměrná dávka přesáhla 500 mg. Ve studii, jíž se účastnilo 131 pacientů, byla sledována účinnost fentanylu ve dvou intervalech (za 30 a 60 min.) a dlouhodobě (12 měsíců). Úleva od bolesti byla ve srovnání s placebem velmi dobrá a nebyly zaznamenány neočekávané nežádoucí účinky. Nejčastějšími nežádoucími účinky byly nauzea (12,5 % případů), zvracení (5,3 %) a ospalost (4,6 %).
Bukální tablety
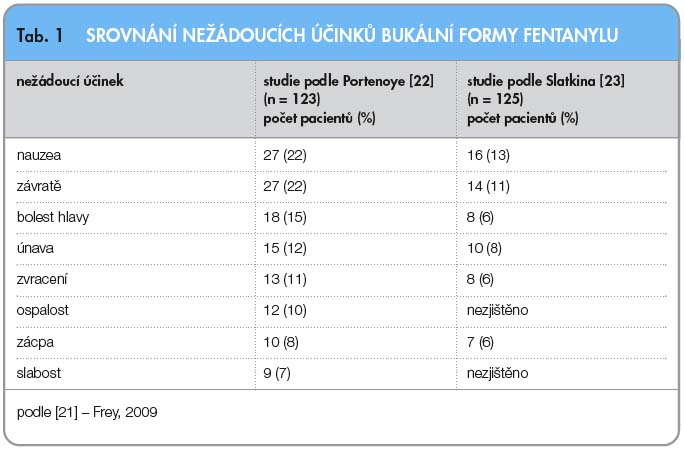 Další formou oromukozálního podání fentanylu je bukální aplikace tablety, která se rozpouští technologií OraVescent®. Nová technologie umožní rychlejší průnik bukální sliznicí, redukce bolesti nastává už po 10 minutách [20]. OraVescent® představuje novou možnost podávání léků slizniční cestou. Léčivo je z tablety uvolňováno oxidem uhličitým, který vzniká reakcí kyseliny citronové a bikarbonátu sodné-ho kontaktem s vlhkou sliznicí. Zároveň dochází ke změně hodnoty pH, uvolní se voda a zvýší se absorpce fentanylu. K uvolnění oxidu uhličitého stačí jen lehce vlhká sliznice, takže rozpuštění tablety není u nemocných se suchými ústy významně omezeno. Biologická dostupnost je 65 %, z toho 48 % se vstřebá velmi rychle [21]. Tableta se umísťuje nad stoličku mezi horní ret a dáseň, kde se rozpouští. Bukální forma fentanylu je další variantou pro účinné léčení PB rychle působícím fentanylem. Nežádoucí účinky jsou podobné jako u ostatních tradičně užívaných opioidů. Portenoy [22] zaznamenal ve studii nejčastěji nauzeu (22 %) a závratě (22 %), viz tab. 1. Dva pacienti měli lokální postižení sliznice během titrace, které pravděpodobně souviselo s aplikací tablety. Ve studii, které se zúčastnilo 77 pacientů, byly užity dávky 100, 200, 400, 600 a 800 mg. Deset epizod PB u 125 pacientů sledoval ve své studii Slatkin [23]. Vedle účinnosti hodnotil i nežádoucí účinky po podání bukální tablety fentanylu ve vytitrované dávce 100, 200, 400, 600 a 800 mg. Nejčastěji se objevují nauzea, závratě, únava, bolest hlavy, zvracení a zácpa (tab. 1). Rozdílné výsledky by mohly být vysvětleny různou základní opioidní medikací podle hodin (tab. 2).
Další formou oromukozálního podání fentanylu je bukální aplikace tablety, která se rozpouští technologií OraVescent®. Nová technologie umožní rychlejší průnik bukální sliznicí, redukce bolesti nastává už po 10 minutách [20]. OraVescent® představuje novou možnost podávání léků slizniční cestou. Léčivo je z tablety uvolňováno oxidem uhličitým, který vzniká reakcí kyseliny citronové a bikarbonátu sodné-ho kontaktem s vlhkou sliznicí. Zároveň dochází ke změně hodnoty pH, uvolní se voda a zvýší se absorpce fentanylu. K uvolnění oxidu uhličitého stačí jen lehce vlhká sliznice, takže rozpuštění tablety není u nemocných se suchými ústy významně omezeno. Biologická dostupnost je 65 %, z toho 48 % se vstřebá velmi rychle [21]. Tableta se umísťuje nad stoličku mezi horní ret a dáseň, kde se rozpouští. Bukální forma fentanylu je další variantou pro účinné léčení PB rychle působícím fentanylem. Nežádoucí účinky jsou podobné jako u ostatních tradičně užívaných opioidů. Portenoy [22] zaznamenal ve studii nejčastěji nauzeu (22 %) a závratě (22 %), viz tab. 1. Dva pacienti měli lokální postižení sliznice během titrace, které pravděpodobně souviselo s aplikací tablety. Ve studii, které se zúčastnilo 77 pacientů, byly užity dávky 100, 200, 400, 600 a 800 mg. Deset epizod PB u 125 pacientů sledoval ve své studii Slatkin [23]. Vedle účinnosti hodnotil i nežádoucí účinky po podání bukální tablety fentanylu ve vytitrované dávce 100, 200, 400, 600 a 800 mg. Nejčastěji se objevují nauzea, závratě, únava, bolest hlavy, zvracení a zácpa (tab. 1). Rozdílné výsledky by mohly být vysvětleny různou základní opioidní medikací podle hodin (tab. 2).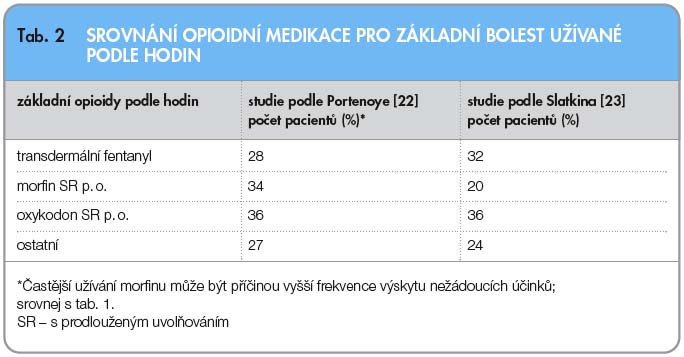 Účinnost oromukozálně podaného fentanylu není ovlivněna věkem, pohlavím, rasou ani tělesnou hmotností. Tablety pro oba způsoby podání jsou k dispozici v dávce od 100 mg do 800 mg.
Účinnost oromukozálně podaného fentanylu není ovlivněna věkem, pohlavím, rasou ani tělesnou hmotností. Tablety pro oba způsoby podání jsou k dispozici v dávce od 100 mg do 800 mg.
Intranazální podání
Posledním způsobem slizniční a velmi rychlé aplikace je nazální podání fentanylu. Intranazální podání látek má svá specifika. Podání vhodné látky touto neinvazivní cestou umožní rychlý účinek a přímou cestu do CNS, protože obchází hematoencefa-lickou bariéru [24]. N. olfactorius a n. trigeminus zprostředkují unikátní přímé spojení zevního prostředí s CNS. Není nutný nosič a bohatě vaskularizovaná nosní sliznice s vy-soce permeabilní strukturou umožní rychlý přestup látky do kapilár. Stejně jako oromukozální podání, tak i nazální aplikace se vyhýbá prvnímu transportu přes játra a GIT, což přispívá ke zvýšení biologické dostupnosti.
Obtíže mohou nastat při rýmě nebo alergii. Rychlost účinku při nosním podání ovlivňují dva faktory – lipofilita a velikost molekuly. Ideální je velikost 1000 Da. Vhodný nosič může dostupnost molekuly zvýšit. Transport z dutiny nosní se děje přes filla olfactoria, přes lamina cribriformis do mozkomíšního moku, přímo také do krevního oběhu a lymfatických cest. Látky proteinového charakteru jsou aktivně transportovány cestou n. trigeminus.
Důležitou roli hraje hodnota pH a množství aplikované účinné látky. Rychlost nástupu účinku při nazální aplikaci (okolo 5–8 minut) je srovnatelná s i.v. podáním [25]. Nástup analgetického efektu je velmi rychlý. Maximální plazmatické koncentrace (tmax) po intranazálním podání bylo dosaženo za 13 minut, při i.v. podání fentanylu za 6 minut. Systémová kinetika fentanylu při nazálním podání se blíží kinetice po intravenózním podání.
Dobrý efekt intranazálně podaného fentanylu opakovaně potvrdily výsledky studií. Intranazální aplikace předpokládá neporušenou nosní sliznici, nepřítomnost patologie v dutině nosní a pacientovu compliance s intranazálním podáním. Kress [26] ve studii účinnosti a tolerability nazálního fentanylu u 111 pacientů potvrzuje primární analgetický efekt po 10 minutách. Vedlejší účinky se objevily u 22 pacientů – nejčastěji se vyskytovaly nauzea (5 pacientů – 4,5 %) a vertigo (2 pacienti – 1,8 %), nebyl zaznamenán žádný závažný nežádoucí účinek. Celkem 108 pacientů užívalo nosní fentanyl průměrně 134,9 dne. Nejvíce nežádoucích účinků bylo způsobeno progresí základního maligního onemocnění (u 55 pa-cientů – 59 %).
Jak užívat transmukózní fentanyl
Orální tablety fentanylu jsou dostupné v dávkách 100–800 mg účinné látky, fentanyl v nosním spreji v dávkách 50–200 mg účinné látky.
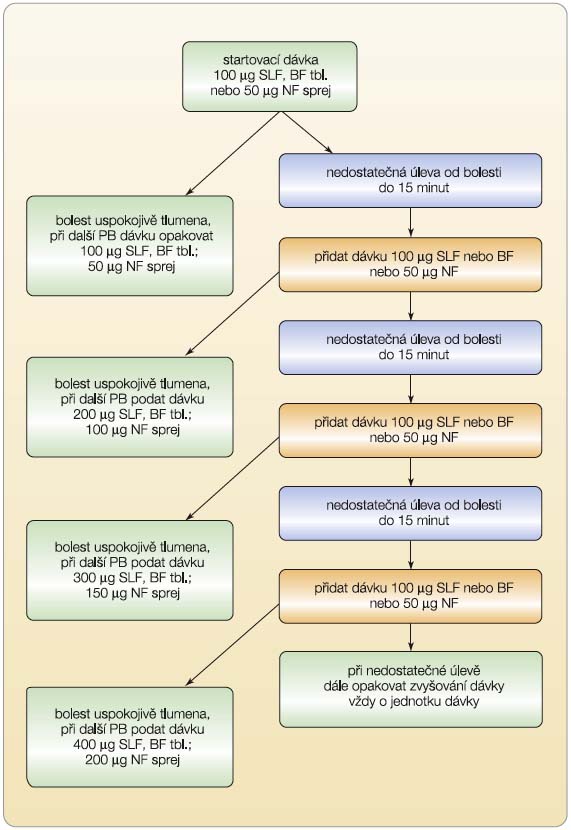 Transmukózní fentanyl (TMF) je určen pacientům s nádorovou bolestí, kteří užívají pro léčbu základní bolesti minimálně 60 mg morfinu za den nebo ekvipotentní dávku jiného silného opioidu (morfin nejméně 60 mg denně perorálně nebo fentanyl nejméně 25 mg za hodinu transdermálně nebo oxykodon nejméně 30 mg nebo hydromorfon 8 mg perorálně) nebo ekvianalgetickou dávku jiného opioidu po dobu nejméně jednoho týdne. Počáteční dávka TMF se neřídí dávkou kontinuálně, systémově podávaného opioidu, jako je tomu u standardně podávané rescue medikace (20 % celkové dávky opioidu pro jednu dávku rescue opioidu, např. morfinu). Dávku TMF je třeba vždy titrovat od nejmenší dávky (u orálních forem od 100 mg, u nosní formy od 50 mg), viz obr. 1. Po dosažení účinné dávky tato zůstává většinou po celou dobu podávání stejná. Ukončování léčby musí být postupné, tedy tzv. step down, jako u běžně systémově podávaných opioidů.
Transmukózní fentanyl (TMF) je určen pacientům s nádorovou bolestí, kteří užívají pro léčbu základní bolesti minimálně 60 mg morfinu za den nebo ekvipotentní dávku jiného silného opioidu (morfin nejméně 60 mg denně perorálně nebo fentanyl nejméně 25 mg za hodinu transdermálně nebo oxykodon nejméně 30 mg nebo hydromorfon 8 mg perorálně) nebo ekvianalgetickou dávku jiného opioidu po dobu nejméně jednoho týdne. Počáteční dávka TMF se neřídí dávkou kontinuálně, systémově podávaného opioidu, jako je tomu u standardně podávané rescue medikace (20 % celkové dávky opioidu pro jednu dávku rescue opioidu, např. morfinu). Dávku TMF je třeba vždy titrovat od nejmenší dávky (u orálních forem od 100 mg, u nosní formy od 50 mg), viz obr. 1. Po dosažení účinné dávky tato zůstává většinou po celou dobu podávání stejná. Ukončování léčby musí být postupné, tedy tzv. step down, jako u běžně systémově podávaných opioidů.
Závěr
Nové aplikační formy fentanylu využívají snadného transportu přes sliznici dutiny ústní a nosní. Rychlým průnikem opioidu do oběhu je pohotově dosaženo úlevy od bolesti. Tablety, které se vkládají pod jazyk nebo na bukální sliznici, a nosní sprej jsou velkým přínosem pro léčbu bolesti pacientů s maligním onemocněním. Praxe potvrzuje výsledky klinických studií, které ukazu-jí lepší efektivitu nových aplikačních cest oproti dosavadní léčbě. Je však třeba působit i preventivně a včas hodnotit stav pacienta. Využívání nefarmakologických postupů (radioterapie, chemoterapie, chirurgické zákroky, podpůrné pomůcky) je důležité ke zmírnění bolesti. Opakované hodnocení stavu pacienta, základní bolesti i PB musí být samozřejmostí. Prozatím je preskripce omezena na algeziology, ale je možná delegovaná preskripce, která umožní i onkologům účinně léčit bolest jejich pacientů. Stejně jako účinně léčená základní bolest, je správné rozpoznání PB předpokladem správné indikace.
Seznam použité literatury
- [1] Davies A. In: Davies A. (ed.) Cancer-related Break-through Pain. Oxford Pain Management Library: Oxford University Press 2006.
- [2] Portenoy RK, Hagen NA. Breakthrough pain: Definition Prevalence and Characteristics. Pain 1990; 41: 273–281.
- [3] Zeppetella G, O’Doherty CA. Collins S. Prevalence and characteristics of breakthrough pain in cancer patients admitted to a hospice. J Pain Symptom Manage 2000; 20: 87–92.
- [4] Mercadante S, Radbruch L, Caraceni A, et al. Episodic (breakthrough) pain: consensus conference of an expert working group of the European association for palliative care. Cancer 2002; 94: 832–839.
- [5] Zeppetella G, O'Doherty CA, Collins S. Prevalence and characteristics of breakthrough pain in patients with non-malignant terminal disease admitted to a hospice. Palliat Med 2001; 15: 243–246.
- [6] Haugen DF, Hjermstad MJ, Hagen NA, et al. Assessment and classification of cancer break-through pain: A systematic literature review. Pain 2010; 149: 476–482.
- [7] Portenoy RK, Bennett DS, Rauck R. Prevalence and characteristics of breakthrough pain in opioid-treated patients with chronic non-cancer pain. J Pain 2006; 7: 583–591.
- [8] Hwang SS, Chang VT, Kasimis B. Cancer break-through pain charateristics and responses to treatment at VA medical center. Pain 2003; 101: 55–64.
- [9] Sláma O, Lejčko J, Kozák J, et al. Epidemiologie a léčba průlomové bolesti u onkologických pacientů v ČR. Výsledky výzkumného projektu PARMA. Část 1. Prevalence a klinické charak-teristiky průlomové bolesti. Bolest 2011; 14: 158–160.
- [10] Hagen NA. The Alberta breakthrough pain assessment tool for cancer patients: a validation study using a delphi proces and patient think-aloud interviews. J Pain Symptom Manage 2008; 35: 136–152.
- [11] Illium L, Watts P, Fisher AN, et al. Intranasal delivery of morphine. J Pharm Exp Ther 2002; 301: 391–400.
- [12] Mock DL, Streisand JB, Hague B, et al. Transmucosal narcotic delivery: an evaluation of fentanyl (lollipop) premedication in man. Anesth Analg 1986; 65: S102.
- [13] Zeppetella G. Sublingual fentanyl citrate for cancer-related breakthrough pain: a pilot study. Palliat Med 2001; 15: 323–328.
- [14] Moffat AC. Absorption of drugs through the oral mucosa. Top Med Chem 1971; 4: 21–29.
- [15] Bredenberg S, Duberg M, Lennernäs B, et al. In vitro and in vivo evaluation of a new sublingual tablet system for rapid oromucosal absorption using fentanyl citrate as the active substance. Eur J Pharm Sci 2003; 20: 327–334.
- [16] Lennernäs B, Hedner T, Holmeberg M, et al. Pharmacokinetics and tolerability of different doses of fentanyl following sublingual administration of a rapidly dissolving tablet to cancer pa-tients: a new approach to treatment of incident pain. Br J Clin Pharmacol 2004; 59: 249–253.
- [17] Rauck RL, Tark M, Reyes T, et al. Efficacy and long-term tolerability of sublingual fentanyl oraly desintegrating tablet for the treatment of break-through cancer pain. Cur Med Res Opin 2009; 25: 2877–2885.
- [18] Lennernäs B, Frank-Lissbrant I, Lennärnas H, et al. Sublingual administration of fentanyl to cancer patients is an effective treatment for breakthrough pain: results from a randomized phase II study. Palliat Med 2010; 24: 286–293.
- [19] Nalamachu S, Hassman D, Wallace MS, et al. Long-term effectiveness and tolerability of sublingual fentanyl orally disintegrating tablet for the treatment of breakthrough cancer pain. Cur Med Res Opin 2011; 27: 519–530.
- [20] Zeppetella G, Ribeiro MDC. Pharmacotherapy of cancer – related episodic pain. Expert Opin Pharmacother 2003; 4: 493–502.
- [21] Frey E. A new transmucosal drug delivery system for patients with breakthrough cancer pain: the fentanyl effervescent buccal tablet. J Pain Res 2009; 2: 13–20.
- [22] Portenoy RK, Taylor D, Messina J, Tremmel L. A randomised, placebo-controlled study of fentanyl buccal tablet for breakthrough pain on opioid-treated patients with cancer. Clin J Pain 2006; 22: 805–811.
- [23] Slatkin NE, Xie F, Messina J, et al. Fentanyl buccal tablet for relief of breakthrough pain in opioid-tolerant patients with cancer-related chronic pain. J Support Oncol 2007; 5: 327–334.
- [24] Talegaonkar S, Mishra PR. Intranasal delivery: An approach to bypass the blood brain barrier. In-dian J Pharmacol 2004; 36: 140–147.
- [25] Foster D, Upton R, Popper L, et al. Pharmacokinetic-pharmacodynamic model of pain relief with intranasal versus intravenous fentanyl following oral surgery. Pharmacother 2008; 42: 1380–1387.
- [26] Kress HG, Oronska A, Kaczmarek Z, et al. Efficacy and tolerability of intranasal fentanyl spray 50 to 200 mg for breakthrough pain in patients with cancer: A phase III, multinational, randomized, double-blind, placebo-controlled, crossover trial with a 12-month, open label extension treat-ment period. Clin Ther 2009; 6: 1–16.