Transmukózní fentanyl v léčbě průlomové bolesti u pacientů s nádorovými chorobami
Souhrn:
Bolest je jedním z nejčastějších příznaků nádorových onemocnění, její intenzita a prevalence roste s pokročilostí choroby, nevyhýbá se však ani pacientům s nádory časnými. Bolest se může projevovat ve formě bazální bolesti a jejích akutních exacerbací, průlomová bolest představuje podjednotku bolesti bazální. Vzhledem ke své dynamice a průběhu je její léčba obtížná, ideální přípravek by měl mít vysokou účinnost, rychlý nástup a krátké trvání účinku. V posledních deseti letech byly do klinické praxe uvedeny transmukózní fentanylové přípravky, které významným způsobem změnily možnosti léčby průlomové bolesti. V úvodu následujícího sdělení jsou shrnuta základní fakta o nádorové bolesti a o možnostech její léčby. V další části jsou přehledně porovnány jednotlivé transmukózní fentanylové přípravky a shrnutí s praktickým managementem léčby nádorové bolesti.
Key words:
background pain – acute pain – cancer pain – breakthrough pain – procedural pain – opioids – fentanyl.
Summary:
Pain is one of the most frequent symptoms in cancer, its intensity and prevalence depends on disease progression, but can occur in early cancer too. Pain is characterized as background pain with acute exacerbations, breakthrough pain is specific type of the background pain. Due to its dynamics and progress is the treatment of breakthrough pain difficult, optimal analgesia should have high effectivity, rapid onset, and short duration. In the last ten years was entered to clinical use new transmucosal fentanyl formulations which highly changed the treatment of breakthrough pain. In the first part of the article are summarized basic facts about cancer pain and its treatment. In the second part are compared transmucosal fentanyl preparations and summarized practical management of cancer pain.
Úvod
Pacienti s nádorovými nemocemi mohou trpět středně silnou a silnou bolestí až v 85 % případů, prevalence a intenzita závisí na druhu a pokročilosti onkologického onemocnění [1]. V posledních patnácti letech byla do klinické praxe uvedena celá řada silných analgetik určených ke zmírnění nádorové bolesti a ke zlepšení kvality života pacientů, stále však v průzkumech a ve studiích část onkologických pacientů udává nepříjemnou až silnou bolest bez odpovídající úlevy [2]. Pro základní orientaci ve volbě analgetik byl již před třiceti lety publikován žebříček Světové zdravotnické organizace (World Health Organization, WHO) pro léčbu nádorové bolesti s aktualizací v roce 1996, kde se volba analgetika řídí její intenzitou [3]. Pro silnou bolest je nejúčinnější léčba silnými opioidy v kombinaci s adjuvantními analgetiky podle typu bolesti. Základem úspěšné léčby bolesti je podrobná anamnéza a zhodnocení původu, typu a intenzity bolesti. Vzhledem k multidimenzionální povaze bolesti představuje přístup k jejímu řešení kombinaci farmakologických a nefarmakologických přístupů (psychoterapie, rehabilitace).
Definice bolesti
Bolest je nepříjemný, multidimenzionální, senzorický a emocionální zážitek, který je spojen s aktuálním nebo s hrozícím poškozením tkáně anebo je v termínech takového poškození popisován, bolest je vždy subjektivní [4]. Bolest má složku senzorickou, která je charakterizována lokalizací, intenzitou, trváním a charakterem bolesti, a složku emoční, jež je spojena s úzkostí, depresí, agresí, s pocitem ohrožení, bezmoci, beznaděje a se ztrátou motivace. Všechny tyto faktory vedou k utrpení a k celkovému zhoršení kvality života.
Epidemiologie nádorové bolesti
Prevalence bolesti se u pacientů s nádory významně mění podle typu a pokročilosti nádorového onemocnění. V časných stadiích onemocnění ji udává 25–30 % pacientů a v pokročilých stadiích 75–90 % nemocných, přičemž i přes současné možnosti je nedostatečně léčeno kolem 43 % pacientů. Původ bolesti lze rozdělit na tři základní skupiny, bolest v souvislosti s nádorem (60–70 %), s jeho léčbou (20–30 %) a bolest bez souvislosti s nádorovým onemocněním (chronická nenádorová bolest, 10 %) [5]. Nádorová bolest může být přítomna ve formě bazální bolesti a akutních exacerbací. Akutní exacerbaci bolesti lze definovat jako intenzivní, rychle vznikající bolest, spontánní nebo vyvolanou, která má zpravidla totožný charakter a lokalizaci jako bolest bazální; akutní exacerbace může být i epizodická bez bolesti bazální. Progrese intenzity a četnosti akutních exacerbací mohou být nepříznivou známkou vývoje nemoci. Akutní exacerbace bolesti významně zhoršují celkovou kvalitu života a spokojenost pacienta s léčbou bolesti. Silná bolest může být přítomna i u pacientů s časnými nádory a často bývá podceňována bolest související s diagnostikou a léčbou (procedurální bolest) [6]. Bolest dělíme dále z hlediska typu na nociceptivní, neuropatickou a smíšenou.
Komplexní management bolesti u pacientů s nádorovými chorobami
Komplexnost celkového přístupu k nádorové bolesti spočívá ve vícerozměrném původu bolesti (model bio‑psycho‑sociálně‑spirituální). Vedle bolesti trpí pacienti s pokročilými nádory únavou, slabostí, poruchami spánku, nechutenstvím, nevolností, dušností a psychickými poruchami. Všechny tyto příznaky zhoršují prožívání a léčbu bolesti a naopak bolest zhoršuje vnímání a léčbu těchto příznaků. Bolest je při dodržení základních principů léčby dobře ovlivnitelná, na rozdíl od výše uvedených symptomů. Vzhledem k vazbám mezi bolestí a dalšími symptomy je v onkologii prosazován koncept časné paliativní péče (early palliative care, EPC), který prokazuje ve studiích přínos ke zlepšení celkové kvality života pacientů s pokročilými nádory.
Mezi základní otázky vstupního zhodnocení bolesti patří to, jestli je bolest v souvislosti s nádorem, zda je možná její kauzální léčba a jaké jsou možnosti symptomatické léčby (farmakologické a nefarmakologické). Dále je nutná rozvaha nad stavem onkologického onemocnění, nad potenciálem protinádorové léčby, nad pravděpodobnou prognózou délky života a rozvaha nad cíli léčby.
Paliativní onkologická léčba (hormonální terapie, chemoterapie, radioterapie, operační postupy, bisfosfonáty) má v léčbě pokročilé nádorové bolesti nezastupitelné místo. Její indikace vychází z reálných možností ovlivnění původu a příčiny bolestivého syndromu a měla by být aplikována v souladu s plánem péče a dle pacientových preferencí. V dalším postupu je snaha ovlivnit případné vyvolávající a spouštěcí faktory bazální bolesti a akutních exacerbací. Jedná se o úpravu životního prostředí (vhodné lůžko, toaletní křeslo, vozík), zajištění protetických pomůcek (ortézy, berle, chodítka), léčbu symptomů a vyvolávajících faktorů (kašel, zácpa, škytavka a jiné) a o edukaci pacienta týkající se vhodných pohybových vzorců (např. vstávání z lůžka a křesla, vyloučení závažné fyzické námahy, rozložení denních aktivit).
Mezi hlavní nefarmakologické postupy patří rehabilitace a ovlivnění psychosociální situace. Existuje celá řada klinických studií, které prokazují účinek kognitivně‑behaviorální terapie, hypnózy, řízené imaginace, meditace a autogenního tréninku na snížení celkové intenzity bolesti, četnosti akutních exacerbací a spotřeby analgetik [7,8].
Invazivní protibolestivé techniky jsou vysoce specializované zákroky, které nacházejí uplatnění ve specifických situacích (blokáda plexus coeliacus, epidurální a spinální analgezie), indikovány jsou u pacientů s jinak neovlivnitelnou bolestí.
Základem farmakologické léčby jsou analgetika, ta dělíme podle analgetického žebříčku WHO na tři základní skupiny: neopioidní analgetika, slabé a silné opioidy. Silné opioidy jsou hlavním pilířem léčby středně silné a silné nádorové bolesti, jejich spotřeba vykazuje řádové rozdíly mezi jednotlivými zeměmi, státy s propracovanou paliativní péčí patří mezi země s nejvyšší spotřebou ekvivalentu morfinu. V současnosti máme široké portfolio přípravků obsahujících silné opioidy v různých formách, jejich nežádoucí účinky jsou dobře definované a předvídatelné a při správném použití jsou tyto přípravky bezpečné [9,10].
Při smysluplné a aktivní aplikaci dostupných postupů, metod a léků lze většinu nádorové bolesti udržet na snesitelné míře, přesto část pacientů trpí vedle bazální bolesti též akutními exacerbacemi, jejichž léčba by měla být závislá na jejich původu, povaze a na časových souvislostech.
Průlomová bolest
Průlomová bolest je definována jako přechodné vzplanutí bolesti, které přichází spontánně nebo je vyvoláno působením specifického předvídatelného nebo nepředvídatelného faktoru, i přes relativně stabilní kontrolu bolesti [11,12]. V době diagnózy nádorového onemocnění je přítomna až u 30–40 % pacientů, v době aktivní léčby u 50–70 % a v terminální fázi nemoci u 70–80 % pacientů. Přímou souvislost s onkologickou léčbou (procedurální bolest) lze nalézt u 11–35 % epizod průlomové bolesti.
Průlomová bolest vede k častějším hospitalizacím a k akutním návštěvám lékaře, je spojena s narušením denních aktivit, spánku, pohybu, činností, vztahů a vazeb, je provázena zhoršením deprese a úzkosti, nespokojeností s bazální léčbou opioidy a obecně špatnými léčebnými výsledky. Klasifikace, etiopatogeneze a postup léčby prošly v posledních letech změnami a odborné mezinárodní společnosti formulovaly obecná doporučení [11–13].
Podle současného vnímání se pod pojem průlomová bolest nezahrnuje akutní exacerbace bolesti u pacientů s nedokončenou titrací opioidů, bolest na konci dávkovacího intervalu opioidu (end‑dose pain) a akutní exacerbace bolesti bez bazální bolesti (epizodická bolest).
Mezi charakteristiky průlomové bolesti patří rychlý nástup účinku (v řádech sekund až jednotek minut, v 50 % se rozvine do 5 minut), vysoká intenzita a krátké trvání bolesti (u 10–15 % do 15 minut, u 30–52 % do 30 minut, u 65–88 % pacientů do 60 minut); její frekvence je výrazně kolísavá (přibližně 60 % pacientů udává 1–3 epizody denně) [14].
Průlomovou bolest dělíme podle vyvolávající příčiny a předvídatelnosti na spontánní a incidentální. Incidentální průlomovou bolest dále dělíme na volní (chůze, denní aktivity a jiné), mimovolní (kašel, kýchání, defekace, škytavka) a procedurální. Incidentální, ale i spontánní průlomová bolest mohou být u části epizod předvídatelné a předvídatelnost je jedním z faktorů ovlivňujících distres pacienta a úspěšnost léčby průlomové bolesti.
Podrobná anamnéza je stejně jako u bazální bolesti základním pilířem úspěšného vedení léčby, po průlomové bolesti bychom měli aktivně pátrat a pacienta se pravidelně dotazovat. Mezi základní dotazy patří počátek a trvání, četnost, lokalizace a vyzařování, charakter a intenzita bolesti, průvodní příznaky, provokující a ovlivňující faktory, úlevová poloha a druh a účinnost dosavadní léčby.
Farmakoterapie průlomové bolesti
Léčba průlomové nádorové bolesti musí být komplexní, je třeba řešit bolest bazální a souběžně s tím akutní exacerbace. Léčebné postupy lze rozdělit na optimalizaci využití onkologické léčby, na farmakoterapii (opioidy, neopioidní analgetika, vlastní léky na průlomovou bolest) a na nefarmakologické postupy.
Optimální lék na ovlivnění průlomové bolesti by měl mít rychlý nástup a krátké trvání účinku, protibolestivá aktivita by měla být dostatečná, dále by měl mít příznivý profil nežádoucích účinků, jednoduchou aplikaci, přijetí nemocným, dostupnost a cenovou dostupnost. Jak bude podrobně uvedeno, nejblíže k tomuto ideálu mají v současnosti transmukózní formy fentanylu (TMF), jejichž účinnost byla prokázána celou řadou klinických studií.
Fentanyl je čistý µ‑agonista s vysokou relativní analgetickou účinností (poměr fentanyl : morfin = 100 : 1), je vysoce lipofilní, snadno tedy proniká přes buněčnou membránu, má relativně krátký účinek (1–3 h). Klinické studie zaznamenaly nástup účinku v rozmezí 5–15 minut s délkou trvání účinku 1–4 hodiny [15–18]. Aktuálně jsou v České republice dostupné fentanylové transmukózní přípravky pro léčbu průlomové bolesti ve formě intranazálního spreje, sublinguální tablety, bukální tablety a bukálního filmu. Všechny přípravky jsou indikovány k léčbě průlomové bolesti u pacientů užívajících opioidy v terapii základní bolesti v ekvivalentu 60 mg morfinu denně (fentanyl náplast 25 µg/h, oxycodon 30 mg/den, hydromorfon 8 mg/den).
Fentanyl v intranazálním spreji
Fentanyl je v nosním spreji (intranasal fentanyl spray, INFS) přítomen jako fentanyl citrát, přípravek byl schválen Evropskou lékovou agenturou (European Medicines Agency, EMA) v roce 2009 a je k dispozici v dávkách 50 µg, 100 µg a 200 µg. Farmakokinetické studie stanovily nejkratší čas do dosažení maximální plazmatické koncentrace – tmax – (12–15 minut) mezi TMF a nejvyšší biologickou dostupnost (89 %). Účinnost oproti placebu byla hodnocena ve studii fáze III [16]. Signifikantně lepší byly parametry úlevy od bolesti při užití INFS od 10. do 60. minuty, záchrannou medikaci potřebovalo 14 % pacientů ze skupiny s léčbou INFS a 45 % pacientů ze skupiny s podáváním placeba. Dobrou/velice dobrou/excelentní léčebnou účinnost udávalo 75,4 % pacientů ze skupiny s léčbou INFS a 30,9 % pacientů ze skupiny s podáváním placeba [16]. V multicentrické studii byl INFS porovnáván s orálním fentanylem ve formě lízátka (oral transmucosal fentanyl citrate, OTFC) [15]. Uspokojivé úlevy od bolesti bylo dosaženo za 11 minut v případě užití INFS a za 16 minut v případě užití OTFC, indikátory úlevy od bolesti byly od páté do 60. minuty signifikantně lepší pro INFS.
Systematický přehled publikovaných studií nepřímo porovnával INFS, OTFC, fentanyl ve formě bukálních tablet (FBT) a morfin v tabletách s okamžitým uvolňováním (immediate release, IR) [19]. Ze srovnání vyplynulo, že fentanylové přípravky poskytovaly účinnější analgezii oproti morfinu do 45. minuty, což při typické dynamice průlomové bolesti vylučuje morfin IR z její léčby. Z hlediska nežádoucích účinků byly zaznamenány pouze nežádoucí účinky typické pro opioidy. Mezi nově zjištěné nežádoucí účinky patří změny chuti (dysgeuzie) a naprosto ojediněle vředy nosní sliznice [15,16]. Fentanyl v nosním spreji upřednostňovalo 77,4 % pacientů a OTFC 22,6 % pacientů (p < 0,001), 90,1 % hodnocených popsalo aplikaci INFS jako snadnou/velice snadnou (v případě OTFC 39,8 % pacientů) [15]. Dávka INFS by měla být titrována od nejnižší síly dostupných přípravků s tím, že pokud nedojde k úlevě od bolesti při užití dané síly během 10 minut, lze dávku o stejné síle zopakovat. V případě další epizody bolesti se použije zvýšená dávka užitá pro minulou epizodu průlomové bolesti, která byla účinná v potlačení bolesti. Fentanyl v nosním spreji by měl být užit maximálně čtyřikrát denně. Mezi kontraindikace podání patří vedle alergie na látky obsažené v přípravku také léčba jiné akutní bolesti než průlomové, léčba je kontraindikována u pacientů bez udržovací terapie opioidy, při předchozí radioterapii obličeje a v případě opakovaných epistaxí.
Fentanyl v sublinguálních tabletách
Sublinguální tablety (SLFT) obsahují fentanyl citras, přípravek byl schválen EMA v roce 2008 a americkým Úřadem pro potraviny a léky (Food and Drug Administration, FDA) v roce 2011. Sublinguální tableta je složena z částic rozpustných ve vodě, které jsou obaleny fentanylem a mukoadhezivním agens k udržení tablety pod jazykem. Sublinguální sliznice je vysoce vaskularizovaná a má vynikající propustnost umožňující rychlou absorpci fentanylu. Fentanyl v sublinguálních tabletách je v ČR k dispozici ve dvou přípravcích v řadách dávek 100 µg, 200 µg, 300 µg, 400 µg, 600 µg a 800 µg, resp. 67 µg, 133 µg, 267 µg, 400 µg, 533 µg a 800 µg. Data z farmakokinetických studií uvádějí rozpustnost kolem 30 minut, tmax 30–60 minut a biologickou dostupnost 54–70 %. Multicentrická studie fáze III kontrolovaná placebem hodnotila účinnost SLFT u nádorové průlomové bolesti [20]. Podání SLFT bylo účinnější než podání placeba na potlačení bolesti od 10. do 60. minuty. Průměrná dávka k potlačení epizody průlomové bolesti byla 600 µg a četnost užití třikrát denně [26]. Nežádoucí účinky byly typické pro opioidy, zánětlivé změny sliznice byly zcela výjimečné. Celková spokojenost s léčbou vyzněla ve prospěch SLFT (29,7 % vs. 19,7 %). V jiné dlouhodobé studii sledující pacienty s léčbou SLFT po dobu 12 měsíců bylo velice spokojených nebo spokojených 77 % pacientů, zlepšila se jejich kvalita života a snížila se depresivita [21]. Ve studii s 217 pacienty s průlomovou bolestí byly při užívání SLFT signifikantně zlepšeny denní aktivity, snížena disabilita vyvolaná bolestí, úzkost a deprese [22].
Tableta je určena k aplikaci pod jazyk (vkládá se co nejdále), nepolyká se, nechá se spontánně rozpustit bez kousání nebo cucání. Pacienti by do jejího úplného rozpuštění neměli jíst ani pít. V případě suchosti sliznic ústní dutiny je vhodné zvlhčení vodou. Titrace dávky probíhá podobně jako u intranazální formy, pouze interval pro podání přídatné dávky je prodloužen na 15–30 minut. Po této době se užije navíc tableta o síle 100 µg (resp. 133 µg); pokud dávku titrujeme nad sílu 400 µg (resp. 533 µg), je vhodné přídatnou dávku zvýšit na 200 µg (resp. 267 µg), při jedné epizodě průlomové bolesti se nepodávají více než dvě dávky. Přípravek by neměl být použit častěji než 4× denně, častější epizody průlomové bolesti se řeší zvýšením základní léčby opioidy. Mezi kontraindikace podání patří alergie na složky léčivého přípravku, pacienti bez udržovací terapie opioidy a léčba jiné akutní bolesti než průlomové.
Fentanyl v bukálních tabletách
Bukální tablety s obsahem fentanyl citras (FBT) byly schváleny pro léčbu průlomové bolesti v roce 2006 (v USA) a 2008 (v Evropě). Přípravek je k dispozici v dávkách 100 µg, 200 µg, 400 µg, 600 µg a 800 µg. Fentanyl v bukálních tabletách využívá technologii OraVescentTM, která umožňuje upravovat ústní pH ke zlepšení rozpouštění a k maximalizaci absorpce fentanylu. Díky synchronizovaným změnám pH v dutině ústní se větší část fentanylu vstřebá sliznicí a menší je polknuta a absorbována gastrointestinálním traktem. Transmukózně je vstřebáno přibližně 50 % fentanylu, díky významnému obejití metabolismu přes cytochrom P450 (CYP3A4) v játrech oproti perorálním morfinovým přípravkům a OTFC vstupuje více fentanylu do systémové cirkulace. K rozpuštění tablety dojde za 14–25 minut, aniž tento proces vyžaduje aktivitu pacienta, tmax se pohybuje v rozmezí 35–45 minut.
Farmakokinetika FBT se neměnila u pacientů s mukozitidami dutiny ústní, k rozpuštění došlo do 30 minut a hodnoty tmax a cmax se nelišily od těchto hodnot u pacientů bez postižení sliznic. Při klinickém hodnocení u zdravých dobrovolníků docházelo ke stejnému vstřebávání při použití FBT bukálně i sublinguálně. Tato léková forma fentanylu byla zkoušena proti placebu v pěti klinických studiích, ve všech prokázala statisticky i klinicky signifikantní úlevu od bolesti [23]. V krátkosti, při srovnání s placebem prokázaly FBT signifikantní snížení sumy PID (pain intensity difference – rozdíl intenzit bolesti) během 60 minut (SPID0–60) a PID od 10. minuty, signifikantní vzestup úlevy od bolesti od 10. minuty a mírné, ale klinicky relevantní zmírnění intenzity bolesti od 5. a 15. minuty. Ve studiích bylo nutné podávat méně záchranné medikace a byla doložena lepší výkonnost při užívání FBT oproti placebu.
Účinnost FBT byla porovnávána s účinností oxycodonu IR u nádorové a nenádorové průlomové bolesti [24]; FBT vykazovala statisticky signifikantně vyšší PID oproti oxycodonu IR od 5. minuty a udržela se do 60. minuty. Úleva od bolesti byla při podávání FBT signifikantně vyšší od 10. do 60. minuty, ostatní sledované parametry (SPID60, PID15, celková úleva od bolesti) byly také signifikantně lepší ve prospěch FBT. Tyto údaje dokazují, že FBT má v porovnání s oxycodonem IR rychlejší nástup účinku, který udržuje po celou dobu sledování. Pacienti udávali, že celková výkonnost 30 minut po užití FBT byla dobrá až excelentní u 41 % epizod průlomové bolesti v porovnání s 26 % epizod průlomové bolesti při podávání oxycodonu IR (p < 0,0001). Ve studiích nebyly zjištěny neočekávané nežádoucí účinky, všechny byly typické pro opioidy a jejich intenzita a četnost se snižovala v čase. Klinické studie zaměřené na preference jednotlivých přípravků v léčbě průlomové bolesti prokázaly superioritu FBT oproti oxycodonu, morfinu a hydromorfonu v parametrech rychlosti účinku, pohodlnosti a jednoduchosti aplikace, celkové preference a kvality života [25,26].
Před užitím je třeba tabletu opatrně vyjmout z blistru a ihned vložit do dutiny ústní nedaleko stoliček mezi tvář a dáseň. Tableta se nerozkousává, necucá a nepolyká, po dobu přibližně 30 minut bychom neměli proplachovat dutinu ústní. Při titraci lze po užití dávky, pokud nedojde do 30 minut k úlevě od bolesti, užít další tabletu. Do dávky 400 µg lze dávku pro následnou epizodu průlomové bolesti vždy zdvojnásobit, od 600 µg by měla být podávána přídavná dávka o síle 200 µg. Kontraindikace jsou totožné jako v případě ostatních TMF.
Fentanyl v bukálním filmu
Fentanyl ve formě bukálního filmu (FBSF) obsahuje také fentanyl citras; pro užití u průlomové bolesti byl schválen v roce 2009 (v USA) a 2010 (v Evropě). Přípravek je k dispozici v dávkách 200 µg, 400 µg, 600 µg, 800 µg a 1 200 µg fentanylu, které se liší velikostí filmu. Využívá tzv. technologii BEMATM (BioErodible MucoAdhesive), která nabízí fentanyl v podobě vnitřní vrstvy adherující ke sliznici tváře a vnější vrstvy izolující fentanylovou vrstvu od slin. Tím je docíleno snížení množství fentanylu, které je spolknuto a znehodnoceno při prvním průchodu játry (first pass effect). Fentanyl ve formě bukálního filmu nevyžaduje mimo aplikaci pacientovu kontinuální aktivitu během vstřebávání. Farmakokinetické studie potvrdily širokou interindividuální variabilitu v jednotlivých parametrech zdůrazňující potřebu opatrné titrace účinné dávky. Dále stanovily čas do rozpuštění mezi 15–30 minutami, tmax 60 minut a biologickou dostupnost kolem 71 %. Účinnost FBSF byla zkoušena v randomizované klinické studii [27], při srovnání s placebem kontrolovala FBSF signifikantně lépe bolest od 15. do 60. minuty (SPID15–60). Při užití FBSF vyžadovalo 30 % epizod průlomové bolesti záchrannou medikaci, u placeba to bylo 45 % epizod (p = 0,002). Spokojenost s léčbou byla excelentní/dobrá/velice dobrá u 67,1 % pacientů ze skupiny s léčbou FBSF a u 47,1 % pacientů ze skupiny s podáváním placeba [27]. Bezpečnost a nežádoucí účinky byly stejné jako v ostatních studiích s opioidy. V této studii byla zaznamenána obecně vysoká účinnost placeba. Jako vysvětlení se nabízí zcela nová technologie náplasti, která byla použita i u placeba, a tím zvýšila očekávání pacientů a zvyšovala jejich citlivost i k minimálním změnám intenzity bolesti. Nutno podotknout, že v jiných studiích s novými technologiemi (SLFT, INFS) takové výrazné výsledky účinnosti placeba dokumentovány nebyly.
Bukální film by měl být aplikován ihned po vyjmutí ze sáčku, a to tak, že se sliznice dutiny ústní jemně navlhčí a bukální film se umístí na sliznici uvnitř tváře. Udává se, že již přibližně po pěti minutách lze pít tekutiny, k úplnému rozpuštění by mělo dojít do 30 minut po aplikaci. Titrace je postupná, pokud k účinku nedojde do 30 minut, pacient použije jiné léčivo, jehož volbu již konzultoval s lékařem, a při další epizodě průlomové bolesti se použije dvojnásobná dávka předchozí neúčinné dávky FBSF. V případě, že dojde k nalezení účinné dávky, užívá se při dalších epizodách průlomové bolesti tato dávka. Vedle kontraindikací platných obecně pro podání TMF je zde navíc kontraindikována souběžná aplikace inhibitorů monoaminooxidázy (IMAO) a ještě dva týdny po ukončení jejich podávání.
Data ze studií s fentanylovými transmukózními analgetiky
Pro potřeby zhodnocení léčby průlomové bolesti byl zpracován Cochranův přehled, který byl aktualizován v roce 2013, a další systematické přehledy [28–30]. Bylo nalezeno celkem 15 klinických studií s TMF pro aplikaci na sliznice nosu a úst. Jednalo se o pacienty, kteří užívali pravidelně opioidy v dávce odpovídající alespoň 60 mg morfinu denně. Tyto studie prokázaly, že přípravky podávané přes sliznici nosu a úst lépe kontrolovaly bolest než placebo a že perorálně aplikovaný transmukózní fentanyl byl účinnější než perorálně užívaný morfin s okamžitým uvolňováním [16–18]. Dále bylo prokázáno, že TMF významně snižovaly maximální intenzitu průlomové bolesti. Nezaslepená studie prokázala lepší účinnost 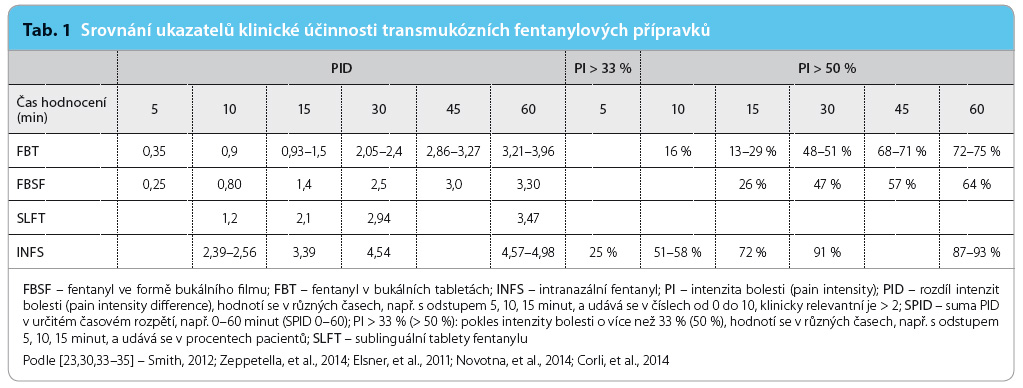 intravenózního morfinu oproti transmukóznímu fentanylu v prvních 15 minutách, bez rozdílu po 30 minutách [31]. V další studii bylo prokázáno, že intranazálně aplikovaný fentanyl poskytuje rychlejší úlevu od bolesti než perorální transmukózní přípravek [15]. Ze studií nevyplynul jednoduchý vztah mezi 24hodinovou dávkou opioidu a účinnou dávkou TMF. Ve většině studií byly uváděny očekávatelné nežádoucí opioidní účinky, nevolnost 13 %, zvracení 6 %, útlum 20 %, obluzenost 15–20 % a závratě [18]. Metaanalýza dostupných studií s TMF prokázala, že INFS a FBT redukovaly intenzitu bolesti lépe než placebo v 15. minutě, SLFT a FBSF prokazovaly stejnou účinnost jako placebo v 15. minutě a byly účinnější od 30. minuty [30]. Morfin v tabletách s okamžitým uvolňováním nepřinášel vyšší účinnost oproti placebu v prvních 30–45 minutách; INFS prokazoval vyš
intravenózního morfinu oproti transmukóznímu fentanylu v prvních 15 minutách, bez rozdílu po 30 minutách [31]. V další studii bylo prokázáno, že intranazálně aplikovaný fentanyl poskytuje rychlejší úlevu od bolesti než perorální transmukózní přípravek [15]. Ze studií nevyplynul jednoduchý vztah mezi 24hodinovou dávkou opioidu a účinnou dávkou TMF. Ve většině studií byly uváděny očekávatelné nežádoucí opioidní účinky, nevolnost 13 %, zvracení 6 %, útlum 20 %, obluzenost 15–20 % a závratě [18]. Metaanalýza dostupných studií s TMF prokázala, že INFS a FBT redukovaly intenzitu bolesti lépe než placebo v 15. minutě, SLFT a FBSF prokazovaly stejnou účinnost jako placebo v 15. minutě a byly účinnější od 30. minuty [30]. Morfin v tabletách s okamžitým uvolňováním nepřinášel vyšší účinnost oproti placebu v prvních 30–45 minutách; INFS prokazoval vyš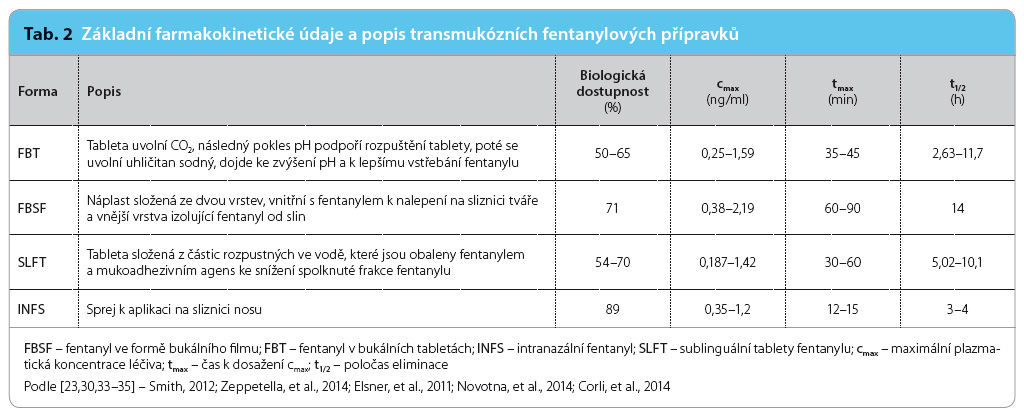 ší účinnost oproti FBT, SLFT a FBSF od páté minuty po celou dobu sledování (do 30. minuty) [30]. Rozdíl intenzit bolesti (PID) před aplikací a po aplikaci v určitých časových intervalech je jedním z hodnocených parametrů, klinicky relevantní je hodnota > 2. Ve studiích vykazoval INFS hodnoty > 2 v 10. minutě, SLFT v 15. minutě, FBT a FBSF tuto hodnotu překračovaly až od 30. minuty [30]. Čas do klinicky relevantní úlevy od bolesti je vždy delší než čas do začátku působení, protože zahrnuje čas od rozvoje účinku po klinicky snesitelnou úlevu od bolesti (tab. 1, 2).
ší účinnost oproti FBT, SLFT a FBSF od páté minuty po celou dobu sledování (do 30. minuty) [30]. Rozdíl intenzit bolesti (PID) před aplikací a po aplikaci v určitých časových intervalech je jedním z hodnocených parametrů, klinicky relevantní je hodnota > 2. Ve studiích vykazoval INFS hodnoty > 2 v 10. minutě, SLFT v 15. minutě, FBT a FBSF tuto hodnotu překračovaly až od 30. minuty [30]. Čas do klinicky relevantní úlevy od bolesti je vždy delší než čas do začátku působení, protože zahrnuje čas od rozvoje účinku po klinicky snesitelnou úlevu od bolesti (tab. 1, 2).
Data ze studií a dosavadní klinická praxe umožňují vyslovit silné doporučení, podle něhož by akutní exacerbace bolesti jinak kontrolované opioidy měly být léčeny dodatečnými dávkami opioidů s rychlým uvolňováním. Pacient by měl být těmito léky vybaven od začátku léčby opioidy, lze je totiž využít jako pomocné při titraci denní dávky opioidu [10]. Pro léčbu vlastní průlomové bolesti lze využít perorální opioidy s okamžitým uvolňováním (morfin) nebo přípravky pro orální nebo intranazální aplikaci (TMF). V léčbě typické průlomové bolesti jsou v současnosti upřednostňovány TMF, protože jejich nástup účinku je rychlejší než u morfinu a odeznění účinku je také rychlejší. U předvídatelné bolesti lze preemptivně použít přípravky s rychlým uvolňováním opioidu (morfin) aplikované přibližně 30 minut před zákrokem nebo před aktivitou vyvolávající bolest (rehabilitace, převaz, defekace).
Shrnutí a praktický návrh managementu nádorové bolesti
Prvním farmakologickým postupem léčby středně silné a silné nádorové bolesti je nalezení dostatečné dávky opioidu, zde musíme vždy volit mezi účinnou dávkou a rozvojem očekávatelných nežádoucích účinků (optimalizace opioidní léčby). Ve většině případů podáváme opioidy v dávkovacích intervalech dle souhrnu údajů o přípravku. Pokud je účinek dostatečný, ale trvá kratší dobu, lze v indikovaných případech intervaly měnit (oxycodon každých 8 hodin, transdermální opioidy každých 48 hodin). Nejedná se o postup první volby, nejprve je snaha o zvýšení denní dávky opioidu, ale u části pacientů může být tento postup efektivní. Vždy je třeba pacienta dostatečně monitorovat z hlediska klinického účinku a rozvoje netolerovatelných nežádoucích účinků. Rozdílná intenzita bolesti ve dne nebo v noci může být důvodem pro podání rozdílné večerní a ranní dávky retardovaného perorálního opioidu. Těmito postupy dojde k potlačení bazální bolesti a akutních exacerbací, které vyplývají z nedostatečné titrace celkové denní dávky opioidů, a bolesti ke konci dávkovacího intervalu. Účinný bývá tento postup také u části krátkodobých epizod průlomové kostní bolesti (do 5 minut) vyvolané pohybem a manipulací a/nebo při ostré a rychlé pleurální bolesti [32].
Pokud není základní bolest dostatečně kontrolována při dosažení dávky vyvolávající nekorigovatelné a obtěžující nežádoucí účinky, je vhodná rotace opioidu. Podle typu bolesti je další volbou zahájení léčby adjuvantními analgetiky, nejčastěji jsou využívána antikonvulziva a antidepresiva u neuropatické a smíšené bolesti. Akutní exacerbace bolesti, které vznikají v době, kdy není optimalizována základní analgezie a dokončena titrace opioidu, nejsou průlomové a není vhodné užívání TMF.
Pokud po optimalizaci základní analgezie pacient trpí záchvaty akutních exacerbací bolesti různé intenzity, délky a frekvence, hovoříme již o této bolesti jako o průlomové bolesti. Její léčba vychází z dynamiky nástupu, délky trvání, intenzity a předvídatelnosti.
Základní analgetika neopioidního typu jsou vhodná spíše jako koanalgetika u procedurální bolesti, kostních bolestí a bolesti, která se objevuje nahodile, spíše výjimečně. Lze využít paracetamol v dávce 1 g, ibuprofen 400 mg nebo metamizol 500–1 000 mg. Všechna tato léčiva mají poměrně pomalý nástup účinku (20–40 minut), jejich efekt je stropový, mají své limitní denní dávky a časté nežádoucí účinky. Dobře využitelné jsou při procedurální a předvídatelné bolesti v kombinaci se sedací (trepanobiopsie, převazy).
Použití perorálních opioidů v neretardované formě (v ČR je k dispozici morfin s bezprostředním uvolňováním) je v léčbě typické spontánní nepředvídatelné průlomové bolesti v současnosti nevhodné. Nástup jeho účinku je kolem 20–40 minut, maxima dosahuje přibližně po 60 minutách a díky farmakokinetice léčiva přetrvává účinek až šest hodin. Morfin s bezprostředním uvolňováním může být podáván u všech typů nádorové bolesti, k titraci základní účinné denní dávky opioidu, pro bolesti předvídatelné a procedurální a jiné akutní exacerbace u pacientů s malou aktivitou, ležících a u pacientů v terminálním stadiu onemocnění, kde délka působení nezhoršuje kvalitu života [10]. Optimální jednotlivá dávka zpravidla činí 5–15 % denní dávky opioidu, ale existují výjimky, je proto potřeba individuální titrace [9,14].
Parenterální formy opioidů jsou využívány v určitých případech managementu nádorové bolesti, upřednostňujeme podání podkožní a nitrožilní před aplikacemi nitrosvalovými. Jejich účinek nastupuje přibližně za 10–15 minut a délka trvání je závislá na druhu opioidu, na četnosti aplikací, na dávce a na renálních funkcích. V případě morfinu činí obvykle 4–6 hodin při bolusových aplikacích. Parenterálně mohou být opioidy užity ve formě bolusových aplikací u procedurálních bolestí a jiných akutních exacerbací, kde nejsou účinná neopioidní analgetika nebo morfin s bezprostředním uvolňováním. Druhou možností je aplikace opioidů kontinuální infuzí, je dosahováno vyrovnanějších plazmatických koncentrací a lepšího působení léčby. Další možnou indikací je rychlá titrace optimální denní dávky opioidů s následným převedením na retardované perorální a transdermální formy opioidů. Specifickou indikací je léčba bolesti u pacientů v terminálním stavu, kde využíváme jejich další výhodné účinky např. na zklidnění dušnosti.
V současnosti je při typické průlomové bolesti u pacientů tolerujících léčbu opioidy nejvhodnější použití TMF. Jejich indikace a optimální účinnost je u typické průlomové bolesti spontánní nebo incidentální. Je nutné důsledně odlišit průlomovou bolest od jiných akutních exacerbací bolesti, od bolesti epizodické, bolesti v důsledku nedokončené titrace a bolesti na konci dávkovacího intervalu. Jednotlivou účinnou dávku TMF je nutné vytitrovat, nelze ji odhadnout podle celkové denní dávky opioidu. U pacienta vždy zahájíme léčbu epizod průlomové bolesti nejnižší dávkou TMF a dávku titrujeme dle účinnosti nebo do rozvoje netolerovatelných nežádoucích účinků. Titrace je, vedle správné indikace, zásadní pro dobrý klinický účinek, s pacientem musíme probrat správnou techniku navyšování dávek a je vhodné být v době titrace v kontaktu.
Volba jednotlivých forem (intranazální sprej, bukální tableta nebo film a sublinguální tableta) záleží na preferenci pacienta po poučení lékařem. Přípravky ve studiích nevykazovaly významné rozdíly v nástupu a účinku nebo v nežádoucích účincích. Některé stavy (radioterapie obličeje) mohou být kontraindikací pro podání intranazální formy. Formy bukální mohou být hůře tolerovány a méně účinné u pacientů s těžkými xerostomiemi po ozáření oblasti hlavy a krku. Tyto konkrétní situace je třeba brát v potaz při volbě konkrétního přípravku (tab. 3). Paralelně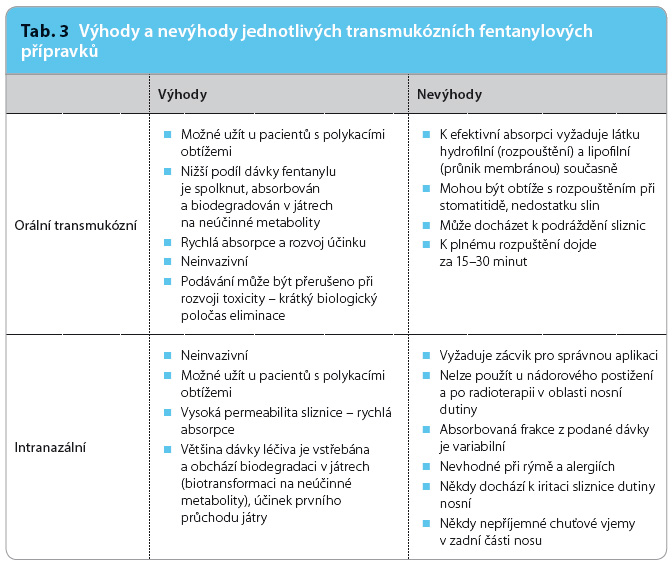 s titrací dávky je nezbytné stále pátrat po možných odstranitelných příčinách bolesti, snažit se o optimalizaci základních analgetik, o využití koanalgetik (adjuvantní analgetika) a o možnosti uplatnění nefarmakologických postupů.
s titrací dávky je nezbytné stále pátrat po možných odstranitelných příčinách bolesti, snažit se o optimalizaci základních analgetik, o využití koanalgetik (adjuvantní analgetika) a o možnosti uplatnění nefarmakologických postupů.
Moderní analgetika určená k ovlivnění průlomové bolesti, jakými jsou TMF, představují výrazný pokrok a zlepšení její léčby a jsou blízko ideálu optimálního analgetika na ovlivnění průlomové bolesti. Pro maximalizaci jejich účinku a plnou spokojenost pacienta s léčbou bolesti je třeba respektovat základní pravidla léčby bazální bolesti a jejích akutních exacerbací.
Závěr
V posledních deseti letech byly uvedeny na trh transmukózní fentanylové přípravky k léčbě průlomové bolesti. Provedené klinické studie potvrdily, že TMF přinesly vyšší účinnost a rychlost účinku v léčbě průlomové bolesti. Vzhledem k tomu, že neproběhly přímé srovnávací studie, nelze upřednostnit žádný z dostupných přípravků. Ze studií vyplynulo, že přípravky jsou srovnatelné z hlediska účinku a bezpečnosti, volba konkrétního přípravku závisí na charakteristikách nemoci, na uskutečněné a probíhající léčbě, na dynamice průlomové bolesti a na pacientových preferencích.
Seznam použité literatury
- [1] Ventafridda V, Tamburini M, Caraceni A, et al. A validation study of the WHO method for cancer pain relief. Cancer 1987; 39: 850–856.
- [2] Deandrea S, Montanari M, Moja L, Apolone G. Prevalence of undertreatment in cancer pain. A review of published literature. Ann Oncol 2008; 19: 1985–1991.
- [3] WHO. Cancer pain relief. 2nd ed. Geneva: World Health Organization, 1996
- [4] Merskey H, Bugduk N. Classification of chronic pain. Description of Chronic Pain Syndromes and Definitions of Pain Terms. 2nd ed. Seattle, WA: IASP Press; 1994.
- [5] Goudas LC, Bloch R, Gialeli Goudas M, et al. The epidemiology of cancer pain. Cancer Invest 2005; 23: 182–190.
- [6] Bennett M, Rayment C, Hjermstad M, et al. Prevalence and etiology of neuropathic pain in cancer patients: A systematic review. Pain 2012; 153: 359–365.
- [7] Fishman B, Loscalzo M. Cognitive behavioral interventions in management of cancer pain: principles and applications. Med Clin North Am 1987; 71: 271–287.
- [8] Abrahm JL. Assessing the patient in pain. In: Abrahm JL, ed. A Physician’s Guide to Pain and Symptom Management in Cancer Patients, 2nd edition, Baltimore, MD: Johns Hopkins University Press, 2005; 107–147.
- [9] Radbruch L, Trottenberg P, Elsner F, et al. A systematic review of the role of alternative application routes for opioid treatment for moderate to severe cancer pain: an EPCRC opioid guidelines project. Palliat Med 2011; 25: 578–596.
- [10] Caraceni A, Hanks G, Kaasa S, et al. Use of opioid analgesics in the treatment of cancer pain: evidence based recommendations from the EAPC. Lancet Oncol 2012; 13: e58–68.
- [11] Davies AM, Dickman A, Reid C, et al. Science Committee of the Association for Palliative Medicine of Great Britain and Ireland. The management of cancer related breakthrough pain: Recommendation of a taskgroup of the Science Committee of the Association for Palliative Medicine of Great Britain and Ireland. Eur J Pain 2009; 13: 331–338.
- [12] Haugen DF, Hjermstad MJ, Hagen N, et al. European Palliative Care Research Collaborative (EPCRC). Assessment and classification of cancer breakthrough pain: A systematic literature review. Pain 2010; 149: 476–482.
- [13] Svendsen K, Andersen S, Arnason S, et al. Breakthrough pain in malignant and non malignant diseases: a review of prevalence, characteristics and mechanisms. Eur J Pain 2005; 9: 195–206.
- [14] Kabelka L, Kozák J, Lejčko J, Sláma O. Doporučený postup pro léčbu průlomové nádorové bolesti. Bolest 2011; 14 (Suppl 1): 1–5.
- [15] Mercadante S, Radbruch L, Davies A, et al. A comparison of intranasal fentanyl spray with oral transmucosal fentanyl citrate for the treatment of breakthrough cancer pain: an open label, randomized, crossover trial. Curr Med Res Opin 2009; 25: 2805–2815.
- [16] Kress HG, Oronska A, Kaczmarek Z, et al. Efficacy and tolerability of intranasal fentanyl spray 50 to 200ug for breakthrough pain in patients with cancer: a phase III, multinational, randomized, double blind, placebo controlled, crossover trial with a 10 month open label extension treatment period. Clin Ther 2009; 31: 1177–1191.
- [17] Portenoy RK, Tayor D, Messina J, Tremmel L. A randomized, placebo controlled study of fentanyl buccal tablet for breakthrough pain in opioid treated patients with cancer. Clin J Pain 2006; 22: 805–811.
- [18] Slatkin NE, Xie F, Messina J, Segal TJ. Fentanyl buccal tablet for relief of breakthrough pain in opioid tolerant patients with cancer related chronic pain. J Support Oncol 2007; 5: 327–334.
- [19] Vissers D, Stam W, Nolte T, et al. Efficacy of intranasal fentanyl spray versus other opioids for breakthrough pain in cancer. Curr Med Res Opin 2010; 26: 1037–1045.
- [20] Rauck RL, Tark M, Reyes E, et al. Efficacy and long term tolerability of sublingual fentanyl orally disintegrating tablet in the treatment of breakthrough cancer pain. Curr Med Res Opin 2009; 25: 2877–2885.
- [21] Nalamachu S, Hassman D, Wallace MS, et al. Long term effectiveness and tolerability of sublingual fentanyl orally disintegrating tablet for the treatment of breakthrough cancer pain. Curr Med Res Opin 2011; 27: 519–530.
- [22] Uberall MA, Muller Schwefe GH. Sublingual fentanyl oraly disintegrating tablet in daily practice: efficacy, safety and tolerability in patients with breakthrough cancer pain. Curr Med Res Opin 2011; 27: 1385–1394.
- [23] Smith H. A Comprehensive review of Rapid Onset Opioids for Breakthrough Pain. CNS Drugs 2012; 26: 509–535.
- [24] Ashburn MA, Slevin KA, Messina J, et al. The efficacy and safety of fentanyl buccal tablet compared with immediate release oxycodone for the management of breakthrough pain in opioid tolerant patients with chronic pain. Anesth Analg 2011; 112: 693–702.
- [25] Weinstein SM, Messina J, Xie F. Fentanyl buccal tablet for the treatment of breakthrough pain in opioid tolerant patients with chronic cancer pain: a long term, open label safety study. Cancer 2009; 115: 2571–2579.
- [26] Fine PG, Messina J, Xie F, et al. Long term safety and tolerability of fentanyl buccal tablet for the treatment of breakthrough pain in opioid tolerant patients with chronic pain: an 18 month study. J Pain Symptom Manage 2010; 40: 747–760.
- [27] Rauck R, North J, Gever LN, et al. Fentanyl buccal soluble film (FBSF) for breakthrough pain in patients with cancer: a randomized, double blind, placebo controlled study. Ann Oncol 2010; 21: 1308–1314.
- [28] Zeppetella G, Davies AN. Opioids for the management of breakthrough pain in cancer patients. Cochrane Database Syst Rev 2013, Issue 10. Art No.: CD004311.
- [29] Zeppetella G. Opioids for the management of breakthrough cancer pain in adults: a systematic review undertaken as part of an EPCRC opioid guidelines project. Palliat Med 2011; 25: 516–524.
- [30] Zeppetella G, Davies A, Eijgelshoven I, Jansen JP. A network meta analysis of the efficacy of opioid analgesics for the management of breakthrough cancer pain episodes. J Pain Symptom Manage 2014; 47: 772–785.
- [31] Mercadante S, Villari P, Ferrera P, et al. Transmucosal fentanyl vs intravenous morphine in doses proportional to basal opioid regimen for episodic breakthrough pain. Br J Cancer 2007; 96: 1828–1833.
- [32] Mercadante S, Villari P, Ferrera P, Casuccio A. Optimization of opioid therapy for preventing incident pain associated with bone metastases. J Pain Symptom Manage 2004; 28: 505–510.
- [33] Elsner F, Zeppetella G, Porta Sales J, Tagarro I. Newer generation fentanyl transmucosal products for breakthrough pain in opioid tolerant cancer patients. Clin Drug Invest 2011; 31: 605–618.
- [34] Novotna S, Valentova K, Fricova J, et al. A randomized, placebo controlled study of a new sublingual formulation of fentanyl citrate (fentanyl ethypharm) for breakthrough pain in opioid treated patients with cancer. Clin Ther 2014; 36: 357–367.
- [35] Corli O, Roberto A. Pharmacological and clinical differences among transmucosal fentanyl formulations for the treatment of breakthrough cancer pain: a review article. Minerva Anestesiol 2014; 80: 1123–1134.