Vakcinace u imunokompromitovaných osob
Očkování pacientů s oslabenou imunitou představuje mezioborovou problematiku zahrnující praktické i odborné lékaře. Přínos vakcinace spočívá ve snížení počtu, resp. závažnosti nejrůznějších infekčních chorob s vědomím, že imunitní odpověď je u této skupiny pacientů často snížená, a navíc existuje riziko diseminace živých vakcinálních agens u těžce imunokompromitovaných osob. Velmi omezené je využití živých atenuovaných vakcín u pacientů s primárními imunodeficity a u pacientů s imunosupresivní terapií kortikosteroidy, cytostatiky, antimetabolity a biologickou léčbou. Jedná se hlavně o pacienty se zánětlivými střevními chorobami, revmatologickými a onkologickými onemocněními. Široká škála pacientů s častými interními chorobami srdce, plic a ledvin bez imunosupresivní léčby je indikována rovněž k vakcinaci proti chřipce, pneumokokovým infekcím, pertusi a hepatitidě B, součástí prevence je také vakcinace proti varicele u vnímavých osob a vakcinace proti herpes zoster u starších osob. U pacientů po transplantaci krvetvorných buněk je nutná revakcinace v případě chorob, proti nimž byli očkováni v dětství, dále vakcinace proti invazivním bakteriálním infekcím a proti chřipce. Cestovatelské možnosti imunokompromitovaných jedinců nejsou omezené ve vztahu k očkování proti hepatitidě A, břišnímu tyfu, meningokokoku a přenosné obrně (neživou vakcínou), problematická je vakcinace proti žluté zimnici při současné imunosupresivní terapii kortikosteroidy převyšující dávku 20 mg prednisonu/den. Ochranu pacientů s oslabenou imunitou zlepšuje vakcinace proti chřipce a pertusi provedená u osob v blízkém kontaktu a dále vakcinace proti varicele, rotavirovým a pneumokokovým infekcím u dětí žijících ve společné domácnosti s imunokompromitovaným pacientem. Reálná účinnost vakcín není ve většině situací známa a vychází z epidemiologické rozvahy a předpokladu alespoň částečně protektivního účinku. Jsou nezbytná další sledování k ověření účinku používaných vakcín.
Seznam zkratek očkovacích látek
ACYW135 – konjugovaná vakcína proti meningokokovým infekcím, sérotypům A, C, Y a W135; BCG – vakcína proti tuberkulóze; dTap – vakcína proti záškrtu (s nižším obsahem antigenu), tetanu a černému kašli (acelulární); Hib – vakcína proti nákaze Haemophilus influenzae typu b; MMR – vakcína proti spalničkám, příušnicím a zarděnkám; PCV13 – 13valentní pneumokoková polysacharidová konjugovaná vakcína; PPSV23 – 23valentní pneumokoková polysacharidová vakcína
Úvod
Očkování je nejrozšířenějším a nejúčinnějším postupem v prevenci infekčních onemocnění, který je po celá desetiletí široce využíván především u dětské populace. V minulosti byla vakcinace u dospělých zaměřena na prevenci tetanu a problematiku cestovní medicíny. Vývoj nových a zdokonalování starších vakcín, měnící se epidemiologická situace a nové medicínské postupy v léčbě nejrůznějších chronických onemocnění obrátily pozornost k širšímu využití očkovacích látek nejen u zdravé populace. V současné době tvoří problematika očkování jedinců se změněnou imunitní odpovědí nedílnou součást vakcinologie a vyžaduje důslednou mezioborovou spolupráci k optimalizaci očkovacích schémat a ke stanovení správné indikace jednotlivých vakcín, nebo naopak jejich kontraindikace. Jedná se o specifické podmínky využití očkovacích látek s nutností určité individualizace přístupu s ohledem na konkrétní chorobu, stav imunity, užívanou medikaci atd.
Význam vakcinace u imunokopromitovaných pacientů
Hlavním smyslem vakcinace této široké heterogenní skupiny pacientů je:- prevence závažných chorob vázaných na přesně definované poruchy imunity – příkladem může být vakcinace proti invazivním pneumokokovým a meningokokovým infekcím a proti infekcím bakterií Haemophilus influenzae typu b u pacientů s hyposplenismem/asplenií;
- snížení výskytu závažných a komplikovaných průběhů vybraných onemocnění např. protrahované nebo fulminantní virové hepatitidy A u pacientů s autoimunitní hepatitidou a imunosupresivní terapií nebo zmírnění závažného průběhu varicely u vnímavých jedinců s atopickým ekzémem nebo psoriázou;
- zamezení dekompenzace základního chronického onemocnění – ischemické choroby srdeční, bronchiálního astmatu – s využitím očkování proti chřipce, pneumokokovým nákazám a pertusi.
Rizika a omezení vakcinace u imunokopromitovaných pacientů
Při vakcinaci imunokompromitovaných jedinců nelze opomenout fakt, že v klinických studiích s hodnocením protilátkové odpovědi, snášenlivosti a bezpečnosti vakcín je zahrnuta v naprosté většině pouze zdravá populace. Navíc je u některých vakcín problematický korelát protekce [1]. Z toho vyplývají i možná omezení spojená s podáním očkovacích látek imunokompromitovaným osobám:
- nedostatečná imunitní odpověď na podanou vakcínu s následným klinickým selháním vakcinace a vznikem onemocnění – příkladem může být očkování proti chřipce u pacientů s biologickou léčbou nebo očkování proti hepatitidě B neadjuvovanou vakcínou u hemodialyzovaných pacientů;
- uplatnění živých atenuovaných virů a bakterií jako patogenních agens u osob s významným defektem imunity s následnými klinickými projevy vyvolanými vakcinálními kmeny – např. manifestace varicely po očkování u osob s útlumem buňkami zprostředkované imunity nebo protrahované průjmy u dětí s těžším protilátkovým deficitem očkovaných proti rotavirovým infekcím;
- dekompenzace autoimunitního onemocnění na podkladě stimulace imunitního systému podanou vakcínou – argument, který je často uváděn jednotlivými odbornými lékaři, vyžaduje pečlivou analýzu k posouzení příčinné, respektive časové souvislosti [2]. Existuje jen velmi málo údajů, které v souladu s poznatky medicíny založené na důkazech dokládají, nebo vyvracejí toto riziko – příkladem je práce, která popírá negativní vliv očkování proti klíšťové meningoencefalitidě u pacientů s roztroušenou sklerózou, nebo práce nepotvrzující zhoršení revmatických onemocnění po vakcinaci proti chřipce [3, 4]. Přesto je třeba mít potenciální riziko na paměti a neočkovat pacienty v době dekompenzace základní choroby.
Přehled  hlavních otázek, které by si lékař pečující o pacienta z některé z uvedených skupin imunokompromitovaných osob měl klást, uvádí tab. 1.Výčet pacientů, které ve vztahu k vakcinaci řadíme mezi „rizikové/indikované“, uvádí tab. 2. Výčet jistě není úplný a v určitých situacích se jednotlivé skupiny i překrývají, z praktického pohledu ale umožňuje nastínit problematiku očkování pro jednotlivé odbornosti a praktic
hlavních otázek, které by si lékař pečující o pacienta z některé z uvedených skupin imunokompromitovaných osob měl klást, uvádí tab. 1.Výčet pacientů, které ve vztahu k vakcinaci řadíme mezi „rizikové/indikované“, uvádí tab. 2. Výčet jistě není úplný a v určitých situacích se jednotlivé skupiny i překrývají, z praktického pohledu ale umožňuje nastínit problematiku očkování pro jednotlivé odbornosti a praktic ké lékaře. Specifickou problematiku prevence infekčních onemocnění tvoří také očkování tzv. blízkých kontaktů, tedy osob, které jsou s imunokompromitovaným pacientem v blízkém kontaktu, případně podávání pasivní imunoprofylaxe.
ké lékaře. Specifickou problematiku prevence infekčních onemocnění tvoří také očkování tzv. blízkých kontaktů, tedy osob, které jsou s imunokompromitovaným pacientem v blízkém kontaktu, případně podávání pasivní imunoprofylaxe.
Základní charakteristika medikamentózní imunosuprese ve vztahu k vakcinaci
Kortikoterapie
Kortikoidní přípravky jsou široce používanými imunosupresivními léky. Podání živých oslabených vakcín je kontraindikováno při léčbě vysokými dávkami kortikoidů. Neživé očkovací látky mohou být podány, ale s vědomím možné redukce účinku. Kontraindikací podání živých vakcín není:
- krátkodobá kortikoterapie (< 14 dní),
- terapie nízkými až středními dávkami kortikoidů (< 20 mg prednisonu/den),
- substituční léčba kortikoidy,
- lokální nebo inhalační nebo intraartikulární aplikace kortikoidů.
Za vysoké dávky kortikoidů se pro tyto účely považuje dávka prednisonu vyšší než 2 mg/kg/den u malých dětí a dávka vyšší než 20 mg/den u starších dětí a dospělých. Pokud je tato dávka podávána déle než 14 dní, je nutné očkování živými vakcínami odložit až o jeden měsíc po skončení kortikoterapie [5].
Další imunosupresivní léky
Mezi další imunosupresiva, která mohou ovlivnit výběr vhodné vakcinace, patří:
- „klasická” imunosupresiva: alkylační látky (např. cyklofosfamid), antimetabolity (např. azathioprin, 6-merkaptopurin), protinádorová chemoterapie;
- imunosupresiva podávaná po transplantaci – cyklosporin, takrolimus, sirolimus, mykofenolát mofetil, mitoxantron;
- monoklonální protilátky proti TNFα (tumor nekrotizující faktor alfa) – etanercept, adalimumab, certolizumab pegol, golimumab, infliximab;
- další biologické léky – rituximab, abatacept, tocilizumab, ustekinumab, anakinra, leflunomid, interferony.
Všechny tyto léky obvykle navozují hluboký imunodeficit, i když u některých přípravků závisí míra imunosuprese na dávce. Při nízkodávkované terapii je suprese jen nízká, takže po očkování dojde pouze k minimálnímu ovlivnění odpovědi na vakcinaci, nebo odpověď není ovlivněna vůbec. S ohledem na tuto skutečnost je pro některé léky určena dávka odpovídající nízkodávkované nebo vysokodávkované terapii. Hodnoty jsou zatím většinou stanoveny arbitrárně na základě konsenzu odborníků a budou se zřejmě upravovat s tím, jak budou přibývat data z klinické praxe.
Očkování neživými vakcínami v průběhu léčby imunosupresivními léky nepředstavuje riziko. Účinek podané vakcíny může být v závislosti na míře imunosuprese snížený. Výjimkou je léčba rituximabem, který působí depleci B lymfocytů, a tím velmi výrazně snižuje tvorbu protilátek po očkování. Po skončení léčby rituximabem přetrvává snížená odpověď na vakcinaci ještě dalších 6 měsíců. Při nutnosti očkování ještě před uplynutím lhůty 6 měsíců (např. očkování proti chřipce v době epidemie) lze neživou vakcínu podat, ale s vědomím velmi nízké účinnosti [6].
Živé vakcíny (MMR, vakcíny proti varicele, žluté zimnici, herpes zoster) lze bez omezení podávat při léčbě sulfasalazinem a hydroxychlorochinem. Očkování proti herpes zoster je dle doporučení Amerického poradního sboru pro očkování (Advisory Committee on Immunization Practices, ACIP) možné při léčbě nízkými dávkami methotrexátu (< 20 mg/týden, respektive < 0,4 mg/kg/týden), azathioprinu (< 3 mg/kg/den) a 6-merkaptopurinu (< 1,5 mg/kg/den) [7]. Dávky byly stanoveny konsenzuálně a platí pouze pro očkování vakcínou proti herpes zoster, nikoli pro očkování dalšími živými vakcínami. Při léčbě ostatními výše uvedenými imunosupresivy je podání živých vakcín kontraindikováno. Po přerušení či ukončení léčby těmito přípravky lze znovu zahájit očkování živou vakcínou až po uplynutí určité doby. Délka tohoto intervalu se odvíjí od biologického poločasu eliminace konkrétního přípravku. Pro většinu přípravků je arbitrárně stanoven interval 3 měsíce mezi ukončením léčby a podáním živé vakcíny. Velmi dlouhý odstup při podání živých vakcín je nutný po léčbě rituximabem (12 měsíců) a leflunomidem (24 měsíců) [8].
Vakcinace a primární imunodeficity, HIV
Pacienti s vrozenými imunodeficity jsou ohroženi zvýšeným rizikem rozvoje závažných infekcí vznikajících nejčastěji na podkladě defektu protilátkové nebo buňkami zprostředkované imunity, případně defektu v komplementové kaskádě nebo mechanismem fagocytózy.
Jde-li o méně závažné deficity typu selektivních deficitů v jednotlivých třídách imunoglobulinů IgG, je možné podávat očkovací látky bez omezení. To platí i pro vakcíny proti rotavirům a MMR. Při závažnějších protilátkových poruchách – hypogamaglobulinemiích nelze samozřejmě detekovat dostatečnou protilátkovou odpověď, nicméně určitý přínos očkování lze očekávat na podkladě imunitní odpovědi zprostředkované buňkami. Z tohoto důvodu není očkování zřejmě zcela zbytečné, přestože dokladovaná účinnost u této skupiny pacientů chybí. Doporučuje se eventuální podání neživých vakcín před zahájením terapie imunoglobuliny. U těchto pacientů lze podat například vakcínu proti varicele jako prevenci vzniku sekundárních bakteriálních komplikací. Pacienti s deficitem buněčné imunity nemohou být vakcinováni žádnou živou (bakteriální nebo virovou) atenuovanou vakcínou pro riziko diseminace a vzniku generalizované infekce. Pacienti s defektem fagocytózy mohou být vakcinováni virovými atenuovanými vakcínami, ale ne bakteriálními (např. BCG, orální tyfová vakcína). Osobám s defektem komplementu mohou být podány živé i neživé vakcíny bez omezení. Některé očkovací látky mohou u těchto pacientů zabránit vzniku nebo závažnému průběhu některých chorob, u naprosté většiny primárních imunodeficitů je doporučeno očkování proti chřipce a pneumokokovým infekcím, přestože účinnost je velmi často nedostatečná [9].
U defektů komplementové řady je navíc indikováno přeočkování proti meningokokovým infekcím, eventuálně i hemofilovým infekcím, pokud nebylo provedeno v rámci dětského očkování. Ve všech případech jsou vakcínou volby konjugované očkovací látky, v případě pneumokokových vakcín s následným rozšířením spektra ochrany polysacharidovou vakcínou [10].
Kombinované defekty imunity vyžadují individuální přístup podle charakteru jednotlivé imunodeficience a nelze pravidla pro vakcinaci shrnout do obecného schématu, protože některé vakcíny jsou kontraindikované, respektive neúčinné – detailní rozbor přesahuje rozsah tohoto článku. Vakcinace včetně aplikace neživých vakcín není v průběhu terapie imunoglobuliny konsenzuálně doporučována. Významnou úlohu v prevenci infekčních onemocnění tvoří u této skupiny pacientů cílená vakcinace rodinných příslušníků a osob v blízkém kontaktu – viz dále.
Očkování pacientů s infekcí HIV (human immunodeficiency virus, virus lidské imunodeficience) se odvíjí od věku pacienta, stadia choroby a anamnézy očkování v minulosti. Není to statický proces, protože u mnoha pacientů po počáteční těžké imunodeficienci znemožňující vakcinaci dochází při antiretrovirové léčbě ke zlepšení imunitního stavu, a tím i k odpovědi na očkovací látky [11].
Dětští pacienti s HIV mají být očkováni všemi inaktivovanými vakcínami jako ostatní dětská populace, navíc je u nich doporučováno očkování proti chřipce a pneumokokovým infekcím. Obě posledně jmenované vakcíny patří do doporučení i pro dospělou populaci, kde navíc indikujeme vakcinaci proti žloutence typu B a proti pertusi. Nově se doporučuje i vakcinace proti lidskému papilomaviru u věkově indikované populace, preferenčně čtyřvalentní vakcínou. Složitější je situace u atenuovaných vakcín, jejichž aplikace se
odvíjí nejčastěji od anamnézy prodělaného onemocnění, počtu CD4 T lymfocytárních populací (více než 200/μl, respektive více než 15 %), věku a epidemiologické situace. Očkování MMR a očkování proti varicele je při naplnění těchto kritérií možné u dětské i dospělé populace. Rotavirovou vakcínu je možné podat HIV-pozitivním dětem bez omezení, ale BCG vakcinace a orální poliovakcína jsou u těchto pacientů kontraindikovány [12].
Vakcinace a hyposplenismus, asplenie
Pacienti s hyposplenismem/asplenií jsou trvale ohroženi závažně probíhajícími infekcemi způsobenými především opouzdřenými mikroby (Streptococcus pneumoniae, Haemophilus influenzae, Neisseria meningitidis), proto je očkování proti těmto patogenům prioritou. Obecně lze říci, že hyposplenickým/asplenickým pacientům může být bez zvláštního rizika aplikována jakákoli (i živá) vakcína. Polysacharidové vakcíny ale vyvolávají u asplenických osob nižší tvorbu protilátek než u zdravých jedinců, zatímco proteinové nebo konjugované vakcíny si zachovávají dobrou imunogenicitu.
Pokud je u pacienta plánována splenektomie nebo zahájení léčby, která povede k hyposplenismu, je optimální provést doporučená očkování před těmito zákroky. U osob podstupujících plánovanou imunosupresivní léčbu (chemote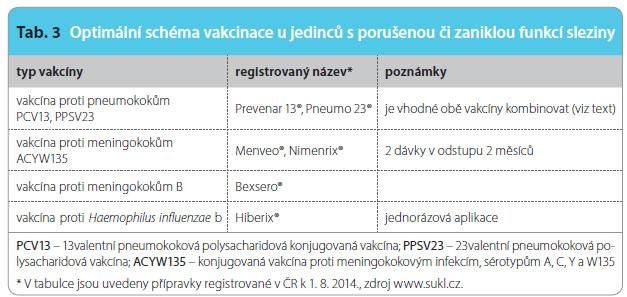 rapie, celotělová radioterapie) se doporučuje aplikovat všechny vakcíny alespoň 14 dnů před zahájením imunosupresivní léčby, nebo až za 3 měsíce od jejich ukončení. V případě elektivní splenektomie je žádoucí aplikovat základní vakcíny (proti pneumokokům, Haemophilus influenzae b a proti meningokokům) alespoň 14 dnů před operací. Postoperační vakcinace je již mnohem méně účinná. Nejvhodnější vakcíny podle současných doporučení uvádí tab. 3.
rapie, celotělová radioterapie) se doporučuje aplikovat všechny vakcíny alespoň 14 dnů před zahájením imunosupresivní léčby, nebo až za 3 měsíce od jejich ukončení. V případě elektivní splenektomie je žádoucí aplikovat základní vakcíny (proti pneumokokům, Haemophilus influenzae b a proti meningokokům) alespoň 14 dnů před operací. Postoperační vakcinace je již mnohem méně účinná. Nejvhodnější vakcíny podle současných doporučení uvádí tab. 3.
Podle stávajících doporučení zahrnuje očkování proti pneumokokovým infekcím u dospělých hyposplenických/asplenických pacientů jednu dávku konjugované pneumokokové vakcíny PCV13 a následně v odstupu minimálně 8 týdnů jednorázovou aplikaci polysacharidové pneumokokové vakcíny PPSV23 k rozšíření spektra pokrytých sérotypů. V odstupu minimálně 5 let od podání první dávky polysacharidové vakcíny se doporučuje jednorázové přeočkování. Pro pacienty, kteří již byli v minulosti očkováni polysacharidovou pneumokokovou vakcínou, je doporučena dodatečná aplikace PCV13 při dodržení odstupu minimálně 12 měsíců od podání polysacharidové vakcíny.
K očkování proti meningokokovým infekcím se doporučuje konjugovaná tetravalentní vakcína, která poskytuje ochranu proti sérotypům A, C, Y, W135. Aplikují se dvě dávky vakcíny v odstupu 2 měsíců. Přeočkování za 5 let se provádí, jestliže hrozí vysoké riziko infekce (např. cestovatelé do zemí s vysokým výskytem invazivních meningokokových onemocnění nebo osoby ve věku 5–25 let). Žádoucí je i doplnění ochrany proti sérotypu B nyní již dostupnou vakcínou. Očkování proti invazivním hemofilovým infekcím se provádí jednorázově jednou dávkou konjugované Hib vakcíny bez nutnosti přeočkování.
Dalším doporučeným očkováním je vakcinace proti chřipce. Vakcína se aplikuje každoročně v podzimním období (v předstihu před začátkem chřipkové epidemie). Pro vakcinaci hyposplenických/asplenických osob jsou vzhledem k vyšší imunogenicitě vhodnější štěpené vakcíny než vakcíny subjednotkové. Aspleničtí pacienti mají být dispenzarizováni infektologem, který zajistí provedení doporučených očkování. S infektologem by také měli konzultovat eventuální cestu do zemí s výskytem malárie nebo břišního tyfu, protože tato onemocnění pro ně představují zvýšené riziko. Celý doporučený postup vznikl v roce 2013 z iniciativy Společnosti infekčního lékařství ve spolupráci s Českou vakcinologickou společností ČLS JEP [13].
Vakcinace a diabetes mellitus
Diabetiků rychle přibývá, jde přitom o osoby obvykle polymorbidní s kumulací zdravotních rizik, opakovaně pobývající ve zdravotnických zařízeních. Infekční onemocnění se u nich vyskytují častěji než v běžné populaci, zejména infekce močových cest, infekce parodontu a kožní či ranné infekce. Akutní infekt s sebou obvykle nese zhoršení kompenzace diabetu (zvýšení a rozkolísání glykemií).
Diabetici mají být každoročně očkováni proti chřipce. Vhodné je také očkování proti invazivním pneumokokovým infektům: diabetici mladší 60 let mají být očkováni vakcínou PPSV23 s jednorázovým přeočkováním po pěti letech. Pro diabetiky starší 60 let je doporučována vakcinace PCV13 jednorázově [14]. Dále se doporučuje očkovat všechny diabetiky mladší 60 let proti virové hepatitidě B. Mají totiž vyšší riziko infekce virem hepatitidy B a průběh této infekce je nepříznivější (častější přechod do chronicity, rozvoj cirhózy, hepatomu, vyšší letalita). Odpověď diabetiků na očkování se snižuje s věkem a progredujícím diabetem, proto je vhodné očkovat proti virové hepatitidě B co nejdříve po zjištění diabetu: dosud neočkovaným pacientům ve věku 19–59 let se aplikují 3 dávky vakcíny co nejdříve po stanovení diagnózy diabetu. Pacientům ve věku nad 60 let lze dle individuál-
ního zvážení také podat 3 dávky vakcíny [15].
Vakcinace pacientů s idiopatickými střevními záněty
Pacienti s idiopatickými střevními záněty (inflammatory bowel disease, IBD) jsou zastoupeni v dětské i dospělé populaci. Rozšíření léčebných modalit u pacientů s touto skupinou chorob vedlo k aktualizaci vakcinačních přístupů. Hlavním důvodem je vyšší riziko závažných infekcí u pacientů s biologickou léčbou a u pacientů léčených kortikoidy. Současně již mnohé odborné práce vyvracejí úvahy o negativním dopadu vakcinace na průběh, respektive relaps základního onemocnění. Méně prokázán je klinický dopad vakcinace – vychází se spíše z obecných principů přínosu očkování stejně jako u ostatní populace ohrožené zvýšeným výskytem infekčních komplikací. Z tohoto pohledu je doporučováno očkování inaktivovanými vakcínami podle platných očkovacích kalendářů s rozšířením vakcinace proti chřipce a pneumokokovým infekcím (primovakcinace PCV13 s následným přeočkováním PPSV23). Součástí prevence je případná vakcinace proti varicele u dětských i dospělých osob s negativní anamnézou varicely a dále vakcinace proti pásovému oparu u osob starších 50 let. V obou případech musí být očkování dokončeno minimálně 4 týdny před zahájením imunosupresivní terapie [16]. V doporučeních se objevuje i očkování proti pertusi u starších osob léčených blokátory TNF [17]. Orální poliovakcína se nepoužívá.
Vakcinace a revmatologická onemocnění
Pacienti s chronickým zánětlivým onemocněním pojiva mají zvýšené riziko infekce jak imunosupresivním vlivem základního revmatologického onemocnění, tak imunosupresivním účinkem léčby, zejména biologické. Z těchto důvodů je očkování vhodnou prevencí, i když účinnost může být nižší než v běžné populaci.
V rámci úvodního hodnocení pacienta by měl být ověřen stav jeho vakcinace. Očkování neživými vakcínami je možné i v průběhu léčby chorobu modifikujícími antirevmatickými léky, kortikoidy a/nebo blokátory TNFα. Kvůli lepší účinnosti je vhodné očkovat ještě před zahájením imunosupresivní léčby, zejména snižuje-li tato léčba počet B lymfocytů (rituximab). Je-li indikováno podání živých vakcín (varicela, herpes zoster), má být provedeno před zahájením imunosupresivní léčby, případně v průběhu nízkodávkované udržovací supresivní terapie [18]. Revmatologickým pacientům se doporučuje očkování proti chřipce a proti pneumokokovým infekcím (kombinace konjugované a polysacharidové vakcíny). Nemocným, kteří byli léčeni rituximabem v uplynulých 24 týdnech, má být v případě rizikového poranění podána pasivní imunizace tetanickým globulinem [19]. Očkování proti virové hepatitidě A a B je doporučováno jen pro pacienty ohrožené rizikem infekce hepatitidou. Riziko infekce některým typem lidského papilomaviru (human papilloma virus, HPV), zvláště vysoce rizikovými onkogenními subtypy, je u revmatologických pacientů vyšší, proto je vhodné zvážit vakcinaci proti HPV [20].
Vakcinace a jiná interní onemocnění
Pacienti s jinými interními onemocněními (ledvin, srdce, plic) tvoří velmi heterogenní skupinu vyžadující často odlišný přístup k vakcinaci, přesto lze najít některé společné rysy. Pokud je onemocnění ve stabilizovaném stavu a není podávána imunosupresivní léčba, mohou být aplikovány všechny vakcíny bez omezení, s důrazem na vhodnou doplňkovou vakcinaci proti chřipce, pneumokokovým infekcím a pertusi, dále proti varicele u vnímavých osob a proti pásovému oparu u starších osob. Po atace nefrotického syndromu nebo po dekompenzaci bronchiálního astmatu se sestupnou kortikoterapií je třeba dodržovat obecně platné intervaly pro odstupy v podání živých vakcín (viz výše) a je možné eventuálně pozdržet aplikaci neživých vakcín – s předpokladem lepší účinnosti po odeznění imunosupresivního účinku kortikoidní léčby. Specifické jsou vakcinace proti chřipce, pneumokokovým infekcím a pertusi, které jsou doporučovány i při udržovací léčbě, aby se zabránilo komplikovaným průběhům respiračních onemocnění. Pacienti s progredující renální insuficiencí jsou indikováni k včasné vakcinaci proti hepatitidě B – před progresí do hemodialyzačního stadia choroby, kdy je již imunitní odpověď nedostatečná a vyžaduje podání většího množství a počtu dávek, respektive využití adjuvované vakcíny [21].
Vakcinace a onkologická onemocnění
Pacienti s nádorovým onemocněním jsou ve zvýšené míře ohroženi infekčními komplikacemi. Dispozice je dána imunosupresivním vlivem základního onemocnění (zvláště u lymfomů a hemoblastóz) a imunosupresivními účinky podávané léčby (chemoterapie, radioterapie, léčba monoklonálními protilátkami). Odpověď na očkování je v průběhu onkologické léčby snížená, proto je vhodné (pokud lze) podat indikované neživé vakcíny alespoň 2 týdny před zahájením léčby. Podání neživých vakcín je bezpečné i v průběhu léčby, ale pak je nutno počítat se suboptimální odpovědí na vakcinaci. Ta může přetrvávat, v závislosti na míře imunosuprese, ještě 6–12 měsíců po ukončení léčby. Živé vakcíny jsou u onkohematologických pacientů kontraindikované. Jejich podání je bezpečné nejpozději 4 týdny před zahájením imunosupresivní léčby, nebo nejdříve za 3 měsíce po jejím ukončení. Je-li pacient léčen anti-B-buněčnými protilátkami, smí být očkován živou vakcínou nejdříve za 6 měsíců po ukončení léčby.
Jednoznačně indikované je pro onkologické pacienty očkování proti chřipce. Riziko onemocnění chřipkou i riziko vzniku komplikací chřipky je u nich zvýšené, chřipka může vést k přerušení terapie, čímž zhoršuje prognózu pacienta. Optimální je podat vakcínu před zahájením léčby nebo během pauzy v terapii, ale v případě potřeby se očkuje kdykoli – s podmínkou, že vakcína by neměla být podána v den chemoterapie. Dle doporučení IDSA (Infectious Diseases Society of America) nemá být chřipková vakcína podávána pacientům léčeným anti-B-buněčnými protilátkami a intenzivní chemoterapií (indukční a konsolidační léčba akutní leukemie). Nezbytné je očkování proti chřipce pro osoby v okolí pacienta s nádorovým onemocněním, zvláště pro členy rodiny a zdravotnický personál [22].
Dalším doporučovaným očkováním je vakcinace proti pneumokokům, protože invazivní pneumokoková onemocnění znamenají pro onkologické pacienty vážnou hrozbu. Očkování zahrnuje podání konjugované pneumokokové vakcíny PCV13 a následně s odstupem minimálně 8 týdnů se aplikuje polysacharidová vakcína PPSV23. Ke zvážení je ještě podání konjugované vakcíny proti Haemophilus influenzae b, i když riziko invazivní hemofilové infekce u onkologického pacienta je nižší než riziko pneumokokové infekce.
Varicela představuje pro onkologické pacienty nebezpečné onemocnění, které u nich může končit i fatálně. Očkování je vhodnou prevencí za předpokladu, že je vakcína podána nejméně 4 týdny před zahájením imunosupresivní léčby. Vakcínu proti varicele lze bezpečně podat i některým pacientům, jimž je podávána dlouhodobá nízkodávkovaná imunosupresivní terapie (např. udržovací léčba leukemie), s tím, že riziko onemocnění divokým virem je výrazně vyšší než potenciální riziko vzniku komplikací po očkování varicelovou vakcínou. Vysoce suprimovaní pacienti nemohou být živou varicelovou vakcínou očkováni; v tomto případě by vakcína měla být podána vnímavým osobám v okolí pacienta [23].
Vakcinace a transplantace solidních orgánů
Pacienti po transplantaci solidních orgánů (solid organ transplant, SOT) jsou ohroženi vysokým rizikem vzniku těžkých infekčních komplikací z důvodu preexistujícího onemocnění (např. renální selhání, postižení plic atd.) a působením imunosupresivní medikace podávané k zamezení rejekce štěpu. Měli by proto být pokud možno očkováni ještě před transplantací, nejlépe už v časné fázi základního onemocnění, kdy jejich odpověď na očkování není dosud snížená. Neživé vakcíny jsou obecně bezpečné i v období po SOT a nejsou doklady o tom, že by jejich podání zvyšovalo riziko rejekce štěpu [24]. Živé vakcíny se pacientům po SOT nepodávají a v případě potřeby mají být aplikovány ještě před plánovanou SOT.
Doporučuje se už před zařazením do transplantačního programu zhodnotit stav očkování pacienta a případně doplnit chybějící vakcinaci tak, aby byl dotyčný jedinec vzhledem ke svému věku správně očkován dle očkovacího kalendáře. Kandidát SOT má být také očkován konjugovanou pneumokokovou vakcínou PCV13 s následným podáním polysacharidové pneumokokové vakcíny PPSV23 nejdříve za 8 týdnů po vakcinaci PCV13. Dalším doporučeným očkováním je vakcinace proti virové hepatitidě B, přičemž pro pacienty v dialyzačním programu se používá vakcína s dvojnásobným obsahem antigenu nebo adjuvovaná vakcína. Doporučeno je i očkování proti hepatitidě A, zejména pro kandidáty transplantace jater. Séronegativním pacientům má být aplikována vakcína proti varicele a pacienti starší 50 let mají být očkováni proti herpes zoster (nejsou-li imunosuprimovaní). Podmínkou podání živých vakcín je načasování nejpozději 4 týdny před vlastní transplantací. Živí dárci orgánů mají být očkováni adekvátně dle očkovacího kalendáře, nejsou doporučována žádná očkování navíc [25]. V období intenzivní imunosuprese po transplantaci, obvykle 2–6 měsíců, se příjemci neočkují. Po uplynutí tohoto intervalu se pokračuje ve standardní vakcinaci dle kalendáře. Odpověď na neživé vakcíny podané po transplantaci je snížená, obvykle méně pro booster dávku než pro primovakcinaci. Pokud nebyl příjemce očkován před transplantací, doplní se v tomto období vakcinace proti pneumokoku a proti virové hepatitidě B. Vakcína proti chřipce může být v případě epidemie podána už jeden měsíc po SOT a dále se aplikuje každoročně. Živé vakcíny jsou pro pacienty po SOT kontraindikované, ale osobám v jejich okolí je lze bezpečně podat. Nejbližší kontaktní osoby pacienta po SOT mají být očkované proti chřipce a hepatitidě B, séronegativní kontaktní osoby mají být očkované proti varicele a MMR [26].
Vakcinace a transplantace krvetvorných buněk
Pacienti po transplantaci kostní dřeně (TKD) nebo periferních kmenových buněk by měli být po transplantaci revakcinováni, protože jejich imunitní ochrana je dlouhodobě snížená [27]. Očkování v České republice řídí příslušná očkovací centra při fakultních nemocnicích. Zahajuje se nejčastěji za 6 měsíců po transplantaci podáním inaktivovaných vakcín (pneumokoková vakcína, HiB, dTap, polio ve třídávkových schématech), každoročně se očkuje proti chřipce. Živé vakcíny se mohou podat při nepřítomnosti reakce štěpu proti hostiteli (graft versus host disease – GVHD), bez přítomnosti imunosupresivní léčby a nejdříve za 24 měsíců po proběhlé transplantaci. Orální poliovakcína se nepoužívá. V doporučeních se objevuje vakcinace dárců, respektive samotných pacientů před zahájením léčebných schémat, ale z praktických důvodů tento přístup není příliš využíván. Literárně diskutované odlišnosti v přístupu k alogenním a autologním transplantacím, respektive odlišnosti v přístupu k vakcinaci pacientů po transplantaci kostní dřeně nebo periferních kmenových buněk, přesahují rámec tohoto sdělení.
Problematika očkování blízkých osob imunokompromitovaného pacienta
Imunokompetentní osoby (dospělí i děti) žijící ve společné domácnosti s imunokompromitovaným pacientem a ostatní jedinci v blízkém kontaktu s imunodeficitním pacientem mohou být očkováni všemi neživými vakcínami podle platného očkovacího kalendáře, včetně podání tzv. cestovatelských vakcín. Důraz je kladen na každoroční očkování těchto osob proti chřipce, které zesiluje ochranu imunokopromitovaného pacienta před tímto onemocněním. Nebezpečné nejsou ani živé vakcíny; po očkování MMR se vakcinální viry na kontakty nepřenášejí a je žádoucí, aby blízké osoby byly chráněny touto vakcinací, pokud onemocnění v minulosti neprodělaly. Dokumentovaný přenos vakcinálního viru varicella zoster je velmi vzácný. Pouze v případě, kdy se po očkování proti varicele, respektive pásovému oparu, objeví kožní výsev, je vhodná izolace od vnímavých kontaktů do vymizení exantému [28]. Omezeno není ani použití atenuované vakcíny proti žluté zimnici, případně atenuované vakcíny proti břišnímu tyfu (v ČR není k dispozici). Rotavirové vakcíny jsou pro děti žijící ve společné domácnosti s touto skupinou pacientů doporučovány – pro těžce imunokompromitované pacienty ale platí upozornění vyhnout se manipulaci s plenami dítěte po dobu 4 týdnů po vakcinaci [29].
Vakcinace a cestovatelé s oslabenou imunitou
Při doporučení vhodného očkování před cestou je nutno vzít v úvahu několik aspektů: nakolik je základní onemocnění stabilizované; zda základní onemocnění nebo jeho léčba nemůže nepříznivě ovlivnit plánované očkování (snížení účinnosti) či zda nepředstavuje kontraindikaci tohoto očkování. Totéž platí i opačně, tj. zda plánované očkování nemůže destabilizovat základní onemocnění pacienta. Dále je třeba uvážit možné interakce pacientovy chronické léčby s antimalariky apod. a zhodnotit případná specifická rizika pro konkrétní destinaci.
Obecně platí, že neživé vakcíny se zpravidla mohou bezpečně podávat i imunosuprimovaným cestovatelům dle obvyklých doporučení. V cestovní medicíně se to týká např. vakcín proti virové hepatitidě A, polysacharidové vakcíny proti břišnímu tyfu, vakcíny proti japonské encefalitidě či vzteklině. Naproti tomu živé vakcíny jsou u imunokompromitovaných pacientů kontraindikované; obvykle se to týká BCG vakcíny, živé chřipkové vakcíny a živé vakcíny proti břišnímu tyfu. Imunosuprimovaní pacienti nemohou být očkováni živou (perorální) vakcínou proti poliomyelitidě a mají se vyvarovat rizika přenosu vakcinálního viru v těch částech světa, kde se živá poliovakcína dosud užívá. Vakcína proti žluté zimnici nemá být imunokompromitovaným pacientům aplikována a tito pacienti by neměli navštěvovat oblasti, kde se onemocnění endemicky vyskytuje. Vakcínu proti žluté zimnici lze podat jen v nevyhnutelných případech, po individuálním zhodnocení možných přínosů a rizik. Pokud cestu nelze odložit, je možné zvážit podání vakcíny proti žluté zimnici u asymptomatických pacientů infikovaných HIV, jejichž počet CD4 T lymfocytů je vyšší než 200/μl [23].
Pacienti s onemocněním či léčbou, která působí jen minimální imunodeficit, mohou být očkováni dle doporučení pro běžné cestovatele. Patří sem např. pacienti s nízkodávkovanou kortikoterapií, onkologičtí pacienti v remisi s odstupem od poslední chemoterapie více než 3 měsíce, pacienti po TKD s odstupem více než 2 roky po transplantaci, bez imunosupresivní léčby a bez projevů GVHD, pacienti s autoimunitními chorobami (systémovým lupus erythematodes, idiopatickými střevními záněty, revmatoidní artritidou), kteří nejsou léčeni imunosupresivní (imunomodulační) léčbou.
Za těžce imunokompromitované cestovale jsou považováni nemocní s aktivní leukemií či lymfomem, generalizovaným maligním onemocněním, aplastickou anémií, GVHD nebo s vrozeným imunodeficitem. Dále se sem řadí pacienti po recentní radioterapii, transplantaci solidních orgánů nebo kostní dřeně a pacienti s imunosupresivní léčbou po transplantaci. Po TKD jsou pacienti přeočkováváni podle příslušného schématu (viz výše) a trvá minimálně 24 měsíců, než se jejich imunokompetence obnoví do té míry, že mohou dostat živé vakcíny (MMR, varicela). Po transplantaci solidních orgánů hrozí nejvyšší riziko infekce v prvním roce po výkonu, a cestování do vysoce rizikových destinací by v tomto období mělo být odloženo. Mezi vysoce imunosuprimované pacienty se dále řadí pacienti léčení vysokodávkovanými kortikoidy, alkylačními látkami (např. cyklofosfamid), antimetabolity (např. azathioprin, 6-merkaptopurin), imunosupresivy užívanými po transplantaci (cyklosporin, takrolimus, sirolimus, mykofenolát mofetil, mitoxantron), protinádorovou chemoterapií, blokátory TNFα (etanercept, adalimumab, certolizumab pegol, golimumab, infliximab) a dalšími biologickými imunomodulátory a monoklonálními protilátkami. Očkování živými vakcínami je při této léčbě kontraindikováno. Podání neživých vakcín není pro pacienta nebezpečné, ale vede obvykle ke snížené odpovědi.
Cestovatele s roztroušenou sklerózou (RS), kteří nedostávají imunomodulační léčbu a nemají exacerbaci RS, mohou být očkováni dle běžných doporučení. Dojde-li k relapsu, lze začít očkovat neživými vakcínami až po stabilizaci stavu, tj. nejdříve za 4–6 týdnů. Při imunosupresivní léčbě je podání neživých vakcín bezpečné (byť s nižší účinností), podání živých vakcín je kontraindikováno. Podání vakcíny proti žluté zimnici nebylo u pacientů s RS studováno. Proti žluté zimnici je pacienty s RS možno očkovat jen v nevyhnutelných případech, po individuálním zhodnocení možných přínosů a rizik.
Cestovatelé s infekcí HIV s počtem CD4 T lymfocytů vyšším než 500/μl mohou být očkováni dle standardních doporučení. Pacienti s těžkým imunodeficitem (CD4 T lymfocyty < 200/μl) nesmějí být očkováni živými vakcínami. Nově diagnostikovaní pacienti s HIV, jejichž počet CD4 T lymfocytů je menší než 200/μl, by měli odložit cestování až do úpravy počtu CD4 po zahájení antiretrovirové léčby [30].
Závěr
Vakcinace osob s oslabenou imunitou nabývá na stále větším významu. Rozšiřující se modality léčby autoimunitních chorob, narůstající počet osob infikovaných HIV a stárnutí populace s rozšiřujícím se spektrem interních a onkologických chorob vyžadují správně indikovanou vakcinaci k prevenci infekčních onemocnění. Současně je vždy třeba brát v úvahu aktuální imunitní stav jedince a omezení ve využití některých typů očkovacích látek. Nezbytné je pokračovat ve výzkumu zaměřeném na reálnou účinnost používaných vakcín u těchto specifických popula
Seznam použité literatury
- [1] Olin P, Hallander HO, Gustafsson L, et al. How to make sense of pertussis immunogenicity data. Clin Infect Dis 2001; 33 (Suppl 4): S288–291.
- [2] Stratton K, Ford A, Rusch E, et al. Institute of Medicine. Adverse Effects of Vaccines: Evidence and Causality. Washington, DC: The National Academies Press, 2012.
- [3] Baumhackl U, Franta C, Retzl J, et al. A controlled trial of tick-borne encephalitis vaccination in patients with multiple sclerosis. Vaccine 2003; 21 (Suppl 1): S56–61.
- [4] Shinoki T, Hara R, Kaneko U, et al. Safety and response to influenza vaccine in patients with systemic-onset juvenile idiopathic arthritis receiving tocilizumab. Mod Rheumatol 2012; 22: 871–876.
- [5] Centers for Disease Control and Prevention. General Recommendations on Immunization – Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR 2006; 55 (No. RR15): [1–56].
- [6] Rosman Z, Shoenfeld Y, Zandman-Goddard G. Biologic therapy for autoimmune diseases: an update. BMC Medicine 2013; 11: 88. Dostupné na: www.biomedcentral.com/1741-7015/11/88 Navštíveno 28. 8. 2014.
- [7] Centers for Disease Control and Prevention. Prevention of Herpes Zoster – Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR 2008; 57 (No. RR5): [1–23].
- [8] Vaccination des personnes avec maladies rhumatismales auto-immunes inflammatoires: résumé des principes et recommandations. Office fédéral de la santé publique (OFSP) et Commission fédérale pour les vaccinations (CFV). État février 2014. Dostupné na: http://www.infovac.ch/index.php?option=com_content&view=article&id=714&Itemid=539 Navštíveno 30. 8. 2014.
- [9] van Assen S, Holvast A, Telgt DS, et al. Patients with humoral primary immunodeficiency do not develop protective anti-influenza antibody titers after vaccination with trivalent subunit influenza vaccine. Clin Immunol 2010; 136: 228–235.
- [10] Shrimpton A, Duddridge M, Ziegler-Heitbrock L. Vaccination with polysaccharide-conjugate-vaccines in adult patients with specific antibody deficiency. Vaccine 2006; 24: 3574–3580.
- [11] Sutcliffe CG, Moss WJ. Do children infected with HIV receiving HAART need to be revaccinated? Lancet Infect Dis 2010; 10: 630–642.
- [12] American Academy of Pediatrics. Active and Passive Immunization Immunization in Special Clinical Circumstances. Children With Chronic Diseases. Dostupné na: http://aapredbook.aappublications.org/content/1/SEC8/SEC56/SEC61.extract Navštíveno 28. 8. 2014
- [13] Polák P, Kosina P, Blechová Z, et al. Doporučený postup péče o pacienty s porušenou či zaniklou funkcí sleziny (hyposplenismem/asplenií). Dostupné na: http://www.vakcinace.eu/doporuceni-a-stanoviska Navštíveno 28. 8. 2014.
- [14] American Diabetes Association: Influenza and pneumococcal immunisation in diabetes. Diabetes Care 2004; 27: suppl. 1.
- [15] Centers for Disease Control and Prevention. Use of Hepatitis B Vaccination for Adults with Diabetes Mellitus: Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR 2011; 60: 1709–1711.
- [16] Lu Y, Bousvaros A. Varicella vaccination in children with inflammatory bowel disease receiving immunosuppressive therapy. J Pediatr Gastroenterol Nutr 2010; 50: 562–565.
- [17] Dezfoli S, Horton H, Brer D, et al. Immunomodulators, but not anti-TNF monotherapy, impair pertussis and tetanus booster vaccine responses in adults with inflammatory bowel disease (IBD) Presented at Digestive Disease Week; May 19–22, 2012; San Diego, California. Abstract Su2081.
- [18] Vencovský J., a výbor České revmatologické společnosti: Bezpečnost biologické léčby – doporučení České revmatologické společnosti. Čes Revmatol 2009; 17: 146–160.
- [19] van Assen S, Agmon-Levin N, Elkayam O, et al. EULAR recommendations for vaccination in adult patients with autoimmune inflammatory rheumatic diseases. Ann Rheum Dis 2011; 70: 414–422.
- [20] Bombardier C, Hazlewood GS, Akhavan P, et al. Canadian Rheumatology Association recommendations for the pharmacological management of rheumatoid arthritis with traditional and biologic disease-modifying antirheumatic drugs: part II safety. J Rheumatol 2012; 39: 1583–1602.
- [21] Eleftheriadis T, Antoniadi G, Liakopoulos V, et al. Disturbances of acquired immunity in hemodialysis patients. Semin Dial 2007; 20: 440–451.
- [22] Centers for Disease Control and Prevention. Prevention and Control of Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices (ACIP). 2010. MMWR 2010; 59: 1–62.
- [23] Rubin LG, Levin MJ, Ljungman P, et al. 2013 IDSA Clinical Practice Guideline for Vaccination of the Immunocompromised Host. Clin Infect Dis 2014; 58: e44–100.
- [24] White-Williams C, Brown R, Kirklin J, et al. Improving clinical practice: should we give influenza vaccinations to heart transplant patients? J Heart Lung Transplant 2006; 25: 320–323.
- [25] Recommandations de vaccination avant et apres transplantation d´organe solide. Office fédéral de la santé publique (OFSP) et Commission fédérale pour les vaccinations (CFV). État février 2014. Dostupné z: www.infovac.ch Navštíveno 30. 8. 2014.
- [26] Danziger-Isakov L, Kumar D, et al. Guidelines for vaccination of solid organ transplant candidates and recipients. Am J Transplant 2009; 9 (Suppl 4): S258–S262.
- [27] Parkman R, Weinberg KI. Immunological reconstitution following bone marrow transplantation. Immunol Rev 1997; 157: 73–78.
- [28] Sharrar RG, LaRussa P, Galea SA, et al. The postmarketing safety profile of varicella vaccine. Vaccine 2000; 19: 916–923.
- [29] Anderson EJ. Rotavirus vaccines: viral shedding and risk of transmission. Lancet Infect Dis 2008; 8: 642–649.
- [30] Kotton CN, Freedman DO. Immunocompromised Travelers. In: Advising Travelers With Specific Needs. Yellow Book. Centers for Disease Control and Prevention. Dostupné na: http://wwwnc.cdc.gov/travel/yellowbook/2014/chapter-8-advising-travelers-with-specific-needs/immunocompromised-travelers Navštíveno 30. 8. 2014.