Význam dlouhodobé léčby schizofrenie
Článek se zabývá významem dlouhodobé antipsychotické léčby, poukazuje na faktory noncompliance, zejména na otázku pacientova náhledu na onemocnění, subjektivní nežádoucí účinky, terapeutický vztah a potenciální možnosti ovlivnění těchto faktorů. V současnosti bohužel není k dispozici dostatek údajů o nejvhodnějším typu antipsychotika a dávce u specifických klinických stavů schizofrenních pacientů. Klinický rozhovor je stále nejpřesnějším nástrojem diagnostického procesu a léčby.
Úvod
Schizofrenie je závažné onemocnění postihující přibližně 1 % populace na celém světě. Její dopady zasahují do sféry nejen medicínské, ale i společenské a ekonomické. Tento článek je zaměřen na význam léčby schizofrenie s důrazem na dlouhodobou terapii tohoto chronického onemocnění.
Ataka a průběh schizofrenie
Průběh onemocnění může být chronický s postupně se zhoršujícím stavem bez zlepšení, ústícím do reziduální schizofrenie. Jinou variantou je epizodický průběh s obdobími plné nebo částečné remise a obdobími vzplanutí symptomů. Přechod mezi variantami je plynulý, z čehož vyplývají i rozličné individuální průběhové varianty.
Projevy schizofrenie můžeme rozdělit podle převahy přítomných symptomů na:
pozitivní – výskyt s bludy a halucinacemi, převážně paranoidní schizofrenie; tento typ lze relativně dobře léčit, někdy bývá dále dělena na projevy s hostilitou a bez ní;
negativní – v projevech zejména abulie, alogie, sociální stažení, často s výraznějším deficitem v oblasti sociální a kognitivní; v klasifikaci často v rámci simplexní a hebefrenní schizofrenie nebo nediferencované schizofrenie;
kognitivní – defekt zejména v oblasti kognitivních funkcí; stejně jako u negativních symptomů převážně chronický průběh bez plných remisí;
afektivní – přítomna dysforie, deprese, mánie, případně jiné poruchy afektivity; některými autory je již takové onemocnění označováno za schizoafektivní poruchu, o významu její klasifikace a výskytu jsou vedeny spory; postschizofrenní deprese; problémem je častější suicidialita a noncompliance, nepřesná diagnostika a z toho vyplývající problémy s vhodnou léčbou;
katatonní schizofrenie – je v současné době v rozvinutých zemích relativně řídká, přítomny jsou poruchy jednání ve smyslu omezení volních aktivit, motorických projevů, místy naopak s masivními rapty.
První projevy
Prvním projevům předchází premorbidní poškození zejména v kognitivní oblasti, ale lze pozorovat i sociální stažení. Tzv. měkké neurologické příznaky a afektivní změny jsou přítomny již v preadolescentním období. Změny jsou pozorovatelné při srovnání větších souborů, mají však individuální charakter. Z tohoto důvodu dosud selhávají pokusy o predikci vzniku a vývoje schizofrenního onemocnění. Negativní a kognitivní změny mají většinou nenápadný plíživý, postupný rozvoj, pozitivní symptomy začínají bouřlivěji a většinou i v relativně pozdějším věku – v 18–30 letech.
Cílem léčby prvních projevů je symptomatická remise a pokus o zlepšení následků ataky onemocnění. Tedy léčba rodinného systému, prevence stigmatizace pacienta i členů rodiny, zlepšení kognitivních funkcí a sociálních dovedností. Kromě antipsychotik zde hraje významnou roli léčba prostřednictvím psychorehabilitace, kognitivní trénink. Zároveň je první léčba důležitá pro spolupráci pacienta při dalším léčebném procesu. Snažíme se proto nalézt rychlejší a účinnější možnosti – z biologických terapií např. cílená rTMS (repetitivní transkraniální magnetická stimulace), urychlit nástup účinku antipsychotické medikace (rychle rozpustné a parenterální aplikační formy, změny titračních schémat). Zásadní význam má navázání spolupráce, terapeutického vztahu a minimalizace výskytu nežádoucích účinků léčby.
Důsledky schizofrenie
Pro úspěšnost a rychlost léčby již prvních epizod je důležitá délka trvání psychotických symptomů před stanovením diagnózy, resp. před zahájením léčby, tzv. DUP (duration of untreated psychosis). Čím déle DUP trvá, tím méně je léčba účinná a efekt nastupuje pomaleji, což souvisí zejména s výskytem negativních symptomů [16].
Již od první epizody dochází často k dalšímu kognitivnímu propadu, který se může dále prohlubovat. Při opakovaných hospitalizacích také pacient dále ztrácí sociální dovednosti a návyky. Zejména často relabující pacienti a pacienti s postupně se prohlubujícím defektem mohou v pozdních stadiích vyžadovat trvalé ústavní ošetřování, protože nejsou schopni dostát nárokům samostatného fungování ve společnosti. Naštěstí se nejedná o častý problém.
Jen menší část pacientů má partnerské-manželské vztahy, žije s rodinou, má zaměstnání a je v životě spokojena. Schizofrenie stigmatizuje již samotným názvem. Následkem je bohužel někdy snaha nejen pacientů, ale i lékařů diagnózu nesdělovat nebo používat diagnózy blízké (schizoafektivní, schizotypální nebo prostě symptomatická psychotická porucha). Důsledkem může být nesprávná léčba a zhoršení stavu pacientů a dalšího vývoje nemoci. Ještě horší může být záměna za osobnostní problematiku a nevhodná aplikace pouhé psychoterapie místo účinné léčby onemocnění. Stigmatizace postihuje i pečovatele pacientů – zejména rodinné příslušníky, ale i profesionální pracovníky v oblasti duševního zdraví.
Pacienti se schizofrenií jsou ohroženi častějším výskytem některých zdravotních komplikací. Diabetes mellitus se vyskytuje asi 2–4krát častěji spolu s následkem antipsychotické medikace jako součást metabolického syndromu (vyšší hladina triglyceridů, nižší HDL, přítomnost LDL cholesterolu, snížená střevní absorpce a vystupňovaná endogenní syntéza cholesterolu). Pacienti s jednou „chronickou diagnózou" bývají později diagnostikováni a léčeni méně intenzivně ve srovnání s běžnou populací.
Společnost je zatížena nejen léčbou pacientů (přímé náklady na léky, hospitalizace, domácí a komunitní péče), ale také ztrátou práceschopnosti pacientů – a to již i v časné dospělosti. Z dalších nepřímých nákladů vyniká zatížení rodinných příslušníků. V ČR jsou vzhledem k ceně hospitalizací méně rozvinuty systémy péče v prostředí pacientů (extramurální – stacionární, chráněné bydlení, vyšší podpora zaměstnanosti), které v původních zemích EU přinášejí finanční úspory a zlepšení stavu pacientů.
Noncompliance
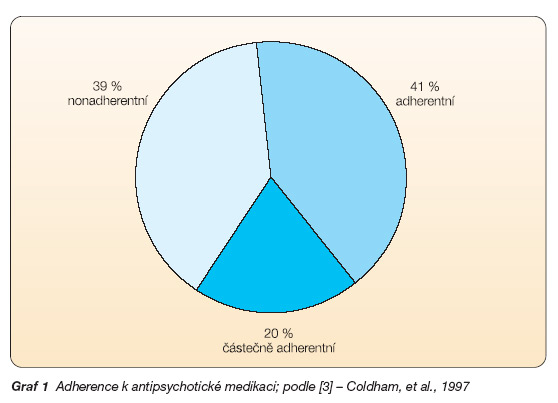
Dosažení spolupráce (compliance – dodržování doporučených léčebných postupů včetně dávek medikace) je klíčovým bodem dlouhodobé léčby schizofrenie. Po první epizodě bylo k medikaci adherentních 41 % pacientů, částečně adherentních 20 % a nonadherentních 39 % nemocných (graf 1) [3]. Odhadem je nespolupracujících 40–60 % pacientů. Tento počet se mění – po první hospitalizaci nespolupracuje zhruba polovina pacientů, v druhém roce již tři čtvrtiny pacientů [4]. Výsledek je závislý na řadě faktorů.
Horší výsledek vykazovali pacienti žijící osamoceně a bezdomovci, míra spolupráce vzrůstá s věkem. Jiné demografické údaje nemají podstatný vliv [10].
Míru compliance může ovlivňovat vlastní onemocnění. Často jsou popisovány poruchy vnímání – hlasy bránící pacientovi v užívání medikace. Stejně tak kognitivní postižení může snižovat schopnost pacienta pochopit potřebu medikace a přijmout fakt onemocnění. Nedostatek náhledu je někdy považován za základní příznak onemocnění. Důležitá je také výška skóre negativních symptomů a míra dezorganizace. Nicméně nedostatečný náhled je stále nejsilnějším prediktorem noncompliance v další léčbě [18]. V recentní studii [22] byl nedostatečný náhled zaznamenán u 63 % nonadherentních pacientů na rozdíl od 24 % adherentních, při propuštění se příliš nezměnil (41 % vs 13 %).
Ke zvýšení náhledu slouží mnoho typů edukačních programů. Nicméně jen některé byly hodnoceny jako úspěšné. Úspěšnější se zdají být ty programy, které směřují k přijetí onemocnění (někdy dokonce role) spíše než k podání prosté informace. Tedy „mám potíže – schizofrenii" spíše než „vím, jak potíže – schizofrenie – vypadají". Zásadní je také zapojení rodiny nebo pečovatelů do těchto programů. Samozřejmě má na další vývoj léčby neblahý vliv přetrvávání potíží, délka předchozí hospitalizace, první výskyt potíží [1]. Náhled také můžeme chápat jako obranný mechanismus, popření, které chrání proti zhoršení psychického stavu. Skutečně při zvýšení náhledu dochází k zhoršení nálady a snížení sebeúcty [11]. Depresivní symptomy také predikují nejen horší náhled, ale rovněž nižší compliance.
Nežádoucí účinky
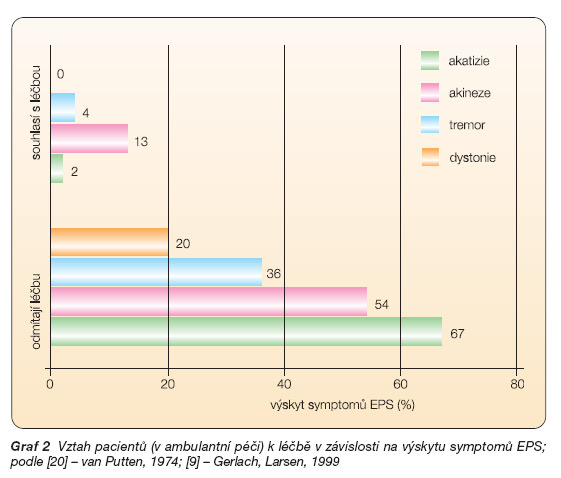
Při medikaci hrají významnou roli nežádoucí účinky, které pacient subjektivně nepříjemně vnímá. Jejich význam je odlišný podle intenzity, typu a zejména vlivu na subjektivní pohodu. Je třeba odlišit nejdůležitější – tedy některé typy extrapyramidových syndromů (EPS) – zejména akatizii, dále dysforii, sedaci, sexuální dysfunkce a nárůst hmotnosti [6]. Vyjma tardivních dyskinezí je jejich výskyt zaznamenán již v prvních hodinách až týdnech terapie, může být většinou okamžitě léčen snížením dávky nebo změnou farmaka. Je třeba si uvědomit, že první zkušenost pacienta s medikací je jedinečná a nevratně ovlivní další průběh léčby (graf 2).
EPS byly v hojně zmiňované studii hodnoceny u 94 % pacientů s dysforií, ale jen u 21 % pacientů nedysforických. Stejně tak samotná dysforie má vliv na odmítání medikace po ukončení hospitalizace. Dysforičtí pacienti oproti nedysforickým častěji ukončují léčbu předčasně (31 % vs 6 %) a častěji plánují nepokračovat v medikaci po dimisi (92 % vs 11 %) [9, 26]. O problematice dysforické reakce zevrubně pojednává i česká literatura [21].
Z dalších nežádoucích účinků v dlouhodobé léčbě mají zřejmě zásadní význam sexuální dysfunkce – a to při jakékoli delší léčbě. Problematika sedace a nárůstu hmotnosti pro další compliance nebyla dosud jednoznačně vyhodnocena z hlediska míry ovlivnění. Vliv je však jednoznačný, patrný z přímých referencí zejména pacientek.
Pacienti často o nežádoucích účincích spontánně nereferují. Nezbytné je aktivní vyhledávání nežádoucích účinků, edukace pacientů a následná kompenzace všech nežádoucích účinků dle současných možností.
V neposlední řadě se na compliance podílí kvalita terapeutického vztahu, resp. to, jak je terapeutický vztah subjektivně vnímán pacientem. 74 % pacientů, kteří vztah se svým terapeutem nehodnotili jako dostatečný, dále neplánovali spolupracovat, oproti 26 % pacientů, kteří vztah vnímali jako dobrý [7].
Z celkového počtu 21 studií sledujících účinnost jednotlivých programů zaměřených na zvýšení compliance jich vykázalo účinnost 15. Bylo použito postupů edukačních, behaviorálních, afektivních a kombinací. Jen multimodální (zahrnující více postupů a cílů) programy přinesly úspěch ve smyslu snížení počtu relapsů, rehospitalizací, snížení psychopatologie, zvýšení sociálních dovedností a zvýšení povědomí o medikaci [5].
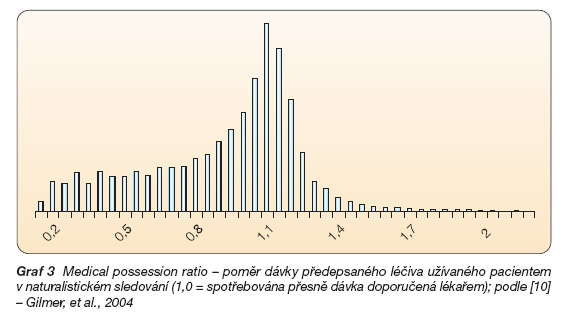
Množství skutečně spotřebované medikace se pohybuje okolo 50 % doporučených (předepsaných) dávek (extrémně až v rozmezí 11–80 %). Samozřejmě lze nalézt i pacienty užívající vyšší dávky než doporučené, ale těch je menšina (graf 3).
Rizika návratu – prevence relapsu
Schizofrenie je chronické onemocnění. Přibližně u 20 % pacientů dochází jen k ojedinělé atace, ostatní mají průběh chronický nebo epizodický. Délka trvání psychotických symptomů zhoršuje sociální funkce, snižuje možnost zaměstnání, zhoršuje vztahy a výsledek léčby. Počet epizod ústí do potřeby delších hospitalizací, zhoršení sociálních dovedností, kognitivních funkcí, vyšší spotřeby léků a zdravotní péče vůbec. Klíčem ke zlepšení stavu je tedy zábrana relapsu [12, 16].
Psychoedukační a rehabilitační aktivity jsou významné pro zlepšení aktuálního stavu, sociálních dovedností a kvality života. Dosud žádný psychoterapeutický program však nebyl dlouhodobě (více než 12 měsíců po skončení) účinný v zábraně relapsu. Jedinou účinnou zábranou relapsu je dlouhodobá antipsychotická medikace [19].
Noncompliance je nejmohutnějším prediktorem relapsu. Pravděpodobnost zhoršení stavu je již po první atace schizofrenie vysoká. V prospektivních neintervenčních sledováních se počet relabujících pacientů pohybuje většinou okolo 50 %. Ze skupiny psychopatologicky stabilních dlouhodobě léčených pacientů, kterým byla vysazena antipsychotická medikace, setrvávalo v remisi po 9 měsících 18 % pacientů, zatímco v kontrolní skupině, které byla antipsychotická medikace podávána kontinuálně, setrvalo v remisi po 9 měsících 88 % pacientů. Počet je závislý na míře compliance, subjektivně vnímaných nežádoucích účincích, náhledu, délce trvání nemoci (počet reagujících pacientů je větší u pacientů po 1. atace než u opakovaně relabujících), stabilitě stavu a dalších faktorech. Při optimální léčbě by zřejmě mohl dosáhnout jen 15 % [2, 4, 14].
Příčinou zhruba 50 % rehospitalizací je vysazení medikace pacienty, méně častěji pak neúčinnost a snížení léčebné dávky (32 %) nebo abúzus drog (10 %). Životní a zdravotní stres je méně významný (viz graf 4). Je otázkou, jaké množství pacientů léky skutečně užívá [27]. V pětileté studii byl počet relapsů u pacientů, kteří neužívali kontinuálně antipsychotickou medikaci, 4,89krát vyšší než u stabilně medikovaných [23].
Doporučení pro léčbu schizofrenie jsou odlišná, ale v některých zásadách se shodují. Dle doporučení je vhodné podávat antipsychotickou léčbu nejméně 12 měsíců pacientům po odeznění symptomů první ataky, nejméně 36 měsíců po plném odeznění další ataky. Po třech a více atakách nebo při neúplné remisi je pravděpodobnost zhoršení tak vysoká, že je vhodné podávat léky dlouhodobě (min. 5 let) nebo celoživotně. Cílem je minimalizace následků onemocnění. Klademe důraz na převahu přínosu léčby nad nežádoucími účinky, která u některých reziduálních stavů není samozřejmostí. Zdá se však, že vzhledem k počtu relapsů i u dlouhodobě stabilních pacientů po první atace nebo po dvou atakách je vhodné podávat antipsychotickou medikaci ještě mnohem déle. Noncompliance přímo souvisí s cenou za léčbu pacienta se schizofrenií [2, 14, 25].
Dalším z nezbytných postupů při zlepšování výsledků dlouhodobé léčby je tedy zvýšení compliance. Strategie vedoucí ke zvýšení compliance zahrnují ovlivnění nežádoucích účinků, náhledu, abúzu psychoaktivních látek a mnoho dalšího. Nelze zapomínat na spolupráci s rodinou nebo dalšími pečovateli a na vliv dobrého terapeutického vztahu.
Antipsychotika v dlouhodobé léčbě
Volba vhodného léku a vhodné dávky u konkrétního jedince ve specifickém prostředí a typu onemocnění je tématem pro samostatné obsáhlé pojednání. Lze popsat jen několik zásad. Vyšší účinnost antipsychotik druhé generace (atypických, nových – AP2, AAP) oproti první generaci (konvenční – CAP) v mnoha doménách účinnosti je patrná z mnoha srovnávacích studií. Problémem je používání nezcela srovnatelných dávek. Při použití nižších dávek (ekvivalenty haloperidolu) komparátoru dochází k významně nižším až žádným rozdílům oproti AP2. Přestože pacienti s „novými antipsychotiky" mají přece jen o něco nižší počet relapsů, při použití komparátoru < 12 mg haloperidolu by mohl být rozdíl klinicky nevýznamný. Rozdíly v účinnosti mezi AP2 tedy nebyly v klinické praxi jednoznačně potvrzeny [8, 15].
Je předpokládán rozdíl v nežádoucích účincích mezi jednotlivými antipsychotiky. Vyšší míra obsazenosti D2-receptorů je zatížena vyšším výskytem dysforické reakce (již od cca 70 %), hyperprolaktinémie (již od cca 72 %) a extrapyramidového syndromu (již od 78 %). Zároveň minimální účinná blokáda receptorů D2 je zřejmě 65% [13].
Strategie optimální obsazenosti receptorů D2 zahrnují: přechodnou blokádu receptorů D2 (clozapin, quetiapin), kompenzaci jinými systémy, např. serotoninergní modulací ( antagonisté 5-HT2- a současně D2-receptorů, multireceptoroví antagonisté), ovlivnění synaptického přenosu dalšími receptory (antagonisté D2- a současně D3-receptorů), přesnou blokádu (titrace dávky, slabší vazba na receptor), parciální antagonismus (aripiprazol) a další. Nežádoucími účinky ve smyslu metabolického syndromu jsou naopak zatíženi zejména multireceptoroví antagonisté (často je zmiňován olanzapin), hyperprolaktinémií antagonisté D2 a D3 (nižší prostup amisulpridu přes hematoencefalickou bariéru), sedací látky s výraznějším antihistaminovým působením (chlorpromazin, quetiapin). Přes velký pokrok v oblasti zobrazovacích vyšetření je stále nejcitlivějším nástrojem výběru vhodného antipsychotika teoretická a klinická zkušenost psychiatra, výběr dávky léku na základě detailního pohovoru s důrazem na neverbální komunikaci.
Závěr
Lze shrnout několik zásadních faktů. Výběr antipsychotika a dávky pro konkrétního pacienta je zásadní hned na počátku onemocnění. Zkušenost s lékem ovlivní další vztah k léčbě. Cílem dlouhodobé léčby je zábrana relapsu. K tomuto cíli vede zvýšení compliance prostřednictvím minimalizace nežádoucích účinků, zvýšení náhledu a širší zapojení pacienta a jeho okolí do léčebného procesu prostřednictvím psychoedukačních a rehabilitačních programů. Tak lze zlepšit kvalitu života a výsledek dlouhodobé léčby pacientů se schizofrenií.
Seznam použité literatury
- [1] Boyer CA, McAlpine DD, Pottick KJ, Olfson M. Identifying risk factors and key strategies in linkage to outpatient psychiatric care. Am J Psychiatry 2000; 157: 1592–1598.
- [2] Boosveld-van Handel LJM, Slooff CJ, vand den Bosch RJ. Reasoning about the optimal duration of prophylactic antipsychotic medication in schizophrenia: evidence and arguments. Acta Psychiatr Scand 2001; 103: 335–346.
- [3] Coldham EL, Addington J, Addington D, et al. Insight, neurocognitive function and symptom clusters in chronic schizophrenia. Schizophr Res 1997; 27: 37–44.
- [4] Corrigan PW, Liberman RP, Engel JD. From non-compliance to collaboration in the treatment of schizophrenia. Hosp Community Psychiatry 1990; 41: 1203–1211.
- [5] Dolder CR, Lacro JP, Leckband S, Jeste DV. Interventions to improve antipsychotic medication adherence: review of recent literature. J Clin Psychopharmacol 2003; 23: 389–399.
- [6] Fleischhacker WW, Meise U, Gunther V, Kurz M. Compliance with antipsychotic drug treatment: influence of side effects. Acta Psychiatr Scand Suppl 1994; 382: 11.
- [7] Frank AF, Gunderson JG. The role of the therapeutic alliance in the treatment of schizophrenia. Relationship to course and outcome. Arch Gen Psychiatry 1990; 47.
- [8] Geddes J, Freemantle N, Harrison P, Bebbington P. Atypical antipsychotics in the treatment of schizophrenia: systematic overview and meta-regresion analysis. BMJ 2000; 321: 1371–1376.
- [9] Gerlach J, Larsen EB. Subjective experience and mental side-effects of antipsychotic treatment. Acta Psychiatr Scand Suppl 1999; 395: 113–117.
- [10] Gilmer TP, Dolder CR, Lacro JP, et al. Adherence to treatment with antipsychotic medication and health care cost among medicaid beneficiaires with schizophrenia. Am J Psych 2004; 161: 692–699.
- [11] McGlashan TH, Carpenter WT Jr. Postpsychotic depression in schizophrenia. Arch Gen Psychiatry 1976; 33: 231–239.
- [12] Haas GL, Garratt LS, Sweeney JA. Delay to first antipsychotic medication in schizophrenia: impact on symptomatology and clinical course of illness. J Psych Res 1998; 32: 151–159.
- [13] Kapur S, Zipursky R, Jones C, et al. Relation-ship between dopamine (D2) occupancy, clinical response, and side effects: a double-blind PET study of first-episode schizophrenia. Am J Psychiatry 2000; 157: 514–520.
- [14] Kissling W, Leucht S. Results of treatment of schizophrenia: is the glass half full or half empty? Int Clin Psychopharmacol 1999; 14 (Suppl 3): S11–S14.
- [15] Leucht S, Barnes TRE, Kissling W, et al. Relapse prevention in schizophrenia with new-generation antipsychotics: a systematic review and exploratory meta-analysis of randomized, controlled trials. Am J Psychiatry 2003: 160: 1209–1222.
- [16] Melle I, Larsen TK, Haahr U, et al. Reducing the duration of untreated first-episode psychosis: effects on clinical presentation. Arch Gen Psychiatry 2004; 61: 143–150.
- [17] Mutsatsa SH, Joyce EM, Hutton SB, et al. Clinical correlates of early medication adherence: West London first episode schizophrenia study. Acta Psychiatr Scand 2003; 108: 439–446.
- [18] Perkins DO. Predictors of noncompliance in patients with schizophrenia. J Clin Psychiatry 2002; 63: 1121–1128.
- [19] Pilling S, Bebbington P, Kuipers E, Garety P, et al. Psychological treatments in schizophrenia: I. Meta-analysis of family intervention and cognitive behaviour therapy. Psychol Med 2002; 32: 763–782.
- [20] Van Putten T. Why do schizophrenic patients refuse to take their drugs? Arch Gen Psychiatry 1974; 31: 67–72.
- [21] Racková S, Janů L. Subjektivní reakce v akutní léčbě schizofrenie. Remedia 2005; 15: 509–513.
- [22] Rittmannsberger H, Pachinger T, Keppelmuller P, Wancata J. Medication adherence among psychotic patients before admission to inpatient treatment. Psychiatr Serv 2004; 55: 174–179.
- [23] Robinson D, Woerner MG, Alvir JM, et al. Predictors of relapse following response from a first episode of schizophrenia or schizoaffective disorder. Arch Gen Psychiatry 1999; 56: 241–247.
- [24] Seifertová D, Libiger J, Švestka J, et al. Schizofrenie. In: Seifertová D, Praško J, Höschl C: Postupy v léčbě psychických poruch. Praha, Academia Medica Pragensis, 2004.
- [25] Thieda P, et al. An economic review of compliance with medication therapy in the treatment of schizofrenia. Psych Serv 2003; 54: 508–516.
- [26] Weiden PJ, Mann JJ, Dixon L, et al. Is neuroleptic dysphoria a healthy response? Compr Psychiatry 1989; 30: 546–552.
- [27] Weiden P, Glazer W. Assessment and treatment selection for „revolving door“ inpatients with schizophrenia. Psychiatr Q 1997; 68: 377–392.