Význam inhibice angiogeneze v protinádorové léčbě
Angiogeneze má významnou úlohu pro růst nádoru a tvorbu metastáz, a proto inhibice angiogeneze v nádoru se zdá být slibnou léčebnou modalitou. Novotvorba cév je závislá na specifických humorálních faktorech, z nichž klíčový význam má rodina vaskulárního endoteliálního faktoru – VEGF, který je aktivátorem receptorových tyrozinkináz. Inhibice VEGF zablokuje signální cestu zprostředkovanou tyrozinkinázami a tím i novotvorbu cév v nádoru, což vede následně k jeho regresi. Přehled shrnuje současné poznatky o biologii angiogeneze, o angiogenních a antiangiogenních faktorech a uvádí různé léčebné modality, které se v současné době prověřují klinickými zkouškami.
Úvod
Úvahy o významu angiogeneze pro růst nádoru a jeho metastazování se datují od sedmdesátých let minulého století [1]. Usilovným studiem mnoha výzkumných pracovišť se v průběhu dvou desetiletí podařilo stanovit základní patogenetické mechanismy angiogeneze. Logickým důsledkem tohoto poznání bylo studium možností, jak proces angiogeneze modulovat a účinně využít možností blokády angiogeneze k léčbě nádorových onemocnění. K pochopení protinádorového účinku antiangiogenních přípravků je nutné připomenout základní mechanismy angiogeneze a její podíl na růstu a metastazování zhoubných nádorů.
Mechanismus angiogeneze
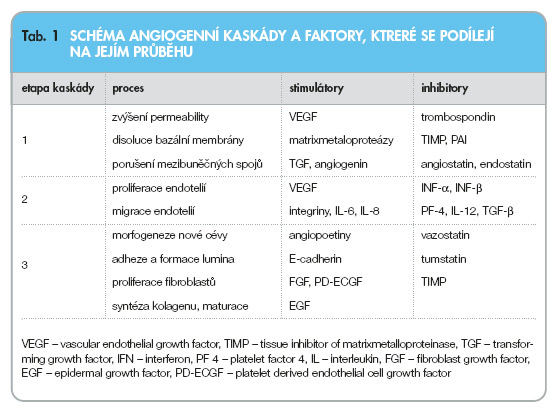
Novotvorba cév je proces, který nachází uplatnění jak za fyziologických okolností (embryogeneze, hojení ran), tak v patogenezi různých chorobných stavů. Zvýšená novotvorba cév je např. odpovědná za některé fibroproliferační pochody, uplatňuje se v patogenezi revmatoidní artritidy, u chronického zánětu nebo v patogenezi aterogeneze [2, 3]. Mechanismus angiogeneze je složitý vícestupňový proces označovaný jako angiogenní kaskáda, který je regulován větším počtem humorálních působků, zejména cytokinů, integrinů, adhezních molekul, proteolytických enzymů a nízkomolekulárních látek [4]. Za fyziologických okolností jsou faktory stimulující krvetvorbu (angiogenní faktory) v rovnováze s faktory antiangiogenními. Ztráta rovnováhy se pak projeví poruchou, jejíž povaha závisí na tom, která ze skupin regulátorů nabyla vrchu. Angiogenní kaskádu lze rozdělit přibližně na 3 etapy. V přehledu jsou uvedeny v tab. 1 spolu s faktory, které se v jejím průběhu uplatňují.
Disoluce bazální membrány
Zpravidla jí předchází vazodilatace, při které se protahuje tvar endotelií. Postupně se narušuje plynulost cévní výstelky nejen mechanicky, ale též enzymaticky působením proteolytických enzymů, matrixmetaloproteáz [5]. Účinkem angiogenních faktorů (dominantní roli má VEGF) se zvyšuje permeabilita bazální membrány umožňující únik fibrinogenu a plazminogenu z cévy s jejich následnou přeměnou na fibrin a plazmin. Síť fibrinových vláken tvoří matrici pro růst novotvořených cév, plazmin přispívá svým proteolytickým účinkem k disoluci membrány a k narušení extracelulární matrix. Od bazální membrány se oddělují podpůrné buňky – pericyty. Aktivita angiogenních faktorů je umožněna potlačením faktorů antiangiogenních (trombospondin, angiostatin, endostatin).
Proliferace a migrace endotelií
Proliferace a migrace endotelií nastává účinkem angiogenních faktorů uvedených v tab. 1. Endotelové buňky nejprve vytvářejí na povrchu cévy útvary připomínající pupeny, později nabývají endotelie lokomočních schopností a uchytí se na síti fibrinových vláken [6]. Vzniká tak základ nové cévy.
Vlastní morfogeneze nové cévy
Vlastní morfogeneze nové cévy předpokládá aktivaci pericytů, vytvoření nové bazální membrány a lumina cévy [7]. Nastává zvýšená proliferace fibroblastů a syntéza kolagenu účinkem PD-ECGF (platelet derived endothelial cell growth factor) a TGF-a (transformující růstový faktor). V novotvořené cévě se vytvářejí transluminální můstky, jimiž se rozdělí proud krve do kanálků, které se postupně separují a formují další dceřiné kapiláry.
Angiogeneze u nádorových onemocnění
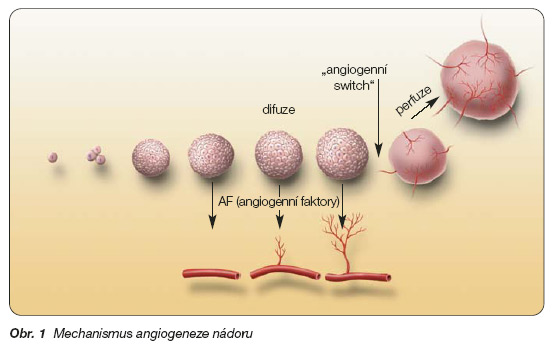
Angiogeneze má mimořádný význam pro růst nádoru a jeho metastazování [8]. Růst nádoru je totiž podmíněn plynulým přísunem kyslíku a živin. Prostá difuze však postačí pouze pro nádorové ložisko o velikosti 1–2 mm3 (tj. 106–7 buněk). Pro další růst nádoru je zapotřebí zajistit přísun kyslíku a živin perfuzí nádoru novotvořenými cévami. Hypoxie, která v kritickém období růstu nádoru vzniká, působí genetickou nestabilitu (objevuje se např. mutace genu p53, aktivuje se onkogen Kiras), a tím dochází k potlačení produkce trombospondinu, důležitého antiangiogenního faktoru [9]. To umožňuje významné uplatnění faktorů angiogenních. Vzniká nový fenotyp nádorových buněk působící stimulaci angiogeneze (tzv. angiogenní switch), jak je znázorněno na obr. 1.
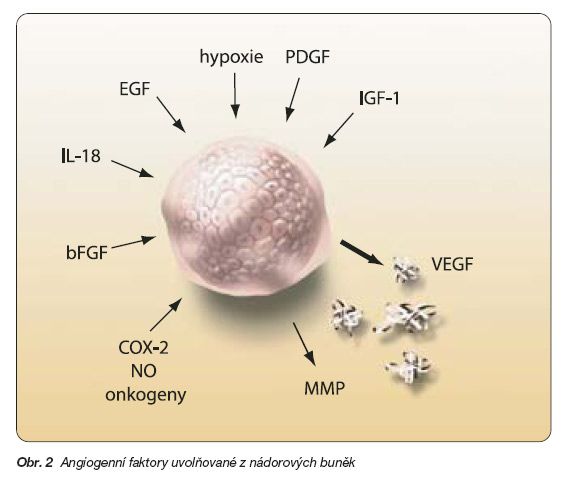
Angiogeneze je stimulována nádorovými buňkami různými mechanismy, zejména cytokiny uvolňovanými z těchto buněk, které podněcují výdej VEGF, klíčového angiogenního faktoru (obr. 2).
Snad nejvýznamnějším podnětem pro výdej VEGF je hypoxie, při níž vzniká specifický stimulátor exprese VEGF nazývaný hif-1 (hypoxia inducible factor). Vysoká aktivita NO syntázy v nádorové tkáni působí vzestup koncentrace NO, který zvyšuje mitogenní účinky VEGF. Kromě toho nádorové buňky produkují proteolytické enzymy, které rozrušují bazální membránu, a usnadňují tak nejen migraci endotelií, ale též migraci nádorových buněk, tj. metastazování [10]. Vaskularizace nádorového ložiska umožní perfuzi nádoru a jeho další exponenciální růst, i když novotvořené cévy nádoru jsou poněkud morfologicky odlišné od normální vaskulatury [11]. Jeví sníženou expresi membránových proteinů, integrinů, obsahují méně pericytů, vaskulatura postrádá organizaci. Nesouvislá výstelka může mít výhodu v tom, že usnadňuje průnik cytostatik do nádoru.
Stupeň vaskularizace nádoru a zvýšená exprese VEGF koreluje s nepříznivou prognózou, jak bylo doloženo v mnoha studiích [12–14]. Lze jej určit morfologickými metodami např. v histologických řezech, zejména na okraji nádoru, kde bývá angiogeneze nejintenzivnější (tzv. MVD = microvessel density) [15]. Oblasti intenzivní angiogeneze (tzv. „hot spots") lze odhalit též monoklonálními protilátkami proti endoteliím nebo protilátkami proti adhezním molekulám CD32 a CD34, popřípadě protilátkami proti v. Willebrandovu faktoru. Jinou možností je stanovení cirkulujících angiogenních faktorů nebo solubilních receptorů VEGF-1 a VEGF-2 [16] nebo stanovení inflamatorních markerů (E-selektin, VCAM-1), popřípadě stanovení akvaporinu 1 (faktor působící synergně s VEGF a významně zvyšující cévní permeabilitu) [17]. Stupeň angiogeneze má prognostický význam pro další růst nádoru a jeho potenciální metastazování, ale bohužel žádný z těchto markerů angiogeneze nepredikuje odpověď na antiangiogenní léčbu.
Možnosti inhibice angiogeneze u nádorových onemocnění
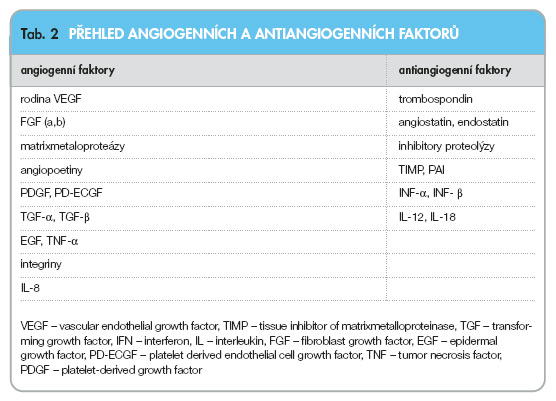
Poznání úlohy angiogeneze pro růst nádoru a jeho metastazování vedlo logicky ke hledání způsobu, jak angiogenezi účinně potlačit, a tak zpomalit nebo zastavit růst nádoru. Výzkum se zaměřil na různé etapy angiogenního procesu s použitím různých inhibitorů angiogenních působků či aplikací působků antiangiogenních. Přehled angiogenních a antiangiogenních faktorů je uveden v tab. 2.
Přirození antagonisté angiogeneze
Použití přirozených antagonistů angiogeneze je dosud málo využívanou možností. Rekombinantní technikou byl připraven ABT-510 (trombospondin mimetic peptid), který má vlastnosti přirozeného trombospondinu a blokuje odpověď na angiogenní podněty. Inhibuje aktivitu endotelií a stimuluje jejich apoptózu [18]. S jeho klinickým zkoušením se teprve začíná.V experimentu při dávkách 20–200 mg/kg/den výrazně omezoval růst nádoru a jeho metastazování. Do skupiny přirozených inhibitorů patří též rekombinantní PF-4 (destičkový faktor 4), který se s jistým úspěchem zkoušel u Kaposiho sarkomu.
Potlačení účinku angiogenních faktorů
Potlačení účinku angiogenních faktorů se dosud jeví jako účinnější. Prověřovaly se zásahy do všech etap angiogenní kaskády.
Ke stabilizaci bazální membrány byl zkoušen větší počet přípravků. Intaktní bazální membrána totiž znesnadňuje invazi endotelií, a proto může mít význam inhibice enzymů, které bazální membránu rozrušují. Tyto enzymy se souhrnně nazývají matrixmetaloproteázy (MMP) a patří mezi ně intersticiální kolagenázy, gelatináza, matrilysin a stromelysin. V experimentu se jevily účinné zejména syntetické inhibitory (prinomastat, marimastat, batimastat), ale v klinických studiích nebyla až na výjimky jejich antiangiogenní (a protinádorová) účinnost signifikantně doložena [19, 20]. Relativně příznivé zprávy byly o použití přípravku neovastat (purifikovaný extrakt ze žraločích chrupavek), který kromě inhibice matrixmetaloproteáz (MMP 2, MMP 9 a MMP 12) působí ještě dalšími antiangiogenními mechanismy, jako je indukce apoptózy endotelií a blokáda receptorů pro VEGF [21].
Inhibici endoteliální proliferace působí fumagilin, extrakt z houby Aspergillus fumigatus, který se však pro výraznou toxicitu v klinické praxi neuplatnil. Také použití jeho méně toxického derivátu AGM-1470 (angiogenesis modulator, chemicky o-chlor-acetyl-karbamoyl-fumagilol) se příliš nerozšířilo, i když bylo referováno o jeho příznivém efektu u Kaposiho sarkomu. Naproti tomu interferony a a b, které rovněž tlumí proliferaci endotelií, se s relativním úspěchem používají k omezení angiogeneze progredujících angiomů. Inhibice endoteliální proliferace se předpokládá jako jeden z antiangiogenních účinků thalidomidu. Mechanismus jeho antiangiogenního účinku není sice přesně definován, ale nelze jej zpochybnit. Dokladem může být i vznik malformací při jeho užívání v graviditě, kde normální vývoj plodu je závislý na intaktní angiogenezi. Inhibiční účinky na proliferaci endotelií mají též combrestatiny, výtažky z africké rostliny Combretum cafrum, které indukují apoptózu endotelií a destabilizují mikrotubuly. Podobný mechanismus účinku mají i skvalaminy.
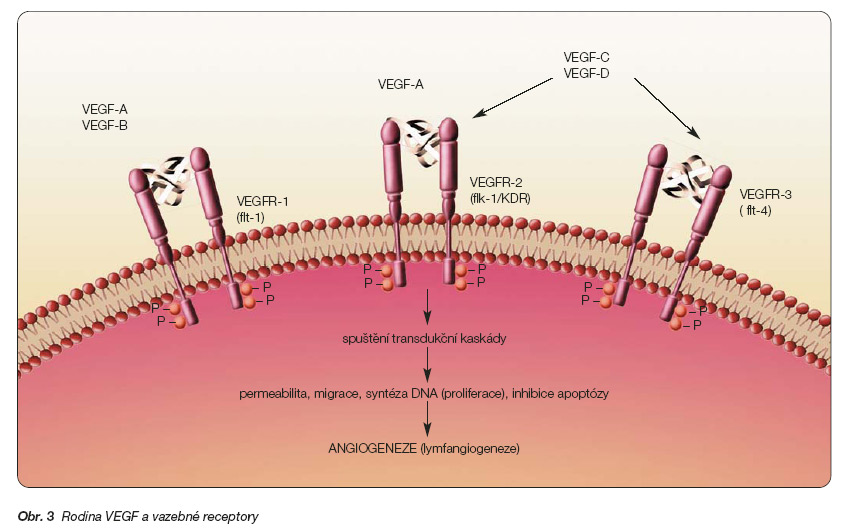
Inhibice klíčového stimulátoru angiogeneze, tj. VEGF, resp. rodiny VEGF se zdá nejúčinnější [22]. Existuje šest variant VEGF (VEGF-A až -E a PIGF – placenta induced growth factor, který je s VEGF homologní) (obr. 3).
Faktory VEGF jsou dimerické glykoproteiny, které se uvolňují z fibroblastů a z různých jiných struktur za patologických okolností z nádorových buněk účinkem EGF (epidermální růstový faktor) a jiných stimulátorů. VEGF-A se považuje za hlavní stimulátor angiogeneze a jeho výdej je silně stimulován hypoxií. Působí výrazné zvýšení cévní permeability, a dříve se proto označoval jako faktor permeability (VPF – vascular permeabilty factor). VEGF-B a VEGF-E mají podobné biologické účinky jako VEGF-A [23]. Naproti tomu VEGF-C a VEGF-D hrají významnou roli zejména při stimulaci lymfangiogeneze. Jejich zvýšená exprese byla nalezena zejména u nádorů metastazujících lymfatickou cestou. Faktory VEGF se vážou podobně jako jiné růstové faktory na specifické membránové receptory a touto vazbou aktivují receptorové tyrozinkinázy. Tím se spustí transdukční kaskáda, jejímž výsledkem je zvýšená proliferace endotelií, usnadní se jejich migrace a zvýší se permeabilita cév [24]. Receptory pro vazbu VEGF nejsou jednotné. Byly identifikovány 3 druhy, z nichž každý je vazebným místem pro jiný faktor VEGF a je odpovědný za odlišné účinky jednotlivých faktorů VEGF. Vazba na VEGFR-1 (Flt-1-fms-like tyrosinkinase) se projeví stimulací proliferace a migrace endotelií, vazba na VEGFR-2 označovaný též jako Flk-1 (fetal liver kinase) nebo KDR (kinase domain region) se projeví blokádou apoptózy endotelií a hlavně zvýšením cévní permeability. Vazba na VEGF-3 (Flt-4) vede ke stimulaci lymfangiogeneze.
Různé možnosti inhibice VEGF
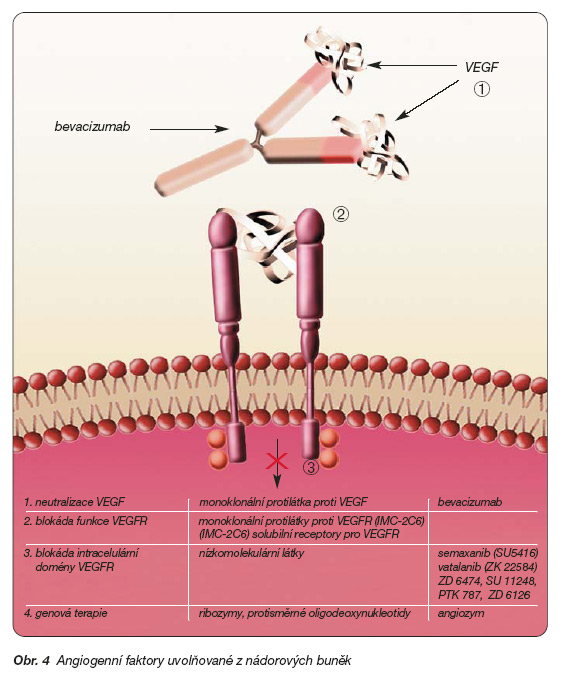
Potlačení účinků VEGF je možné několika způsoby (viz obr. 4).
1. Je to především neutralizace tohoto růstového faktoru humanizovanou monoklonální protilátkou s generickým názvem bevacizumab. Slibné výsledky experimentálních studií urychlily zahájení klinického testování. Zjistilo se, že bevacizumab významně omezuje novotvorbu cév, snižuje intersticiální tlak v nádoru, a tím usnadňuje i průnik cytostatika do nádoru. To vysvětluje i výhody kombinace bevacizumabu s chemoterapií. Po ověření tolerance bevacizumabu při humánním podání byly zahájeny zkoušky u různých nádorů, neboť podíl angiogeneze na růstu a metastazování má obecný charakter. Nejvíce zkušeností je dosud v léčbě kolorektálního karcinomu, ale probíhá větší počet klinických studií u různých solidních nádorů [25, 26]. Dokonce bylo zjištěno, že cévní denzita v kostní dřeni se odráží i v prognóze hematologických malignit. Uplatní se zde zejména zvýšená exprese receptorů KDR a c-kit na leukemických buňkách. Receptory c-kit jsou totiž rovněž vazebným místem pro VEGF-2 [27]. Ve většině klinických studií se podává bevacizumab v kombinaci s chemoterapií, popřípadě s biologickou terapií, jak v přehledu ukazuje tab. 3.
2. Druhou, zatím málo využívanou možností je inhibice receptorů pro VEGF monoklonální protilátkou nebo aplikace solubilního VEGF (vytvořením inaktivního heterodimeru), který obsadí vazebná místa a neumožní aktivaci transdukční kaskády [28].
3. Perspektivní možností je blokáda receptorových tyrozinkináz různými nízkomolekulárními sloučeninami [29]. Inhibice tyrozinkináz znemožní zpravidla aktivaci transdukční kaskády po její aktivaci jakýmkoliv typem VEGF. Některé z přípravků blokují i kinázy receptorů pro jiné růstové faktory. Patří mezi ně indolinový derivát semaxanib (SU-5416). Po nadějných výsledcích I. a II. etapy klinického zkoušení u nemalobuněčného karcinomu plic, u Kaposiho sarkomu a u kolorektálního karcinomu bylo přikročeno k III. etapě, ve které se nenaplnila očekávání vyplývající z předchozího testování, a studie byla předčasně ukončena [30]. Naproti tomu dobré zkušenosti jsou s anilinoftalazinovým derivátem s generickým názvem vatalanib (PTK 787/ZK 22584). Tento přípravek inhibuje intracelulární doménu tyrozinkinázových receptorů VEGFR-1, VEGFR-2, ale též doménu receptoru PDFGF, c-kit a c-Fms. Na základě výrazného protinádorového účinku u experimentálních nádorů bylo přikročeno ke klinickému zkoušení. Výsledky na souboru více než 1 000 nemocných potvrdily účinek u metastatického kolorektálního karcinomu, zejména při současné léčbě kombinací FOLFOX (fluorouracil, leucovorin a oxaliplatina). Povzbudivé výsledky byly též u glioblastoma multiforme v kombinaci s temozolomidem [31]. Vatalanib se podává denně per os v dávce 500 mg/den.
Klinicky se zkouší větší počet nízkomolekulárních inhibitorů, z nichž mnohé zatím nemají svá generická jména a nesou pouze kódová označení. Je to např. ZD6474, přípravek, který kromě inhibice VEGF blokuje též tyrozinkinázy receptoru pro EGF. Zkouší se u nemalobuněčného karcinomu plic v kombinaci s docetaxelem [32]. SU 11248 je inhibitor tyrozinkináz receptorů pro VEGF, PDGF, c-kit a Flt-3. Zkouší se v léčbě karcinomu prsu, ledviny, kolorekta a u gastrontestinálního stromálního tumoru (GIST) rezistentního na léčbu imatinibem. PTK 787 blokuje receptory pro VEGF-1 a VEGF-2. Ze zkoušených inhibitorů má patrně největší toxicitu a zatím nebyl klinicky zkoušen. Poněkud jiným mechanismem působí přípravek ZD6126, který je odpovědný za disrupci cytoskeletu novotvořených endotelií, což vede k jejich rychlému zániku.
4. Další prověřovanou možností je využití genové terapie. Zkouší se buď protisměrné oligodeoxynukleotidy proti mRNA pro VEGF, nebo specifický ribozym (angiozym) štěpící specificky mRNA pro VEGF receptor [33, 34].
Závěr
Není pochyb o tom, že omezení novotvorby cév působí alteraci nádorového růstu, především jeho zpomalení. Experimentální studie i výsledky četných klinických zkoušek ukázaly na vzájemnou potenciaci účinku bevacizumabu a chemoterapie, bez synergní toxicity. Je proto pravděpodobné, že se bevacizumab stane pravidelnou součástí kombinované protinádorové léčby, zejména u nádorů s prokazatelně vystupňovanou angiogenezí.
Seznam použité literatury
- [1] Folkman J. Tumour angiogenesis: therapeutic implications. N Engl J Med 1971; 285:1182–1186.
- [2] Folkman J. Angiogenesis-dependent diseases. Semin Oncol 2001; 28: 536–542.
- [3] Pipp F, Heil M, Issbrucker K, et al. VEGFR – selective VEGF homologue PIGF is arteriogenic. Circ Res 2003; 92: 378–385.
- [4] Bergers G, Benjamin LE. Tumorigenesis and the angiogenic switch. Nature Rev 2003; 3: 401–409.
- [5] Hessig B, Hattori K, Friedrich M, et al. Angiogenesis: vascular remodeling of extracelular matrix involves metalloproteinases. Curr Opin Hematol 2003; 10: 136–141.
- [6] Karkkainen MJ, Petrova TV. Vascular endothelial growth factor receptors in the regulation of angiogenesis and lymphangiogenesis. Oncogene 2000; 19: 5598–5605.
- [7] Gerhardt H, Betsholtz C. Endothelial-pericyte interactions in angiogenesis. Cell Tissue Res 2003; 314: 15–23.
- [8] Hahn WC. Rudles for making human tumour cells. N Engl J Med 2002; 347: 1593–1603.
- [9] Pugh CW, Radcliffe PJ. Regulation of angiogenesis by hypoxia. Nat Med 2003; 9: 677–684.
- [10] Dvorak HF. Vascular permeability factor/vascular endothelial growth factor: a critical cytokine in tumour angiogenesis and a potential target for diagnosis and therapy. J Clin Oncol 2002; 20: 4368–4380.
- [11] Morikawa S. Abnormalities in pericytes on blood vessels and endothelial sprouts in tumours. Am J Pathol 2002; 160: 985–1000.
- [12] Brown LF, Berse B, Jackman RW, et al. Expression of vascular permeablity factor (vascular endothelial factor ) and its receptors in adenocarcinomas of the gastrointestinal tract. Cancer Res 1993; 53: 4727–4735.
- [13] Plate KH, Breier G, Weich HA, et al. Vascular endothelial factor is potential tumour angiogenesis factor in human gliomas in vivo. Nature 1992; 359: 845–848.
- [14] Salven P, Lymboussaki A, Heikkila P, et al. Vascular endothelial growth factors VEGF-B and VEGF-C are expressed in human tumours. Am J Pathol 1998; 153: 103–108.
- [15] Hlatky L. Clinical application of antiangiogenic therapy: microvessel density, what it does and doesn´t tell us. J Nat Cancer Inst 2002; 94: 883–893.
- [16] Poon RT, Fan ST, Wong J. Clinical implication of circulating angiogenic factors in cancer patients. J Clin Oncol 2001; 19: 1207–12025.
- [17] Vacca A, Frigeri A, Ribattri D, et al. Microvessel overexpression of aquaporin-1 parallels bone marrow angiogenesis in patients with multiple myeloma. Brit J Haematol 2001; 113: 415–421.
- [18] Nor JE, Mitra RS, Sutorik MM, et al. Thrombo-spondin-1 induces endothelial cell apoptosis and inhibits angiogenesis by activating the caspase death pathway. J Vasc Res 2000; 37: 209–218.
- [19] Giavazzi R, Garofalo A, Ferri C, et al. Batimastat, a synthetic inhibitor of matrix metalloproteinases potentiates the antitumour activity of cisplatin in ovarian carcinoma xenografts. Clin Cancer Res 1998; 4: 985–992.
- [20] Bramhall SR, Rosemurgy A, Brown PD, et al. Marimastat as first-line therapy for patients with unresectable pancreatic cancer: a randomized trial. J Clin Oncol 2001; 129: 3445–3446.
- [21] Falardea P, Champagne P, Poyet P, et al. Neovastat, a naturally occuring multifunctional antiangiogenic drug in phase III clinical trials. Semin Oncol 2001; 28: 620–625.
- [22] Ferrara N, Gerber HP, LeCouter J. The biology of VEGF and its receptors. Nat Med 2003; 9: 669–676.
- [23] McMahon. VEGF receptor signaling in tumour angio-genesis. Oncologist 2000; 5: (Suppl. 1); 3–10.
- [24] Kerbel R. Clinical translation of angiogenesis inhibitors. Nature Rev Cancer 2002; 2: 727–739.
- [25] Hurwitz H, Fehrenbacher L, Novotny W, et al. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med 2004; 350: 2406–2408.
- [26] Rugo HS. Bevacizumab in the treatment of breast cancer: rationale and current data. Oncologist 2004; Suppl. 9: 43–49.
- [27] Karp JE, Gojo I, Pili R, et al. Targetig vascular endothelial growth factor for relapsed and re-fractory adult acute myelogenous leukemias. Clin Cancer Res 2004; 10: 3577–3585.
- [28] Lin P, Sankar S, Shan S, et al. Inhibition of tumour growth by targeting tumour endothelium using soluble vascular endothelial growth factor receptor. Cell Growth Differ 1998; 9: 49–58.
- [29] Mendel DV, Laird AD, Smolich BD, et al. Development of SU 5416, a selective small molecule inhibitor of VEGF receptor tyrosine kinase activity, as an antiangiogenic agent. Anti-cancer Drug Design 2000;15: 29–41.
- [30] Garber K. Angiogenesis inhibitors suffer new setback. Nature Biotechnol 2002; 20: 1067–1068.
- [31] Reardon D, Friedman H,Yung WKA, et al. A phase I/II trial of PTK 787/ZK 2225845, a novel oral angiogenesis inhibitor in combination with either temozolomide or lomustine for patients with recurrent glioblastoma multiforme. J Clin Oncol 2004; 22: 1513.
- [32] Heymach JV, Dong RP, Dimery I, et al. ZD 6474, a novel antiangiogenic agent, in combination with docetaxel in patients with NSCLC. Proc Am Soc Clin Oncol 2004; 22: 14.
- [33] Sandberg JA, Sproul CDm, Blanchard KS, et al. Acute toxicology and pharmacokinetic assessment of a ribozyme (Angiozyme) targeting vascular endothelial growth factor receptor mRNA in the Cynomolgus monkey. Antisense Nucl Acid Drug Develop 2000; 10: 153–162.
- [34] Parry TJ, Cushman C, Callegos AM, et al. Bio-availability of antiangiogenic ribozymes targeting Flt-1 and KDR mRNA. Nucleic Acid Res 1999; 27: 2569–2577.