Warfarin – starý známý?
Souhrn:
Pavlík T. Warfarin – starý známý? Remedia 2018; 28: 412–417.
Warfarin v příštím roce oslaví své 65. výročí. Ačkoliv byla v posledních letech na trh uvedena řada nových perorálních antikoagulancií, stále zůstává jedním z nejpoužívanějších léčiv. Dle odhadů jej v celosvětovém měřítku užívá 0,5−1,5 % celosvětové populace. Od konce sedmdesátých let je znám i mechanismus jeho účinku, tj. inhibice epoxid reduktázy a s tím související nedostatečná syntéza koagulačních faktorů závislých na vitaminu K. Zásadní komplikací terapie je významná variabilita dávkování a úzké terapeutické rozmezí. Ustálených hodnot INR je dosaženo při dávkování 1−20 mg za den, ale i v širším rozmezí. Dosažení cílové hodnoty INR může trvat několik týdnů až měsíců. Během tohoto období jsou pacienti vystaveni zvýšenému riziku nedostatečné, nebo naopak nadměrné antikoagulace. Komplikace vyplývající z nesprávného dávkování warfarinu a z následné nutnosti vyhledání lékařské péče patří stále k nejčastěji hlášeným nežádoucím příhodám. Warfarin tedy zůstává v centru pozornosti vědeckých skupin i po půlstoletí. Kromě dnes již známých negenetických faktorů (BMI, hmotnost, pohlaví, věk, dieta a současně užívaná léčiva) jsou v poslední době podrobně zkoumány faktory genetické (především polymorfismy CYP2C9 a VKORC1) a jejich klinické využití ve vztahu k predikci správné dávky warfarinu.
Summary:
Pavlik T. Warfarin – an old acquaintance? Remedia 2018; 28: 412–417.
Warfarin will celebrate its 65th “birthday” next year. Although many new oral anticoagulants have been launched during the last years, it remains one of the most popular medications. It has been estimated that between 0.5% and 1.5% of the world population take warfarin. The mechanism of its action, i.e. inhibition of epoxide reductase leading to reduced synthesis of vitamin K‑dependent coagulation factors, has been known since the end of the 1970th. Significant variability of its dosing and narrow therapeutic window are the crucial complications of warfarin use. Steady INR values are being achieved with 1mg to 20mg of warfarin daily; the range of dosages can be even wider. Moreover, steady INR values may not be reached before several weeks to months of therapy have elapsed. During this period, the patients are at risk of insufficient or too intense anticoagulation. Complications following incorrect warfarin dosing and ensuing need of medical attention still represent the most common adverse events. Warfarin thus never stopped, event after half of a century, to attract the interest of scientific groups. Beside the well‑known non‑genetic factors (BMI, weight, sex, age, diet, and concomitant medications), genetic factors influencing warfarin therapy have been studied meticulously in the past years (especially CYP2C9 a VKORC1 polymorphisms); special attention has been paid to their clinical use with respect to correct warfarin dose prediction.
Key words: warfarin, CYP2C9, VKORC1, pharmacogenetics, algorithms.
Negenetické a genetické faktory
Velikost denní dávky warfarinu je
podmíněna ze 40−60 % faktory negenetickými. Při
užším výběru snadno kvantifikovatelných faktorů (věk,
pohlaví, tělesná hmotnost a výška pacienta) pak pouze
z 10−20 % [1]. Mezi zbylé hůře identifikovatelné faktory
patří obsah vitaminu K v potravě, compliance/adherence
pacienta k léčbě, stav jaterních a ledvinných funkcí,
poměr anabolismus/katabolismus a další, viz obr. 1.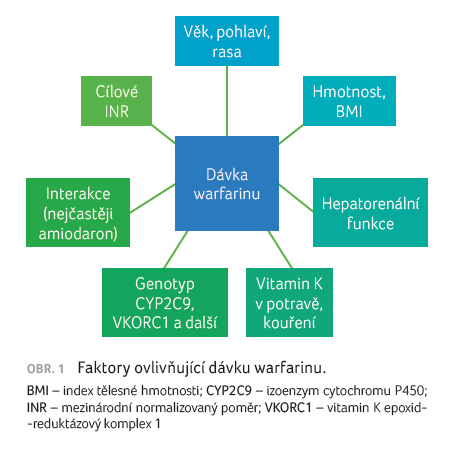
V případě genetických faktorů je dávka ovlivněna z 50−60 % [1]. Dnes je již popsáno více než tisíc polymorfismů ve více než 30 genech, které by mohly různým způsobem ovlivňovat účinek, a tedy i dávku warfarinu. Zatím nejlépe popsanými jsou polymorfismy v genech pro vitamin K epoxid reduktázový komplex 1 (VKORC1) a izoenzym cytochromu P450 CYP2C9 [2−4]. V případě polymorfismů CYP2C9 dochází k ovlivnění požadované dávky warfarinu v rozsahu přibližně 18 %, u VKORC1 pak dokonce v rozsahu 30 % [5]. Vliv těchto polymorfismů se zdá být rozhodující a vykazuje aditivní charakter. U variantních alel genu CYP2C9 byla potvrzena vedle nižší dávky také potřeba delšího času k dosažení stabilní hodnoty mezinárodního normalizovaného poměru (international normalized ratio, INR). Výsledkem je vyšší riziko krvácivých komplikací. Variantní alely genu VKORC1 jsou spojeny s obecně vyšší citlivostí k warfarinu, tj. s potřebou nižších dávek, méně pak s časem dosažení stabilních hodnot INR a s rizikem předávkování [6]. Dalšími studovanými jsou například polymorfismy genů pro apolipoprotein E (APOE), CYP4F2, epoxid hydrolázu 1 (EPHX1) a gama glutamyl karboxylázu (GGCX). Ty v součtu vysvětlují zhruba 10 % variability dávky warfarinu [7].
Rozdíly mezi etniky
Jedním z významných faktorů,
který hraje úlohu při stanovení denní dávky warfarinu, je rasa
(etnikum). To je dáno popsanou potřebou rozdílných dávek
warfarinu u různých populací (kavkazská, mongoloidní,
negroidní). Nejvyšších dávek je v průměru potřeba
u černošské (negroidní) populace, naopak populace asijská
(mongoloidní) vyžaduje dávky nejnižší [1−3]. Z výsledků
retrospektivní studie z roku 2005, která zkoumala variabilitu
dávkování warfarinu u různých etnických skupin, vyplynula
potřeba průměrné týdenní dávky u Afroameričanů 43 mg
(respektive 39–47 mg/týden), 36 mg u bělochů
(34–39 mg/týden), 31 mg u Hispánců (25–37 mg/týden)
a pouze 24 mg u Asiatů (21–27 mg/týden), viz graf 1. V přepočtu na denní dávku bylo nutné
podat u Afroameričanů v průměru 6,1 mg, u bělochů
5,1 mg a u Asiatů 3,4 mg warfarinu [8].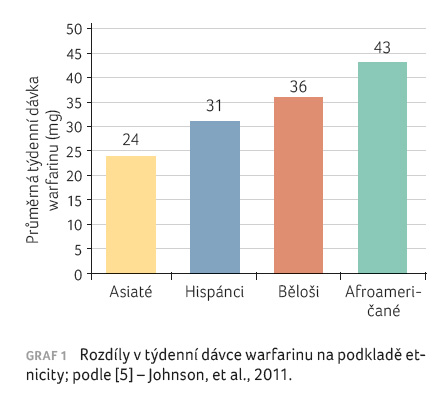
Z výsledků je tedy patrné, že dávka 5 mg denně, která je doporučována dle Souhrnu údajů o přípravku (SPC) při úvodu warfarinizace, odpovídá spíše kavkazské populaci. U Asiatů hrozí zvýšené riziko krvácení, naopak u černošské populace spíše riziko nedostatečné dávky s rizikem tromboembolických komplikací. Tyto rozdíly jsou připisovány mimo jiné rozdílnému zastoupení polymorfismů CYP2C9 a VKORC1 a jejich vlivu na dávkování u daných etnik [5]. Ačkoliv se zmínky o vlivu polymorfismů a rasy objevily v doporučeních odborných společností již v letech 2012 a 2014 [9,10], stále chybí začlenění těchto znalostí do SPC přípravků registrovaných v ČR, a tedy i do běžné klinické praxe.
Polymorfismus CYP2C9
Polymorfismus genu CYP2C9 je spojen se změnami ve farmakokinetice warfarinu [11]. Účinnější levotočivá forma warfarinu (s warfarin) je metabolizována katalytickou reakcí právě prostřednictvím CYP2C9. Geneticky podmíněné změny vedou ke zpomalení přeměny na neaktivní formy a následně k potřebě nižších dávek warfarinu. Dnes je již známo více než 30 mutací tohoto genu [3]. Kromě tzv. divoké (wild type, v populaci převažující) alely CYP2C9*1 byly zkoumány i varianty CYP2C9*2 a CYP2C9*3 a jejich vliv na dávkování warfarinu. Bylo potvrzeno, že obě jsou spojeny s potřebou nižších dávek warfarinu. Jak varianta CYP2C9*2, tak CYP2C9*3 jsou exprimovány v enzym s nižší metabolickou aktivitou. Stran polymorfismu CYP2C9 přinesla velké shrnutí metaanalýza z roku 2005, která vycházela z osmi dříve publikovaných studií [12]. Z 2 775 pacientů bylo přibližně 20 % nositelem alespoň jedné z variantních alel (CYP2C9*2 12,2 %, CYP2C9*3 7,9 %). U genotypu CYP2C9*2 byla pozorována průměrná potřeba snížení denní dávky warfarinu o 17 %, tj. v průměru o 0,85 mg denně, a v případě CYP2C9*3 dokonce o 37 %, tj. v průměru o 1,92 mg denně. Z klinického hlediska je také velmi důležité, že obě varianty byly spojeny s delším časem potřebným k nalezení správné dávky warfarinu a k udržení INR v cílovém rozmezí [5].
Snadnou interpretaci výsledků nicméně komplikuje možnost kombinace různých alel. V populacích se mohou vyskytovat současně jak homozygoté s divokým typem alel (CYP2C9*1*1), tak heterozygoté (CYP2C9*1*2, CYP2C9*1*3, CYP2C9*2*3), ale také homozygoté s variantními alelami (CYP2C9*2*2, CYP2C9*3*3). Nicméně u všech nositelů variantních alel je očekávána potřeba redukce dávky warfarinu oproti skupině homozygotů CYP2C9*1*1 [13].
V případě CYP2C9*2 se jedná o polymorfismus na úrovni jednoho nukleotidu (single nucleotide polymorphism, SNP) v exonu 3, kdy je nahrazen cytosin za thymin, někdy je v literatuře označován také jako rs1799853, Cys144Arg nebo C430T. Při podrobnějším pohledu na vliv tohoto SNP, který je spojen s přibližně 12% zachovanou enzymatickou aktivitou CYP2C9, literatura ukazuje na nutnost přibližně 20% redukce dávky warfarinu v případě heterozygota CYP2C9*1*2 (C/T) a asi 40% redukce u homozygota CYP2C9*2*2 (T/T) [14].
V případě CYP2C9*3 se jedná o SNP v exonu 7, kdy je nahrazen adenin za cytosin, někdy se v literatuře označuje také jako rs1057910, Ile359Leu nebo A1075C. Metabolická aktivita výsledného enzymu CYP2C9 je výrazně snížena, uváděna je enzymatická aktivita nižší než 5 % hodnoty CYP2C9*1. Průměrná očekávaná redukce dávky warfarinu je u heterozygota CYP2C9*1*3 (A/C) odhadována na 40 % a v případě variantního homozygota CYP2C9*3*3 (C/C) dokonce až na 80 % [15].
Polymorfismus CYP2C9 v podmínkách ČR
Četností výskytu
variantních alel genu pro enzym CYP2C9 v podmínkách České
republiky se zabývala studie z roku 2007 [16]. Byla provedena
na vzorku 254 zdravých osob, vysokoškolských studentů
1. lékařské fakulty
Univerzity Karlovy v Praze. Potvrdila výskyt uvedených alel
blízký ostatním evropským státům kavkazské populace. Divoký
typ CYP2C9*1 se
vyskytoval u 81,9 % populace, CYP2C9*2 u 12,2 %
a CYP2C9*3
u 5,9 %, viz tab. 1.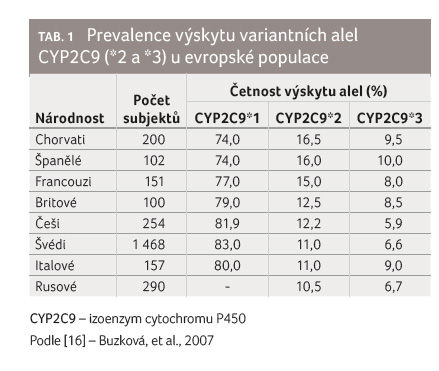
Rozdíly v zastoupení polymorfismů CYP2C9 mezi populacemi
Výše uvedené polymorfismy nejsou
jedinými klinicky významnými polymorfismy, a dokonce ani
nejběžnějšími variantami u některých etnických skupin,
neboť řada studií prokázala odlišný výskyt variantních alel
mezi jednotlivými etniky [5,17]. V případě CYP2C9*2 je
nejvyšší zastoupení u kavkazské populace (8−18 %),
negroidní a mongoloidní populace vykazují pouze vzácné
zastoupení, viz tab. 2.
V případě CYP2C9*3 je zastoupení vyrovnanější, nicméně
i tentokrát je nejvyšší u kavkazské populace (5−13 %)
[5]. To by mohlo vysvětlovat vyšší citlivost vůči warfarinu
u kavkazské populace v porovnání s Afroameričany,
nikoliv však s Asiaty. Proto je pozornost věnována
rovněž zastoupení dalších méně často se vyskytujících
variantních alel, především CYP2C9*4, *5, *6, *8, *9 a *11
[17,18]. Varianty CYP2C9*5, CYP2C9*6 byly dosud nalezeny pouze
u černošské populace. V případě CYP2C9*9 a *8
byla zaznamenána četnost výskytu u této populace dokonce
srovnatelná s výskytem CYP2C9*2 a *3 u populace
kavkazské [18]. Souvislost mezi variantní alelou CYP2C9*8
a potřebou nižších dávek warfarinu byla potvrzena, zatímco
význam CYP2C9*9 není dosud zcela objasněn [19,20].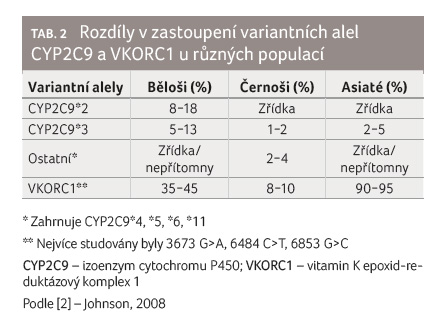
Polymorfismus VKORC1
VKORC1 představuje cílové místo působení warfarinu. Změny v genu kódujícím tento komplex tedy vedou k ovlivnění jeho farmakodynamiky. Gen VKORC1 kóduje transmembránový protein složený ze 163 aminokyselin, ten tvoří podjednotku komplexu epoxid reduktázy a je nezbytný pro karboxylaci zbytků glutamových kyselin koagulačních proteinů [1]. Polymorfismus je zodpovědný za 30% variabilitu v dávkování warfarinu [5,21].
Z celé řady dnes známých polymorfismů tohoto genu jsou nejčastěji citovány SNP v promotorové části genu označovaný jako 1639 G>A (3673 G>A, rs9923231) a SNP lokalizovaný v prvním intronu 1173 C>T. U těchto dvou polymorfismů byla prokázána těsná vazba, a proto se jeví jako dostačující detekce pouze jednoho z nich (častěji 1639 G>A). Z výsledků řady studií vyplývá, že u kavkazské populace byla u homozygotních nositelů divoké alely 1639 G/G průměrná dávka warfarinu 6,1 mg denně, v případě heterozygotů G/A 4,5 mg denně a u variantních homozygotů A/A jen 3 mg denně [5].
V populaci se mohou na druhou stranu vyskytovat rovněž vzácné bodové mutace genu VKORC1 (kodony 29, 45, 58, 66 a 128), které jsou naopak zodpovědné za „warfarinovou rezistenci“, zde je naopak potřeba denních dávek warfarinu vyšších než 25 mg [6].
Rozdíly v zastoupení polymorfismů VKORC1 mezi populacemi
Tak jako v případě polymorfismů CYP2C9 je i u polymorfismů VKORC1 četnost výskytu variantních alel rozdílná u různých populací. U asijské populace dominuje variantní genotyp A/A. Četnost jeho výskytu je popisována mezi 70−90 %, v případě heterozygotů G/A mezi 13−18 %. Zastoupení divoké formy, která u bělochů převažuje, je naopak velmi nízké, viz tab. 2 [3,5]. U asijské populace je u homozygotů AA popisována denní dávka warfarinu pouze 2,8 mg. S ohledem na vysoké zastoupení variantních alel VKORC1 u Asiatů, a tedy jejich vyšší citlivost k warfarinu, je vhodná vyšší opatrnost při dávkování u této skupiny pacientů.
Polymorfismy CYP2C9 a VKORC1 v podmínkách Thomayerovy nemocnice
V letech 2008−2014 bylo
na Oddělení patologie a molekulární medicíny
Thomayerovy nemocnice v Praze provedeno u 13 pacientů
obtížně léčitelných warfarinem stanovení VKORC1 1639 G>A,
CYP2C9 430C>T (CYP2C9*2) a 1075 A>C (CYP2C9*3)
polymorfismů. V šesti případech byla zastoupena variantní
alela genu pro VKORC1, z toho ve třech případech se
jednalo o heterozygoty GA a ve třech případech
o homozygoty AA. Variantní alela se v tomto případě
vyskytla u 46 % testovaných pacientů. Zastoupení
variantních alel polymorfismu CYP2C9 bylo nižší. V případě
CYP2C9*2 i CYP2C9*3 se jednalo shodně o dva heterozygoty,
variantní alela se vyskytla u obou polymorfismů v 15,4 %,
viz tab. 3. Ačkoliv
šlo o malý počet cíleně zvolených pacientů, výskyt
variantních alel byl přesto blízký výsledkům studie z roku
2007 provedené na 1. LF UK [16].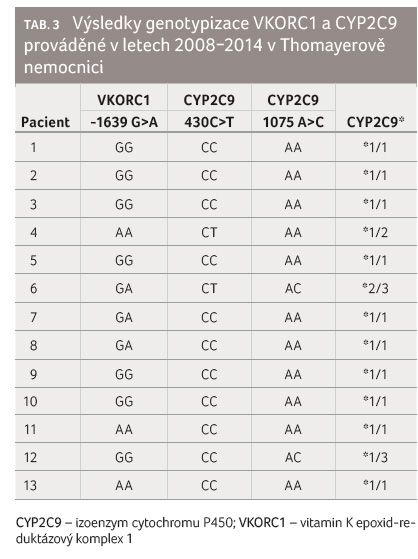
Negroidní populace – odlišnosti
Jak bylo již uvedeno, genetické faktory ovlivňují výslednou dávku warfarinu přibližně z 50 % [1,5]. To platí především pro kavkazskou a asijskou populaci. V případě populace negroidní se zdá být tento vliv nižší, pouze okolo 10 % [18]. Zmíněný stav je vysvětlován nižším stupněm vazebné nerovnováhy u jednotlivých SNP. Proto je výběr jednoho zástupce SNP, který by jednoduchým způsobem určil citlivost k warfarinu, obtížný. I přes uvedenou vazebnou nerovnováhu a velký počet SNP VKORC1 se jeví spojitost mezi polymorfismy 1639 G>A a 1173 C>T a dávkováním warfarinu u této populace stále jako významná [5]. V případě 1639 G>A polymorfismu byly pro jednotlivé genotypy zaznamenány dávky velmi blízké dávkám u kavkazské populace − pro genotypy GG, GA a AA 5,7 mg, 4,5 mg a 3,1 mg [22]. Vzhledem ke skutečnosti, že většina negroidní populace je nositelem genotypu GG (divoký typ), je logicky průměrná denní dávka warfarinu u této populace nejvyšší, viz graf 1.
Správné rozmezí hodnot INR u Asiatů
Vyšší citlivost k warfarinu u asijských pacientů, a tedy potřeba nižších dávek k dosažení cílového INR v rozmezí 2–3 není jediným důvodem k vyšší obezřetnosti při warfarinizaci u tohoto etnika. Diskutováno je samo optimální rozmezí INR. Rozmezí INR 2−3 v obvyklých indikacích je u Asiatů spojeno s vyšším rizikem krvácení, ale i tromboembolických komplikací. V retrospektivní studii z roku 2005 zahrnující 491 asijských pacientů se jako optimální rozmezí INR jevily hodnoty 1,8−2,4 [23]. Situace může být nicméně komplikovanější a pouhé snížení cílového rozmezí INR nemusí být řešením, což potvrdila japonská studie z roku 2007, kdy i přes snížení cílového INR na rozmezí 1,6−2,6 byla zaznamenána vyšší míra rizika velkého krvácení a intrakraniální hemoragie [24].
Informace v SPC u přípravků registrovaných v ČR a v zahraničí
Z výše uvedených dat
vyplývá, že denní dávky warfarinu pro jednotlivé genotypy jsou
podobné napříč populacemi. Ve vztahu dávky warfarinu a rasy
je rozhodující rozdíl v zastoupení variantních alel
u různých etnik. Přesto můžeme v obecné rovině
počítat s vyšší citlivostí k warfarinu (tj.
s potřebou nižších dávek) u Asiatů v porovnání
s ostatními populacemi. Nicméně jako spolehlivější přístup
pro predikci dávky warfarinu se jeví využití znalosti genotypů.
I proto můžeme u přípravků obsahujících warfarin
registrovaných v USA nalézt kromě upozornění na potřebu
nižších dávek u Asiatů rovněž tabulku s doporučenými
dávkami pro jednotlivé genotypy, viz tab. 4.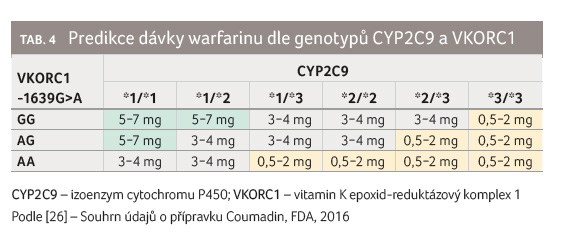
Již v roce 2007 vydal americký úřad pro kontrolu potravin a léčiv (FDA) doporučení, že stanovení genotypů pro CYP2C9 a VKORC1 může být přínosné pro určení optimální dávky warfarinu [25]. V roce 2010 následovala implementace těchto informací do SPC a texty byly doplněny o uvedenou tabulku. Dnes tyto informace nalezneme u přípravků dodávaných na trh pod obchodními názvy Coumadin (Bristol Myers Squibb) a Jantoven (Upsher Smith Laboratories) [26,27]. Využívána je znalost genotypů SNP CYP2C9 (*1, *2, *3) a haplotypů VKORC1 ( 1639G>A; A/A, A/B, B/B). Celkově můžeme najít v populaci teoreticky 18 možných kombinací. Pro praxi je však výhodnější rozdělení do skupin podle celkového počtu variantních alel (VA) obou genů, tj. 0 až 4 VA, a následná kategorizace do skupin dle předpokládané denní dávky warfarinu (0,5–2 mg, 3–4 mg a 5–7 mg denně). Přesnost predikce (koeficient determinace R2) takto určené denní dávky warfarinu je i s 20% odchylkou 43 % [28].
Situace v ČR je odlišná. Registrované léčivé přípravky (WARFARIN ORION a WARFARIN PMCS) informace o potřebě nižších dávek u Asiatů neobsahují. Dokonce není zmíněn ani význam znalosti genotypů. Obvyklou iniciální dávkou je dle SPC v běžné klinické praxi 5 mg warfarinu. Za určitých podmínek dokonce 10 mg. S touto dávkou naproti tomu v USA registrované přípravky nepočítají. Naopak při neznalosti genotypů CYP2C9 a VKORC1 je dokonce doporučena dávka jen 2−5 mg denně. Problematika rozdílných informací uvedených v SPC se nicméně netýká pouze přípravků registrovaných v ČR a USA. Ačkoliv je léčivý přípravek Coumadin dodáván současně i na německý trh, ani zde zmínku o potřebě nižších dávek u Asiatů či zohlednění genotypů CYP2C9 a VKORC1 nenajdeme [29].
Algoritmy pro výpočet dávky warfarinu
Kromě obvyklého stanovení iniciální
dávky warfarinu na základě SPC, výchozího INR a dalších
faktorů (věk, tělesná hmotnost, současně užívaná léčiva
apod.) existuje řada výpočtů (algoritmů), které se
snaží, zejména na základě inkorporace nových
farmakogenetických znalostí, lépe predikovat dávku a zkrátit
dobu do dosažení stabilních hodnot INR. V posledních
letech se tedy výzkum orientuje na převedení farmakogenetiky
do klinické praxe. Výsledkem snah je nalezení co možná
nejpřesnějšího výpočtu dávky warfarinu, viz graf 2.
Existuje několik teoretických přístupů s rozdílnou mírou
spolehlivosti: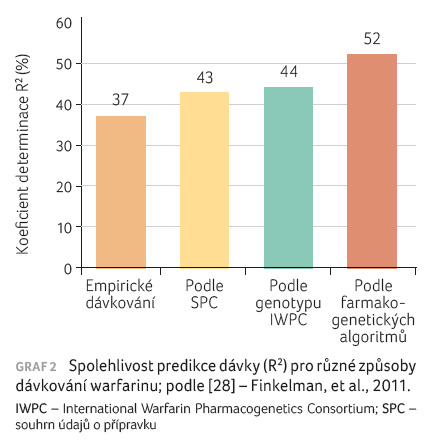
- na základě znalosti genotypů, tj. využití výše uvedené tab. 4 (R2 = 43 %) [28];
- individualizace výpočtu dávky na základě farmakogenetických a dalších faktorů (např. algoritmy dle Sconceové – R2 = 54,2 %, dle Gageho – pro kavkazskou populaci R2 = 57 % a pro černošskou populaci R2 = 31 %, dle Andersona – R2 = 44,6 %) [30−32];
- úprava dávky warfarinu dle algoritmu s využitím farmakogenetických dat a aktuální naměřené hodnoty INR. Taková metoda pak dosahuje nejvyšší míry spolehlivosti, koeficient determinace R2 se pohybuje okolo 70 % [33].
Spolehlivost predikce dávky pomocí algoritmů byla potvrzena zejména u osob s potřebou velmi nízkých (< 21 mg/týden) a vysokých (> 49 mg/týden) dávek. Míra přesnosti predikce nebyla signifikantně ovlivněna tělesnou hmotností. Naopak věk hrál významnou roli, neboť vyšší míra spolehlivosti byla potvrzena u osob starších 80 let, a dokonce nejnižší u osob ve věku do 40 let [34].
Algoritmus TOMATO
Ačkoliv existuje celosvětově celá řada algoritmů, budou v následujícím textu stručně zmíněny pouze tři z nich. V prvním případě se jedná o algoritmus vytvořený v podmínkách České republiky. Dosahuje vysoké hodnoty přesnosti predikce dávky. S koeficientem determinace R2 62,3 % se řadí mezi jeden z nejspolehlivějších způsobů výpočtu dávky, a to i ve srovnání s dosud publikovanými zahraničními algoritmy. Výpočet dávky je volně dostupný na webové adrese www.warfarindose.com [35]. Na vzniku tohoto algoritmu se podílel MUDr. Aleš Tomek, Ph.D., (Neurologická klinika 2. LF UK a FN Motol) v rámci své disertační práce [36].
Výpočet dávky warfarinu podle algoritmu TOMATO [35]:
√Denní dávka, mg = (2,049 - (0,016*[věk, roky]) + (0,007* [výška, cm]) + (0,004* [hmotnost, kg]) - (0,227* [CYP2C9*2, počet alel 0–2]) - (0,296* [CYP2C9*3, počet alel 0–2]) - (0,340* [VKORC, A/A = 0, A/B = 1, B/B = 2]) - (0,397* léčba amiodaronem [ne = 0, ano = 1])
Algoritmus WARFARINDOSING
Rovněž druhý způsob výpočtu dávky warfarinu je volně dostupný na internetu (www.warfarindosing.org) [37]. Data využitá k tvorbě tohoto algoritmu vycházejí z údajů od více než 1 000 pacientů. Pro výpočet iniciační dávky warfarinu je popisována hodnota koeficientu determinace 54 %. Při opakovaném využití výpočtu (po doplnění aktuálního INR po 3. a 4. dávce) se spolehlivost ještě zvyšuje [33]. Kromě standardních genotypů CYP2C9 (tj. CYP2C9*2 a CYP2C9*3) a VKORC1 je výpočet obohacen o genotypy CYP2C9*5 a *6, CYP4F2 a GGCX. (Pozn. GGCX označuje gama glutamyl karboxylázu, která je umístěna v endoplazmatickém retikulu a vede k oxidaci vitamin K 2,3 epoxidu, jenž je nezbytný pro aktivaci koagulačních faktorů II, VII, IX a X, v případě polymorfismu genu pro GGCX je variantní alela spojena s potřebou redukce dávky warfarinu o 6 % [38].)
Podle doporučení Clinical Pharmacogenetics Implementation Consortium (CPIC) (https://cpicpgx.org) z listopadu 2013, které vychází ze společného projektu PharmGKB (https://www.pharmgkb.org/) a Pharmacogenomics Research Network (http://www.pgrn.org/), se jedná o nejspolehlivější způsob výpočtu dávky warfarinu [39]. To platí především pro kavkazskou a asijskou populaci (R2 = 57 %). U populace Afroameričanů je spolehlivost algoritmu podstatně nižší (R2 = 31 %) [40]. U této populace by mohlo být řešením obohacení výpočtu o polymorfismy CYP2C9*8 a *11, případně SNP genu pro kalumenin (regulátor VKORC1), kdy nositelé variantní alely G vyžadují o 14,5 % vyšší dávku warfarinu [41].
Algoritmus Mezinárodního konsorcia pro farmakogenetiku warfarinu
Posledním z vybraných algoritmů, který se svým rozsahem zvažovaných parametrů nachází mezi výše uvedenými, je algoritmus IWPC (International Warfarin Pharmacogenetics Consortium). Jedná se o algoritmus, který byl součástí doporučení CPIC z října roku 2011 [5]. Oproti předchozímu algoritmu doporučovanému v současnosti chybí inkorporace genotypu CYP4F2 a GGCX a zároveň možnost upřesnění dávky warfarinu na základě doplněných aktuálně naměřených hodnot INR pacienta.
Přínos farmakogenetiky a algoritmů pro klinickou praxi
Pro každodenní klinickou praxi je důležitou otázkou skutečný přínos algoritmů využívajících farmakogenetické poznatky. Řada klinických studií, které se zabývaly hodnocením rizik a výhod algoritmů, přinesla pozitivní výsledky především ve vztahu ke zkrácení doby pro dosažení stabilního INR, prodloužení doby v terapeutickém rozmezí INR a pro snížení rizika podání příliš vysokých či nízkých dávek během počátečního období [42]. Dle očekávání bylo prokázáno jak snížení rizika krvácení, tak tromboembolických komplikací [43].
Na druhou stranu existují i potenciální rizika. Přílišná důvěra ve vypočtenou dávku warfarinu pomocí algoritmů může vést k podcenění a k následnému nedostatečnému monitorování INR. Dokonce se uvažuje o snížení adherence k léčbě u pacientů, kteří vyžadují nízké dávky warfarinu. Proti využití uvedených algoritmů rovněž stojí cena a dostupnost genotypizace, uvedení nových perorálních antikoagulancií na trh a v neposlední řadě rovněž závěry některých studií, které přínos využití algoritmů zpochybňují [44]. Významným omezením je také skutečnost, že algoritmy jsou konstruovány většinou pro rozmezí hodnot INR 2−3. Další výzkum v této oblasti je tedy nutný. Příkladem může být studie, která byla započata na konci roku 2016 a která je cílena na zhodnocení přínosu farmakogenetikou podmíněných algoritmů u warfarinizovaných pacientů s krátkým časem setrvání v terapeutickém rozmezí INR [45].
Implementace nových znalostí do SPC
Znalost rozdílné citlivosti na základě genotypu či etnicity je z výše uvedených důvodů přínosná. Pozornost si s ohledem na potřebu nižších dávek a zastoupení v naší populaci bezesporu zaslouží pacienti asijského původu. Při obvyklém úvodním dávkování (5 mg/den) jsou tito pacienti více ohroženi rizikem krvácení. Jak vyplývá ze statistik Českého statistického úřadu, vietnamská menšina je s počtem asi 57 000 obyvatel třetí nejpočetnější skupinou cizinců žijících na území ČR [46]. Implementace nových poznatků do SPC u nás registrových léčivých přípravků je tedy nasnadě. Alespoň v minimálním rozsahu by v uvedených textech měla zaznít informace o vlivu genotypu a současně o potřebě nižších dávek u Asiatů. Výsledkem by pak bylo zvýšení účinnosti a bezpečnosti zdravotní péče při používání starého známého warfarinu.
Poděkování patří PharmDr. Marcele Heislerové, Ph.D., vedoucí Katedry lékárenství IPVZ, za její podporu a motivaci k sepsání tohoto článku.
Seznam použité literatury
- [1] Sekce pro trombózu a hemostázu České hematologické společnosti ČLS JEP, Kessler P. Farmakogetika warfarinu – Doporučení pro klinickou praxi (2006). Dostupné na: http://www.thrombosis.cz/sources/Guidelines‑Warfarin_farmakogenetika_STH _III062.pdf
- [2] Johnson JA. Ethnic Differences in Cardiovascular Drug Response Potential Contribution of Pharmacogenetics; Circulation 2008; 118: 1383−1393.
- [3] Scott SA, Khasawneh R, Peter I. Combined CYP2C9, VKORC1 and CYP4F2 frequencies among racial and ethnic groups. Pharmacogenomics 2010; 11: 781−791.
- [4] Lam MPS, Cheung BMY. The pharmacogenetics of the response to warfarin in Chinese. Br J Clin Pharmacol 2012; 73: 340–347.
- [5] Johnson JA, Gong L, Whirl‑Carrillo M. Implementation Consortium Guidelines for CYP2C9 and VKORC1 genotypes and warfarin dosing Clinical Pharmacogenetics 2011; 90: 625−629.
- [6] Tomek A, Maťoška V, Kumstýřová T. Farmakogenetické vyšetření a antikoagulační léčba warfarinem, Medicína po promoci 2011; 12 (Supl 2): 1−5.
- [7] Lam MPS, Cheung BMY. The pharmacogenetics of the response to warfarin in Chinese. Br J Clin Pharmacol 2012; 73: 340–347.
- [8] Dang MT, Hambleton J, Kayser SR. The influence of ethnicity on warfarin dosage requirement. Ann Pharmacother 2005; 39: 1008−1012.
- [9] Doporučení České angiologické společnosti ČLS JEP z roku 2014: http://www.csth.cz/soubory/Zilni_tromboza_doporuceni.pdf
- [10] Guyatt GH, Akl EA, Crowther M. Executive Summary: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence‑Based Clinical Practice Guidelines. Chest 2012; 141 (Suppl): 7S−47S.
- [11] Flockhart DA, O’Kane D, Williams MS. Pharmacogenetic testing of CYP2C9 and VKORC1 alleles for warfarin; Genetics in Medicine 2008; 10: 139–150.
- [12] Sanderson S, Emery J, Higgins J. CYP2C9 gene variants, drug dose, and bleeding risk in warfarin‑treated patients: A HuGEnet™ systematic review and meta‑analysis; Genet Med 2005: 7: 97–104.
- [13] Matýšková M, Čech Z. Warfarin a farmakogenetika. Klin Biochem Metab 2009; 17: 215–219.
- [14] https://www.snpedia.com/index.php/Rs1799853
- [15] https://www.snpedia.com/index.php/Rs1057910
- [16] Buzková H, Pechandová K, Slanař O. Genetický polymorfismus cytochromu CYP2C9 v české populaci. Klin Biochem Metab 2007; 15: 102–105.
- [17] Takahashi H, Wilkinson GR, Nutescu EA. Different contributions of polymorphisms in VKORC1 and CYP2C9 to intra‑ and inter‑population differences in maintenance dose of warfarin in Japanese, Caucasians and African‑Americans. Pharmacogenet Genomics 2006; 16: 101–110.
- [18] Limdi NA, Arnett DK, Goldstein JA. Influence of CYP2C9 and VKORC1 on warfarin dose, anticoagulation attainment and maintenance among European American and African Americans; Pharmacogenomics 2008; 9: 511–526.
- [19] Liu Y, Jeong HY, Takahashi H, Drozda K. Decreased warfarin clearence with the CYP2C9 R150H (*8) polymorphism; Clin Pharmacol Ther 2012; 91: doi:10.1038/clpt.2011.269.
- [20] Daly AK, Rettie AE, Fowler DM, Miners JO. Pharmacogenomics of CYP2C9: Functional and Clinical Considerations; J Pers Med 2018; 8: doi:10.3390/jpm8010001
- [21] https://www.pharmgkb.org/label/PA166104776
- [22] Schelleman H, Chen Z, Kealey C. Warfarin response and vitamin K epoxide reductase complex 1 in African Americans and Caucasians. Clin Pharmacol Ther 2007; 81: 742–747.
- [23] You JH, Chan FW, Wong RS, Cheng G. Is INR between 2.0 and 3.0 the optimal level for Chinese patients on warfarin therapy for moderate intensity anticoagulation? Br J Clin Pharmacol 2005; 59: 582–587.
- [24] Suzuki S, Yamashita T, Kato T. Incidence of major bleeding complication of warfarin therapy in Japanese patients with atrial fibrillation. Circ J 2007; 71: 761–765.
- [25] http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/2007/ucm108967.htm
- [26] Souhrn údajů o přípravku NDC 0590‑0324‑35 Coumadin 5 mg tbl. Revize textu 9/2016. Dostupné na: http://www.accessdata.fda.gov/drugsatfda_docs/Label/2010/009218s108lbl.pdf
- [27] Souhrn údajů o přípravku NDC 0832‑1216‑00 Jantoven 5mg tbl. Dostupné na: http://www.upsher‑smith.com/wp‑content/uploads/Jantoven‑PI.pdf, revize 10/2016.
- [28] Finkelman BS, Gage BF, Johnson JA, et al. Genetic warfarin dosing: tables versus algorithms. J Am Coll Cardiol 2011; 57: 612–618.
- [29] https://medikamio.com/de‑de/medikamente/coumadin‑5‑mg/pil
- [30] Sconce EA, Khan TI, Wynne HA, et al. The impact of CYP2C9 and VKORC1 genetic polymorphism and patient characteristics upon warfarin dose requirements: proposal for a new dosing regimen. Blood 2005; 106: 2329–2333.
- [31] Gage BF, Eby C, Johnson JA, et al. Use of pharmacogenetic and clinical factors to predict the therapeutic dose of warfarin. Clin Pharmacol Ther 2008; 84: 326–331.
- [32] Anderson JL, Horne BD, Stevens SM, et al. Randomized trial of genotype‑guided versus standard warfarin dosing in patients initiating oral anticoagulation. Circulation 2007; 116: 2563–2570.
- [33] Horne BD, Lenzini PA, Wadelius M, et al. Pharmacogenetic warfarin dose refinements remain significantly influenced by genetic factors after one week of therapy. Tromb Haemost 2012; 107: 232−240.
- [34] Tomek A, Kolářová T, Lacinová Z. Přesnost farmakogenetických algoritmů pro výpočet denní dávky warfarinu. Cesk Slov Neurol N 2013; 76/109: 596−602.
- [35] www.warfarindose.com
- [36] Tomek A. Farmakogenetika warfarinu. Praha, 2014. 129 stran, 11 příloh. Disertační práce. Univerzita Karlova v Praze, 2. lékařská fakulta, Neurologická klinika 2. LF UK a FN Motol. Školitel Goetz P.
- [37] www.warfarindosing.org
- [38] King CR, Deych E, Milligan P. Gamma‑glutamyl carboxylase and its influence on warfarin dose; Thromb Haemost 2010; 104: 750–754.
- [39] https://www.pharmgkb.org/chemical/PA451906
- [40] Gage BF, Eby C, Johnson JA, Deych E. Use of pharmacogenetic and clinical factors to predict the therapeutic dose of warfarin. Clin Pharmacol Ther 2008; 84: 326−331.
- [41] Voora D, Koboldt DC, King CR. A polymorphism in the VKORC1‑regulator calumenin predicts higher warfarin doses in African‑Americans; Clin Pharmacol Ther 2010; 87: 445–451.
- [42] Caraco Y, Blotnick S, Muszkat M. CYP2C9 genotype‑guided warfarin prescribing enhances the efficacy and safety of anticoagulation: a prospective randomized controlled study. Clin Pharmacol Ther 2008; 83: 460–470.
- [43] Oden A, Fahlen M. Oral anticoagulation and risk of death: a medical record linkage study. BMJ 2002; 325: 1073–1075.
- [44] Kimmel SE, French B, Kasner SE. A pharmacogenetic versus a clinical algorithm for warfarin dosing. N Engl J Med 2013; 369: 2283−2293.
- [45] Marcatto LR, Sacilotto L, Bueno CT. Evaluation of a pharmacogenetic‑based warfarin dosing algorithm in patients with low time in therapeutic range – study protocol for a randomized controlled trial; BMC Cardiovascular Disorders 2016; 16: 224.
- [46] ČSÚ – Cizinci v ČR podle státního občanství v letech 1994−2016 (k 31. 12.). Dostupné na: https://www.czso.cz/csu/cizinci/4‑ciz_pocet_cizincu#cr