Edoxaban v klinických studiích a v klinické praxi
Souhrn:
Edoxaban – přímý perorální inhibitor faktoru Xa – má prokázaný antikoagulační i antiagregační účinek a je k dispozici v dávkách 15 mg, 30 mg a 60 mg. Ve studii ENGAGE s 21 105 pacienty prokázal snížení výskytu primárního cílového ukazatele (cévní mozkové příhody a systémové embolie). Při léčbě warfarinem se primární cílový ukazatel vyskytl u 1,50 % nemocných, při podávání vysoké dávky edoxabanu u 1,18 % (p < 0,001 pro non‑inferioritu) a při podávání nízké dávky edoxabanu byl primární cílový ukazatel zjištěn u 1,61 % pacientů (p = 0,005 pro non‑inferioritu). Roční výskyt krvácení při podávání warfarinu byl 3,43 %, při podávání vysoké dávky edoxabanu 2,75 % (p < 0,001) a v případě léčby nízkou dávkou edoxabanu 1,61 % (p < 0,001). Ve studii HOKUSAI, která zahrnula 4 951 nemocných s hlubokou žilní trombózou a 3 319 nemocných s plicní embolií, byl edoxaban non‑inferiorní k warfarinu. Hlavním ukazatelem účinnosti byl počet nemocných, u nichž došlo k recidivě hluboké žilní trombózy nebo k plicní embolii; jednalo se o 130 ze 4 118 (3,2 %) nemocných ve skupině s léčbou edoxabanem a o 146 ze 4 122 (3,5 %) nemocných léčených warfarinem (p < 0,001 pro non‑inferioritu). Edoxaban podávaný 1× denně byl non‑inferiorní u nemocných s hlubokou žilní trombózou a/nebo s plicní embolií se signifikantně nižším výskytem krvácení.
Key words: edoxaban – atrial fibrillation – venous thrombosis – lung embolism.
Summary:
Edoxaban – a direct inhibitor of factor Xa – has a confirmed anticoagulant and antiaggregatory effect and is available in doses 15, 30, and 60 mg. Edoxaban showed a decrease in primary endpoint (stroke and systematic embolism) in 21 102 patients in the ENGAGE study. The primary endpoint occurred in 1.50% patients treated with warfarin, 1.18% (p < 0,001 for non‑inferiority) on high dose edoxaban, and 1.61% (p = 0.005 for non‑inferiority) on low dose edoxaban. The annual incidence of bleeding was 3.43% on warfarin, 2.75% (p < 0.001) on high dose edoxaban, and 1.61% (p < 0.001) on low dose edoxaban. Edoxaban was non‑inferior to warfarin in the HOKUSAI clinical trial comprising 4 951 patients with deep venous thrombosis and 3 319 patients with lung embolism. The primary endpoint was new deep venous thrombosis or lung embolism, which appeared in 130 of 4 118 (3.2%) patients treated with edoxaban and in 146 of 4 122 (3.5%) patients treated with warfarin (p < 0.001 for non‑inferiority). Edoxaban was non‑inferior in patients with deep venous thrombosis and/or lung embolism with lower incidence of bleeding.
Úvod
Možnosti ovlivnění krevního srážení jsou využívány vědomě nebo bezděčně již od starověku. Avšak až od minulého století jsou cílevědomě a systematicky klinicky uplatňovány a ještě později – až od poloviny století – byl jejich účinek také systematicky vyhodnocován.
Mezi klasická antikoagulancia či antitrombotika patří heparin a kumariny a tento arzenál doplňuje ještě nejvýznamnější antiagregans – kyselina acetylsalicylová (ASA). První dvě skupiny léčiv jsou dominantně využívány při žilním tromboembolismu, zatímco ASA je určena spíše k řešení tepenných afekcí. Navíc se v posledních letech objevila dlouho očekávaná perorální a specifická, resp. specifičtěji působící antitrombotika s účinkem přímé inhibice trombinu (FIIa) nebo faktoru Xa (FXa).
Klasické léky působící proti trombóze jsou v klinickém užívání téměř sedmdesát let; první z nich – heparin – použili Murray a Best v roce 1938, použití warfarinu jako v pořadí druhého antitrombotika bylo prezentováno v roce 1955. Nicméně jak warfarin, tak i heparin mají celou řadu vlastností, které limitují jejich antitrombotické působení nebo je činí pro běžnou klinickou praxi nevýhodnými.
Warfarin je nenahraditelný u nemocných s fibrilací síní a clopidogrel je nenahraditelný po akutním koronárním syndromu. Tak zněla doporučení v učebnicích kardiologie až do srpna 2009 [1]. Po kongresu Evropské kardiologické společnosti v Barceloně v roce 2009 bylo vše jinak. Na tomto kongresu byly předneseny výsledky dvou velkých multicentrických studií – RE‑LY (Dabigatran versus warfarin in patients with atrial fibrillation) a PLATO (Ticagrelor versus clopidogrel in patients with acute coronary syndromes), které zahájily éru nové antikoagulační léčby fibrilace síní a nové antiagregační léčby po akutním koronárním syndromu. Studie ukázaly, že warfarin může být u nemocných s fibrilací síní nahrazen modernějším přípravkem a clopidogrel může být u pacientů po akutním koronárním syndromu nahrazen účinnější antiagregační látkou. Od té doby jsme získali dostatek důkazů o přínosu tzv. nových antikoagulancií [4,7–9,16].
Americká kardiologická společnost (American Heart Association, AHA) označila studie s léčivy, která mají nahradit warfarin u nemocných s fibrilací síní, za jeden z deseti nejvýznamnějších objevů roku 2010. Jednalo se o studie RE‑LY, ROCKET AF a ARISTOTLE [1–4,10,11,13,14].
Studie ENGAGE
Další velká klinická studie – ENGAGE – se zabývala léčbou edoxabanem a byla ukončena v roce 2013 [5,12]. Studie ENGAGE randomizovala do dvojitě zaslepené fáze celkem 21 105 pacientů, z toho 1 173 pacientů v České republice. Národním koordinátorem studie pro Českou republiku byl prof. MUDr. Jindřich Špinar, CSc., FESC, největším centrem této studie na světě se 160 pacienty s fibrilací síní a s vysokým rizikem vzniku cévní mozkové příhody (CMP) se stala Interní kardiologická klinika FN Brno, koordinátorem studie byla doc. MUDr. Růžena ![Obr. 1 Uspořádání studie ENGAGE; podle [5] – Giugliano, et al., 2013. CMP – cévní mozková příhoda; FS – fibrilace síní; CHADS2 – skóre rizika vzniku tromboembolie při FS; SE – systémová embolie * Dávka snížena na 50 % při clearance kreatininu 30–50 ml/min; při tělesné hmotnosti ≤ 60 kg; při léčbě silným inhibitorem P-glykoproteinu](https://www.remedia.cz/photo-a-30773---.jpg) Lábrová, Ph.D. Sledovány byly dvě dávky edoxabanu, průměrná doba sledování byla 2,8 roku. Primární cílový ukazatel studie představovala CMP a systémová embolizace, primárním bezpečnostním cílovým ukazatelem bylo krvácení.
Lábrová, Ph.D. Sledovány byly dvě dávky edoxabanu, průměrná doba sledování byla 2,8 roku. Primární cílový ukazatel studie představovala CMP a systémová embolizace, primárním bezpečnostním cílovým ukazatelem bylo krvácení.
Uspořádání studie ENGAGE ukazuje obr. 1, základní charakteristiku souboru pacientů při vstupu do studie uvádí tab. 1. Léčbu, kterou pacienti užívali v době randomizace do studie ENGAGE, ukazuje tab. 2.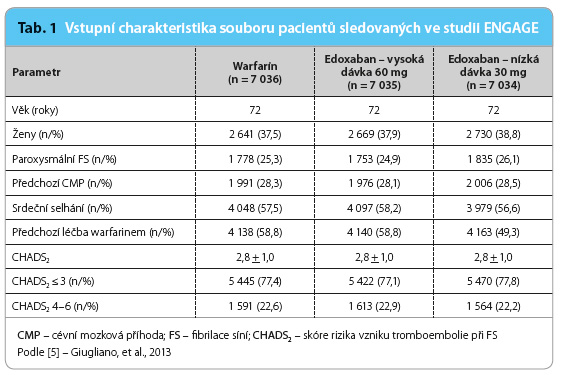
Roční výskyt primárního cílového ukazatele byl 1,50 % u pacientů léčených warfarinem, 1,18 % při podávání vysoké dávky edoxabanu (p < 0,001 pro non‑inferioritu) a 1,61 % při podávání nízké dávky edoxabanu (p = 0,005 pro non‑inferioritu). Roční výskyt krvácení byl u pacientů užívajících warfarin 3,43 %, v případě užívání vysoké dávky edoxabanu 2,75 % (p < 0,001) a při léčbě nízkou dávkou 1,61 % (p < 0,001).
Hlavní výsledky studie ENGAGE ukazuje tab. 3 a graf 1.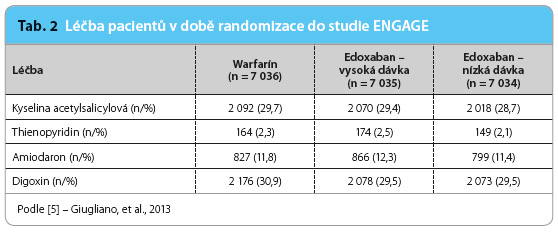
![Graf 1 Primární cílové ukazatele studie ENGAGE; podle [5] – Giugliano, et al., 2013. CI – confidence interval, interval spolehlivosti](https://www.remedia.cz/photo-a-30776---.jpg) Hlavními přednostmi studie ENGAGE AF‑TIMI 48 je velmi rozsáhlý vzorek nemocných, dlouhodobé sledování s minimem pacientů, kteří opustili studii, a velmi vysoký počet nemocných, kterým byl podáván warfarin v tzv.
Hlavními přednostmi studie ENGAGE AF‑TIMI 48 je velmi rozsáhlý vzorek nemocných, dlouhodobé sledování s minimem pacientů, kteří opustili studii, a velmi vysoký počet nemocných, kterým byl podáván warfarin v tzv. 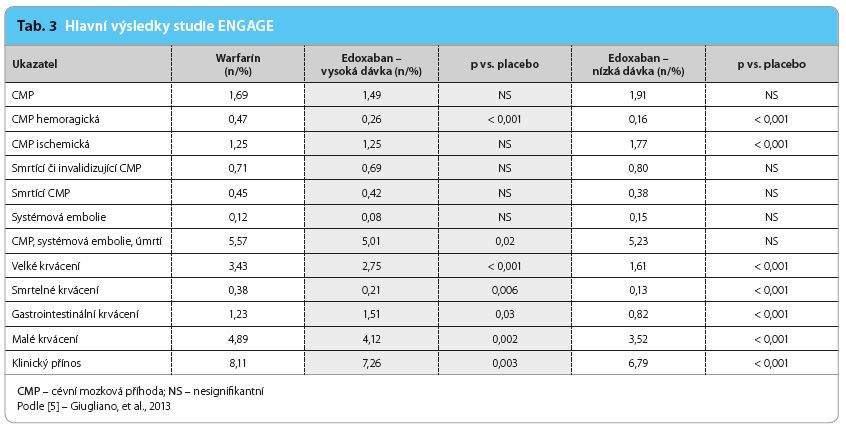 terapeutickém okně (68,4 %). Nedostatkem je celkově nízký výskyt primárního cílového ukazatele i u nemocných léčených warfarinem. Celkově je třeba zdůraznit, že obě dávky edoxabanu byly non‑inferiorní v prevenci CMP a systémové embolie a jejich podávání bylo provázeno výrazně nižším výskytem krvácení a úmrtí z kardiovaskulárních příčin.
terapeutickém okně (68,4 %). Nedostatkem je celkově nízký výskyt primárního cílového ukazatele i u nemocných léčených warfarinem. Celkově je třeba zdůraznit, že obě dávky edoxabanu byly non‑inferiorní v prevenci CMP a systémové embolie a jejich podávání bylo provázeno výrazně nižším výskytem krvácení a úmrtí z kardiovaskulárních příčin.
Platná doporučení
Výsledky velkých klinických studií s novými perorálními antikoagulancii jsou pak zabudovány i do upravených doporučení České asociace pro srdeční rytmus ČKS pro používání tzv. non‑vitamin K antagonistů i u pacientů s fibrilací síní, kde se jako nová a aktuální jeví především pasáž souběhu koronární intervence a fibrilace síní [6]:
- Neexistuje dosud jediná klinická studie, jež by porovnala pacienty léčené warfarinem a pacienty léčené novými antikoagulancii, kteří podstoupili intervenční léčbu. Stejně tak neexistují data pro kombinaci nových perorálních antikoagulancií s novými antiagregancii, jako je ticagrelor a prasugrel.
- Kombinace monoagregace i duální antiagregace novými perorálními antikoagulancii i s warfarinem výrazně zvyšuje riziko krvácení. Délka a intenzita antiagregační i antikoagulační léčby by proto měla být individualizována se zvažováním přínosu a rizik pro pacienta. Používání skórovacích systémů, jako je CHA2DS2‑VASc či HAS‑BLED, je doporučeno.
- U pacientů s elektivní perkutánní transluminální koronární angioplastikou (percutaneous transluminal coronary angioplasty, PTCA) je doporučeno podávat tzv. plnou triple terapii (duální antiagregace + antikoagulace) po dobu jednoho měsíce za použití kovového stentu (bare metal stent, BMS) nebo moderních stentů typu BMS s následným snižováním dávek antikoagulace či antiagregace.
- Po jednom roce je doporučeno pokračovat pouze v monoterapii novými perorálními antikoagulancii, riziko krvácení může tuto dobu zkrátit i na 3–6 měsíců.
- U pacientů s chronickou ischemickou chorobou srdeční (> 1 rok v anamnéze) a se současnou fibrilací síní by samotná antikoagulační léčba s preferencí nových perorálních antikoagulancií měla být upřednostněna.
- Obecně by u všech nemocných s ischemickou chorobou srdeční a s fibrilací síní měla po jednom roce souběhu antiagregační a antikoagulační léčby pokračovat pouze léčba antikoagulační, s výjimkou velmi rizikových pacientů [6].
Studie HOKUSAI
Další významnou oblastí, kde jsou nová perorální antikoagulancia zkoušena, je léčba hluboké žilní trombózy a plicní embolie. Studie provedená s edoxabanem dostala název HOKUSAI [15]. Nemocným byl v úvodu léčby podán heparin a následně dávka 30 mg nebo 60 mg edoxabanu. Plánovaná délka léčby byla 3–12 měsíců. Celkem bylo do studie zařazeno 4 951 nemocných s hlubokou žilní trombózou a 3 319 nemocných s plicní embolií. Edoxaban byl non‑inferiorní k warfarinu. Hlavním ukazatelem účinnosti byl počet nemocných, u nichž došlo k recidivě hluboké žilní trombózy nebo k plicní embolii; jednalo se o 130 ze 4 118 (3,2 %) nemocných léčených edoxabanem a o 146 ze 4 122 (3,5 %) nemocných léčených warfarinem (p < 0,001 pro non‑inferioritu). Bezpečnostní cílový ukazatel se vyskytl u 349 nemocných (8,5 %) ze skupiny s edoxabanem a u 423 (10,3 %) nemocných ze skupiny s léčbou warfarinem (p = 0,004 pro superioritu). Edoxaban podávaný 1× denně po úvodní léčbě heparinem byl non‑inferiorní u širokého spektra nemocných s hlubokou žilní trombózou a/nebo s plicní embolií se signifikantně nižším výskytem krvácení.
Shrnutí
Edoxaban – přímý perorální inhibitor FXa – má prokázaný antikoagulační i antiagregační účinek a je k dispozici v dávkách 15 mg, 30 mg a 60 mg a má schválenou indikaci pro léčbu nevalvulární fibrilace síní a hluboké žilní trombózy s plicní embolií.
Nejčastějším nežádoucím účinkem léčby edoxabanem (až u 10 % nemocných) je krvácení do kůže a do měkkých tkání, epistaxe a vaginální krvácení. Dalšími možnými nežádoucími účinky jsou anemie, vyrážka a zhoršení jaterních funkcí. Edoxaban nesmí být podáván těhotným ženám a není schválen v kombinaci s jinými antikoagulancii.
Americký Úřad pro potraviny a léky (Food and Drug Administration, FDA) definitivně schválil edoxaban ve výše uvedených indikacích dne 8. ledna 2015 pod názvem Savaysa®, Evropská léková agentura (European Medicines Agency, EMA) a Výbor pro humánní léčivé přípravky (Committee for Medicinal Products for Human Use, CHMP) schválily užívání edoxabanu v daných indikacích v Evropě dne 24. dubna 2015 pod názvem Lixiana®. Tento krok byl definitivně potvrzen Evropskou komisí (European Commission, EC) dne 25. června 2015. V České republice ani v polovině roku 2016 tento lék není k dispozici.
Práce byla podpořena projektem (Ministerstva zdravotnictví ČR) koncepčního rozvoje výzkumné organizace 65269705 (FN Brno).
Seznam použité literatury
- [1] Camm AJ, Kirchhof P, Lip GY, et al. Guidelines for the management of atrial fibrillation. Eur Heart J 2010; 31: 2369–2429.
- [2] Camm AJ, Lip GY, De Caterina R, et al. 2012 focused update of the ESC Guidelines for the management of atrial fibrillation: an update of the 2010 ESC Guidelines for the management of atrial fibrillation. Eur Heart J 2012; 33: 2719–2747.
- [3] Conolly SJ, Ezekowitz MD, Phil D, et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361: 1139–1151.
- [4] Ezekowitz MD, Conolly S, Pareth A, et al. Rationale and design of RE LY randomised evaluation of long term anticoagulant therapy, warfarin compared with dabigatran. Am Heart J 2009; 157: 805–810.
- [5] Giugliano RP, Ruff CT, Braunwald E, et al, for the ENGAGE TIMI 48 Investigators: Edoxaban versus warfarin in Patients with Atrial fibrillation. N Engl J Med 2013; 369: 2093–2104.
- [6] Heidbuchel H, Verhamme P, Alings M, et al. Updated European Heart Rhythm Association Practical Guide on the use of non vitamin K antagonist anticoagulants in patients with non valvular atrial fibrillation. Europace 2015; 17: 1467–1507.
- [7] Karetová D, Bultas J. Nová perorální antitrombotika v prevenci a léčbě trombembolizmu. Kardiologická revue 2012; 14: 88–92.
- [8] Lábrová R. Fibrilace síní – kardiovaskulární epidemie – editorial. Vnitř Lék 2008; 54: 12–13.
- [9] Lábrová R, Špinar J. Antikoagulační terpaie a fibrilace síní. Kardiologická revue 2012; 14: 79–87.
- [10] ROCKET AF Study Investigators. Rivaroxaban once daily, oral, direct factor Xa inhibition compared with vitamin K antagonism for prevention of stroke and Embolism Trial in Atrial Fibrillation: rationale and design of the ROCKET AF study. Am Heart J 2010; 159: 340–347.
- [11] Špinar J, Vítovec J. Komu zvoní hrana. Kardiologická revue 2009; 11: 197–199.
- [12] Špinar J, Vítovec J. Zasnouben se špičkovou kočkou aneb ENGAGED to TOPCAT. Kardiologická revue 2013; 15: 205–206.
- [13] Špinar J, Vítovec J, Špinarová L, Lábrová R. Rivaroxaban v léčbě fibrilace síní. Farmakoterapie 2013; 9: 20–25.
- [14] Táborský M, Heinc P, Hrčková Y. Dabigatran etexilát v klinické praxi pro prevenci tromboembolických příhod u nemocných s fibrilací síní. Vnitř Lék 2012; 58: 769–778.
- [15] The Hokusai VTE Investigators: Edoxaban versus Warfarin for the Treatment of Symptomatic Venous Thromboembolism. N Engl J Med 2013; 369: 1406–1415.
- [16] Wallentin L, Becker RC, Budaj A for the PLATO Investigators: Ticagrelor versus Clopidogrel in Patients with Acute Coronary Syndromes. N Engl J Med 2009; 361: 1045–1057.