Postavení cetuximabu v léčbě pokročilých nádorů ORL oblasti
Zhoubné nádory otorinolaryngologické (ORL) oblasti zaujímají páté až šesté místo v četnosti celosvětového výskytu maligních tumorů a šesté místo v příčině úmrtí způsobené malignitou [1]. V posledních letech dochází k významným změnám v léčebných možnostech těchto nádorů. Současná léčba bývá často účinná v časných stadiích, většina nemocných však přichází s rozsáhlým onemocněním. Vezmeme-li v úvahu věkový výskyt (střední a zejména starší věk), je zřejmé, že nemocní trpí často komorbiditami. Společným rysem těchto nádorů je jejich tendence k lokálnímu šíření s časným vznikem lokoregionálních metastáz a pozdním vznikem vzdálených metastáz. 90–95 % těchto nádorů tvoří dlaždicobuněčný karcinom s různým stupněm diferenciace. Společné jsou i rizikové faktory. Jsou to zejména tabakismus (kouření cigaret, dýmky, doutníků, žvýkání tabáku), kouření marihuany a nadužívání alkoholu. Za kokan-cerogeny se považují i některé viry. Z uvedeného vyplývá, že část nemocných se rekrutuje z nižších sociálních tříd.
Léčba nádorů hlavy a krku je multimodální, ale optimální sled jednotlivých léčebných způsobů je dosud předmětem diskusí a klinických studií. Chirurgické řešení, vzhledem k anatomickým poměrům, může být zejména u pokročilých stavů mutilující (znetvořující). Chemoterapie i radioterapie jsou zatíženy toxickými průvodními jevy, zejména mukozitidou, včetně pozdních negativních jevů (xerostomie, dysfagie, fibróza).
V posledních letech se dosáhlo v léčbě nádorů ORL oblasti určitých pokroků, převážně díky novým léčebným koncepcím. Multidisciplinární léčebné protokoly, neoadjuvance pro místně pokročilé nádory, konkomitantní chemoradioterapie s cytostatickou indukcí nebo bez ní, záchovné protokoly a zcela nedávno biologická terapie přinášejí určitý pokrok a změnu léčebných náhledů.
Závažným problémem však stále zůstává léčba místně pokročilých nádorů. Jsou charakterizovány vysokým procentem recidiv a vysokou mortalitou. Lokoregionálními terapeutickými postupy se v tomto stadiu podaří vyléčit jen malé procento nemocných. Asi 30 % nádorů recidivuje místně a 25 % metastazuje vzdáleně. Zvláště špatnou prognózu má skupina nemocných s neresekabilním nádorem, z nichž umírá většina do 18 měsíců od stanovení diagnózy (tab. 1).
Zlepšení účinnosti a zároveň i tolerability v léčbě nádorů ORL oblasti se stalo současným imperativem. Významným pokrokem je zavádění biologické terapie, která se stává realitou v léčbě recidivujících a metastatických nádorů [2, 3].
Vývoj inhibitorů signální soustavy je atraktivní díky vazbě na preferenční nádorové specifické cíle a menší toxicitu. Signální cesty EGFR (epidermal growth factor receptor – receptor epidermálního růstového faktoru) a angiogeneze jsou významným cílem pro monoklonální protilátky. Významná je i skutečnost, že aplikace monoklonálních protilátek bývá doprovázena menšími vedlejšími účinky než léčba konvenčními cytostatiky.
Návrh protinádorové terapie s použitím inhibitorů EGFR pochází již z časných 80. let. Byl založen na autokrinní hypotéze autonomní proliferace nádorových buněk. Během následujících 20 let bylo vypracováno mnoho experimentálních i klinických prací, které podporovaly tuto hypotézu.
Receptor pro epidermální růstový faktor je považován za významný cíl protinádorové léčby, protože se účastní kontroly buněčné proliferace, diferenciace a metastazování. Monoklonální protilátky a nízko-molekulární inhibitory blokující EGFR byly již schváleny pro léčbu různých nádorů, zejména kolorektálního karcinomu, nemalobuněčného karcinomu plic a v současné době také karcinomu ORL oblasti.
EGFR je transmembránový protein s vnitřní části aktivity tyrozinkinázy, který vede signály z povrchu epiteliálních buněk do intracelulární domény. Funkce EGFR může být inhibována, resp. zablokována na extracelulární úrovni buď monoklonálními protilátkami, nebo konjugáty toxinů, které soutěží s přirozenými ligandy na vazebném místě receptoru, nebo specifickými inhibitory tyrozinkinázy postihujícími signální cesty EGFR.
Aberantní signalizace cestou EGFR hraje klíčovou roli v kancerogenezi nádorů ORL oblasti, které mají tendenci ve vysoké míře exprimovat EGFR. Vysoké hodnoty exprese EGFR korelují se stadiem onemocnění, zvyšujícím se objemem nádoru, kratším přežíváním a zvýšenou pravděpodobností recidivy. Exprese EGFR se v karcinomech ORL oblasti zjišťuje v mnohem vyšších hodnotách než v normálním epitelu [4, 5]. Tento jev předpokládá možnost relativně specifického zásahu pomocí antiEGFR protilátky (tab. 2).
Význam exprese EGFR dokumentovali Bentzen a kol. [6], kteří studovali vztah mezi expresí EGFR a možnými klinickými přednostmi akcelerované radioterapie. Akcelerovaná repopulace je u nádorů ORL hlavní příčínou místního relapsu po frakcionované radioterapii. Autoři [6] stanovili EGFR u 304 nemocných z 918, kteří byli randomizováni pro konvenční frakcionovanou radioterapii nebo hyperfrakcionovanou akcelerovanou radioterapii. Na rozdíl od pacientů s nízkou expresí EGFR bylo u nemocných s vysokou expresí EGFR dosaženo hyperfrakcionovanou akcelerovanou radioterapií významného benefitu.
První práce s použitím látek inhibujících EGFR dospěly k zajímavým výsledkům v léčbě recidivujícího a metastatického ORL onemocnění. Potvrdilo se, že inhibitory EGFR přinášejí možnost dalšího zlepšení léčebného účinku u nemocných s vysokou pravděpodobností recidivy. Výhodou je také snížení toxicity ve srovnání s cytostatickou léčbou [7, 8].
Protilátky, které se vážou na EGFR, popsal jako první Mendelsohn v roce 1983. Jeho laboratoř vyvinula několik antiEGFR monoklonálních protilátek (Mab), které inhibují in vivo a in vitro růst nádorových lidských buněčných linií exprimujících TGF-a a EGFR. Pro klinické použití byla vyvinuta chimérická lidská-myší Mab 225 – cetuximab, která obsahuje lidský IgG1. Cetuximab váže EGFR s větší afinitou než myší Mab a blokuje EGFR indukovanou autofosforylací EGFR v nádorových liniích in vitro.
Cetuximab
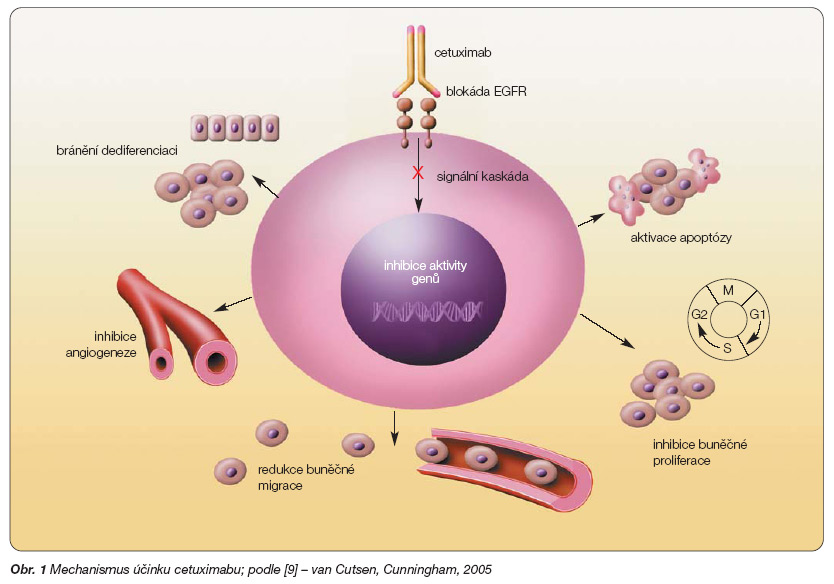
Cetuximab je chimérická IgG1 monoklonální protilátka, která se specificky váže na receptor EGFR v jeho extracelulární doméně. Kompetitivně vytěsňuje z vazby na receptor endogenní ligandy, jako je endogenní růstový faktor (EGF). V experimentálních modelech inhibuje nádorový růst, blokuje buněčnou proliferaci, indukuje apoptózu, inhibuje angiogenezi, indukuje diferenciaci a zabraňuje metastazování (obr. 1). Cetuximab zvyšuje protinádorový účinek současně podávaných cytostatik a záření. Po podání jedné dávky je poločas v séru 66–97 hodin, což umožňuje týdenní podávání. Farmakokinetika cetuximabu je stejná po jednorázovém i mnohočetném podání. Nejsou doklady o farmakokinetických interakcích mezi cetuximabem a současně podávanými cytostatiky [9].
První studie fáze I sledující cetuximab v monoterapii nebo v kombinaci s cisplatinou byly provedeny u nemocných s pokročilými epiteliálními nádory s pozitivní expresí EGFR [10]. V monoterapii se cetuximab podával v týdenních intervalech v dávkách 5 až 100 mg/m2. Při kombinaci s cisplatinou se dávky cetuximabu zvýšily na 400 mg/m2 týdně a cisplatiny na 100 mg/m2, později se pro toxicitu snížily dávky cisplatiny na 60 mg/m2 ve 4týdenním intervalu. Zaznamenaná toxicita byla: teploty, astenie, nauzea, kožní toxicita (seboroická dermatitida a akneiformní rash). Rash byl pozorován při dávkách vyšších než 100 mg/m2 a byl většinou jen prvního či druhého stupně. U čtyř z 19 léčených pacientů došlo k závažnější alergické reakci včetně urtiky a anafylaktické reakce. Ve studii v kombinaci s cisplatinou byly v 69 % (13 pacientů) zaznamenány dvě částečné odpovědi [10].
Cetuximab v léčbě nádorů ORL oblasti
Zájem o cetuximab v léčbě nádorů ORL oblasti byl dán vysokou expresí EGFR u těchto nádorů. V řadě studií byla exprese EGFR hodnocena jako nezávislý negativní prognostický faktor [11, 12]. Prokázala se rovněž výrazná korelace mezi rezistencí na radioterapii a zvýšenou expresí EGFR [13].
Předklinické studie
Předklinické studie prokázaly účinnost cetuximabu v buněčných liniích a xenograftech (xenoštěpech) nádorů ORL. Cetuximab inhiboval růst buněčných linií snížením jejich proliferace a zvýšením apoptózy [14, 15]. Radiace a cisplatina jsou široce používány v léčbě pacientů s nádory ORL a předklinické studie prokázaly, že cetuximab může výrazně zvýšit protinádorovou účinnost záření a cisplatiny [14, 16]. Tyto studie podpořily použití cetuximabu v léčbě nádorů ORL.
Cetuximab v léčbě druhé linie nádorů ORL
Byla publikována pouze jedna studie s cetuximabem v monoterapii [17]. Ve studii bylo 103 pacientů s recidivou a/nebo metastázami, jejich onemocnění bylo refrakterní na cisplatinu. Dávkování bylo standardní, tj. 400 mg/m2 v úvodní dávce, následované 250 mg/m2 týdně, celkem 6krát. Autoři zaznamenali 15,5 % remisí, s mediánem doby do progrese 85 dní a mediánem přežití 175 dní [17].
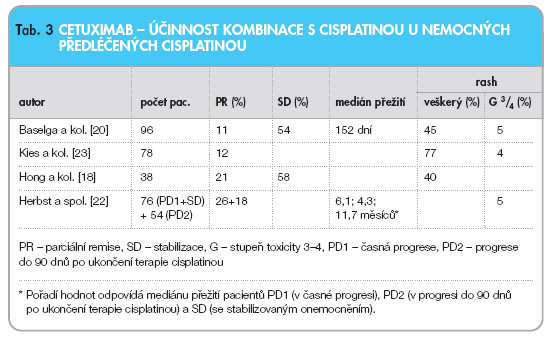
V řadě studií fáze II se cetuximab podával v kombinaci s cisplatinou nebo carboplatinou po selhání chemoterapie první linie založené na cisplatině. Hong a kol. použili cetuximab v kombinaci s cisplatinou u 38 pacientů již dříve léčených tímto cytostatikem. Zaznamenali 21 % léčebných odpovědí [18] (viz tab. 3).
Stabilizaci onemocnění pozorovali u 58 % pacientů. Rash pozorovali u 40 % nemocných. Shin a kol. [19] provedli studii fáze I v kombinaci s cisplatinou. Do studie bylo zařazeno 12 pacientů, kteří měli vysoké hodnoty exprese EGFR. Nemocní dostali 3 rozdílné dávky cetuximabu až do výše 500 mg/m2. V úvodní dávce byla aplikována cisplatina ve 100 mg/m2 v třítýdenním intervalu. Týdenní dávky cetuximabu byly 250 mg/m2 po dobu 6 týdnů. Imunohistochemicky autoři zjistili zvýšení saturace nádorové EGFR cetuximabem až na 95 %. U 4 pacientů byla hodnocena aktivita EGFR tyrozinkinázy, která po infuzi cetuximabu výrazně poklesla. U 6 z 9 pacientů pozorovali význačné klinické odpovědi včetně dvou kompletních remisí. Toxicita byla mírná, a to převážně v podobě alergických reakcí (stupeň 2 a 3) vždy u jednoho nemocného, u dvou nemocných se objevil kožní rash třetího stupně. Na základě zjištěných výsledků autoři doporučili pro další studie režim s cetuximabem o nárazové dávce 400 a udržovací 250 mg/m2 [19].
Baselga a kol. zařadili do studie 96 pacientů, kteří již dříve podstoupili 2–4 cykly kombinované chemoterapie s cisplatinou a posléze jejich onemocnění progredovalo. Cetuximab byl podán se stejným režimem cisplatiny nebo carboplatiny, po kterém choroba dříve progredovala. Celková remise byla 15%, kontroly onemocnění bylo dosaženo u 54 % pacientů, medián přežití byl 6 měsíců. Hlavní toxicitou byl rash, který se vyskytl u 45 % pacientů, ale jen v 5 % dosáhl stupně až 3–4, anémie u 33 %, akné u 25 %, suchost kůže u 16 % a astenie u 16 % pacientů [20].
Chan a kol. uveřejnili v roce 2005 studii fáze II, ve které podali kombinaci cetuximabu s carboplatinou u nemocných s nádory nazofaryngu s vysokou expresí EGFR. Zařazení nemocní s původně recidivující nebo metastatickou chorobou progredovali během 12 měsíců po předchozím podání cisplatiny. Cetuximab byl podán v režimu 400 a 250 mg/m2 týdně, carboplatina (AUC5) v třítýdenním intervalu s maximem 8 cyklů. Do studie autoři zařadili 60 nemocných a zhodnoceno jich bylo 59. U sedmi nemocných (11,7 %) se dosáhlo částečné odpovědi, stav u 29 pacientů (48,3 %) byl hodnocen jako stabilizovaný, u 23 nemocných (38,3 %) došlo k progresi. Medián doby do progrese byl 81 dní, nejdelší odpověď byla 173 dní a zaznamenala se u nemocných, kteří reagovali na léčbu. Medián přežití byl 233 dní. 6 nemocných (10 %) mělo závažné vedlejší projevy. Stupeň toxicity 3 a 4 se vyskytl u 31 nemocných (51,7 %), ale pouze u 19 z nich (31,7 %) souvisela toxicita s podáním cetuximabu [21].
Herbst a kol. zkoumali účinnost kombinace cetuximabu s cisplatinou u nemocných s refrakterním, recidivujícím nebo metastatickým onemocněním. První předběžné výsledky autoři publikovali již v roce 2001 na jednání AACR-NCI-EORTC. Do studie zařadili 132 pacientů, kteří dostali nejprve dva cykly kombinace cisplatina/ paclitaxel nebo cisplatina/fluorouracil ve třítýdenních intervalech. U 30 z nich došlo k léčebné odpovědi ve smyslu CR (kompletní remise) nebo PR (parciální remise) a ti pokračovali dále ve standardní terapii. 76 nemocných se stabilizací onemocnění (SD, n = 51) nebo s progresí choroby (PD1, n = 25) dostalo kombinaci cetuximabu (400 mg/m2 i.v. den 1, poté 250 mg/m2/týdně) s cisplatinou (75 nebo 100 mg/m2 den 1 každé 3 týdny). Do studie byli posléze zařazeni i nemocní, u kterých došlo k progresi onemocnění během 90 dní po ukončení terapie cisplatinou (PD2, n = 54). Výsledně byla objektivní remise dokumentována u 20 % pacientů (n = 5) v PD1, 6 % (n = 3) v PD2 a u 18 % (n = 9) nemocných se stabilizovaným stavem. Nejčastějšími toxickými projevy byla anémie, kožní rash, leukopenie, únava, nauzea a zvracení. U 7 nemocných (5 %) se vyskytla hypersenzitivita na cetuximab, a to 3. a 4. stupně [22].
V řadě dalších studií byla v kombinaci použita i další cytostatika. Kies a kol. [23] provedli studii fáze II, ve které podali kombinaci cetuximabu s cisplatinou pacientům, kteří dříve dostali 2 cykly chemoterapie na bázi cisplatiny a byli ve fázi progrese nebo stabilizace. Ve studii bylo 78 nemocných, celková odpověď činila 12 % a procento dosažené kontroly onemocnění 28 %. Nejčastějším nežádoucím účinkem byl rash – celkem u 77 %, (stupeň 3 a 4 pouze u 4 %), astenie celkem u 49 % (stupeň 3 a 4 u 18 % nemocných) a nauzea v 51 % (stupeň 3 a 4 u 5 % pacientů).
Cetuximab v první linii
Mezníkem v hodnocení cetuximabu v léčbě pokročilých nádorů ORL byla studie Eastern Cooperative Group uvedená Burtnessovou a kol. v roce 2003 [25]. Pacienti s měřitelným nebo hodnotitelným metastatickým onemocněním nebo s místní recidivou po první chirurgické nebo radiační léčbě byli léčeni buď cisplatinou 100 mg/m2 každé 4 týdny v kombinaci s cetuximabem v týdenním režimu, nebo cisplatinou v monoterapii. Účinnost kombinace byla 26% oproti 10% účinnosti v monoterapii (viz tab. 4)
Hlavní toxicitou stupně 3–4 byla nauzea, dále neutropenie a rash, a to u 38 z 57 nemocných léčených kombinací.
Humblet a kol. [24] podali kombinaci cetuximabu s cisplatinou či carboplatinou spolu s různými dávkami 5-fluorouracilu. Jejich cílem bylo zhodnocení farmakokinetického profilu cetuximabu a platinových přípravků u pacientů s recidivujícím nebo metastatickým karcinomem ORL oblasti. Cetuximab byl podán ve standardním dávkování, cisplatina 100 mg/m2 druhý den, nebo carboplatina (AUC5) v první den. 5-fluorouracil byl podán 1. den v kontinuální infuzi trvající 120 hodin v dávkách 600, 800 a 1000 mg/m2. Cyklus byl opakován za 3 týdny. Do studie bylo zařazeno 53 nemocných (12 pacientů s nízkou dávkou 5-FU, 16 se střední a 24 s vysokou dávkou). Toxicita pro kombinaci cetuximabu s cisplatinou (27 pacientů) se projevila jako neutropenie (48 %), astenie (30 %), nauzea/zvracení (30 %), mukozitida (15 %), kardiální problémy (15 %), trombocytopenie (11 %). Toxicita ve skupině s carboplatinou (26 pacientů) byla následující: neutropenie stupně 3 a 4 (36 %), astenie (20 %), trombocytopenie (12 %). Předběžné výsledky u 47 nemocných: ORR (celková odpověď na léčbu) 48,9 %, z toho 2 CR (kompletní remise), 21 PR (parciální remise), 16 SD (stabilizace) a 7 PD (parciální progrese), 1 pacient nehodnotitelný. Autoři uzavírají, že tato kombinace je bezpečná (tab. 5).
Uvedené studie prokázaly že cetuximab je schopen překonat rezistenci na platinové přípravky. U 11–12 % pacientů, jejichž choroba progredovala po předchozím podání platiny, se opět dosáhlo odpovědi, a to i přesto, že současně s cetuximabem byl podán týž režim s cisplatinou jako v primoléčbě. Navíc u 17–36 % pacientů byla zaznamenána stabilizace onemocnění. Údaje o kombinaci cisplatina-cetuximab u dosud neléčených nemocných ukazují, že cetuximab lze kombinovat s plnými dávkami cytostatik a že tato kombinace vede ke zvýšení procenta remisí. Běžná toxicita chemoterapie, zvláště myelosuprese, není zvýšená, vysoké je ale procento kožního postižení – rash až v 80 %, avšak závažný rash jen ve 3 %. Alergické reakce se mohou vyskytnout asi ve 3 %.
Cetuximab v kombinaci s radioterapií
Robert a kol. [26] referovali již v roce 2001 o podání cetuximabu spolu s radioterapií v první linii léčby místně pokročilých nádorů ORL: 13 pacientů podstoupilo standardní radioterapii (celková dávka 70 Gy v sedmi týdnech) a 3 pacienti podstoupili hyperfrakcionovanou radioterapii (celková dávka 76,8 Gy). Cetuximab byl podáván v počáteční dávce 100 až 500 mg/m2, dále 100 až 250 mg/m2 týdně po dobu 7–9 měsíců. Z 15 hodnotitelných pacientů se dosáhlo kompletní remise u 13 z nich (87 %) a u dalších dvou nemocných byla zaznamenána parciální remise. U všech se tedy dosáhlo kladné odpovědi (100 %). Medián trvání léčebné odpovědi byl 28 měsíců, jednoleté přežití 73 % a dvouleté 65 %. Udávané nežádoucí účinky byly teplota, astenie, nauzea a kožní rash [26]. Úvodní dávka byla 400 mg/m2 a 250 mg/m2.
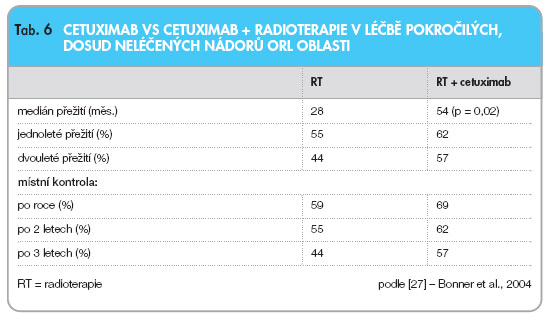
Za jednu z nevýznamnějších prací se považuje studie fáze III prezentovaná Bonnerem a kol. [27]. Dosud neléčení pacienti (celkem 424) s pokročilými nádory ORL byli randomizováni do dvou ramen. V prvním rameni byli nemocní léčeni pouze cetuximabem. V druhém rameni se zařazení pacienti podrobili radioterapii současně s podáním cetuximabu. Pacienti byli dále stratifikováni dle PS (performance status), a to 90–100 % a 60–80 %. Další stratifikace byla podle místního rozsahu choroby a pozitivity regionálních uzlin. U nemocných se jednalo o karcinom orofaryngu (60 %), laryngu (25 %) a hypofaryngu (15 %). Medián přežití byl 28 a 54 měsíců, dvouleté přežití 55 a 62 %, tříleté přežití 44 a 57 %. Rash třetího stupně se vyskytl ve 34 %. Místní kontrola činila 48 a 56 %.
Jak je jasně patrné, přidání cetuximabu k radioterapii vedlo k výraznému prodloužení přežití a ke zdvojení mediánu přežití (tab. 6).
Vedlejší účinky byly typické pro radioterapii. 34 % pacientů mělo kožní reakce, které však byly snadno ovlivnitelné a reverzibilní po ukončení léčby. Jen u 3 % pacientů léčených cetuximabem došlo k závažnému kožnímu postižení. Ke zvýšení výskytu mukozitidy nedošlo a u pacientů, u kterých byla provedena disekce uzlin, nebylo ovlivněno hojení ran. Použití této kombinace u nemocných se špatným PS, u nichž není vhodné chirurgické řešení nebo chemoradioterapie, se jeví jako velmi účelné.
Harari a kol. studovali problém hojení ran u pacientů s pokročilým nádorem ORL oblasti léčených ozářením nebo kombinací cetuximabu a radioterapie. Ve výše uvedené studii prodělalo 20 pacientů disekci krčních uzlin po ukončené radioterapii a 19 po kombinované léčbě radioterapií s cetuximabem. Komplikace nebo rozdíly v postoperační léčbě autoři nezjistili, podání cetuximabu neovlivnilo hojení ran [28].
Pfister a kol. použili kombinaci cetuximab + cisplatina + radioterapie u 21 místně pokročilých nádorů ORL, dosud neléčených, přičemž 86 % pacientů bylo ve stadiu IV. Výsledky: 2 kompletní a 13 částečných remisí. Za 2 roky po ukončené léčbě bylo stále 76 % pacientů bez známek progrese. Byla pozorována velká kožní toxicita – rash u 95 %. U 10 nemocných došlo k toxicitě 4. stupně, což vedlo k předčasnému ukončení studie [29].
V současné době probíhají další studie hodnotící integraci cetuximabu do programu chemoradioterapie. Studie E2303 zkoumá indukční chemoterapii s cetuximabem následovanou chemoradioterapií s cetuximabem u potenciálně resekabilních nádorů ORL oblasti. Studie E3303 sleduje kombinaci cetuximabu s chemoradioterapií následovanou cetuximabem pro neresekabilní místně pokročilé nádory [30]. Výsledky jsou očekávány s napětím.
Toxicita
Cetuximab je dobře snášen v týdenním podání v monoterapii i v kombinaci s dalšími cytostatiky nebo radioterapií. Kožní reakce jsou nejčastějším nežádoucím vedlejším projevem. Manifestují se většinou jako rash podobný akné. Vyskytuje se během prvních tří týdnů v obličeji, horní části hrudníku, na zádech a občas i na končetinách. Klinicky vypadá jako mnohočetné folikulární nebo pustulární léze, histologicky jde o lymfocytární perifolikulitidu nebo supurativní superficiální folikulitidu. Výskyt je vysoký, 60 až 80 %, ale většinou dosahuje jen 1.–2. stupně [20]. Závažný 3.–4. stupeň je uváděn u 5–10 % pacientů. Tyto projevy vymizí bez následků po ukončení terapie [31]. Za příčinu kožní toxicity se považuje vazba cetuximabu na EGFR v epidermis.
Jiným často popisovaným nežádoucím projevem jsou poruchy nehtů, paronychiální zánět. Bolesti v distální části prstů, které jsou různého stupně. Obtíže přetrvávají až tři měsíce po ukončení léčby.
Popisují se pokusy o zklidnění místní reakce antibiotiky nebo místní aplikací steroidů. Význam těchto postupů je však nejistý.
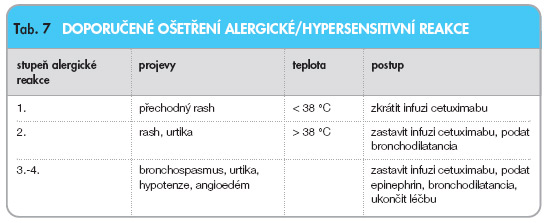
Alergické reakce 3. nebo 4. stupně jsou udávány u 2,2 % léčených nemocných. Doporučuje se premedikace antihistaminiky.
Doporučené ošetření alergické/hypersenzitivní reakce je uvedeno v tab. 7.
Zajímavým poznatkem je souvislost intenzity kožní reakce a odpovědi na léčbu. Tento vztah byl potvrzen ve studii BOND a dalších čtyřech studiích, a to u kolorektálního karcinomu, u karcinomu ORL oblasti a karcinomu pankreatu [32]. Burtnessová a kol. ve studii fáze III se 116 pacienty s nádory v ORL oblasti udává výrazné zlepšení v mediánu bezpříznakového období (p = 0,0022) a mediánu přežití (p = 0,013) u nemocných s rashem ve srovnání s pacienty bez tohoto projevu [25]. Obavy z alergických reakcí se nepotvrdily. Hypersenzitivní reakce 3.–4. stupně jsou uváděny pouze ve 2–4 % [32].
Závěr
Monoklonální protilátky proti EGFR jsou příkladem snahy o cílenou terapii. Pro nemocné s pokročilými nádory a expresí EGFR se nabízí možnost specifičtějšího a méně toxického léčebného přístupu u nádorů ORL oblasti. Dosavadní zprávy o léčbě cetuximabem jsou nadějné, samozřejmě bude třeba dalších informací a ověření předložených výsledků, zvláště pro kombinace s radioterapií a cytostatiky. Je účelné uvažovat o tomto léčebném přístupu u vybrané skupiny nemocných, kteří nejsou kandidáty pro chirurgické řešení nebo chemoradioterapii. Někteří autoři již zvažují zařazení cetuximabu do léčebných protokolů [33].
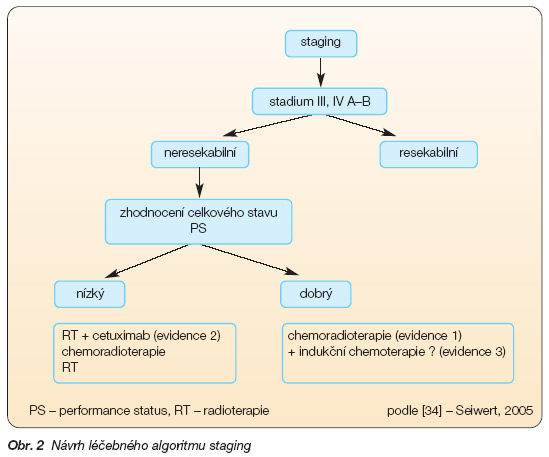
Seiwert a kol. uvádějí návrh algoritmu na podkladě evidence based medicine pro nemocné s místně pokročilými karcinomy ORL oblasti [34] (viz. obr. 2).
Cetuximab prokázal účinnost v léčbě první řady u místně pokročilých a metastatických nádorů ORL oblasti v kombinaci s chemoterapií a radioterapií. Nadějné jsou i výsledky v léčbě druhé řady, u pacientů rezistentních na platinu.
Seznam použité literatury
- [1] Bourhis J. Redefining state of the art in head and neck cancer. Ann Oncol 2005; 16 (Suppl 6): 5–6.
- [2] Iro H, Waldfahrer F. Evaluation of the newly updated TNM classification of head and neck carcinoma with data from 3247 patients. Cancer 1998; 83: 2201–2207.
- [3] Pomerantz RG, Grandis JR. The epidermal growth factor receptor signaling network in head and neck carcinogenesis and implications for targeted therapy. Semin Oncol 2004; 1: 734–743.
- [4] Grandis JR, Melhem MF, Holding WE, et al. Levels of TGF- and EGFR protein in head and neck squamous cell carcinoma and patient survival. J Natl Canc Ins 1998; 90: 824–832.
- [5] Cohen EW. Novel therapeutic targets in squamous cell carcinoma of the head and neck. Semin Oncol 2004; 31: 755–768.
- [6] Bentzen SM, Atasoy BM, Daley FM, et al. Epidermal growth factor receptor expression in pretreatment biopsies from head and neck squamous cell carcinoma as a predictive factor for a benefit from accelerated radiation therapy in a randomized controlled trial. J Clin Oncol 2005; 23–24: 5560–5567.
- [7] Cohen EW, Rosen F, Stadler WM. Phase II trial of ZD 1839 in recurrent or metastatic squamous cell carcinoma of the head and neck. J Clin Oncol 2003; 21: 1980–1987.
- [8] Soulieres D, Senzor NN, Vokes EE, et al. Multicenter phase II study of Erlotinib, an oral epidermal growth factor receptor tyroxine kinase inhibitor, in patiens with recurrent or metastatic squamous cell cancer of the head and neck. J Clin Oncol 2004; 22: 77–85.
- [9] Cutsem EV, Cunningham D (edits). Cetuximab (Erbitux) in the treatment of cancer. Oncol Biotherapeutics 2005; 3: 8–14.
- [10] Baselga J, Pfister D, Cooper MR, et al. Phase I studies of antiepidermal growth factor receptor chimeric antibody C225 alone and in combination with cisplatin. J Clin Oncol 2000; 18: 904–914.
- [11] Ma BB, Poon TC, To KF, et al. Prognostic significance of tumor angiogenesis, Ki 67, p53 oncoprotein, epidermal growth factor receptor and HER2 receptor protein expression in undifferentiated nasopharyngeal carcinoma – a prospective study. Head Neck 2003; 25: 864–872.
- [12] Grandis JR, Melhem MF, Holding WE, et al. Levels of TGF-alpha and EGFR protein in head and neck squamous cell carcinoma and patient survival. J Natl Cancer Inst 1998; 90: 824–828.
- [13] Ang L, Berky BA, Tu X, et al. Impact of epidermal growth factor receptor expression on survival and pattern of response in patients with advanced head and neck carcinoma. Cancer Res 2002; 62: 7350–7356.
- [14] Huang SM, Bock JM, Harari PM. Epidermal growth factor receptor blockade with C225 modulates proliferation, apoptosis, and radiosensitivity in squamous cell carcinoma of the head and neck. Cancer Res 1999; 59: 1935–1940.
- [15] Bonner JA, Ezekiel MP, Robert F, et al. Continued response following treatment with IMC-C255, an EGFr MaAb, combined with RT in advanced head and neck malignancies. Proc ASCO 2002; 21: Abst 925.
- [16] Wild R, Kan D, Inigo I, et al. Antitumor activity of cetuximab (Erbitux) in human carcinoma xenografts: potentiation in combination with cisplatin and comparisons with gefinitib (ZD1839) monotherapy. Clin Cancer Res 2003; Suppl. 9, Abst 127.
- [17] Trigo J, Hitt R, Koralewski E, et al. Cetuximab monotherapy is active in patiens with platinum refractory recurrent/metastatic squamous cell carcinoma of the head and neck (SCCHN): Results of a phase II study. Proc ASCO 2004; 22: 487, Abst 5502.
- [18] Hong WK, Arquette M, Nabell L. Efficacy and safety of the antiepidermal growth factor receptor antibody (EGFR) IMC-C225, in combination with cisplatin in patients with recurrent squamous cell carcinoma of the head and neck refractory to cisplatin containing chemotherapy. Proc ASCO 2001; 20: 224a.
- [19] Shin DM, Donato HJ, Perez-Soler R. Epidermal growth factor receptor-targeted therapy with C225 and cisplatin in patients with head and neck cancer. Clin Cancer Res 2001; 7: 1204–1213.
- [20] Baselga J, Trigo JM, Bourhis J, et al. Cetuximab (C225) plus cisplatin/carboplatin is active in patiens with recurrent/metastatic squamous cell carcinoma of the head and neck progressing on a same dose and schedule platinum-based regimen. Proc ASCO 2002; 21: Abst 925.
- [21] Chan AT, Hsu MM, Goh BC, et al. Multicenter, phase II study of cetuximab in combination with carboplatin in patients with recurrent or metastatic nasopharyngeal carcinoma. J Clin Oncol 2005; 23: 3568–3576.
- [22] Herbst RS, Arquette M, Shin DM, et al. Phase II mulicenter study of the epidermal growth factor receptor antibody cetuximab and cisplatin for recurrent and refractory squamous cell carcinoma of the head and neck. J Clin Oncol 2005; 23–24: 5578–5587.
- [23] Kies MS, Arquette MA, Nabell L, et al. Final report of the efficacy and safety of the antiepidermal growth factor antibody Erbitux (IMC-C225) in combination with cisplatin in patients with recurrent squamous cell carcinoma of the head and neck refractory to cisplatin containing chemotherapy. Proc ASCO 2002; 21: Abst 92.
- [24] Humblet Y, Vega-Villas E, Mesia R, et al. Phase I study of cetuximab in combination with cisplatin or carboplatin and 5-fluorouracil in patients with recurrent and/or metastatic squamous cell carcinoma of the head and neck. Proc ASCO 2004; Abst 5513.
- [25] Burtness BA, Li Y, Flood W, et al. Phase II randomized trial of cisplatin + placebo versus cisplatin + C255, a monoclonal antibody directed to the epidermal growth factor-receptor: An Eastern Cooperative Oncology Group trial. Clin Cancer Res 2003; 9 Suppl: Abst 77.
- [26] Robert F, Ezekiel MP, Spencer SA, et al. Phase I study of antiepidermal growth factor receptor antibody cetuximab in combination with radiation therapy in patients with advanced head and neck cancer. J Clin Oncol 2001; 19: 3234–3243.
- [27] Bonner JA, Goraly J, Harari PM, et al. Cetuximab prolongs survival in patiens with locoregionally advanced squamous cell carcinoma of head and neck. A phase III study of high dose radiation therapy with and without cetuximab. Proc ASCO 2004; 23: Abst 5507.
- [28] Harari P. EGFR therapies with radiation. Proc Int Conf Head Neck Cancer 2004; Abst s087.
- [29] Pfister DG, Aliff TB, Kraus DH, et al. Concurrent cetuximab, cisplatin, and concomitant boost radiation therapy for locoregionally advanced, squamous cell head and neck cancer. Preliminary evaluation of a new combined-modality paradigm. Proc ASCO 2003; 22: Abst 1993.
- [30] Mehra R, Burtness B. Integrating epidermal growth factor inhibitors into standard practice. Educational Book ASCO 2005; 443–448.
- [31] Gustafson NF, Saltz I, Cunnigham D, et al. Safety profile of cetuximab in patients with metastatic colorectal cancer. ASCO Gastrointestinal Cancer Symposium 2004; Abst 237.
- [32] Saltz I, Kies M, Abbruzzese JL, et al. The presence and intensity of the cetuximab- induced acne like rash predicts increased survival in studies across multiple malignancies. Proc ASCO 2003; 22 Abst 817.
- [33] Awada A, Lalami Y. Molecular markers, molecular-targeted therapies and taxanes: how to integrate the progress into clinical research and practice fot the management of head and neck cancers. Curr Opinion in Oncology 2005; 17: 209–211.
- [34] Seiwert TY, Cohen EEW. State-of-the-art management of locally advanced head and neck cancer. Brit J Cancer 2005; 92: 1341–1348.