Pregabalin v léčbě neuropatické bolesti
Neuropatická bolest představuje farmakologicky obtížně zvládnutelný stav, který bývá rezistentní na léčbu nesteroidními antiflogistiky. Léky první volby představují antidepresiva a antiepileptika. Pregabalin je antiepileptikum odvozené od gabapentinu, které prokazatelně snižuje intenzitu neuropatické bolesti. Mechanismem účinku je pravděpodobně vazba na α2 δ-podjednotku napěťově řízeného kalciového kanálu, čímž pregabalin redukuje vyplavování excitačně působícího kalcia. Pregabalin se podává dvakrát či třikrát denně v celkové denní dávce 150–600 mg. Je obecně dobře snášen, nejčastějším nežádoucím účinkem jsou závratě, ospalost a periferní edém.
Úvod
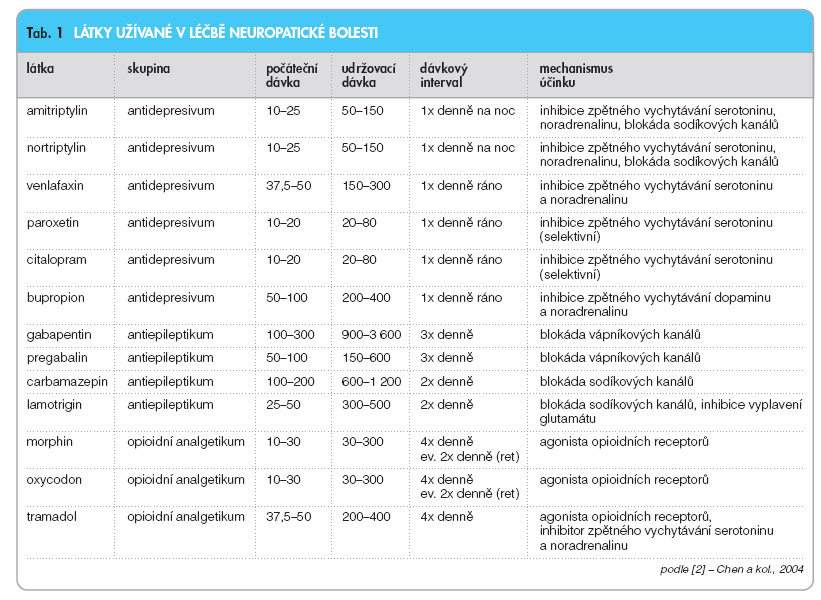
Schopnost cítit bolest hraje v našem životě protektivní roli. Bolest varuje před hrozícím poškozením tkáně nebo informuje o akutním poškození tkáně a vyvolává reakci ve formě koordinovaného reflexu nebo změny chování za účelem minimalizace poškození. Pokud dojde k poškození tkáně, rozvíjí se mechanismy v periferním i centrálním nervovém systému, které vedou k přechodné hypersenzitivitě v místě zánětu. Bolest doprovází hojení ran proto, aby nedocházelo ke kontaktům hojící se tkáně s okolním prostředím. Pokud však bolest či mechanismy přecitlivělosti k podnětům zůstávají trvalé, neznamenají pro organismus žádnou biologickou výhodu, naopak způsobují utrpení a stres. Tyto stavy jsou typické při poškození nervového systému – periferního nervu, ganglia zadního kořene míšního, zadního kořene míšního nebo centrálního nervového systému – a jsou označovány jako neuropatická bolest. Jednu z nejčastějších forem neuropatické bolesti představuje diabetická periferní neuropatie (DPN) postihující pětinu diabetické populace v USA (zhruba 3 miliony lidí) a postherpetická neuralgie (PHN) postihující 1 milion lidí v USA [1]. Neuropatické bolesti mohou být dále způsobeny poškozením periferních nervů kompresí (např. zúžením karpálního tunelu, vyhřeznutím ploténky) nebo přílišným napnutím (např. při zlomenině), při protětí (např. při amputaci), při toxických poškozeních (např. po chemoterapii), jako následek ischémie i dalšími příčinami. Poškození centrálního nervového systému traumaty, zánětlivými onemocněními (např. při sclerosis multiplex) nebo ischémií (např. po CMP) může být též příčinou neuropatických bolestí. V průběhu hojení způsobují mediátory zánětu zvýšení citlivosti primárních aferentních nociceptorů k podnětům. Tento jev je nazýván periferní senzitizace. Neurony centrálního nervového systému, ke kterým vedou aferentní axony těchto nociceptorů, podstupují též řadu funkčních excitačních změn. Tento jev je nazýván centrální senzitizace. Po zhojení tkáně dochází k normalizaci a vymizení obou jevů. Při poškození neuronů může stav senzitizace přetrvávat a vést k neuropatickým bolestem, které jsou rezistentní na léčbu nesteroidními antiflogistiky. Farmakoterapie neuropatických bolestí se snaží především ovlivnit periferní (blokádou vápníkových a sodíkových kanálů) i centrální (blokádou vápníkových kanálů, inhibicí N-methyl-D-aspartázových NMDA a glutamátových receptorů) senzitizaci, podpořit tlumivé mechanismy přenosu vzruchu (inhibicí zpětného vychytávání noradrenalinu a serotoninu, aktivací opioidních a GABA receptorů) a tlumit aktivaci sympatiku [2]. Lékem první volby v terapii neuropatických bolestí jsou v současné době tricyklická antidepresiva, některá antiepileptika (gabapentin) a opioidní analgetika (tab. 1).
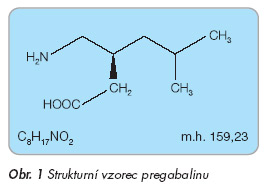
Tricyklická antidepresiva (TCA) byla první skupinou léčiv s prokazatelným účinkem na neuropatické bolesti [3]. Předpokládaným mechanismem jejich účinku je inhibice zpětného vychytávání serotoninu a noradrenalinu a dále blokáda sodíkových kanálů [4]. Klinicky používány jsou především amitriptylin a nortriptylin. Bohužel jejich nežádoucí účinky spojené s anticholinergním působením (srdeční arytmie, sucho v ústech, malátnost, závratě atd.) a množství interakcí (jaterní metabolismus na cytochromu P-450 CYP 2D6) limitují jejich používání. Antiepileptika modulují periferní i centrální mechanismy blokádou vápníkových kanálů a sodíkových kanálů, inhibicí NMDA receptorů a aktivací GABA inhibičních neuronálních mechanismů. Gabapentin patří do třetí generace antiepileptik, jeho předpokládaným mechanismem účinku je nepřímá blokáda vápníkových kanálů. Jeho analgetický účinek byl u diabetické periferní neuropatie srovnatelný s účinkem amitriptylinu [5]. Výhodou gabapentinu oproti TCA je jeho menší potenciál k interakcím a příznivější bezpečnostní profil. Dalšími používanými antiepileptiky v této indikaci jsou carbamazepin, phenytoin a lamotrigin. Opiáty prokázaly v klinických studiích účinek na zmírnění neuropatických boles tí, který byl nepatrně větší ve srovnání s TCA [6]. Vzhledem k jinému mechanismu účinku lze TCA či gabapentin s opiáty kombinovat. Nevýhodou užívání opiátů jsou jejich nežádoucí účinky (zácpa, sedace) a potenciální návykovost. Nemocní periferní diabetickou neuropatií by se měli snažit především o dobrou kompenzaci diabetu. Pregabalin (PGB) je farmakologicky aktivní S-enantiomer 3-aminomethyl-5-methyl- hexanové kyseliny (obr. 1). Farmakologickým profilem je podobný svému vývojovému předchůdci – gabapentinu. Na zvířecích modelech vykazoval pregabalin srovnatelnou analgetickou účinnost jako gabapentin při podávání třetinových dávek. Vedle analgetického účinku vykazoval pregabalin v klinických studiích účinek antikonvulzivní a anxiolytický.
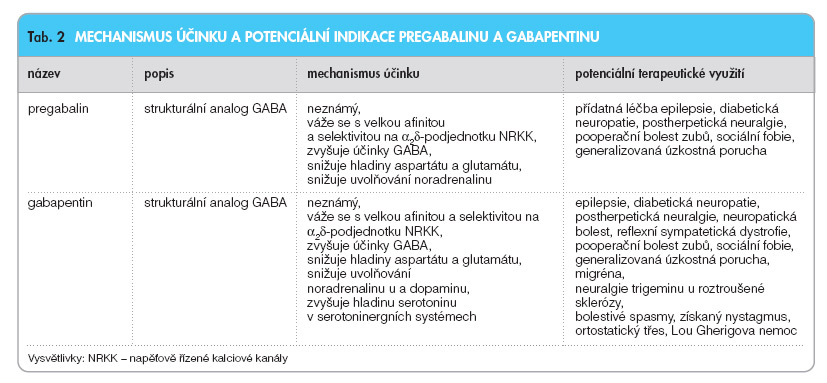
Mechanismus účinku
Pregabalin má podobný farmakologický profil jako gabapentin (tab. 2).
Svou schopnost antialodynického a antihyperalgetického účinku potvrdil ve studiích neuropatické bolesti na různých zvířecích modelech zahrnujících: alodynii (bolestivý vjem při doteku) způsobenou vincristinem, streptozocinem či nervovým poškozením a hyperalgezii způsobenou substancí P, NMDA a teplotou [7,8]. Pregabalin moduluje presynaptické uvolnění excitačních neurotransmiterů (glutamátu, noradrenalinu) specifickou vazbou na α2δ-proteiny, které jsou strukturální součástí napěťově řízených vápníkových kanálů (NRKK). Studie na myších, které měly mutovaný gen pro α2δ-protein, ukázaly, že vazba pregabalinu na tento protein je nezbytným předpokladem jeho analgetického účinku. Ačkoliv je strukturálně podobný GABA, neinteraguje s jejími receptory, avšak zřejmě zvyšuje vyplavování GABA interakcí s transportním proteinem GAT-1, který ovlivňuje její synaptické vyplavování. Pregabalin snižoval uvolňování substance P z míchy myší, ale jen za podmínky, že mícha byla senzitizována zánětem.
Farmakokinetika
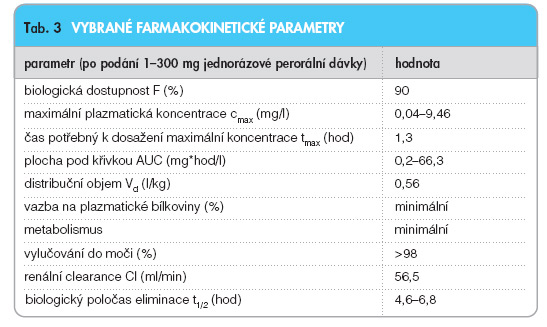
Po jednorázovém perorálním podání 86 zdravým dobrovolníkům byl pregabalin rychle absorbován, čas potřebný k dosažení maximální plazmatické koncentrace se pohyboval okolo 1,3 hod. Maximální plazmatická koncentrace (cmax) i plocha pod křivkou (AUC) byly závislé na dávce. Po podání 300 mg pregabalinu dosáhla cmax průměrné hodnoty 9,46 mg/l a AUC 66,3 mg x h/l. Při opa kovaném podání léčiva bylo ustáleného stavu dosaženo po 24–48 hodinách. Pregabalin byl téměř kompletně resorbován, jeho biologická dostupnost – 90% – byla nezávislá na dávce [9]. Potrava negativně ovlivňovala rychlost vstřebávání (tmax až za 2,5 hod, cmax klesá přibližně o 30 %), nikoli však celkové vstřebané množství [10]. Pregabalin se nevázal na plazmatické bílkoviny a jeho distribuční objem činil přibližně 0,56 l/kg [11]. V předklinických studiích bylo dokázáno, že pregabalin prochází hematoencefalickou bariérou. Pokusy s březími samicemi potkanů ukázaly, že pregabalin prochází placentou do plodu, prokázán byl i jeho výskyt v mléce. Léčivo je pouze nepatrně metabolizováno v játrech. Vzhledem k nepatrnému matabolismu cytochromem P-450 i vazbě na plazmatické bílkoviny se nepředpokládají významnější farmakokinetické interakce. Primární cestou eliminace pregabalinu jsou ledviny; 98 % podané dávky je vyloučeno jako nezměněné léčivo do moči. N-methylovaný derivát pregabalinu tvořil 0,9 % podané dávky. Biologický poločas eliminace se pohyboval v intervalu 4,6–6,8 hod a byl nezávislý na dávce. Farmakokinetika pregabalinu je v rozmezí doporučené denní dávky lineární, variabilita hodnot farmakokinetických parametrů mezi jednotlivými osobami je nízká (<20 %). Pohlaví nemá klinicky významný vliv na plazmatické koncentrace pregabalinu. Zatímco díky minimálnímu jaternímu metabolismu pregabalinu není zřejmě kinetika pragabalinu výrazněji ovlivněna jaterním poškozením, snížení renálních funkcí výrazně ovlivňuje clearance pregabalinu. Ve studii 26 jinak zdravých lidí s různým stupněm renálního poškození byli účastníci rozděleni podle clearance kreatininu do čtyř skupin: >60 ml/min, 30–60 ml/min, 15–29 ml/min, <15 ml/min. V rámci studie byli sledováni i dialyzovaní pacienti. Renální clearance pregabalinu proporčně kopírovala clearance kreatininu (56,5 ml/min, 30,6 ml/min, 16,7 ml/min, 8,3 ml/min). U pacientů s renálním poškozením je proto nutná úprava dávky pregabalinu. Dialýza (jeden 4hodinový cyklus) účinně snižovala hladiny pregabalinu o 50%. Vybrané farmakokinetické parametry viz tab. 3.
Klinické zkušenosti
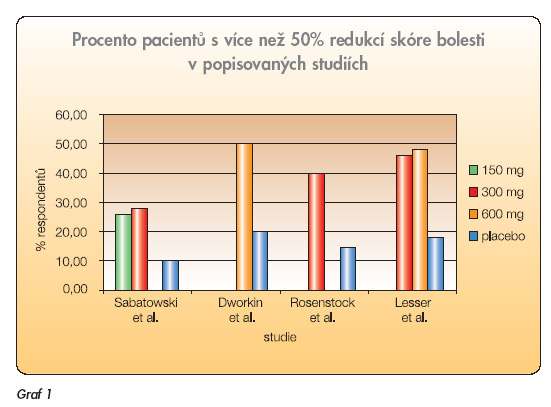
Schopnost pregabalinu tlumit intenzitu bolesti byla ověřena na dvou klinických modelech neuropatické bolesti – postherpetické neuralgii (PHN) a chronické diabetické periferní neuropatii (DPN). Do klinických studií byli zařazováni pacienti na základě podobných kritérií. Všichni museli dosáhnout 18 let věku. Pacienti s PHN museli trpět bolestmi minimálně tři měsíce od doby vymizení kožních projevů nemoci, pacienti s DPN museli mít diagnózu určenou minimálně jeden rok. Pacienti byli zařazeni do studií, pokud ráno zaznamenali do svého zápisníku bolest pociťovanou během předchozího dne minimálně čtyřikrát během hodnotícího týdne. Týdenní průměr intenzity bolesti musel být větší než 4 z jedenáctibodové škály (NRS), kde 0 znamenala žádnou bolest a 10 nejhorší představitelnou bolest. Pacienti museli též skórovat intenzitu bolesti v krátké formě McGillova dotazníku bolesti. Skóre bolesti muselo být ≥40 mm ze 100 milimetrové vizuální stupnice. Do studií nebyli zařazováni pacienti s poškozením ledvin (clearance kreatininu ≤30) a nereagující na léčbu gabapentinem v dávce ≥1 200 mg. Výsledky byly hodnoceny na základě intention-totreat analýz. Primárním cílem bylo určit změnu průměrného skóre intenzity bolesti na jedenáctibodové NRS škále oproti placebu, odečítané z posledních sedmi záznamů v zápisnících pacientů v průběhu léčby pregabalinem. Doplňkovým vyjádřením primárního cíle bylo procento pacientů, kteří dosáhli 30% nebo 50% zlepšení na konci studie (graf 1).
Sekundárními cíli byly změny bolesti a kvality života zachycené pomocí dotazníků a škál. Ve studiích byla používána již zmíněná krátká forma McGillova dotazníku bolesti, dále bylo sledováno skóre interference bolesti se spánkem. Vyplňován byl dotazník pacientova a lékařova dojmu zmírnění bolesti v průběhu studií, kvalita života byla měřena pomocí dotazníku SF-36, pocit deprese byl měřen pomocí Zungovy hodnotící škály deprese, kde pacienti sami hodnotili frekvenci pociťovaných příznaků deprese apod.
Postherpetická neuralgie
V klinické studii Sabatowskiho a kol. [12] bylo randomizováno 238 pacientů do skupiny užívající 150 mg pregabalinu denně (n = 81 pacientů), 300 mg pregabalinu denně (n = 76 pacientů) a placebo (n = 81 pacientů) a léčeno po dobu 8 týdnů. Skupina užívající placebo měla průměrné skóre bolesti 6,33. Skupiny léčené pregabalinem měly statisticky významně nižší průměrná skóre bolesti, tzn. 5,14 (při užívání 150 mg pregabalinu denně), resp. 4,76 (při užívání 300 mg pregabalinu denně). Léčené skupiny měly též větší procento respondentů definovaných jako zlepšení skóre o 50 %. V placebové větvi bylo 10 % respondentů, podávání 150 mg pregabalinu denně zvýšilo počet respondentů na 26 %, podávání 300 mg pregabalinu denně pak na 28 %. Ve srovnání s placebem měly léčené skupiny též signifikantně zlepšené parametry sekundárních cílů popsaných výše. Dworkin a kol. [13] uspořádali randomizovanou, dvojitě slepou 8týdenní klinickou studii se 173 pacienty. Oproti předchozí studii byly použity vyšší dávky pregabalinu odstupňované podle funkce ledvin. Pacienti v léčebné větvi s clearance kreatininu >60 ml/min dostávali 600 mg pregabalinu denně. Pokud byla clearance kreatininu mezi 30 a 60 ml/min, denní dávka byla 300 mg. Pacienti léčení pregabalinem měli větší pokles skóre bolesti (3,6) než v placebové větvi (5,29). Změny intenzity bolesti se projevovaly již po prvním dnu léčby. Poměr pacientů s 30% či 50% poklesem průměrného skóre bolesti byl větší v pregabalinové skupině (63 % vs 25 % a 50 % vs 20 %, p = 0,001). Pregabalin zlepšil též kvalitu spánku a další sekundární parametry. Další studie [14] byla prezentována pouze jako abstrakt. I zde se dávkové režimy 150 mg, 300 mg a 600 mg pregabalinu denně ukázaly lepší než placebo v redukci intenzity bolesti (skóre: 4,81, 4,72, 4,07 vs 5,74) po 13týdenní léčbě pregabalinem. Průměrná skóre bolesti určená během týdne před randomizací se pohybovala v léčených skupinách mezi 6–7 u všech tří studií.
Diabetická periferní neuropatie
Účinnost pregabalinu v léčbě periferní diabetické neuropatie byla hodnocena v celkem pěti randomizovaných klinických studiích, dostupné ve formě článků jsou však zatím pouze dvě studie [15]. V randomizované dvojitě slepé 8týdenní studii 1008-131 [16] bylo 146 pacientů náhodně rozděleno do placebové skupiny (n = 70) a skupiny léčené pregabalinem v dávce 300 mg denně (n = 76). Průměrné skóre bolesti bylo na začátku studie 6,5 v pregabalinové a 6,1 v placebové větvi. Na konci studie bylo dosaženo léčbou pregabalinem skóre 4,0, což bylo statisticky významně více ve srovnání s placebem (skóre 5,3, p <0,0001). 40 % pacientů ve skupině léčené pregabalinem klasifikovalo ústup intenzity bolesti jako o více než 50 %, ve skupině placeba jen 14,5 %. Statisticky významného snížení bylo dosaženo i u sekundárních ukazatelů. Skóre interference bolesti se spánkem (rozmezí 0–10; 0 – bolest neinterferuje se spánkem) dosáhlo v placebové skupině hodnoty 4,32, ve skupině pregabalinu 2,78 (p <0,0001). Výsledné skóre dotazníku SF-36 prokázalo po léčbě pregabalinem zmírnění pocitu bolesti a zlepšení mentálního zdraví i vitality. V randomizované dvojitě slepé 5týdenní studii 1008-029 [17] byla zkoušena účinnost 75 mg, 300 mg a 600 mg pregabalinu denně ve srovnání s placebem. Prokazatelný účinek na snížení bolesti měly dávky 300 mg a 600 mg pregabalinu denně. Průměrné skóre bolesti bylo 3,8 ve skupině užívající 300 mg pregabalinu denně a 5,06 v placebové skupině. Na konci studie dosáhlo 50% redukce bolesti ve srovnání s počátečním stavem 46 % pacientů užívajících 300 mg pregabalinu denně, 48 % pacientů užívajících 600 mg pregabalinu denně a pouze 18 % pacientů užívajících placebo.
Nežádoucí účinky
Pregabalin byl v klinických studiích dobře tolerován. Poměr pacientů s diabetickou periferní neuropatií, kteří dokončili klinické studie s dávkami 300–600 mg pregabalinu denně, se pohyboval mezi 85–94 % (vs 85–92 % placebo) [16,17]. Ve studii starších lidí s postherpetickou neuralgií byl jejich počet po podávání 600 mg pregabalinu denně na konci studie redukován výrazněji (65 % vs 88 % v placebové skupině) [13]. Nejčastějšími nežádoucími účinky, které souvisely s terapií pregabalinem, byly závratě, ospalost, periferní edém, bolesti hlavy a rozmazané vidění. Gastrointestinální nežádoucí účinky vyskytující se u více než 1 % pacientů zahrnovaly zácpu, zvracení, sucho v ústech, zvýšenou chuť k jídlu, zvýšení hmotnosti. Intenzita nežádoucích účinků byla ve většině případů malá. Tři nejčastěji se vyskytující nežádoucí účinky léčby pregabalinem se jeví jako závislé na dávce. Incidence závratí se pohybovala mezi 27–39 % při dávce pregabalinu 300 mg/den nebo 600 mg/den (incidence závratí při podávání placeba se pohybovala mezi 2–11 %). Při dávkách 150 mg pregabalinu denně se 10% incidence závratí blížila placebu. Incidence ospalosti a periferního edému byla 20–27 % a 7–17 % při léčbě pregabalinem v dávce 300 a 600 mg denně, resp. 5 % a 4 % při léčbě pregabalinem v dávce 150 mg denně. Ve skupině užívající placebo činila incidence ospalosti 3–4 % a periferního lymfedému 1–5 % [16–18]. Pregabalin neměl žádný vliv na hladiny glykosylovaného hemoglobinu HbA1C ani dalších laboratorních indikátorů.
Interakce
Pregabalin podléhá u lidí zanedbatelnému metabolismu v játrech a neváže se na plazmatické bílkoviny. Ve studiích in vivo nebyly pozorovány žádné klinicky významné interakce mezi pregabalinem a phenytoinem, carbamazepinem, kyselinou valproovou, lamotriginem, gabapentinem, oxycodonem, perorálními kontraceptivy, perorálními antidiabetiky, diuretiky, inzulinem ani topiramatem. Pregabalin může teoreticky potencovat účinek benzodiazepinů a ethanolu.
Dávkování
Dávkovací rozmezí pregabalinu je 150–600 mg denně ve dvou nebo třech dílčích dávkách. Léčba pregabalinem může být zahájena dávkou 150 mg denně. V závislosti na individuální odpovědi a snášenlivosti pacienta může být po 3–7 dnech zvýšena na 300 mg denně a v případě potřeby po dalších 7 dnech až na maximální dávku 600 mg denně. Léčivo lze podávat s jídlem nebo bez něj. V případě nezbytnosti ukončení léčby je doporučováno postupné snižování dávek v průběhu minimálně jednoho týdne. Protože clearance pregabalinu je přímo úměrná clearance kreatininu, musí být dávky pregabalinu u pacientů s poruchou funkce ledvin individuálně sníženy v závislosti na clearance kreatininu. Clearance kreatininu z plazmatické koncentrace kreatininu lze spočítat např. podle Cockroftovy-Gaultovy rovnice: Clcr (ml/min) = [140 – věk (roky)] x hmotnost (kg) / 72 x kreatinin v séru (mg/dl) x (0,85 u žen). Na základě clearance kreatininu jsou pacienti děleni do 4 skupin: >60 ml/min, 30–60 ml/min, 15–29 ml/min, <15 ml/min. Odpovídající maximální denní dávky jsou 600, 300, 150 a 75 mg. Zahajovací dávky tvoří zhruba 1/3–1/4 dávek maximálních. U pacientů se selháním ledvin je třeba vzít v potaz dialyzovatelnost pregabalinu a upravit dávkování.
Závěr
Pregabalin v klinických studiích prokázal schopnost tlumit pocit bolesti u neuropatických bolestí. Jeho benefit však bude nevyhnutelně srovnáván s benefitem jeho vývojového předchůdce gabapentinu, se kterým sdílí stejný mechanismus účinku. Odhadnutý počet pacientů (NNT), které je nutno léčit, aby se dosáhlo 50% redukce bolesti u jednoho pacienta, se ve studiích s pregabalinem pohyboval mezi 3,2 a 4,4. Ekvivalentní NNT gabapentinu je 3,6. První klinické zkušenosti prokazují též podobné spektrum nežádoucích účinků obou těchto léčiv. Definitivní odpověď na otázku, zda celkový benefit léčby pregabalinem je vyšší než u gabapentinu, by dala až klinická studie, která by tyto dvě látky přímo srovnala. Podobně je třeba provést klinické hodnocení pregabalinu ve srovnání s ostatními alternativami léčby neuropatické bolesti, jaké představují např. tricyklická antidepresiva.
Seznam použité literatury
- [1] Schmader KE. Epidemiology and impact on quality of life of postherpetic neuralgia and painful diabetic neuropathy. Clin J Pain 2002; 18:350–4.
- [2] Chen H, Lamer TL, Rho RH, et al. Contemporary management of neuropathic pain for the primary care physician. Mayo Clin Proc 2004;79:1533–45.
- [3] McQuay HJ, Tramer M, Nye BA, et al. A systematic review of antidepressants in neuropatic pain. Pain 1996;68:217–27.
- [4] Sawynok J, Esser MJ, Reid AR. Antidepressants as analgesics: an overview of central and peripheral mechanisms of action. J Psychiatry Neurosci 2001;26:21–9.
- [5] Morello CM, Leckband SG, Stoner CP, et al. Randomized double-blind study comparing the efficacy of gabapentin with amitriptyline on diabetic peripheral neuropathy pain. Archives of Internal Medicine 1999;159:1931–7.
- [6] Raja SN, Haythornthwaite JA, Pappagallo M, et al. Opioids versus antidepressants in postherpetic neuralgia: a randomized, placebo- -controlled trial. Neurology 2002;59:1015–21.
- [7] Lauria-Horner BA, Pohl RB. Pregabalin: a new anxiolytic. Expert Opin Investig Drugs 2003; 12:663–72.
- [8] Frampton JE, Foster RH. Pregabalin in the treatment of postherpetic neuralgia. Drugs 2005;65:111–18.
- [9] Busch JA, Strand JC, Posvar EL, et al. Pregabalin (CI-1008) single-dose pharmacokinetics and safety/tolerance in healthy subjects after oral administration of pregabalin solution or capsule doses
- [10] Bockbrader HN, Wesche D. Pharmacokinetic profile of pregabalin: results of a series of studies
- [11] Czuczwar SJ & Patsalos PN. The new generation of GABA enhancers: potential in the treatment of epilepsy. CNS Drugs 2001; 15:339–50.
- [12] Sabatowski R, Gálvez R, Cherry DA, et al. Pregabalin reduces pain and improves sleep and mood disturbances in patients with postherpetic neuralgia: results of a randomised, placebo- controlled clinical trial. Pain 2004;109: 26–35.
- [13] Dworkin RH, Corbin AE, Young JP Jr, et al. Pregabalin for the treatment of postherpetic neuralgia: a randomized, placebo controlled trial. Neurology 2003;60:1274–83.
- [14] van Seventer R, Bladin C, Hoggart B, et al. Pregabalin dosed twice a day (BID) efficaciously and safely treats neuropathic pain associated with postherpetic neuralgia (abstract). J Pain 2004;5(Suppl 1):58.
- [15] Frampton JE, Scott LJ. Pregabalin in the treatment of painful diabetic peripheral neuropathy. Drugs 2004;64:2813–20.
- [16] Rosenstock J, Tuchman M, LaMoreaux L, et al. Pregabalin for the treatment of painful diabetic peripheral neuropathy: a double-blind, placebo- controlled trial. Pain 2004;110:628–38.
- [17] Lesser H, Sharma U, LaMoreaux L, et al. Pregabalin relieves symptoms of painful diabetes neuropathy. Neurology 2004;63:2104–10.
- [18] Sharma U, Allen R, Glessner C, et al. Pregabalin effectively relieves pain in patients with diabetic peripheral neuropathy. Study 1008-014