Rivaroxaban – nové antitrombotikum na trhu
Prvým představitelem nové lékové skupiny přímých reverzibilních inhibitorů aktivovaného X. faktoru – xabanů – je rivaroxaban. Blokáda faktoru Xa je důležitá, jedná se o poslední krok aktivace trombinu. Nespornou výhodou je, že není zcela eliminován biologický efekt trombinu potřebný k aktivaci trombomodulinu a k zajištění aktivity antikoagulačně působících proteinů C a S. Výhodou rivaroxabanu je možnost perorálního podávání. Dostatečná doba účinku (t1/2 je 5–11 hod.) umožňuje podávání jedenkrát denně. Další předností je rychlý nástup účinku (cmax je 2–4 hod.) a duální, tj. renální i hepatální vylučování. Díky více cestám bioeliminace (oxidázami CYP i hydrolázami) zůstává minimální prostor pro uplatnění lékových interakcí. V zatím jediné schválené indikaci, tj. v profylaxi tromboembolických komplikací u elektivních ortopedických výkonů (náhrad kloubů), byla dokumentována asi o polovinu vyšší účinnost proti „zlatému standardu“ enoxaparinu, při stejné úrovni výskytu významných krvácivých příhod. Terapeutický potenciál rivaroxabanu bude pravděpodobně širší, probíhají registrační studie u nemocných s akutními koronárními příhodami, s fibrilací síní, s léčbou flebotrombózy a plicní embolie.
Úvod
Antikoagulancia jsme dosud mohli dělit do tří skupin: hepariny a jejich deriváty, hirudiny a jejich deriváty a antivitaminy K. Zatím nejvýraznější vývoj jsme zaznamenali ve skupině heparinů, postupné užití menších a menších podjednotek polysacharidové sekvence heparinu vedlo k zavedení nejméně dvou důležitých lékových skupin – nízkomolekulárních heparinů a pentasacharidů. Třetí skupina heparinových derivátů – dermatansulfáty – se sice v klinické praxi užívá, nicméně jejich postavení jako antikoagulancií není ještě definitivně určeno. Všechny užívané skupiny mají řadu výhod, ale také nevýhod. U derivátů heparinu je velkou nevýhodou nutnost parenterální aplikace. Také skutečnost, že jak heparin, tak nízkomolekulární hepariny i pentasacharidy působí inhibici trombinu či aktivovaného faktoru X (faktor Xa) zprostředkovaně, tj. aktivací antitrombinu, není výhodná. Vedle rizika nízké dostupnosti antitrombinu je handicapem i to, že prostorové vlastnosti antitrombinu neumožní vazbu na trombin již vázaný na fibrinovou síť. Po uvolnění trombinu ze sítě tak vzniká přechodně hyperkoagulační stav, kterému musíme čelit prodlouženým podáváním těchto nepřímých inhibitorů trombinu či faktoru Xa. Třetím problémem, se kterým se můžeme setkat při užití heparinů, je výskyt trombocytopenie indukované heparinem (HIT), která může nemocného ohrozit na životě.
Při užití hirudinů, přímých inhibitorů trombinu, sice odpadá potřeba antitrombinu, nesetkáme se s indukcí HIT, nicméně zůstává potřeba parenterálního podání, a navíc přistupuje vysoká cena léčby a úzké indikační spektrum. Poslední skupina, antivitaminy K, je v praxi nejrozšířenější. Výhodou jsou nízké náklady na vlastní lék (v našich podmínkách warfarin), dostatek klinických zkušeností a zejména možnost perorální aplikace. Nicméně nevýhod je více: zmiňme jen nutnost důsledné monitorace efektu při velké inter- i intraindividuální variabilitě účinku (při polymorfismu cílového enzymu a polymorfismu biodegradace), vysoké riziko lékových a potravinových interakcí a pomalý nástup účinku.
Tyto nevýhody dostupných antikoagulancií vedly k vývoji nových antitrombotik. Máme tak recentně dostupné dvě skupiny léčiv: inhibitory trombinu – gatrany – a inhibitory faktoru Xa – xabany. Blokáda faktoru Xa stojí o krok výše a inhibuje konverzi protrombinu na trombin. Trombin není pouze aktivátor hemostázy (vnitřní cesty, konverze fibrinogenu na polymer fibrinu a aktivace destiček), ale aktivací trombomodulinu spouští antikoagulační kaskádu proteinů C a S, a tak zpětnou vazbou zajišťuje rovnováhu koagulačního i antikoagulačního systému. Z těchto důvodů může inhibice trombinu vést k rebound fenoménu a ve srovnání s inhibitory faktoru Xa je terapeutické spektrum relativně užší. Vývoj proto směřuje k přímým (tj. na antitrombinu nezávislým) a současně perorálně účinným inhibitorům trombinu či faktoru Xa. Faktor Xa je klíčovým koagulačním faktorem, který může být aktivován jak vnitřní, tak zevní cestou, a jedna molekula faktoru Xa dává vznik tisíci molekulám trombinu.
Celkově vývoj na poli antitrombotik směřuje k vytvoření ideálního antikoagulačního léku, který by splňoval řadu vlastností. Měl by optimálně mít možnost perorální aplikace (ideálně současně i možnost parenterální aplikace v případě urgentních stavů), účinek by měl být rychlý a spolehlivý, bez nutnosti monitorace, měl by mít širokou terapeutickou šíři, nízkou variabilitu interindividuální léčebné odpovědi, nízký potenciál k lékovým interakcím, možnost rychlého ukončení účinku podáním antidota a konečně příznivou farmakoekonomickou charakteristiku. Jak vyplyne z následujícího přehledu, nový přímý inhibitor faktoru Xa rivaroxaban se této charakteristice v řadě bodů přibližuje, nesplňuje jen podmínku dostupnosti antidota a nejsou ještě známy všechny údaje o farmakoekonomických vlastnostech. Čekáme také na výsledky studií v ostatních léčebných indikacích.
Mechanismus působení rivaroxabanu, farmakologické vlastnosti
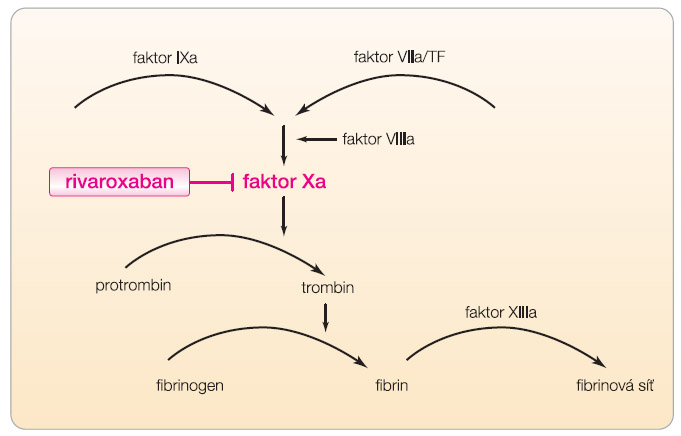 Rivaroxaban, derivát oxazolidinonu, je přímý reverzibilní inhibitor aktivovaného faktoru Xa (obr. 1). Vlastní, relativně malá molekula přímo kompetitivně obsazuje katalytické místo koagulačního faktoru. Jde o vysoce selektivní vazbu, která inhibuje faktor Xa v přímé závislosti na dávce. Jakožto přímý inhibitor může rivaroxaban inhibovat jak volný Xa, tak vázaný v protrombinázovém komplexu. Maximální inhibice aktivity faktoru Xa se pohybuje mezi 22–68 % a přetrvává po dobu nejméně 12 hodin. Absorpce po perorální aplikaci je vysoká, dosahuje téměř 100 %. Maximální koncentrace (cmax ) je dosaženo po 2,5–4 hodinách a mírně se prodlužuje příjmem potravy. Biologická dostupnost činí 80 %. Eliminace je ze dvou třetin cestou renální a zbytek je játry eliminován žlučí. U nemocných v renálním selhání či s jaterní cirhózou se setkáváme s dvoj- až trojnásobně vyšší expozicí rivaroxabanu, analogicky se také prodlužuje doba eliminace. Podobně mírné prodloužení eliminace (více než 6–9 hodin) vidíme u starších pacientů a u osob s nízkou hmotností. Nadváha naopak eliminaci neovlivňuje. Preklinické studie na zdravých dobrovolnících ukázaly, že v rozmezí dávek 5–80 mg dochází k inhibici faktoru Xa v závislosti na podané dávce. Monitorace efektu je obtížná. Prodloužení protrombinového času (PT) a aktivovaného parciálního tromboplastinového času (aPTT) sice koreluje s plazmatickou koncentrací rivaroxabanu, vztah je však pouze orientační.
Rivaroxaban, derivát oxazolidinonu, je přímý reverzibilní inhibitor aktivovaného faktoru Xa (obr. 1). Vlastní, relativně malá molekula přímo kompetitivně obsazuje katalytické místo koagulačního faktoru. Jde o vysoce selektivní vazbu, která inhibuje faktor Xa v přímé závislosti na dávce. Jakožto přímý inhibitor může rivaroxaban inhibovat jak volný Xa, tak vázaný v protrombinázovém komplexu. Maximální inhibice aktivity faktoru Xa se pohybuje mezi 22–68 % a přetrvává po dobu nejméně 12 hodin. Absorpce po perorální aplikaci je vysoká, dosahuje téměř 100 %. Maximální koncentrace (cmax ) je dosaženo po 2,5–4 hodinách a mírně se prodlužuje příjmem potravy. Biologická dostupnost činí 80 %. Eliminace je ze dvou třetin cestou renální a zbytek je játry eliminován žlučí. U nemocných v renálním selhání či s jaterní cirhózou se setkáváme s dvoj- až trojnásobně vyšší expozicí rivaroxabanu, analogicky se také prodlužuje doba eliminace. Podobně mírné prodloužení eliminace (více než 6–9 hodin) vidíme u starších pacientů a u osob s nízkou hmotností. Nadváha naopak eliminaci neovlivňuje. Preklinické studie na zdravých dobrovolnících ukázaly, že v rozmezí dávek 5–80 mg dochází k inhibici faktoru Xa v závislosti na podané dávce. Monitorace efektu je obtížná. Prodloužení protrombinového času (PT) a aktivovaného parciálního tromboplastinového času (aPTT) sice koreluje s plazmatickou koncentrací rivaroxabanu, vztah je však pouze orientační.
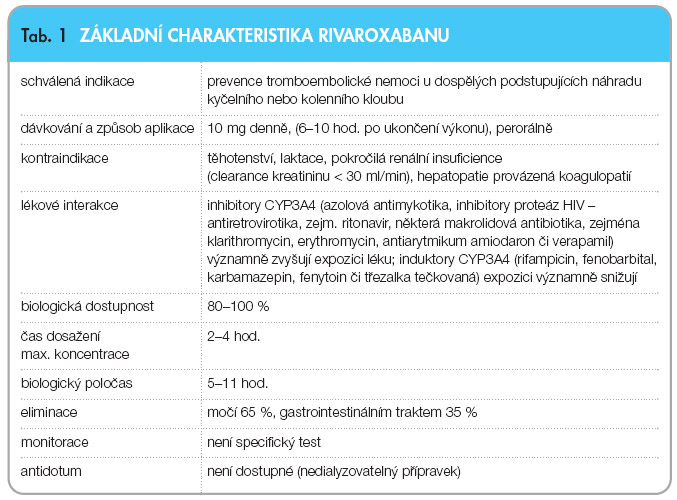 Bioeliminace rivaroxabanu je zprostředkována jak oxidací a zvýšením hydrofilie izoenzymem CYP3A4 (a částečně též CYP2J2), tak transportním systémem – glykoproteinem P (P-gp). Transformace oxidázou CYP3A4 je zřejmě významnější, neboť po podání silných inhibitorů, jako jsou azolová antimykotika (zejm. ketokonazol) či antiretrovirotika (zejm. ritonavir), dochází k významnému zvýšení expozice, naopak inhibice P-gp zvyšuje expozici jen málo. Podobně indukce CYP3A4 klinicky významně snižuje expozici rivaroxabanu. Při studování rizika interakcí mezi rivaroxabanem a nejčastější konkomitantní terapií – acetylsalicylovou kyselinou (ASA) nebo nesteroidními antirevmatiky (např. naproxenem) – nebylo prokázáno ovlivnění účinku. Na druhé straně byl v řadě případů potvrzen teoretický předpoklad významného zvýšení účinku po inhibitorech CYP3A4 (itrakonazol, ketokonazol, klarithromycin, erythromycin, verapamil, amiodaron, řada antiretrovirotik) a snížení efektu při současném podávání induktorů (např. rifampicin, fenobarbital či třezalka tečkovaná) [1–4]. Ve vztahu k izoenzymům CYP i ke glykoproteinu P se chová rivaroxaban jako substrát, a neovlivňuje tak metabolismus jiných léčiv. Souhrnně je rivaroxaban charakterizován v tab. 1.
Bioeliminace rivaroxabanu je zprostředkována jak oxidací a zvýšením hydrofilie izoenzymem CYP3A4 (a částečně též CYP2J2), tak transportním systémem – glykoproteinem P (P-gp). Transformace oxidázou CYP3A4 je zřejmě významnější, neboť po podání silných inhibitorů, jako jsou azolová antimykotika (zejm. ketokonazol) či antiretrovirotika (zejm. ritonavir), dochází k významnému zvýšení expozice, naopak inhibice P-gp zvyšuje expozici jen málo. Podobně indukce CYP3A4 klinicky významně snižuje expozici rivaroxabanu. Při studování rizika interakcí mezi rivaroxabanem a nejčastější konkomitantní terapií – acetylsalicylovou kyselinou (ASA) nebo nesteroidními antirevmatiky (např. naproxenem) – nebylo prokázáno ovlivnění účinku. Na druhé straně byl v řadě případů potvrzen teoretický předpoklad významného zvýšení účinku po inhibitorech CYP3A4 (itrakonazol, ketokonazol, klarithromycin, erythromycin, verapamil, amiodaron, řada antiretrovirotik) a snížení efektu při současném podávání induktorů (např. rifampicin, fenobarbital či třezalka tečkovaná) [1–4]. Ve vztahu k izoenzymům CYP i ke glykoproteinu P se chová rivaroxaban jako substrát, a neovlivňuje tak metabolismus jiných léčiv. Souhrnně je rivaroxaban charakterizován v tab. 1.
Klinické studie
 S rivaroxabanem byla provedena řada studií k vyhledání optimální léčebné dávky (fáze II klinického hodnocení), kdy byly zkoušeny v ortopedických indikacích dávky 2,5 až 40 mg podávané jednou či dvakrát denně, lék byl podáván 6–8 hodin po provedené operaci a porovnáván se standardní dávkou enoxaparinu aplikovanou večer před výkonem. V rámci II. fáze hodnocení v indikaci léčby flebotrombóz byla dokumentována stejně velká regrese trombu i stejná incidence tromboembolizace jako u enoxaparinu v kombinaci s antivitaminem K [5–7]. Na komplexu studií II. fáze byla k detailnímu prověření účinnosti a bezpečnosti v indikaci prevence tromboembolické nemoci u elektivních ortopedických výkonů zvolena dávka 10 mg jedenkrát denně.
S rivaroxabanem byla provedena řada studií k vyhledání optimální léčebné dávky (fáze II klinického hodnocení), kdy byly zkoušeny v ortopedických indikacích dávky 2,5 až 40 mg podávané jednou či dvakrát denně, lék byl podáván 6–8 hodin po provedené operaci a porovnáván se standardní dávkou enoxaparinu aplikovanou večer před výkonem. V rámci II. fáze hodnocení v indikaci léčby flebotrombóz byla dokumentována stejně velká regrese trombu i stejná incidence tromboembolizace jako u enoxaparinu v kombinaci s antivitaminem K [5–7]. Na komplexu studií II. fáze byla k detailnímu prověření účinnosti a bezpečnosti v indikaci prevence tromboembolické nemoci u elektivních ortopedických výkonů zvolena dávka 10 mg jedenkrát denně.
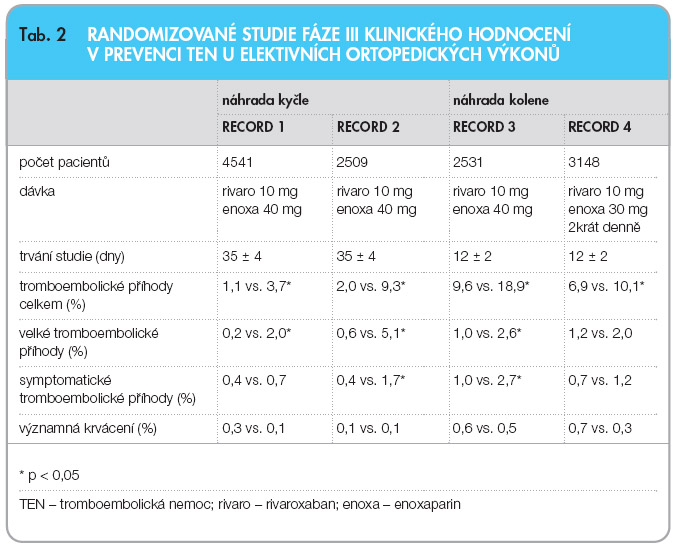
 Pro zhodnocení účinnosti a bezpečnosti je rozhodující III. fáze klinického hodnocení. V době publikování tohoto článku byly dokončeny studie v rámci indikace v ortopedii. Celý výzkumný program byl nazván RECORD (Regulation of Coagulation in Major Orthopaedic Surgery Reducing the Risk of DVT and PE), celkem se jednalo o 4 samostatné studie v indikaci prevence tromboembolické nemoci po náhradách kyčelních nebo kolenních kloubů. Prospektivní, dvojitě slepé, randomizované studie provedené u celkem 12 730 nemocných porovnávaly účinnost a bezpečnost rivaroxabanu a enoxaparinu. Rivaroxaban byl podáván v jedné dávce 10 mg postoperačně, enoxaparin v dávce 40 mg rovněž jedenkrát denně (s prvou dávkou enoxaparinu preoperačně). Pouze ve studii RECORD 4 byla užita dávka 30 mg 2krát denně. Studie RECORD 1 a 2 byly provedeny v indikaci náhrady kyčle, RECORD 3 a 4 byly prováděny u nemocných po náhradě kolenních kloubů. Charakteristika studií a výsledky
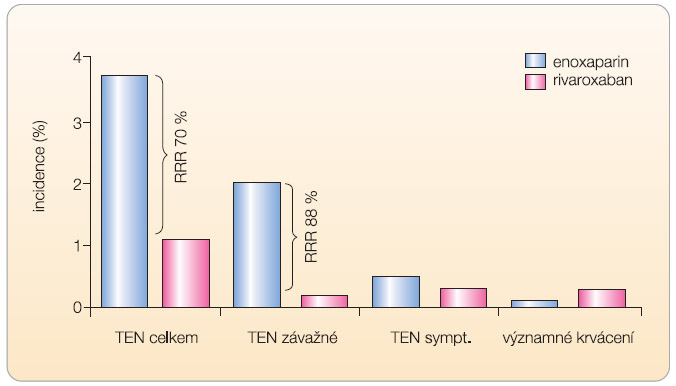
Pro zhodnocení účinnosti a bezpečnosti je rozhodující III. fáze klinického hodnocení. V době publikování tohoto článku byly dokončeny studie v rámci indikace v ortopedii. Celý výzkumný program byl nazván RECORD (Regulation of Coagulation in Major Orthopaedic Surgery Reducing the Risk of DVT and PE), celkem se jednalo o 4 samostatné studie v indikaci prevence tromboembolické nemoci po náhradách kyčelních nebo kolenních kloubů. Prospektivní, dvojitě slepé, randomizované studie provedené u celkem 12 730 nemocných porovnávaly účinnost a bezpečnost rivaroxabanu a enoxaparinu. Rivaroxaban byl podáván v jedné dávce 10 mg postoperačně, enoxaparin v dávce 40 mg rovněž jedenkrát denně (s prvou dávkou enoxaparinu preoperačně). Pouze ve studii RECORD 4 byla užita dávka 30 mg 2krát denně. Studie RECORD 1 a 2 byly provedeny v indikaci náhrady kyčle, RECORD 3 a 4 byly prováděny u nemocných po náhradě kolenních kloubů. Charakteristika studií a výsledky 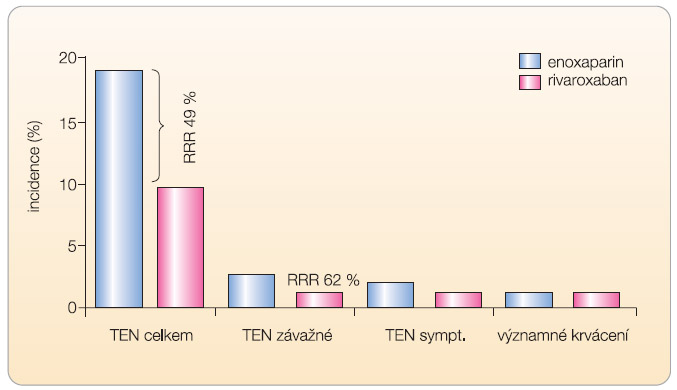 účinnosti jsou uvedeny v tab. 2. Ve všech studiích byl rivaroxaban účinnější než enoxaparin – v primárním ukazateli sestávajícím z incidence všech prokázaných flebotrombóz, plicní embolizace a celkové mortality, stejně jako v ukazateli proximální trombózy, plicní embolizace a úmrtí na následky tromboembolické nemoci (graf 1, 2). Současně ve studii RECORD 2 a RECORD 3 se snížila incidence symptomatických forem trombózy. Bezpečnostní profil rivaroxabanu se sice zásadně nelišil od enoxaparinu ve
účinnosti jsou uvedeny v tab. 2. Ve všech studiích byl rivaroxaban účinnější než enoxaparin – v primárním ukazateli sestávajícím z incidence všech prokázaných flebotrombóz, plicní embolizace a celkové mortality, stejně jako v ukazateli proximální trombózy, plicní embolizace a úmrtí na následky tromboembolické nemoci (graf 1, 2). Současně ve studii RECORD 2 a RECORD 3 se snížila incidence symptomatických forem trombózy. Bezpečnostní profil rivaroxabanu se sice zásadně nelišil od enoxaparinu ve 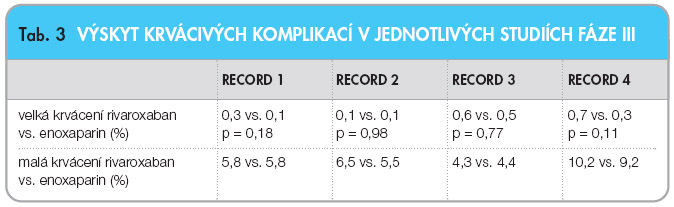 smyslu výskytu významných a méně závažných krvácení, nicméně mírně vyšší procento krvácení bylo při léčbě rivaroxabanem vyčísleno (jakékoliv krvácení přítomno u 7 % ze 6183 léčených rivaroxabanem, oproti 6,5 % u 6200 léčených enoxaparinem, viz tab. 3) [8–12].
smyslu výskytu významných a méně závažných krvácení, nicméně mírně vyšší procento krvácení bylo při léčbě rivaroxabanem vyčísleno (jakékoliv krvácení přítomno u 7 % ze 6183 léčených rivaroxabanem, oproti 6,5 % u 6200 léčených enoxaparinem, viz tab. 3) [8–12].
Indikace
Jedinou schválenou indikací je profylaxe žilní tromboembolie při elektivní náhradě kyčelního či kolenního kloubu dospělých. Efekt v ostatních perspektivních indikacích – v indikaci léčby flebotrombózy, v profylaxi tromboembolické mozkové příhody u nemocných s fibrilací síní, v léčbě akutních koronárních příhod, zejména nestabilní anginy pectoris a non-Q infarktu myokardu, tedy non-STEMI příhod, či v prevenci tromboembolické nemoci u interních nemocných se prověřuje.
Nežádoucí účinky a kontraindikace
Stejně jako u všech antitrombotik je nutno počítat s rizikem krvácení. Při střednědobém podávání (2–6 týdnů) se krvácení vyskytlo u 3–4 % nemocných, převážně se jednalo o krvácení z dásní, rektální krvácení, hematemézu, hematurii či perioperační krvácení z rány. Významné krvácení, které vedlo k anémii, se objevilo asi u 1 % nemocných. Při krvácení z rány je indikováno lokální ošetření (komprese apod.), při méně závažném krvácení stačí prodloužení dávkovacího intervalu, závažnější krvácení řešíme krevními převody, infuzemi a vynecháním podání léku. Snížit resorpci je možno podáním aktivního uhlí, urychlit biodegradaci můžeme např. extrakty z třezalky. Rivaroxaban není dialyzovatelný. Specifické antidotum není známo. Ostatní nežádoucí účinky jsou vzácnější. Občas se vyskytlo zvýšení hladiny jaterních enzymů (GMT, ALT či AST), z kožních projevů se objevil pruritus a exantém. Rivaroxaban je kontraindikován především při výskytu krvácení či při jeho významném riziku, při přecitlivělosti na účinnou látku či na pomocné látky a při riziku nedostatečné bioeliminace léčiva, tj. při těžkém renálním selhání (s glomerulární filtrací pod 0,25 ml/s) nebo při těžkém jaterním selhání. Vzhledem k tomu, že rivaroxaban přechází placentou a do mateřského mléka, je jeho podání v graviditě a při laktaci přísně kontraindikováno.
Dávkování
Doporučené dávkování v profylaxi je 10 mg rivaroxabanu v jedné denní dávce, nicméně existují studie o výhodnosti rozdělení do dvou dávek. První dávka má být podána 6–10 hodin po ortopedickém zákroku. U nemocných s renálním selháním s poklesem filtrace pod 0,5 ml/s musíme být opatrní a být si vědomi vyššího rizika krvácení, dávkovací interval je možno i prodloužit. Při terminálním renálním selhání s poklesem filtrace pod 0,25 ml/s je léčba rivaroxabanem kontraindikována. Při jaterním selhání se opět expozice zvyšuje na dvojnásobek, dávku můžeme proto redukovat či dávkovací interval prodloužit. Délka podávání po operaci či náhradě kyčle má trvat 5 týdnů, u kolenního kloubu 2 týdny.
Závěr
Předností rivaroxabanu je vysoká selektivita, předvídatelný účinek při perorální aplikaci a dlouhé působení, což umožňuje aplikaci v prevenci jedenkrát denně. Výsledky III. fáze klinického hodnocení v programu RECORD prokázaly vyšší účinnost rivaroxabanu v prevenci vzniku trombózy u elektivních ortopedických výkonů na velkých kloubech při porovnání s enoxaparinem. Probíhají rozsáhlé studie v léčbě žilní trombózy a plicní embolie (EINSTEIN DVT, EINSTEIN PE, EINSTEIN EXT). V profylaxi tromboembolizace při fibrilaci síní probíhá studie ROCKET AF, na prevenci 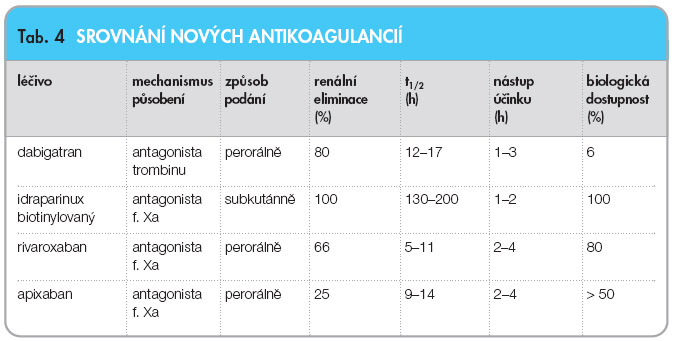 tromboembolických událostí u hospitalizovaných pro akutní onemocnění interního charakteru je zaměřena studie MAGELLAN a léčbou akutních koronárních příhod se zabývá studie ATLAS ACS – TIMI 46. V budoucnosti by bylo zajímavé přímé porovnání efektivity rivaroxabanu s ostatními novými antikoagulancii – dabigatranem, biotinylovaným idraparinuxem nebo apixabanem (tab. 4). Všechny tyto nové molekuly se zdají být v prevenci tromboembolické nemoci pokrokem oproti stávajícímu standardu.
tromboembolických událostí u hospitalizovaných pro akutní onemocnění interního charakteru je zaměřena studie MAGELLAN a léčbou akutních koronárních příhod se zabývá studie ATLAS ACS – TIMI 46. V budoucnosti by bylo zajímavé přímé porovnání efektivity rivaroxabanu s ostatními novými antikoagulancii – dabigatranem, biotinylovaným idraparinuxem nebo apixabanem (tab. 4). Všechny tyto nové molekuly se zdají být v prevenci tromboembolické nemoci pokrokem oproti stávajícímu standardu.
Seznam použité literatury
- [1] Kubitza D, Becka M, Wensing G, et al. Safety, pharmacodynamics and pharmacokinetics of BAY 59-7939 an oral, direct factor Xa inhibitor after multiple dosing in healthy male subjects. Eur J Clin Pharmacol 2005; 61: 873–880.
- [2] Mueck W, Eriksson BI, Bauer KA, et al. Population pharmacokinetics and pharmacodynamics of rivaroxaban – an oral, direct factor Xa inhibitor in patients undergoing major orthopaedic surgery. Clin Pharmacokinet 2008; 47: 203–216.
- [3] Laux V, Perzborn E, Kubitza D, et al. Preclinical and clinical characteristics of rivaroxaban: a novel, oral, direct factor Xa inhibitor. Semin Thromb Hemost 2007; 33: 512–523.
- [4] Kubitza D, Becka M, Mueck W, et al. Rivaroxaban (BAY 59-7939) – an oral, direct factor Xa inhibitor – has no clinically relevant interaction with naproxen. Br J Clin Pharmacol 2007; 63: 496–476.
- [5] Eriksson BI, Borris LC, Dahl OE, et al. Dose-escalation study of rivaroxaban BAY 59-7939 – an oral, direct Factor Xa inhibitor for the prevention of venous thromboembolism in patients undergoing total hip replacement. Thromb Res 2007; 120: 685–693.
- [6] Eriksson BI, Borris LC, Dahl OE, et al. Oral, direct Factor Xa inhibition with BAY 59-7939 for the prevention of venous thromboembolism after total hip replacement. J Thromb Haemost 2006; 4: 121–128.
- [7] Turpie AGG, Fisher WD, Bauer KA, et al. BAY 59–7939: an oral, direct Factor Xa inhibitor for the prevention of venous thromboembolism in patients after total knee replacement. A phase II dose-ranging study. J Thromb Haemost 2005; 3: 2479–2486.
- [8] Eriksson BI, Borris LC, Friedman RJ, et al., for the RECORD1 Study Group. Rivaroxaban versus enoxaparin for thromboprophylaxis after hip arthroplasty. N Engl J Med 2008; 358: 2765–2775.
- [9] Lassen MR, Ageno W, Borris LC, et al., for the RECORD3 Investigators. Rivaroxaban versus enoxaparin for thromboprophylaxis after total knee arthroplasty. N Engl J Med 2008; 358: 2776–2786.
- [10] Kakkar AK, Brenner B, Dahl OE, et al., for the RECORD2 Investigators. Extended duration rivaroxaban versus short-term enoxaparin for the prevention of venous thromboembolism after total hip arthroplasty: a double-blind, randomised, controlled trial. Lancet 2008; 372: 31–39.
- [11] Turpie AGG, Lassen MR, Davidson BL, et al. Rivaroxaban versus enoxaparin for thromboprophylaxis after total knee arthroplasty (RECORD4): a randomised trial. Lancet 2009; 373: 1673–1680.
- [12] Eriksson BI, Borris LC, Dahl OE, et al. A once-daily, oral, direct Factor Xa inhibitor, rivaroxaban (BAY 59-7939), for thromboprophylaxis after total hip replacement. Circulation 2006; 114: 2374–2381.