Ximelagatran
V prognóze nemocných s kardiovaskulárními chorobami hrají trombotické a tromboembolické příhody klíčovou roli. Bez trombózy, nasedající zpravidla na nestabilní plát, by degenerativní cévní choroby nebyly na prvním místě příčin úmrtí. Bez tromboembolizace by fibrilace síní byla málo závažnou arytmií a flebotrombóza bez rizika plicní embolie by nebyla postrachem operačních oborů. Vzájemně se proplétající řetězec – destičková hemostáza, hemokoagulace a fibrinolýza – ovlivňujeme na řadě úrovní, užíváme protidestičkové léky, antikoagulancia a fibrinolytika. Antikoagulancia typu antimetabolitů vitaminu K jsou sice podávána již déle než 50 let a prodělala veliký vývoj, nicméně dosud zdaleka nemáme v ruce ideální lék. Jediné dostupné antikoagulans pro perorální užití – warfarin – má řadu nevýhod. Jmenujme jen pomalý nástup účinku, možný prokoagulační efekt v prvních fázích léčby, významnou interakci s řadou léků či velké interindividuální rozdíly ve farmakokinetice s nutností monitorace. Z těchto důvodů je logický intenzivní vývoj v této oblasti farmakoterapie. Jedním z nejslibnějších a ve výzkumu nejdále pokročilým perorálním antikoagulanciem je ximelagatran.
Mechanismus účinku
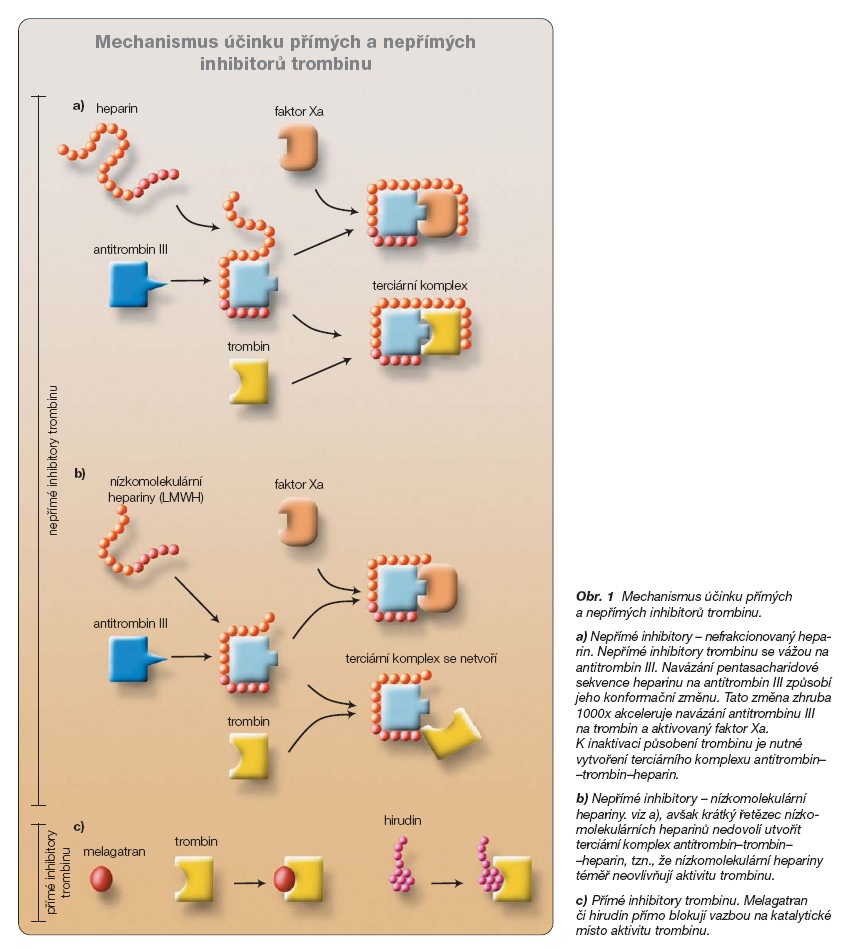
Melagatran, aktivní metabolit ximelagatranu, je přímým inhibitorem trombinu. Trombin je klíčovou proteázou hemostázy. V prvních fázích trombogeneze aktivuje trombocyty. V koagulační kaskádě vzniká malé množství trombinu aktivací „zevní cesty" po uvolnění tkáňového faktoru z poškozené tkáně. Toto malé množství trombinu pak aktivuje „vnitřní cestu", která teprve amplifikací jednotlivých kroků vedoucích k další aktivaci protrombinu celý proces koagulace rozběhne. Výsledkem je polymerizace rozpustného fibrinogenu na nerozpustnou fibrinovou síť. K zajištění rovnováhy je též přítomen systém antikoagulační. Klíčovou reakcí je zde vazba trombinu s povrchovým endotelovým receptorem trombomodulinem. Vazbou na trombomodulin ztrácí trombin schopnost polymerizovat fibrin, a naopak aktivuje antikoagulační protein C, který degraduje aktivní faktory koagulační kaskády. Uvědomíme-li si výjimečné místo trombinu, pak nás nepřekvapí, že většina farmakologických intervencí směřuje právě k inhibici trombinu. V organismu je trombin přirozeně inhibován antitrombinem. Afinita antitrombinu k vazebnému místu trombinu je malá, a proto je potřeba antitrombin nejprve aktivovat heparinem či heparany.
Antikoagulancia aktivující antitrombin (heparin, nízkomolekulární hepariny či pentasacharidy) označujeme jako nepřímé inhibitory trombinu. Jejich nevýhodou je nutnost parenterální aplikace a neschopnost inaktivovat trombin vázaný ve fibrinové síti. Tento trombin vázaný na fibrin i trombin uvolněný z vazby po fibrinolýze (spontánní či farmakologické) je stále aktivní a zachovává si svou enzymatickou aktivitu. Po odeznění účinku nepřímého inhibitoru (např. heparinu) se tak může objevit hyperkoagulační stav. Z těchto důvodů jsou do praxe zaváděny přímé inhibitory trombinu. Pro parenterální aplikaci jsou již k dispozici hirudiny (desirudin, lepirudin či bivalirudin) či nepeptidový argatroban. Jejich nevýhodou je nutnost parenterální aplikace a relativně kratší doba účinku.
S velkými nadějemi je tedy očekáván první perorálně účinný přímý inhibitor trombinu – ximelagatran a jeho účinný metabolit melagatran.
Melagatran je nízkomolekulárním analogem N-terminální sekvence a-řetězce fibrinogenu, oblasti vazebného místa pro trombin. Díky této podobnosti melagatran obsazuje katalytické místo jak volného, tak vázaného trombinu. Tato vazba je velmi specifická, afinita k trombinu je asi 350–450krát větší než afinita k ostatním dvojřetězcovým serinovým proteázám (např. než k plazminu). Důsledkem obsazení katalytického místa trombinu je inhibice prokoagulační i antikoagulační vlastnosti trombinu (obr. 1).
Překvapením bylo, když se zjistilo, že melagatran inhibuje i tvorbu trombinu. Tento fakt lze vysvětlit tím, že v prvé fázi koagulace je pozitivní zpětnou vazbou autokatalyticky trombinem potencována vlastní konverze z protrombinu [1,2].
Farmakokinetické vlastnosti
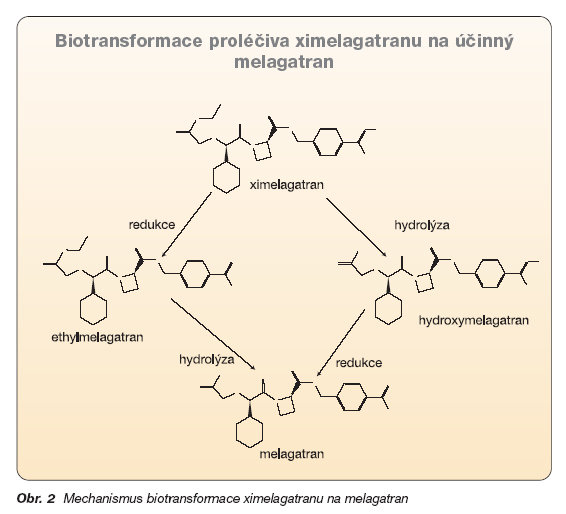
Ximelagatran je prekurzor přímého inhibitoru trombinu melagatranu. Vzhledem k tomu, že účinná látka melagatran má nízkou biologickou dostupnost (4–8 %), je perorálně podáván ve formě prekurzoru, ximelagatranu, který má biologickou dostupnost dostatečnou. Po resorpci se ximelagatran rychle biokonvertuje na melagatran (tmax je 1,6–2,0 hod. po perorálním podání ximelagatranu). Ani jeden z intermediálních metabolitů (hydroxymelagatran či ethylmelagatran) není biologicky aktivní (obr. 2).
Resorpce ximelagatranu je stabilní s nízkou interindividuální variabilitou a není ovlivněna potravou či příjmem alkoholu. Rovněž konverze na melagatran (hydrolýzou či redukcí) je stabilní, není závislá na cytochromovém systému a nebyla zjištěna ani variabilita konverze na podkladě polymorfismu konvertujících enzymů. Interindividuální variabilita AUC byla pouze 8–12 %. Biologická dostupnost melagatranu, je-li podán ve formě proléčiva, je 20–25 %. V plazmě je melagatran volný, jen méně než 15 % je vázáno na bílkoviny plazmy. Plazmatický poločas je středně dlouhý (t1/2 je 3–5 hodin) a umožňuje podávat lék ve dvanáctihodinových intervalech. Většina léku – asi 80 % – je přímo bez další degradace eliminována z organismu ledvinami, při renálním selhání je proto nutno dávky redukovat. Věk, tělesná hmotnost ani hepatopatie vylučování melagatranu neovlivňují [1,3].
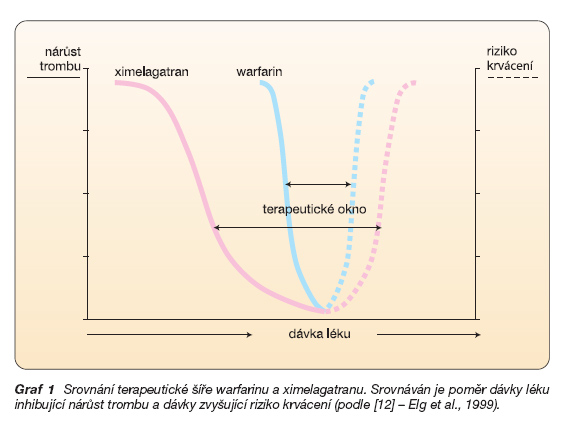
Díky stabilní dostupnosti, minimální variabilitě v metabolismu a ve vylučování je účinek léku spolehlivý, a není jej proto nutno monitorovat. Právě tato skutečnost a relativně široká terapeutická šíře melagatranu jej činí ve srovnání s jediným dalším perorálně účinným antikoagulanciem – warfarinem – daleko výhodnějším (graf 1).
Lékové interakce
V rámci registračních studií byla testována léková interakce s představiteli hlavních typů metabolismu (substrátů, induktorů i inhibitorů) na podkladě izoenzymů systému CYP, transferáz či transportních proteinů (např. amiodaronu, atorvastatinu, digoxinu či dihydropyridinů). Nebyla zjištěna významná interakce. Pouze erythromycin mírně zvýšil maximální dosaženou koncentraci ximelagatranu, nicméně zvýšení expozice léku nemělo klinický dopad.
Klinické zkušenosti
Účinek ximelagatranu byl testován v rámci profylaxe tromboembolické nemoci a různých stavů provázených trombotickými a tromboembolickými příhodami: u chronické fibrilace srdečních síní, u akutních koronárních příhod či v léčbě flebo-trombóz.
a) Účinek u nemocných s fibrilací síní
První velkou oblastí, kde by bylo užití ximelagatranu perspektivní, jsou nemocní s fibrilací síní. Tato arytmie je v populaci rozšířená, v šesté až sedmé věkové dekádě postihuje asi 5 % populace a ve věku nad osmdesát let již trpí fibrilací síní každý desátý. Hlavní riziko vyplývající z fibrilace síní jsou tromboembolizační příhody do velkého oběhu. Zhruba šestina iktů spadá na vrub fibrilace síní, resp. riziko iktu je touto tachyarytmií zvýšeno pětinásobně. Výskyt mozkových příhod při fibrilaci síní výrazně stoupá s věkem: v šestém deceniu je nízké – 1,5 %/rok, u osmdesátníka již dosahuje 23 % za rok [4–6]! Antikoagulační léčba warfarinem je schopna toto riziko snížit o 62 %, absolutní riziko je sníženo v primární prevenci o 2,7 % a v sekundární o 8,4 % [4]. Z těchto dat jednoznačně vyplývá důležitost antikoagulační léčby v této indikaci. Dosavadní postupy, zejména léčba antagonisty vitaminu K, mají mnoho limitací: velká interindividuální i intra-individuální variabilita účinku a problémy s ní spojené vedou k nedostatečnému využívání léčebného přínosu, k významnému poddávkovávání a na druhé straně i k častému výskytu krvácivých komplikací. Proto by spolehlivější antikoagulační léčba měla velký klinický význam.
Účinek antikoagulační léčby ximelagatranem u nemocných s fibrilací síní byl testován v rámci programu SPORTIF. Studie SPORTIF II testovala optimální dávku a volně přešla v dlouhodobou, více než čtyři roky trvající studii SPORTIF IV. Průběžná analýza výsledků po dvou letech studie ukázala pokles závažných příhod (iktu, tranzitorní mozkové ischémie – TIA či většího krvácení) při léčbě ximelagatranem (2,2 % ročně) proti warfarinu (7,8 % ročně) [7].
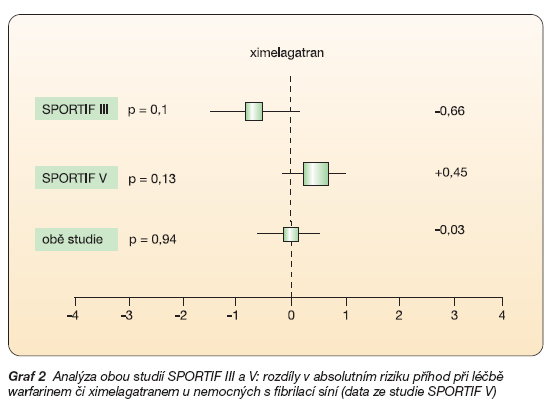
Zatím největší antitrombotickou studií byla dvojstudie SPORTIF III/V. V indikaci profylaxe tromboembolických komplikací u fibrilace síní byl ximelagatran (v dávce 2 x 36 mg) porovnáván s warfarinem (s cílem udržet INR mezi 2–3). Do obou studií bylo zařazeno více než 7 300 nemocných s chronickou či paroxysmální fibrilací síní bez chlopenní vady, délka léčby byla 1,5 až 2 roky. Cílových hodnot antikoagulace ve warfarinové větvi (INR 2–3) bylo dosaženo obdobně v obou studiích, tj. v 66 % a 68 %, tedy častěji nežli v běžné praxi. Sdružená analýza dvou obdobně navržených studií SPORTIF III (otevřená) a V (dvojitě zaslepená) dokumentovala srovnatelný účinek ximelagatranu a warfarinu na incidenci ischemických mozkových příhod (graf 2).
Ve studii SPORTIF III byl pozorován nevýznamný pokles iktů a ve SPORTIF V naopak vzestup. Vzhledem k tomu, že studie byly koncipovány k souhrnné analýze, je podstatné, že v obou studiích dohromady poklesl výskyt mozkových příhod nevýznamně o 3 %. To znamená, že byl prokázán dostatečný antitrombotický účinek ximelagatranu. Výskyt krvácivých komplikací byl významně nižší při léčbě ximelagatranem (25,8 % proti 29,8 %). Při léčbě ximelagatranem byl pozorován vyšší výskyt tranzitorních asymptomatických elevací ALT, tento nežádoucí účinek bude později probrán samostatně.
b) Účinek v léčbě a v profylaxi flebo-trombózy
Ximelagatran byl rovněž úspěšně testován u akutních flebotrombóz, v léčbě i v profylaxi tromboembolických příhod. Flebotrombóza (trombóza hlubokého žilního systému dolních končetin, DVT) komplikovaná plicní embolií je třetí nejčastější kardiovaskulární chorobou, hned po ICHS a mozkových cévních příhodách. Incidence plicní embolie je asi 0,1 % ročně, bezprostřední mortalita se pohybuje kolem 15 % [8]. K dlouhodobým následkům flebotrombóz patří posttrombotický syndrom (bércové vředy, otoky a bolest). Profylaxe i léčba flebotrombóz patří k důležitým oblastem užití antikoagulancií. V profylaxi (například perioperačně) i v léčbě jsou zlatým standardem nízkomolekulární hepariny (LMWH), event. v profylaxi pentasacharid fondaparinux. Jejich nevýhodou je zejména nutnost parenterální aplikace. V dlouhodobé profylaxi užívaný warfarin má opět nevýhody probírané výše. Užití ximelagatranu v této indikaci je tedy logickým a nadějným krokem.
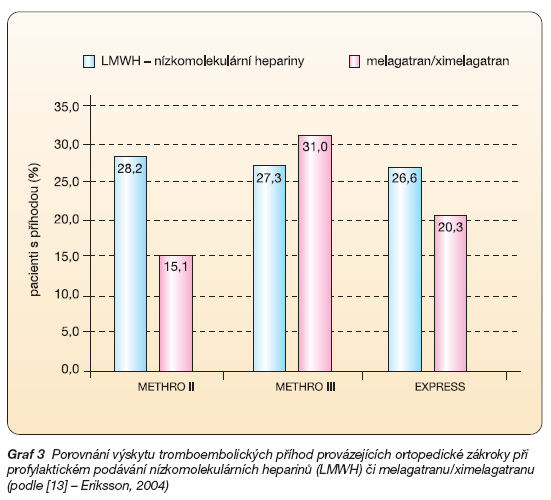
U ortopedických operací je riziko flebotrombózy největší, bez profylaxe je trombus v žilním systému prokazatelný u 40–80 % nemocných a symptomatická plicní embolie postihne 5–10 % operovaných. V profylaxi flebotrombózy u ortopedických nemocných byl porovnáván ximelagatran s LMWH v programu METHRO. Dvojitě slepá studie METHRO II u téměř dvou tisíc nemocných po náhradě kyčelního či kolenního kloubu porovnávala dalteparin (5000 IU/denně) s melagatranem podávaným v různých dávkách parenterálně v období bezprostředně po operaci a s ximelagatranem v období pozdějším, tj. do 7.–10. dne. Účinek byl sledován rutinním venografickým vyšetřením. Výskyt tromboembolické příhody klesal v závislosti na dávce. Při podávání nejvyšší dávky, tj. 3 mg melagatranu sc. (4x denně), a ximelagatranu 24 mg (2x denně) byl výskyt téměř poloviční (15,1 %) proti dalteparinu (28,2 %). Výskyt krvácivých příhod byl srovnatelný [9]. Tato vyšší dávka melagatranu i ximelagatranu byla testována též proti enoxaparinu (40 mg denně) ve studii METHRO III u nemocných po implantaci kyčelní endoprotézy. V obdobně koncipované studii (flebografická kontrola) nebyl prokázán rozdíl ve výskytu tromboembolických příhod ani krvácení. Největší studií byla studie EXPRESS s více než 2 700 nemocnými po náhradě velkých kloubů. Kombinace melagatran/ximelagatran byla provázena 2,3 % výskytu proximální flebotrombózy či plicní embolie, zatímco při léčbě enoxaparinem bylo riziko významně vyšší, tj. 6,3 %. Opět nebylo rozdílu v součtu krvácivých příhod, incidence závažnějšího krvácení byla nižší u ximelagatranu (1,2 % versus 3,1 %) [9].
Bylo-li započato s léčbou odloženě, tj. až v následujícím pooperačním dnu, byla výhodnější léčba enoxaparinem [9]. Byl-li porovnáván ximelagatran s warfarinem nasazeným po operaci, byl výhodnější ximelagatran [9]. Postupy v obou studiích však nelze považovat za lege artis, a není proto nutné je blíže rozvádět.
V profylaxi tromboembolických komplikací provázejících ortopedické zákroky se melagatran/ximelagatran osvědčil. Jak vyplývá z přehledu (graf 3), je profylaxe přímým inhibitorem trombinu významně lepší, či alespoň srovnatelná s profylaxí nízkomolekulárním heparinem. V řadě zemí Evropy je proto tato indikace schválena a léčba ximelagatranem již zavedena.
Vedle profylaxe je nutná i účinná léčba flebotrombózy. V kvartetu studií THRIVE byl hodnocen význam ximelagatranu v této indikaci. Porovnáván byl s dalteparinem a s warfarinem. V těchto studiích byla potvrzena dobrá účinnost i snášenlivost v léčbě akutní trombózy (THRIVE I, II). V porovnání s dalteparinem došlo ke srovnatelné regresi trombu u obou antikoagulancií u téměř 70 % vyšetřených. V hodnocení progrese trombu bylo v ximelagatranové větvi pozorováno nevýznamně více případů, nález však bylo možno vysvětlit pozdějším podáním přímého inhibitoru trombinu [10].
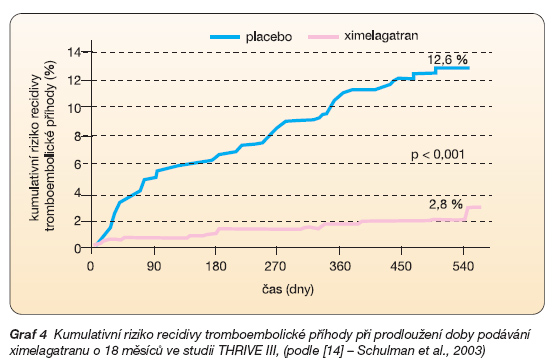
Zajímavé jsou i výsledky dlouhodobé profylaxe ximelagatranem u nemocných, kteří prodělali tromboembolickou příhodu a u kterých byl šestiměsíční interval podávání lege artis antikoagulační léčby warfarinem doplněn o dalších 18 měsíců trvající profylaxi ximelagatranem (THRIVE III). Ve srovnání s placebem vedlo prodloužení antikoagulační léčby k několikanásobnému snížení recidivy tromboembolické příhody (2,8 % vs 12,6 %), tj. recidiva embolizace poklesla o absolutních 9,8 % (graf 4).
Výskyt drobného i významného krvácení stoupl nevýznamně z 21 % při podávání placeba na 23,9 % při léčbě ximelagatranem [10]. Zastavení progrese či regrese embolizujícího trombu při plicní embolii u 92 % postižených bylo dokumentováno ve studii THRIVE IV [10].
c) Účinek v léčbě akutních koronárních příhod
Poslední ze základních vhodných indikací je antikoagulační léčba akutních koronárních příhod (tj. nestabilní anginy pectoris i infarktu myokardu s elevací či bez elevace úseku ST). Akutní koronární příhody jsou na prvním místě v příčinách mortality v průmyslových zemích. Koronární trombóza je rozhodující událostí v etiopatogenezi těchto akutních forem ICHS. Při destabilizaci plátu se vedle obnažení subendoteliálních vrstev cévní stěny a aktivace destičkové hemostázy uplatní i uvolnění tkáňového faktoru iniciujícího koagulaci. Proto jsou v léčbě akutních koronárních příhod výhodná, vedle protidestičkové léčby, i antikoagulancia. Dosud byl zlatým standardem v této indikaci nízkomolekulární heparin enoxaparin. Uvědomíme-li si nevýhody LMWH vyplývající z neschopnosti inaktivovat vázaný trombin, pak je zcela logické užití přímého inhibitoru trombinu.
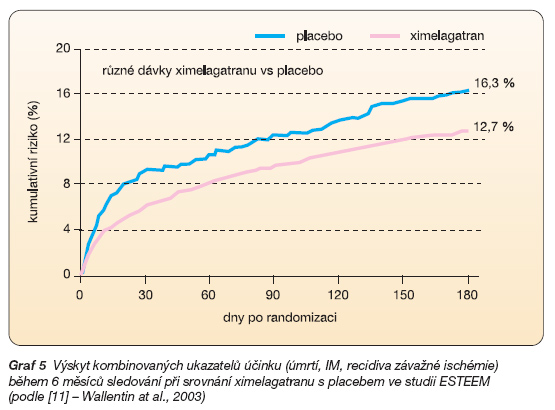
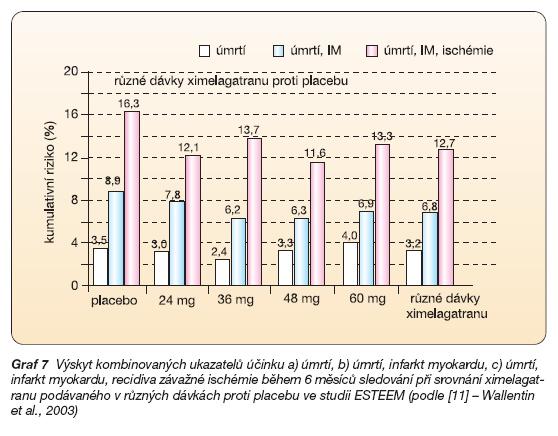
Ve studii ESTEEM byl porovnáván ximelagatran v různých dávkách s placebem v indikaci sekundární prevence po překonaném infarktu myokardu (s elevací ST i bez elevace úseku ST). Do studie bylo zařazeno téměř 1 900 nemocných v subakutní fázi infarktu léčených protidestičkovou léčbou – acetylsalicylovou kyselinou. Po šesti měsících léčby byl v ximelagatranové skupině patrný významně nižší pokles kombinovaného ukazatele (úmrtí, výskyt reinfarktu či závažné ischémie) o 24 % (graf 5).
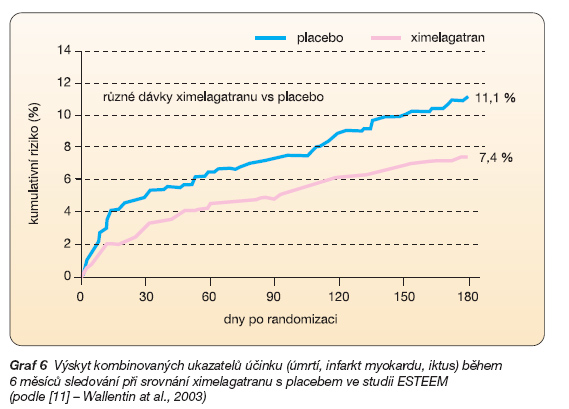
Velké cévní příhody (úmrtí, reinfarkt či iktus) poklesly ještě významněji, tj. o 34 % (graf 6).
Při analýze významu různých dávek se ukázalo, že nebyl rozdíl mezi nízkými a vysokými dávkami (graf 7).
Výskyt závažných krvácivých komplikací byl v ximelagatranové skupině 1,8 %, při placebu 0,9 %, rozdíl nedosáhl významnosti [11]. Studie jasně ukázala výhodnost ximelagatranu v kombinaci s acetylsalicylovou kyselinou proti acetylsalicylové kyselině samotné. Nicméně chybí srovnání proti duální kombinační léčbě kyselinou acetylsalicylovou a clopidogrelem, která je pokládána za léčbu lege artis v prvních měsících po překonané koronární příhodě.
Indikace
V současné době není zatím v ČR ximelagatran registrován. Nicméně v řadě členských zemí EU je léčba ximelagatranem schválena v indikaci profylaxe tromboembolických příhod v ortopedii. Tato indikace totiž byla ověřena nejdříve a podávání ximelagatranu je pouze krátkodobé. V ostatních indikacích, tj. v léčbě flebo-trombóz, v profylaxi tromboembolických příhod provázejících fibrilaci síní či v časné sekundární prevenci po překonaném myokardiálním infarktu, bude nutno počkat na schválení regulačními orgány.
Nežádoucí účinky
Stejně jako u ostatních antikoagulancií je podávání ximelagatranu spojeno s rizikem krvácivých komplikací. V porovnání s warfarinem či s LMWH však bylo toto riziko menší, zejména byl uniformně zaznamenán pokles výskytu závažných krvácivých příhod ve skupině nemocných léčených ximelagatranem.
Na tomto místě je vhodné uvést určitou nevýhodu ximelagatranu: není dořešeno účinné a specifické antidotum. Ukazuje se však, že v situacích, kdy je nutno ukončit léčbu, je řešením podání rekombinantního aktivovaného faktoru VII, který je schopen inhibici trombinu melagatranem částečně neutralizovat.
Specifickým nežádoucím účinkem ximelagatranu je tranzitorní asymptomatické zvýšení transamináz, konkrétně ALT. Ve všech studiích, kdy podávání ximelagatranu trvalo déle než několik málo týdnů, se objevuje zpravidla asymptomatické tranzitorní zvýšení alanin-transamináz (ALT). Více než dvojnásobný vzestup hodnot je pozorován asi u 10 % léčených, více než trojnásobné zvýšení u 6–8 % léčených. Typické je, že se zvýšení objevuje ve druhém až třetím měsíci léčby, trvá zpravidla několik málo týdnů a spontánně se upravuje nehledě na to, zda byla léčba přerušena či zda bylo v léčbě pokračováno. Vzestup je zpravidla zcela asymptomatický a bez monitorování jaterních testů by jistě unikl pozornosti. Při dalším pokračování v léčbě po dobu tří až čtyř let se již další zvýšení hodnot hladin transaminázy neobjevuje. Zvýšení v naprosté většině neústí ve vznik hepatopatie, nicméně při dlouhodobé léčbě zhruba deseti tisíc nemocných v rámci klinických studií se objevily tři případy jaterního selhání nenavazujícího na epizodu vzestupu. Vzhledem k tomu, že výskyt jaterního selhání v neléčené populaci není nižší, lze o kauzalitě pochybovat. Mechanismus specifického vzestupu ALT není jasný. U nemocných, kteří byli léčeni ximelagatranem kratší dobu než dva týdny, nebyl vzestup zaznamenán vůbec.
Pro bezpečnost nemocného je doporučováno v prvních měsících léčby sledovat hodnoty ALT. Nicméně není jasné, zda je výhodné léčbu ximelagatranem ukončit či přerušit. Úprava hodnot byla totiž stejně rychlá u nemocných, kteří pokračovali v léčbě, jako u těch, kterým byla léčba přerušena. Sami z vlastní zkušenosti víme, že u nemocných, u kterých se vzestup ALT objevil a kteří pokračovali v léčbě v rámci studie SPORTIF IV, se již v průběhu 3–4 let pravidelných kontrol další zvýšení jaterních testů neobjevuje.
Závěr
Shrneme-li uvedené poznatky, pak se před námi rýsuje v podobě ximelagatranu velmi slibné antitrombotikum, které v řadě ohledů předčí stávající zavedené léčebné postupy. Doložena je výhodnost v indikaci prevence tromboembolických příhod u postoperačních stavů, v léčbě a v dlouhodobé profylaxi nemocných s flebotrombózou, v profylaxi tromboembolizačních mozkových příhod u nemocných s fibrilací síní či v časné sekundární prevenci u nemocných, kteří překonali infarkt myokardu. Hlavní výhodou je možnost perorální aplikace a spolehlivost účinku, aniž by bylo nutno účinek léčby monitorovat. Z těchto důvodů se dá očekávat, že ximelagatran v řadě indikací nahradí ostatní antikoagulancia, zejména warfarin.
Seznam použité literatury
- [1] Dobesh PP. Ximelagatran: pharmacology, pharmacokinetics, and pharmacodynamics. Pharmacotherapy 2004; 24: 169S–178S.
- [2] Bostraom SJ, et al. Effects of melagatran, the active form of the oral direct thrombin inhibitor ximelagatran. Blood Coagul Fibrinolysis 2003; 14: 457–462.
- [3] Kereiakes DJ. Ximelagatran: pharmacokinetics and pharmacodynamics of a new strategy for oral direct thrombin inhibition. Rev Cardiovasc Med 2004; 5 (suppl 5): S4–S11.
- [4] Fuster V, et al. AC/AHA/ESC guidelines for the management of patients with atrial fibrilation. Circulation 2001; 104: 2118–2150.
- [5] Atrial Fibrilation Investigators: Risk factor for stroke and efficacy of abtithrombotic therapy in atrial fibrilation. Arch Intern Med 1994; 271: 1449–1457.
- [6] Wittkowsky AK, et al. Pharmacotherapy 2004; 24 (10Pt2): 190S–198S.
- [7] Halperin JL. Ximelagatran: oral thrombin inhibition as anticoagulant therapy in atrial fibrilation. JACC 2005; 45: 1–9
- [8] Goldhaber S. Pulmonary embolism. N Engl J Med 1998; 359: 93–104.
- [9] Hawkins D. The role oral direct thrombin inhibitors in the prophylaxis of venous thrombembolism. Pharmacotherapy 2004; 24 (10Pt2): 179S–183S.
- [10] Busti AJ, et al. The role oral direct thrombin inhibitors in the treatment of venous thrombembolism. Pharmacotherapy 2004; 24 (10Pt2): 184S–189S.
- [11] Wallentin L, et al. Oral ximelagatran for secondary prophylaxis after myocardial infarction: the ESTEEM randomised controlled trial. Lancet 2003; 362: 789–797.
- [12] Elg M, et al. Antithrombotic effects and bleeding time of thrombin inhibitors and warfarin in the rat. Thromb Res 1999; 94: 187–197.
- [13] Eriksson B. Clinical experience with ximelagatran in orthopaedic surgery. Drugs. 2004; 64 (Suppl 1): 27–35.
- [14] Schulman S, et al. Secondary prevention of venous thrombembolism with the oral direct thrombin inhibitor ximelagatran. N Engl J Med 2003; 349: 1713–1721.