Akutní bolest
Bolest lze dělit podle celé řady kritérií. Základní dělení bolesti vychází z délky jejího trvání a rozlišuje mezi bolestí akutní a chronickou. Léčba bolesti vychází z třístupňového žebříčku léčby bolesti SZO. Základ léčby bolesti tvoří neopioidní analgetika, k nimž jsou dle intenzity bolesti přidávána analgetika opioidní. Zatímco při léčbě chronické bolesti se postupuje od léků s nejslabším účinkem k lékům s účinkem nejsilnějším, u léčby akutní bolesti se volí postup opačný. U některých specifických bolestivých stavů je vhodná kombinace s jinými koanalgetiky nebo doplnění terapie o adjuvantní léky používané ke zmírnění nežádoucích účinků analgetik.
Historie léčby bolesti
Historie léčby bolesti je snad stejně stará jako lidstvo samo. Z některých nálezů a kreseb z doby kamenné se usuzuje, že člověk již v této době používal rybích kostí ke stimulaci některých míst na těle, a tím dokázal tlumit bolest. Techniku tlumení bolesti pomocí stimulace akupunkturních bodů dovedli k dokonalosti staří Číňané. Staří Řekové zase používali elektroléčbu bolesti. Všimli si, že pacientům s bolestivým revmatickým postižením kloubů pomáhají opakované elektrické výboje úhoře Scriborinus longum. Základ léčby bolesti však již v době dávno před naším letopočtem tvořila „farmakoterapie". Prvními léky proti bolesti byly rostlinné výtažky a alkoholické nápoje. Prvním používaným lékem byla maková šťáva, kterou rozšířili nomádští obchodníci ze Sýrie. Znalosti účinku opia měli i Řekové, kteří rozlišovali mezi šťávou vytlačovanou z nezralých makovic zvanou meconium a mléčnou šťávou získávanou naříznutím nezralých makovic zvanou opos (odtud název opium). Osobní lékař císaře Nerona vymyslel lék theriak, který se používal jak při nespavosti, tak při léčbě silné bolesti a jehož základní složkou bylo právě opium.
Do Evropy se opium dostalo v období renesance. Na rozvoji jeho používání se významně podílel švýcarský lékař pracující v oblasti farmakologie Paracelsus, který vynalezl opiovou tinkturu. V 18. a 19. století bylo opium dodáváno lékárníkům a lékařům jako lék proti bolesti a sedativum. Již od 16. století však opium bylo stále častěji zneužíváno jako droga.
K významnému objevu došlo v roce 1805, kdy německý lékárník Serturner izoloval z opia bílý prášek, který nazval podle boha spánku Morphea – morphin.
Bohužel od začátku našeho letopočtu až do 19. století převládal v léčbě bolesti spíše církevní názor vycházející z doktríny základního vztahu k bolesti na podkladě Kristovy oběti k záchraně a spasení lidstva. Z tohoto názoru vycházelo i přesvědčení, že bolest a utrpení jsou nutným průvodním jevem života a prostředkem vykoupení a že nikdo nemá právo ji tišit. V 19. století se však objevil v církvi nový pokrokovější názorový proud, který zastávali především katoličtí lékaři a jeptišky ocitající se v bezprostředním kontaktu s trpícími v nemocnicích. Za pomoci tlaku široké katolické veřejnosti byli nakonec nuceni i církevní hodnostáři ustoupit snahám o tišení bolesti.
K významnému zlomu v léčbě peroperační bolesti došlo 16. října 1846. Zubní lékař Wiliam Morton provedl v Bostonu první veřejnou extrakci stoliček v celkové etherové anestezii. Ether byl sice syntetizován již roku 1540 Valeriem Cordusem, ale až počátkem 19. století byla objevena jeho schopnost vyvolávat letargii a ospalost. Ether poprvé použil William Crawford Long 30. března 1842, své výsledky však publikoval až 3 roky po veřejném vystoupení Mortona, a proto o své prvenství přišel. V Praze byl ether poprvé použit pouhých 16 týdnů po jeho prezentaci v Bostonu. O tento čin se zasloužil magistr chirurgie Celestýn Opitz.
Prvním lékařem, který se začal systematicky věnovat léčbě chronické bolesti, byl John J. Bonica, který v roce 1947 ve státě Ilinois ve městě Tacoma založil „Pain Clinic", tedy první ambulanci léčby bolesti. V roce 1953 vydal první ucelenou publikaci věnující se problematice léčby bolesti nazvanou Management of Pain.
Dělení bolesti
Bolest je definována jako nepříjemný senzorický a emocionální prožitek spojený se skutečným či potenciálním poškozením tkání nebo je popisována výrazy takového poškození. Nejčastějším kritériem dělení bolesti je délka jejího trvání. Podle ní se bolest dělí na akutní a chronickou.
Bolest akutní je definována jako bolest, která délkou svého trvání odpovídá vyvolávající příčině a většinou netrvá déle než tři měsíce. Akutní bolest bývá dobře lokalizovatelná, ostrého charakteru, vede k převaze sympatiku a potlačení parasympatiku, k aktivaci neuroendokrinních, imunitních a zánětlivých reakcí, katabolismu, imunosupresi, zvýšené spotřebě kyslíku myokardem, ke snížení motility GIT a řadě dalších změn. Akutní bolest má na rozdíl od bolesti chronické ochranný charakter – upozorňuje na možné poškození organismu. V pooperačním období je jejím výsledkem zvýšení morbidity a mortality, často již výrazně ovlivněné vlastní nemocí, úrazem nebo operací. Kvalitní analgezie snižuje výskyt pooperačních komplikací, umožňuje časnější rehabilitaci a zkrácení hospitalizace a v neposlední řadě má pozitivní vliv na psychiku nemocného, neboť pokud akutní bolest dosahuje vyšší intenzity, často se pojí se strachem a obavami. Akutní bolest i netraumatického původu se výrazně podílí na dočasném snížení kvality života a na ekonomických ztrátách v důsledku pracovní neschopnosti. Jedním z největších rizik akutní bolesti je její přechod v bolest chronickou. Nejúčinnější léčbou akutní bolesti je odstranění vyvolávající příčiny a její včasná a intenzivní léčba. Akutní bolest bývá farmakologicky dobře ovlivnitelná, velmi často lze vystačit s jednou léčebnou modalitou.
Bolest chronická naopak délkou svého trvání neodpovídá vyvolávající příčině, trvá déle než tři měsíce, je spíše tupého a špatně lokalizovatelného charakteru, často místo bolesti neodpovídá místu vzniku bolesti. Chronická bolest je emočně spojená s depresí. Důležitou roli v její léčbě mají vedle farmakoterapeutických též nefarmakologické léčebné postupy.
Léčba akutní bolesti
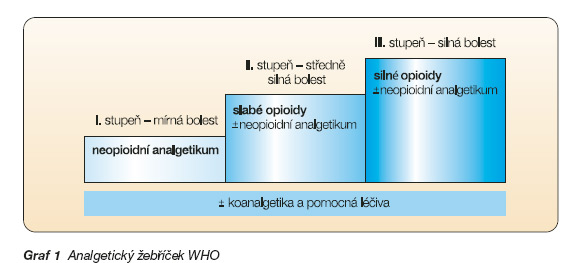
Základ léčby bolesti tvoří žebříček Světové zdravotnické organizace (WHO) publikovaný poprvé v roce 1986, původně určený pro léčbu onkologické bolesti (graf 1).
Velmi záhy byl však zcela přejat také pro léčbu bolesti neonkologického původu. Zatímco pro léčbu bolesti chronické je doporučován postup „step up", tedy po žebříčku směrem nahoru, pro léčbu akutní bolesti je vhodný postup „step down". Analgetický žebříček používá dvě základní skupiny analgetik – neopioidní (1. stupeň) a opioidní (2. a 3. stupeň). Podle žebříčku se u mírných bolestí s VAS 0–4 (vizuální analogová škála vyjadřující intenzitu bolesti, kdy 0 je stav bez bolesti a 10 je maximální představitelná bolest) doporučuje začínat s analgetiky 1. stupně. Pokud bolest přetrvává, nebo se zvyšuje (středně silná bolest s VAS 4–7), mají se přidat slabá opioidní analgetika, a pokud ani to nestačí (silná bolest s VAS 7–10), mají se slabé opioidy vyměnit za silné. Počítá se i s uplatněním tzv. koanalgetik, která mohou tlumit některé specifické typy bolesti, a pomocných léků určených ke zmírnění nežádoucích účinků analgetik (laxativa, antiemetika).
Při léčbě akutní bolesti je vhodné analgetikum použít již na začátku bolestivé ataky. Oddalování užití analgetika vede k nutnosti použít vyšší analgetické dávky. Rizikem nedostatečně léčené akutní bolesti je její chronifikace se všemi důsledky, které k chronické bolesti patří [1].
Neopioidní analgetika
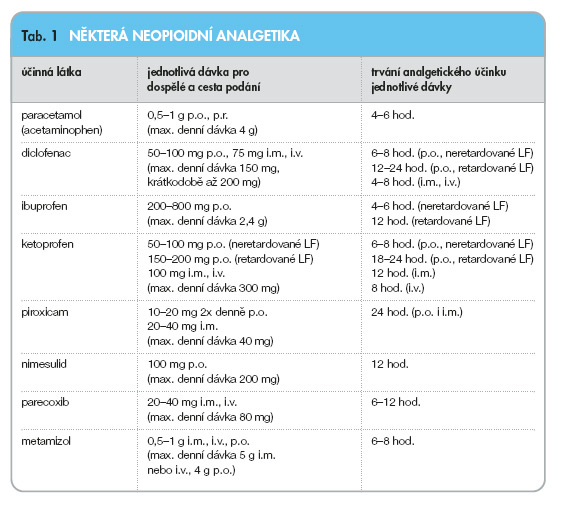
Základ léčby bolesti tvoří neopioidní analgetika. Do této skupiny léků jsou řazeny paracetamol, metamizol a strukturálně poměrně nesourodá skupina nesteroidních antiflogistik (NSA).
Paracetamol patří mezi dobře snášená analgetika. Pro léčbu bolesti je nutné použít dostatečně vysokou jednotlivou dávku, tj. alespoň 650 mg. Maximální denní dávka je 4 g, při jejím dlouhodobějším překračování hrozí riziko hepatotoxicity.
Metamizol je považován spíše za analgetikum poslední volby, zejména pro potenciální riziko poruch krvetvorby či anafylaktické reakce. Jednotlivá dávka je 0,5–1 g, maximální denní dávka je 4–6 g.
Základní princip účinku NSA spočívá v blokádě enzymu cyklooxygenázy (COX), který se v lidském těle vyskytuje ve dvou izoformách: COX 1 se podílí na tvorbě prostaglandinů a ovlivňuje především fyziologické funkce organismu (adhezivita trombocytů, bariérová schopnost žaludeční sliznice, renální funkce), COX 2 se podílí na akceleraci zánětlivé reakce a stimulaci receptorů bolesti (nocisenzorů). Podle selektivity k cyklooxygenáze se NSA dělí na COX 1 preferenční, COX neselektivní, COX 2 preferenční a COX 2 selektivní, pro něž se ujal počeštěný název koxiby.
COX 1 preferenční NSA zastupuje kyselina acetylsalicylová (ASA), která se vzhledem ke svým nežádoucím účinkům (především riziko zvýšené krvácivosti či gastrointestinálních ulcerací) pro dlouhodobější léčbu bolesti nehodí.
Skupina COX neselektivních NSA je zastoupena celou řadou léčiv, z nichž některá jsou dostupná i bez lékařského předpisu (ibuprofen, diclofenac, naproxen). Tyto léky jsou vhodné pro krátkodobou léčbu bolesti u osob bez rizikových faktorů, tj. osob bez poruch krevní srážlivosti či krvetvorby, s normální funkcí ledvin a bez anamnézy peptického vředu.
Některá z těchto analgetik jsou dostupná i v injekčních lékových formách (diclofenac, ketoprofen). Parenterální aplikace analgetik je však obecně indikována pouze u intenzivní akutní bolesti (akutní infarkt myokardu, ledvinové nebo žlučníkové koliky), v ostatních případech má jednoznačně přednost podávání neinvazivní.
COX 2 preferenční NSA zastupují meloxicam a nimesulid. Výhodný se jeví zejména nimesulid, jehož analgetický účinek nastupuje za 15–30 minut a s jehož podáváním se díky jeho COX 2 preferenčnímu působení pojí nižší výskyt nežádoucích účinků, než je tomu u COX neselektivních NSA. Vedle periferního účinku nimesulid vykazuje i účinek centrální pravděpodobně ovlivněním TNF-a. Je vhodný pro léčbu akutních bolestí zad, bolestí hlavy, dysmenorey i jako koanalgetikum při léčbě opioidy [2].
Ve skupině koxibů zbyl v současné době v perorální lékové formě pouze celecoxib, v injekční lékové formě je dostupný parecoxib.
Opioidní analgetika
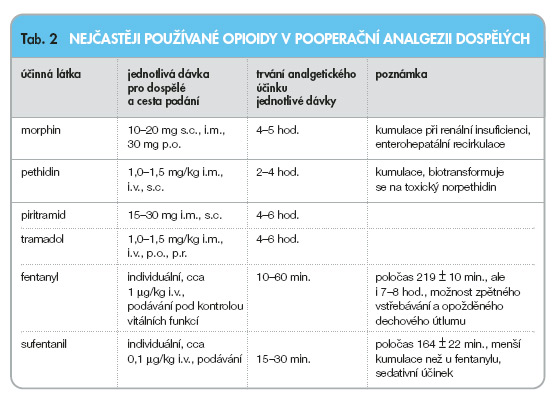
Opiody jsou analgetika působící prostřednictvím opioidních receptorů, jejichž přítomnost byla prokázána v centrálním a v poslední době i v periferním nervovém systému. Opioidy se dělí na slabé a silné.
Ke slabým opioidům se řadí tramadol, dihydrocodein a codein.
Tramadol je slabý m- a k-agonista. Zřejmě silnější jsou jeho účinky na descendentní noradrenergní a serotoninergní antinociceptivní systém. Aplikací tramadolu formou kontinuální intravenózní infuze lze docílit účinné analgezie, maximální denní dávka se v tomto případě pohybuje mezi 500–600 mg, jen výjimečně bývá vyšší. Současné podání neopioidních analgetik může být vhodné u viscerálních bolestí zejména spastického rázu. Často používaná je intramuskulární aplikace tramadolu u pacientů s pooperační bolestí. Optimální interval mezi aplikacemi jednotlivých dávek po 50–100 mg je 4–6 hodin při dodržení maximální denní dávky 400–600 mg. Zdá se, že při infuzní aplikaci tramadolu není při dodržení terapeutické dávky nezbytné sledování dechové frekvence, neboť tramadol v této dávce působí jen velmi zřídka dechový útlum. Tramadol však může působit sedativně, proto by u pacientů rizikových a ve vyšším věku měla být jeho dávka snížena o 30–50 %. Mezi jeho nejčastější nežádoucí účinky patří nauzea, zvracení, pocení, ospalost. Nauzeu a zvracení lze podstatně omezit, pokud je počáteční dávka 1–1,5 mg/kg podávána pomalu během 15–20 minut. Před začátkem léčby tramadolem lze rovněž injekčně podat 10 mg metoclopramidu, nebo lze současně s tramadolem aplikovat infuzi metoclopramidu v dávce 50 mg za 24 hodin, případně podávat jiná antiemetika.
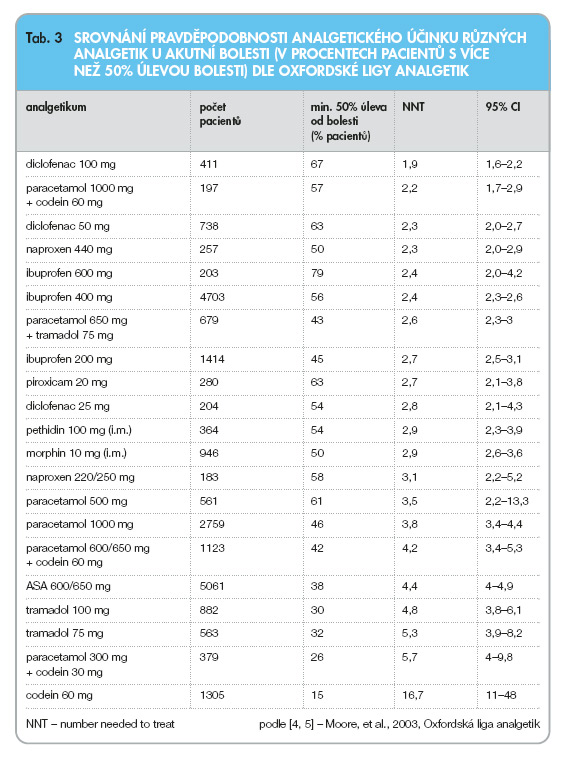
Zesílení analgetického účinku tramadolu lze docílit jeho kombinací s paracetamolem. Kombinace 75 mg tramadolu s 650 mg paracetamolu vykazuje výrazně vyšší analgetický účinek ve srovnání s tramadolem použitým v monoterapii.
Codein je analgeticky slabě působícím opioidem, který se v současnosti používá především v kombinaci s jinými analgetiky, nejčastěji s paracetamolem. Kombinace 60 mg codeinu s 1 g paracetamolu vykazuje velmi dobrý analgetický účinek.
Dihydrocodein vykazuje analgetický účinek obdobný codeinu, jeho maximální racionální denní dávka je 360 mg.
Silné opioidy se podle selektivity dělí na čisté m-agonisty (morphin, hydromorphon, oxycodon, pethidin, piritramid, fentanyl, sufentanil), parciální agonisty (buprenorphin) a agonisty-antagonisty (pentazocin, nalbuphin).
Čistí m-agonisté jsou u intenzivních, zejména pooperačních bolestí analgetiky první volby. Jejich analgetický účinek je mohutný, po intravenózní aplikaci nastupuje do několika minut.
Morphin je klasickým standardem v léčbě bolesti, u akutní bolesti se používá především jeho subkutánní aplikace, kterou lze použít i pro titraci vhodné perorální dávky. Vedle injekčních lékových forem je dostupný i ve formě retardovaných tablet, vhodných však spíše pro léčbu bolesti chronické.
Fentanyl a sufentanil jsou téměř čistí m-agonisté. Ve srovnání s morphinem vykazuje fentanyl 100x vyšší účinnost, sufentanil pak dokonce 1 000x vyšší účinnost. V intenzivní péči je často využíváno jejich kontinuálního intravenózního podávání k léčbě pooperační bolesti. Fentanyl je k dispozici i v lékových formách transdermálních náplastí určených především k dlouhodobější terapii chronické bolesti.
Často používaným lékem pro léčbu pooperační bolesti je piritramid. Jeho dávkování se řídí potřebami pacienta a často se u jednotlivých pacientů velmi liší. Zatímco u jednoho dostačuje 15 mg piritramidu na kvalitní 24hodinovou analgezii, jiný k dosažení stejného efektu potřebuje dávku až šestinásobnou. Z nežádoucích účinků se nejčastěji vyskytuje nauzea a zvracení. Velmi výhodná se jeví kombinace opioidů s neopioidními analgetiky, která umožňuje často velmi výraznou redukci dávky opioidů.
Pethidin má ve srovnání s morphinem nižší spasmogenní efekt, a je tudíž vhodnější pro léčbu akutní kolikovité bolesti. Pro svůj krátký (2 hodiny) a slabý analgetický efekt a možnost hromadění toxického metabolitu je nevhodný k rutinnímu používání při léčbě pooperační bolesti.
Parciální agonisté a smíšení agonisté-antagonisté vykazují na rozdíl od čistých m-agonistů stropový efekt, tzn. že maximálního analgetického účinku je dosaženo již při relativně nízkých dávkách a další zvyšování dávky nevede k intenzivnější analgezii, ale pouze k výraznějším nežádoucím účinkům. K jejich nevýhodám patří především více či méně výrazný psychomimetický efekt. Výhodou je, že při případném předávkování převládne jejich antagonistický účinek, který zabrání dechovému útlumu.
Závěr
Akutní bolest je nejenom nepříjemným subjektivním pocitem, ale pokud je nedostatečně léčena, může se stát významným faktorem komplikujícím pooperační a post-traumatické stavy, nebo příčinou chronifikace bolesti se všemi svými důsledky, jako je výrazné zhoršení kvality života, ekonomické ztráty, vznik depresí, sociální izolace ústící až v rozvrat osobnosti. Základem úspěchu léčby akutní bolesti je její včasně zahájená, dostatečně razantní a pokud možno nežádoucích účinků prostá léčba.
Seznam použité literatury
- [1] Doležal T, Hakl M, Kozák J, Kršiak M, et al. Metodické pokyny pro farmakoterapii akutní a chronické nenádorové bolesti. Bolest, Supplementum, 1, 2004.
- [2] Doležal T, Slíva J. Nimesulidum. Remedia 2004; 14: 2–10.
- [3] Ševčík P. Léčba pooperační bolesti. V Intenzivní perioperační péče, Ed. Zazula, 2000, 67–81.
- [4] Moore A, Edwards J, Barden J, et al. Bandolier´s lit-tle book of pani. Oxford: Oxfords University Press, 2003.
- [5] Oxfordská liga analgetik: www.jr2.ox.ac.uk/bandolier/booth/ painpag/Acutrev/Analgesics/Leagtab.html