Cílená léčba v onkologii
Při pohledu do historie medikamentózní léčby nádorů lze vystopovat první pokusy o nalezení účinného protinádorového léku na počátku minulého století. Šlo o empirií získané poznatky (například podávání Fowlerovy soluce pacientovi s chronickou myeloidní leukémií). Rozvoj v oblasti protinádorové medikamentózní léčby začal v podstatě až po druhé světové válce v padesátých a šedesátých letech, kdy se po klinickém testování dostala do standardní praxe alkylační cytostatika a posléze cytostatika dalších skupin. Podstatou účinku cytostatik je poškozování genetické informace buňky. Vývoj nových léků ze skupiny cytostatik sice pokračuje dále, ale zdá se, že potenciál této skupiny léků poškozujících nespecificky nukleové kyseliny je vyčerpán a nové preparáty z této skupiny nepřinášejí zásadní průlom [2].
Úvod
V letech osmdesátých a devadesátých vzbudily novou naději preparáty ovlivňující (modulující) imunitu: interferony a interleukin-2. Od obou léků se očekávalo zásadní zlepšení. Po desetiletích klinického zkoušení se zjistilo, že přinášejí malé prodloužení života, řádově v měsících, a to jen u omezeného počtu diagnóz. Dnes již mají pevně stanovené indikace ve standardní léčbě [3].
S prudkým rozvojem oblasti molekulární biologie v posledních desetiletích souviselo hlubší poznání regulačních pochodů fyziologických i maligních buněk. Molekulární biologové postupně odhalovali stále hlouběji podrobnosti procesu kancerogeneze. Zjistili, že je to neobyčejně složitý proces podmíněný několikanásobnými genetickými změnami buňky. Následkem těchto pochodů v genomu jsou produkovány aberantní a fúzní molekuly RNA a jimi kódované proteiny, kterými se nádorové buňky liší od jejich fyziologických protějšků. Rozdíly však nemusí být vždy jenom v kvalitě regulačních proteinů, ale někdy i v pouhé kvantitě, v níž jsou určité regulační molekuly tvořeny maligními anebo fyziologickými buňkami [47].
Jakmile byly tyto odchylky a rozdíly mezi maligními a fyziologickými buňkami rozpoznány, soustředily farmaceutické firmy svoje úsilí na hledání nových léků, které by tyto signální cesty ovlivnily. A tak vzniká nová generace léků, které na rozdíl od cytostatik nezasahují a nepoškozují genetickou informaci buňky, ale zasahují o několik úrovní níže, v oblasti proteinů s regulačními a signálními účinky.
Zatím pro tuto lékovou skupinu není standardně zaveden a všeobecně akceptován odborný termín. V literatuře lze nejčastěji nalézt termín cílená terapie – targeted therapy. Použijme tedy tohoto termínu pro všechny protinádorové léky, jejichž mechanismus účinku je jiný než necílené poškozování nukleových kyselin.
Pokud akceptujeme tuto definici, je na první pohled zřetelné, že tato skupina léků sestává z více podskupin, nejzřetelnější skupinou jsou monoklonální protilátky, které jsou namířeny proti některému proteinovému cíli. Druhou výraznou skupinou jsou léčiva o nevelké molekulové hmotnosti, jejichž cílem je obvykle zablokovat aktivní centrum některého regulačně důležitého enzymu. V anglické literatuře se tyto léky velmi často nazývají termínem small drugs.
Nové léky pro léčbu maligních chorob si kladou za cíl zasáhnout přímo a cíleně do klíčových mechanismů kancerogeneze na úrovni buňky. Tyto léky zpravidla specificky ovlivňují jeden určitý buněčný proces s cílem poškodit dominantně buňky nádoru (případně jeho mikroprostředí), pokud možno s minimálními nežádoucími vedlejšími účinky [27].
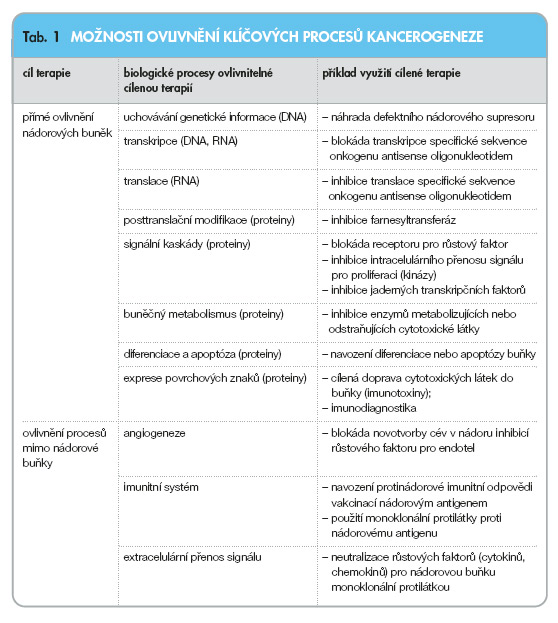
Bohužel však ani tyto léky nejsou bez výraznějších nežádoucích účinků, neboť do určité míry ovlivní i některé fyziologické buňky. Ovlivnění klíčových procesů kancerogeneze viz tab. 1.
Jejich použití v monoterapii nebo v kombinaci s konvenčními postupy přináší pokrok v léčbě doposud obtížně léčitelných a nevyléčitelných nádorů. Toto sdělení poskytuje obecné shrnutí poměrně nové a velmi široké problematiky. Shrnuje mechanismy účinku targeted therapy a pouze zmiňuje jednotlivé preparáty. Právě obšírnost tématu nutí autory k zařazení pouze těch léků, jež překročily hranice klinických studií fáze II. Neboť kdyby byla zmíněna všechna klinicky testovaná farmaka ve fázích I a II klinických studií, text by byl neúnosně rozsáhlý, a navíc velká část těchto léků se pravděpodobně vůbec nedostane do klinické praxe [57].
Velmi obtížné je zvolit didakticky přehledné rozdělení preparátů pro cílovou léčbu. Za nejpřehlednější se nám jevilo vyjít z cílového působení jednotlivých léků.
Čtenář se může setkat i s jiným schematickým dělením, neboť uvedené léky se často v mnohém prolínají, například všechny léky s účinkem na EGFR jsou ve své podstatě inhibitorem tyrozinkinázy a mají vzato do důsledku také účinek antiangiogenní, antiapoptotický, antiproliferativní apod.
Pro ilustraci, jakými cestami se ubíral vývoj, začneme přehledem léků, které ovlivňují receptor pro epidermální růstový faktor.
Léčebné možnosti ovlivnění receptoru pro epidermální růstový faktor
Receptor pro epidermální růstový faktor je přítomen u řady karcinomů a významně se podílí na jejich vzniku. Jeho ovlivnění je proto žádoucí u mnoha nádorových onemocnění. Proto byl receptor pro epidermální růstový faktor vybrán jako jeden z cílů moderních léčebných postupů [56].
Léky ovlivňující tuto receptorovou skupinu tvoří v současnosti klinicky nejvýznamnější a nejširší skupinu, jednotlivé látky však mají odlišný níže uvedený mechanismus účinku [15, 49].
Základní údaje o receptoru pro epidermální růstový faktor (EGFR)
EGFR (známý také jako ErbB-1 nebo HER1) patří spolu s HER2/Neu (ErbB-2), ErbB-3/HER3 a ErbB-4/HER4 do rodiny epidermálních receptorů růstových faktorů. Tato receptorová skupina hraje klíčovou roli v homeostáze normálních tkání a fetálního vývoje u rozmanitých druhů organismů včetně člověka. Změny v rodině receptorů EGFR často doprovází vznik a rozvoj řady karcinomů a zcela zásadně u nich zasahuje do procesu kancerogeneze. Jeho ovlivnění je proto žádoucí u mnoha nádorových onemocnění. Zvýšená exprese EGFR v nádorové tkáni má navíc negativní prognostický význam [37, 35, 40, 47].
Aktivace receptoru pro epidermální růstový faktor
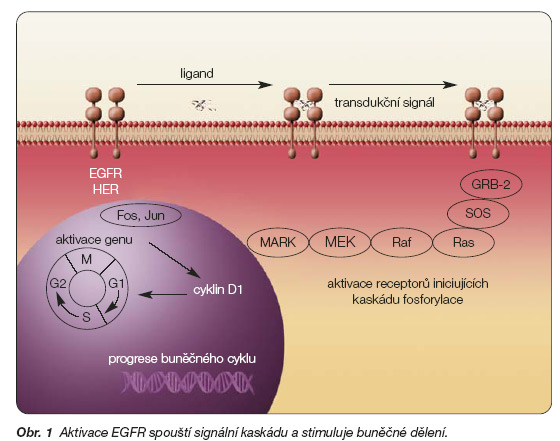
EGFR je aktivován některým z růstových faktorů (EGF, TGF-a) či obecně ligandem, který se váže na extracelulární část receptoru. Intracelulární část receptoru má tyrozinkinázovou aktivitu a je po aktivaci vnější části autofosforylována. Tato fosforylace vede k dimerizaci (párování) receptorů. Tím je zahájena signální kaskáda, ve které je řadou navazujících fosforylací přenesen signál až do jádra, kde se projeví aktivací transkripce cílových genů. Aktivace EGFR genu je znázorněna na obr. 1 [47, 79].
Gen kódující receptor epidermálního růstového faktoru
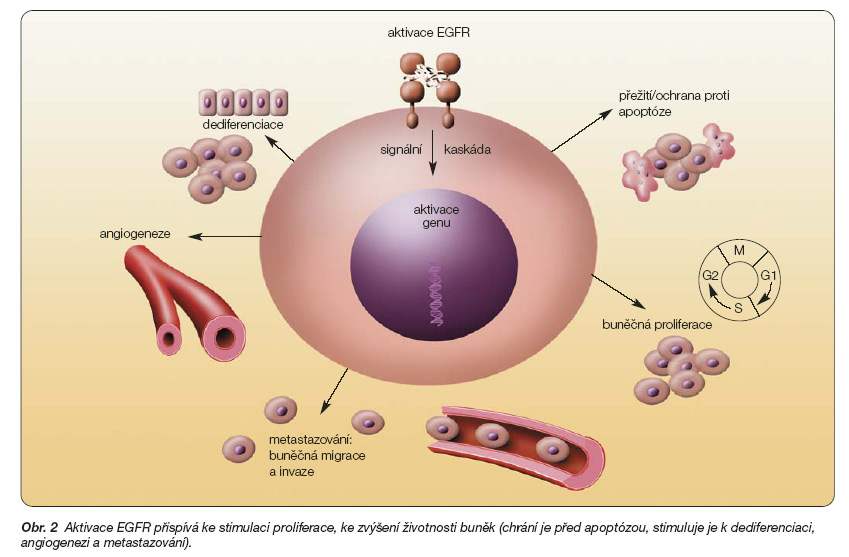
Jde o protoonkogen umístěný na chromozomu 7q22. Jeho onkogenní aktivace může být způsobena genovou amplifikací, genovou mutací, ale také intracelulárními interakcemi nebo prostou nadprodukcí růstových faktorů či jiných molekul se schopností vazby na receptor a aktivace příslušné signální kaskády. EGFR je protein, který zasahuje do řady klíčových procesů buňky. Podílí se na ochraně buňky před apoptózou, na stimulaci proliferace, angiogenezi, buněčné diferenciaci a migraci, jak je znázorněno na obr. 2 [49].
Význam zvýšené exprese receptoru pro epidermální růstový faktor
Zvýšená exprese EGFR ve srovnání s buňkami okolních tkání je prokázána u mnoha buněčných nádorových typů (viz tab. 2).
Navíc u karcinomu hlavy a krku, vaječníků, čípku děložního, močového měchýře a karcinomu jícnu je značně zvýšená exprese EGFR spojena s kratší dobou do relapsu i kratším celkovým přežitím a EGFR status je potvrzen i jako nezávislý prognostický faktor. U ostatních nádorů není tento vztah zcela jednoznačný. Jsou rovněž známa data prokazující souvislost mezi zvýšenou expresí receptorů rodiny EGFR a rezistencí k hormonální terapii, chemoterapii a radioterapii.
Důvody, proč právě EGFR se dostal do centra pozornosti, lze shrnout do následujících bodů:
– ‑zapojení signální dráhy EGFR do vývoje nádorů;
– ‑výskyt u řady nádorových onemocnění;
– ‑prokázaný vztah exprese EGFR s negativní prognózou nádorů;
– ‑jiný mechanismus účinku cílených léčebných přístupů ve srovnání s konvenčními postupy, (chemoterapie, radioterapie, hormonální terapie) snižuje možnost zkřížené rezistence;
– ‑prokázaná anti-EGFR aktivita některých látek v experimentech in vitro a in vivo;
– ‑potenciace účinku cytotoxických látek a radioterapie látkami s anti-EGFR aktivitou v preklinických experimentech [49].
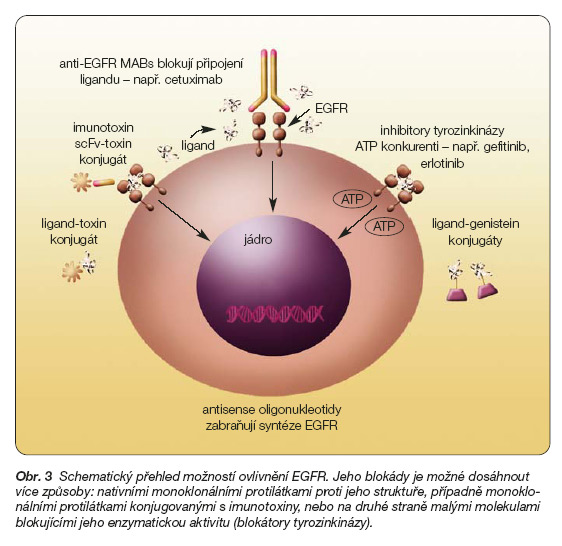
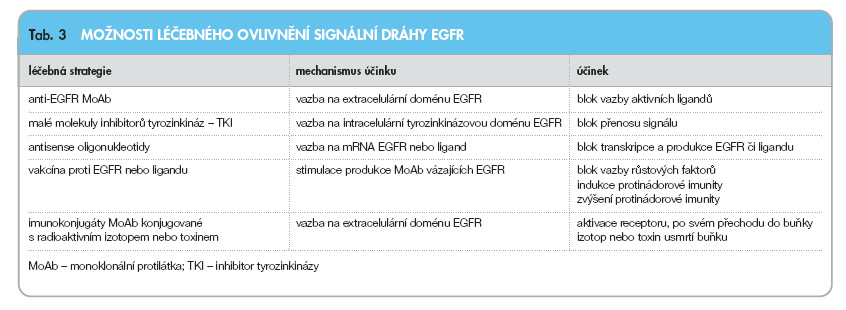
Na obr. 3 a v tab. 3 je uveden základní přehled dostupných léčebných strategií určených k ovlivnění EGFR.
Mezi tzv. anti-EGFR přístupy patří použití monoklonálních protilátek volných či s navázaným toxinem či radionuklidem, použití malých molekul inhibitorů tyrozinkináz, antisense oligonukleotidů nebo protinádorových vakcín. O možnostech genové terapie se uvažuje. V další části jsou stručně uvedeny klinické aplikace a výsledky u jednotlivých anti-EGFR léčebných strategií. K dispozici jsou v současnosti nejméně 4 anti-EGFR monoklonální protilátky (monoclonal antibody MoAb). Stručně se zmíníme pouze o dvou, které mají větší klinický význam.
Monoklonální protilátky blokující EGFR
Cetuximab
Cetuximab je chimérická monoklonální protilátka. Cetuximab se kompetitivně váže na extracelulární doménu EGFR, tímto inhibuje vazbu dalších možných aktivátorů. A takto je zabráněno autofosforylaci receptoru a následně celé kaskádě dějů, které vedou k aktivaci onkogenu a následně způsobí růst tumoru. Léčba MoAb není doprovázena hematologickou a gastrointestinální toxicitou pozorovanou po použití většiny konvenčních cytostatik. U pokročilých onemocnění se léčbou MoAb často dosahuje stabilizace. Fáze III klinických studií právě probíhají u nemocných s karcinomem hlavy a krku a metastazujícím kolorektálním karcinomem. U pacientů s pokročilým nebo recidivujícím karcinomem hlavy a krku ve studii fáze III bylo dosaženo odpovědi u 23 % nemocných léčených cisplatinou v kombinaci s cetuximabem oproti 9 % pacientů léčených cisplatinou a placebem. Celkové přežití však nebylo rozdílné v obou skupinách. Cetuximab je rovněž testován u nemalobuněčného karcinomu plic, karcinomu pankreatu a dalších EGFR pozitivních nádorů, někdy v kombinaci s cytostatiky. Studie s monoterapií cetuximabem prokázaly velmi dobrou toleranci bez hematologické toxicity. Hlavním vedlejším účinkem byla kožní reakce vyskytující se téměř u všech nemocných, která však nebyla limitující pro zvyšování dávky. V současné době je cetuximab povolen jako léčba druhé linie pro metastazující karcinom kolorekta v USA i v Evropě. A probíhají studie fáze III testující cetuximab v kombinaci s cytostatiky jako léčbu první linie a adjuvantní léčbu [8, 9, 16, 35, 51, 54].
Trastuzumab
Jde o protilátku proti epidermálnímu růstovému faktoru kódovanému genem HER-2/neu (proteinu p185HER-2). Receptor HER-2 je transmembránový glykoprotein, je součástí rodiny receptorů pro epidermální růstový faktor. Trastuzumab se váže na extracelulární část receptoru, a blokuje tak jeho funkci. Přestože lze nadměrnou expresi HER-2 prokázat u více druhů solidních nádorů (např. u karcinomů ovaria, endometria, pankreatu, žaludku, prostaty a meduloblastomu), největší klinické zkušenosti jsou s využitím trastuzumabu v léčbě karcinomu prsu. Základním předpokladem úspěšné léčby trastuzumabem je přesné a spolehlivé určení nadměrné exprese či amplifikace HER-2 v nádoru. Vyskytuje se u 25–30 % žen s karcinomem prsu a koresponduje se špatnou prognózou onemocnění. Trastuzumab je podle výsledků klinických studií účinný v monoterapii i v kombinaci s chemoterapií u pacientek s karcinomem prsu a zvýšenou expresí HER-2/neu. Léčba trastuzumabem je obvykle velmi dobře tolerována, časným nežádoucím účinkem je cytokinová reakce. Závažným pozdním nežádoucím účinkem je kardiotoxicita. Může způsobit jen asymptomatický pokles ejekční frakce levé komory, ale i manifestní srdeční selhání. K této komplikaci dochází častěji u pacientek s předchozím srdečním onemocněním a také při současné nebo předchozí léčbě antracykliny [45, 59].
ABX-EGFI
Jde o plně humanizovanou protilátku anti-EGFR zkoušenou ve fázích II klinických studií u kolorektálního karcinomu, karcinomu prostaty, ledvin a plic. Rozporně interpretovány jsou výsledky získané u karcinomu ledvin, kde byla pozorována buď minimální léčebná odpověď, nebo stabilizace u 58 % nemocných s pokročilým onemocněním, zatímco nemoc u 42 % nemocných dále progredovala. Z těchto dat vyplývá, že žádaného cíle (vyléčení) tyto léky nedosahují [57].
Další možnosti využití protilátek proti EGFR
Jen pro úplnost uvádíme, že monoklonální protilátky proti EGFR mohou být využity jako nosiče radioaktivního izotopu nebo toxinu. Po navázání protilátky dojde k aktivaci receptoru, ale současně je internalizován toxin, který nádorovou buňku usmrtí. V případě navázaného izotopu je zdroj záření v přímém kontaktu s nádorovou buňkou a rovněž ji dokáže zničit. Radioaktivně značené monoklonální protilátky mohou být využity terapeuticky i diagnosticky. Takové protilátky existují i pro EGFR, zatím však nepřešly z klinického experimentu do standardní praxe [57].
Inhibitory blokující tyrozinkinázovou aktivitu pro epidermální růstový faktor
Další léčebnou možností ovlivnění EGFR jsou inhibitory blokující tyrozinkinázovou aktivitu receptoru, tyrosine kinase inhibitors, TKI (viz níže).
Malé molekuly těchto aktivních látek se kompetitivně vážou na vazebné místo pro makroergní fosfát ATP na intracelulární doméně receptoru. Tím dojde k zablokování fosforylace a přenosu signálu [6]. Stručně se zmíníme o dvou s větším klinickým významem, což jsou gefitinib a erlotinib.Tyto inhibitory blokující tyrozinkinázovou aktivitu receptoru EGFR jsou perorálními léky s velmi dobrou tolerancí. Nežádoucími vedlejšími účinky jsou průjmy a kožní toxicita.
Gefitinib
Je to malá molekula, derivát chinazolinu, inhibující tyrozinkinázovou aktivitu EGFR, s dobrou biologickou dostupností po perorálním podání. Nadějné výsledky byly zaznamenány u nemocných s pokročilým nemalobuněčným karcinomem plic progredujícím po selhání chemoterapie. Odpověď na léčbu byla zaznamenána u 18 % pacientů, stabilizace choroby byla zaznamenána u cca 50 % pacientů. Na základě těchto dat byl již tento inhibitor EGFR povolen pro léčbu inoperabilního nemalobuněčného karcinomu plic ve třetí linii. Zkouší se u nemocných s karcinomem ledvin, karcinomem hlavy a krku či pokročilými solidními nádory. Gefitinib prokázal velmi dobrou toleranci bez hematologické toxicity. Nejčastějšími vedlejšími účinky jsou vyrážky typu akné, svědění a mírné gastrointestinální potíže. V současnosti probíhají studie fáze III [14, 32].
Erlotinib
U tohoto inhibitoru tyrozinkinázy byla prokázána účinnost u karcinomu ovarií, hlavy a krku a nemalobuněčného karcinomu plic, kde byly pozorovány parciální nebo minimální léčebné odpovědi či stabilizace onemocnění u 30–45 % nemocných předléčených jinými chemoterapeutickými agens. Nežádoucí účinky jsou podobné jako u gefitinibu, průjem a kožní toxicita.V současnosti probíhají studie fáze III [31, 32].
Antisense oligonukleotidy ovlivňující expresi receptoru pro epidermální růstový faktor
Další skupinou, kterou uvádíme pouze pro úplnost, neboť nemá zatím větší klinický význam, jsou antisense oligonukleotidy ovlivňující expresi receptoru pro epidermální růstový faktor. Jsou to jednořetězcové krátké sekvence oligonukleotidů komplementárních ke známé sekvenci bází cílové mRNA. Obecně je smyslem použití antisense oligonukleotidů snížení exprese určitého genu. Jak EGFR, tak jeho ligand (TGF, EGF) mohou být cílem této strategie. Z preklinických výzkumů in vitro vyplývá, že použití EGFR antisense oligonukleotidů vede ke snížení exprese EGFR, inhibici proliferace nádorových buněk a k indukci apoptózy. Tento účinek může být posílen současným použitím cytotostatik jako cisplatina, doxorubicin, paclitaxel a topotecan. Uplatnění v klinické praxi však doposud antisense oligonukleotidy nenašly [27].
Diferenciační terapie
Vznik a progrese nádoru je zpravidla spojena s poruchou vyzrávání a diferenciace nádorových buněk. Jednou z možností, jak ovlivnit nádor a zastavit jeho progresi, je donutit nádorové buňky vyzrát do podoby diferencovaných buněk s malou či žádnou proliferační aktivitou, jejichž biologický cyklus je zakončen normální buněčnou smrtí neboli apoptózou. Taková léčebná strategie není zaměřena přímo na zničení nádorové buňky. Prozatím jedinou skupinou, která se dostala do klinického použití, jsou retinoidy, konkrétně tretinoin a bexaroten, o nichž se zmíníme podrobněji. Retinoidy indukují buněčnou diferenciaci a brzdí proliferaci různých buněk organismu včetně buněk maligních (epiteliální karcinomy melanom, neuroblastom, karcinom prsu a leukémie). Retinoidy také potlačují karcinogenezi v pokusech in vitro na buněčných kulturách [54, 55].
Tretinoin, kyselina all-trans retinová
Tretinoin je přirozeným metabolitem retinolu. Největším úspěchem tretinoinu a vůbec všech retinoidů je vliv kyseliny all-trans retinové na akutní promyelocytární leukémii (APL), u níž velmi často indukuje remisi. Odpovědí na aplikaci kyseliny alltrans retinové je indukce diferenciace maligních promyelocytů a přechod aktivní choroby do remise nemoci. Pacienti s APL mají chromozomální translokaci v genu pro receptor a kyseliny retinové (RARa). RARa patří do skupiny jaderných receptorů, které tvoří osobitou skupinu transkripčních faktorů. RAR tvoří heterodimery s příbuzným receptorem RXR a po vazbě ligandu – kyseliny retinové (RA) – aktivuje transkripci svých cílových genů. V nepřítomnosti ligandu dimer RAR/RXR interaguje s korepresory, mezi něž patří také histon deacetylázy (HDAC). Histon deacetylázy jsou enzymy, které odstraňují acetylové skupiny z lysinu na histonech. Tato deacetylace histonů má za následek tzv. uzavření chromatinu, tj. vytvoření takové struktury chromatinu, která zabraňuje přístupu transkripčního aparátu a znemožňuje transkripci. Po vazbě RA na heterodimer RAR/RXR dojde ke konformační změně dimeru, z něhož je uvolněn represivní komplex, a naopak se tvoří aktivující komplex, jehož součástí jsou i histon acetyltransferázy (např. p300/CBP, PCAF). Histon acetyltransferázy (HAT) acetylují histony a v důsledku zvýšené míry acetylace histonů se mění struktura chromatinu v tzv. otevřenou strukturu, která je nutná k aktivaci transkripce genů.
Chimérické proteiny PML/RAR i PLZF/ RAR obsahují vždy takový podíl proteinu RARa, který nese DNA vazebnou doménu, a proto tyto chiméry rozpoznávají cílové geny jaderného receptoru RARa. Dimer tvořený RXR a chimérickým proteinem PML-RARa má ale silnější afinitu k represivnímu komplexu než dimer RXR/RAR. Tuto vazbu ke korepresorům lze překonat pouze vysokými farmakologickými dávkami kyseliny retinové. Chiméra PLZF-RARa neaktivuje transkripci ani po působení farmakologických dávek RA. Příčinou je to, že PLZF má své vlastní vazebné místo pro korepresor a tato vazba je nezávislá na ligandu. Proto i při vysokých dávkách kyseliny retinové váže heterodimer RXR/PLZF-RAR korepresory včetně histon deacetylázy a důsledkem je tvorba uzavřeného chromatinu v dané oblasti. Tento blok může být překonán pouze společným působením kyseliny retinové a inhibitorů histon deacetyláz (například trichostatin A, butyrát sodný) [43].
Tretinoin se dobře vstřebává při perorální aplikaci. Indikace je omezena na akutní promyelocytární leukémie, v lokální aplikaci je částečně účinný u bazaliomu a intraepidermálních dysplazií. U promyelocytární leukémie zcela změnil prognostické výhledy všech pacientů. Výsledky léčby promyelocytární leukémie dokumentují, že léčba antracykliny a tretinoinem má vysoký kurativní potenciál. Vyléčení je možné až u 80 % nemocných. Velmi závažným nežádoucím účinkem je syndrom kyseliny retinové, který je pozorován asi u 40 % pacientů léčených kyselinou all-trans retinovou. Je charakterizován vysokou horečkou, dušností, plicními infiltráty zřejmými na rentgenovém snímku, vzestupem váhy a vznikem výpotků v serózních prostorách. Leukocytóza může tento syndrom doprovázet, není však podmínkou. Časný záchyt tohoto syndromu je podmínkou úspěšné kortikoidní léčby [54].
Bexaroten – další v onkologii používaný retinoid
O něco později se do klinického použití dostal další derivát retinoidů, bexaroten. V zahraničí již získal standardní místo v léčbě kožních lymfomů a testuje se u nemocných s karcinomem plic [11, 30, 54, 50].
Inhibitory tyrozinkináz
Tyrozinkináza je enzym, který fosforyluje cílový protein na zbytku tyrozinu a moduluje jeho regulační aktivitu.
U savců bylo do současnosti popsáno už více než 200 tyrozinkináz, enzymů podílejících se na nitrobuněčném přenosu informací a uplatňujících se v procesech buněčného dělení, diferenciace, růstu a apoptózy. Již v 80. letech 20. století byl zahájen vývoj selektivních proteinkinázových inhibitorů [53].
Funkce tyrozinkináz a význam jejich ovlivnění pro onkologickou léčbu
Tyrozinkináza je enzym, který fosforyluje cílový protein na zbytku tyrozinu.Všechny tyrozinkinázy se aktivují adenozintrifosfátem (ATP) a katalyzují fosforylaci svých substrátů, které jsou často součástí buněčných signálních drah. Těmito drahami se informace či signál zachycený na buněčném povrchu prostřednictvím specifických receptorů přenáší k cílovým strukturám v cytoplazmě nebo jádře. Aktivační mechanismus je univerzální: obsazení vazebného místa pro ATP tímto makroergním fosfátem. Konečným efektorem signalizace je transkripční faktor, který se podílí na regulaci exprese cílového genu. Výstupem jednoho nebo více transkripčních a translačních dějů je produkt či produkty – peptidy nebo proteiny s definovanou funkcí [53].
Inhibitory tyrozinkináz jsou jednou z nejperspektivnějších lékových skupin pro cílené terapie. Po dlouhou dobu nebylo možné vyvinout inhibitory kináz zaměřené cíleně na části molekuly obsahující vazebné místo – „kapsu" pro ATP (ATP- binding pocket). Až v devadesátých letech dvacátého století byly klinicky testovány první inhibitory receptorů tyrozinkinázového typu. Tyto inhibitory patří do dvou kategorií léčiv: monoklonálních protilátek a malých molekul kinázových inhibitorů, kterým je věnována tato část. Je zajímavé, že léčebné použití inhibitorů EGFR typu malých molekul nebo monoklonálních protilátek vyvolává obdobné nežádoucí účinky. Pro malé molekuly tyrozinkinázových inhibitorů je z klinického pohledu podstatná skutečnost, že existuje dostatečná strukturní variabilita v oblasti vazebného místa pro ATP, která umožňuje použití daného inhibitoru pro inhibici kináz různého typu. Cílem klinicky testovaných zásahů jsou v současnosti zejména EGFR, PDGFR (platelet-derived growth factor receptor), VEGF (vascular endothelial growth factor), FGFR (fibro-blast growth factor receptor) a tyrozinkináza BCR-Abl. Existuje velký počet kináz podílejících se na aktivaci onkogenních signálních drah. Jejich inhibice může ovlivnit fenotyp nádoru, ale neřeší základní poruchu, kterou představuje genetická změna. Tento typ léčby může být velmi účinný, nepovede však velmi pravděpodobně k vyléčení [53].
Imatinib mesylat
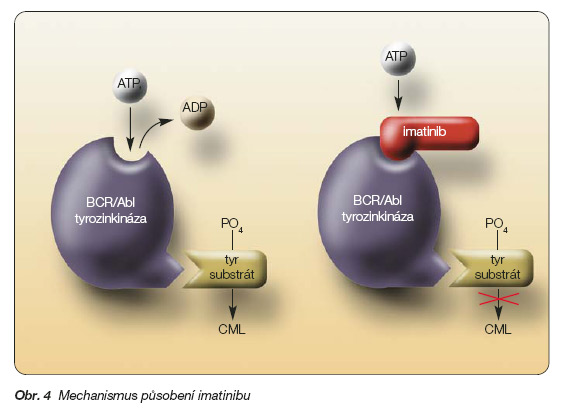
Imatinib mesylat blokuje především BCR-ABL tyrozinkinázu, která se nachází zejména v buňkách chronické myeloidní leukémie (CML), a dále Ph1 pozitivní akutní lymfoblastické leukémie (ALL). Podání imatinibu vede k zablokování ATP kapsy BCR-ABL tyrozinkinázy, čímž tyrozinkináza pozbývá schopnosti fosforylovat svůj substrát a dochází k potlačení maligního buněčného klonu, jehož proliferace je na funkci tyrozinkinázy závislá (viz obr. 4).
Imatinib je schopen už v monoterapii navodit terapeutickou odpověď u CML i Ph1 pozitivní ALL. Je účinný zejména v chronické fázi CML, ale lze jej použít též v akceleraci a při blastickém zvratu. U CML v chronické fázi navozuje monoterapie imatinibem už během několika týdnů podávání kompletní hematologickou odpověď (> 90 % nemocných) a velkou cytogenetickou odpověď (> 40 % nemocných). V případě CML v akceleraci a blastickém zvratu jsou výsledky terapie imatinibem v monoterapii horší, nicméně i tak dávají nemocným velkou naději na zlepšení jejich zdravotního stavu. Velká cytogenetická odpověď je imatinibem navozena u 20–30 % nemocných v akceleraci a u asi 15 % nemocných v blastickém zvratu. Kompletní hematologická odpověď není u těchto pacientů častá, ale zlepšení parametrů krevního obrazu lze pozorovat u více než 60 % nemocných v akceleraci a u čtvrtiny nemocných v blastickém zvratu. 20–30 % nemocných v pokročilých stadiích CML se při léčbě imatinibem vrací do chronické fáze nemoci. V případě Ph1 pozitivní ALL navodí monoterapie imatinibem kompletní remisi u 1/3 nemocných. Při dlouhodobějším podávání imatinibu se může rozvinout rezistence na léčbu. Lék se má podávat nemocným s CML dlouhodobě, pokud se ale nedostaví do 6 měsíců cytogenetická odpověď na léčbu, měl by být vysazen a nahrazen jiným léčebným postupem. Stejně tak by měl být vysazen při rozvoji rezistence onemocnění na preparát. Všechny nežádoucí účinky jsou většinou mírné. K závažnějším nežádoucím účinkům patří pouze myelosuprese, pro kterou je někdy třeba imatinib na přechodnou dobu vysadit.
Ostatními chorobami, kde je léčba imatinib mesylatem přínosem, jsou další myeloproliferativní onemocnění s eozinofilií charakterizovaná mutací genu PDGFRB nebo PFGFRA. Proto se dnes doporučuje otestovat účinnost tohoto léku u všech osob s chronickou myeloproliferativní chorobou provázenou eozinofilií a u pacientů s léčebnou odpovědí pak dále pokračovat v léčbě.
Třetí oblastí, kde je imatinib účinný, je oblast stromálních gastrointestinálních nádorů, což je relativně nově vytvořená nozologická jednotka [17, 38, 50].
Inhibitory tyrozinkináz specifické pro EGFR
Několik tyrozinkinázových inhibitorů selektivně ovlivňuje receptor EGFR. Jejich charakteristika je uvedena výše.
Inhibitory cyklin-dependentních a jiných kináz
Cyklin-dependentní kinázy (CDK) regulují postup buňky jednotlivými fázemi buněčného cyklu. Buněčný cyklus představuje velmi komplexní proces, který může být ovlivněn řadou strategií. Jedním z perspektivních léčebných směrů je vývoj malých molekul, které inhibují aktivitu CDK tím, že interagují s vazebným místem pro ATP. V současnosti se testují dva vysoce selektivní inhibitory CDK: flavopiridol a 7-hydroxystaurosporin (UCN-01). Flavopiridol je semisyntetický flavon, který inhibuje jak CDK (CDK2 a CDK4), tak proteinkinázu C a indukuje zastavení buněčného cyklu ve fázi G1. 7-hydroxystaurosporin je rovněž inhibitor proteinkinázy C, který současně inhibuje CDK. Jedním z mechanismů rezistence nádorových buněk na cytostatika poškozující DNA je zastavení buněčného cyklu ve fázi G1 a/nebo G2, jehož smyslem je získání času pro opravu poškozené DNA před začátkem replikace nebo mitózy. Zpomalení buněčného cyklu ve fázi G2 je typické pro nádory exprimující mutovaný p53. 7-hydroxystaurosporin tento proces inhibuje [19].
Inhibitory dalších kináz
V buňce existuje řada mitogenních a antimitogenních signálních kaskád, ve kterých hrají dominantní roli kinázy. Mnoho proteinů, které jsou zapojeny do těchto signálních drah, představuje vhodné cíle pro působení inhibitorů v rámci protinádorových terapií. Patří mezi ně například MAP kinázy (mitogen-activated protein kinases), IKK1 a IKK2 kinázy, regulační dráhy NF-kB (nuclear factor kappa B), JNK kinázy (Jun N-terminal kinases) a mnoho dalších. Jejich výčet je nad rámec tohoto sdělení. Řada z těchto inhibitorů je testována nejen v onkologii a hematologii, ale i v imunologii, revmatologii a jiných oborech.
Inhibitory farnesyltransferázy
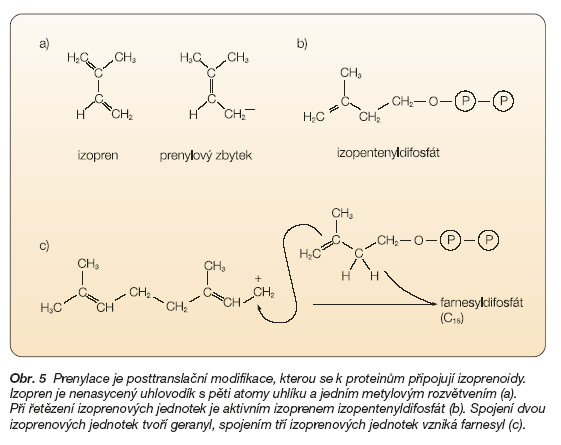
Posttranslační úpravy jsou chemické nebo fyzikální modifikace probíhající na polypeptidovém řetězci po skončení jeho syntézy na ribozomu. Mezi posttranslační modifikace patří prenylace, kterými se k proteinům připojují izoprenoidy. Izopren je nenasycený uhlovodík s pěti atomy uhlíku a jedním metylovým rozvětvením (obr. 5a), který se tvoří během biosyntézy cholesterolu. Farnesylová skupina představuje lineární seskupení tří izoprenových jednotek. Geranylová skupina vzniká lineárním spojením dvou izoprenových jednotek, a geranylgeranylace tak znamená připojení lineárního seskupení čtyř izoprenových jednotek. Při „řetězení" izoprenových jednotek je „aktivním izoprenem" izopentenyldifosfát (obr. 5b). Postupně se tvoří geranyldifosfát, farnesyldifosfát atd. (obr. 5c).
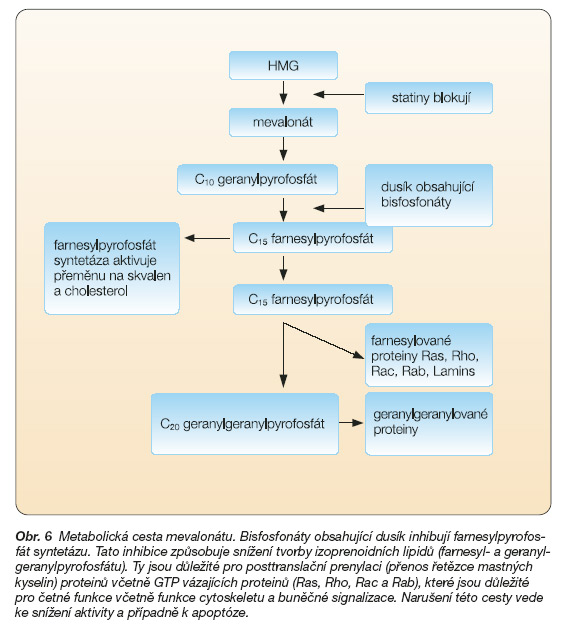
Schematicky je celý proces znázorněn na obr. 6.
Farnesylace je katalyzována cytoplazmatickým enzymem farnesyltransferázou, geranylgeranylace geranylgeranyltransferázou. Tyto enzymy rozpoznávají motiv CysAAX na C-konci svých cílových proteinů a přenášejí farnesylovou, resp. geranylgeranylovou skupinu na SH skupinu cysteinu. Tato modifikace je nezbytná pro připojení takto modifikovaných proteinů k cytoplazmatické membráně. Mezi významné prenylované substráty patří G-proteiny z nadrodiny (superfamily) Ras/Rho/Rac. Například proteiny Ras (H-, N- a K-Ras) jsou modifikovány farnesylem (C15), zatímco RhoA a RhoC geranylgeranylem (C20) [10].
Proteiny Ras jsou součástí mitogenních signálních drah, účastní se regulace proliferace a diferenciace a podílejí se na vývoji mnoha lidských nádorů. Jejich modifikace farnesylací a následné připojení k cytoplazmatické membráně jsou naprosto kritické pro jejich funkci a tedy také pro jejich transformační aktivitu. Inhibitory farnesyl-transferáz (FTI) proto představují slibnou kategorii protinádorových léků [12, 52].
V případě bisfosfonátů existuje přímá korelace mezi mírou inhibice farnesyldifosfátsyntetázy, jednoho z důležitých enzymů mevalonátové metabolické cesty, a účinností in vivo.
V klinických studiích jsou však testovány inhibitory prenylace cílené na postižení maligních buněk i mimo kostní tkáň.
Úloha inhibitorů farnesyltransferázy (FTI) spočívá v modulaci aktivity nádorových proteinů a přerušení počátečních stadií signálních aktivačních kaskád. Původně se FTI považovaly především za inhibitory onkoproteinu Ras a jeho signální kaskády. Inhibitory farnesyltransferázy však dokázaly vyvolat inhibici i těch nádorů, ve kterých nebyl gen Ras mutován. Předpokládá se, že FTI ovlivňují některé kontrolní body mitózy, lamin B, Rho B, proteiny asociované s centromerou (centromere-associated proteins), TGF a další růstové faktory. Mechanismus účinku inhibitorů farnesyltransferázy spočívá v kompetici s fyziologickým substrátem nebo cílovým proteinem farnesyltransferázy. Za normálních okolností se aktivační dráha řízená proteinem Ras podílí na regulaci proliferace. Protein Ras může být například fosforylován membránovou tyrozinkinázou (např. EGFR) a následně vyvolat aktivaci signální kaskády, která vede ke zvýšené proliferaci buňky.
Protein Ras je součástí vnitřní strany plazmatické membrány, se kterou je spojen prostřednictvím izoprenoidní lipidové skupiny nazývané farnesyl. Tato skupina se připojuje k prekurzoru Ras sérií post-translačních úprav. Klíčovou úpravu katalyzuje enzym farnesyltransferáza. Mutace protoonkogenu Ras vede ke vzniku onkogenu, který způsobuje neregulovanou proliferační aktivitu buňky. Inhibitory farnesyl-transferázy účinkují i na mutantní Ras a tím, že mu znemožní připojit farnesylovou skupinu, zamezí přenosu signálu buňkou a aktivaci kinázové kaskády. Následkem takového zásahu může být zpomalení či zastavení růstu nádoru. V některých případech je protein Ras k membráně připojen alternativním izoprenoidem (geranyl-geranyl). Tuto modifikaci Ras katalyzuje enzym geranylgeranyltransferázou. V takovém případě nejsou inhibitory farnesyltransferázy účinné. Z mnoha testovaných látek se do klinických studií do konce roku 2004 dostaly nejméně 3 nepeptidové inhibitory farnesyltransferázy. Tyto léky vykazovaly v preklinických testech antiproliferativní, antiangiogenní a proapoptotickou aktivitu. Byl prokázán jejich synergický účinek s některými cytostatiky u řady solidních nádorů (např. karcinom plic, kolorektální karcinom, karcinom pankreatu, karcinom prsu a další) i hematologických nádorů (chronická myeloidní leukémie, akutní myeloidní leukémie, myelodysplastický syndrom) [18, 21].
Inhibitory proteazomu
Bortezomib
Bortezomib je první a zatím jediný klinicky významný lék ze skupiny inhibitorů proteazomu. Významný antiproliferační a cytotoxický účinek bortezomibu byl prokázán u celé řady nádorových linií [37, 41]. Bortezomib působí selektivně inhibičně na chymotrypsin-like aktivitu b5 podjednotky 20S proteazomu. Proteazomální degradace hraje zásadní roli v proteinovém metabolismu buňky, a podílí se tedy na řízení buněčného cyklu a apoptózy, reparaci genomové DNA či na mezibuněčné komunikaci, pomocí tohoto děje jsou v buňce eliminovány chybně přepsané či nesprávně sestavené proteiny. Jeho účinnost je zatím ověřena u mnohočetného myelomu, ale velmi povzbudivě vypadají výsledky i u jiných lymfoproliferací a dalších nádorových onemocnění [4, 23, 46].
Podle dnešních doporučení v USA i EU je indikován pro léčbu nejméně prvního relapsu mnohočetného myelomu. Probíhající klinické studie hodnotí efekt bortezomibu v primoléčbě mnohočetného myelomu. Nežádoucí účinky jsou většinou mírné, i když pestré, největším problémem se zdá být přechodná trombocytopenie a neutropenie [48].
Bortezomib inhibuje však pouze jednu enzymatickou aktivitu proteazomu. V klinickém zkoušení jsou již i další, účinnější blokátory proteazomu s širším spektrem účinnosti [5, 26, 39, 40].
Standardně používané monoklonální protilátky pro léčbu maligních chorob
Objev hybridomové techniky umožnil téměř neomezenou produkci monoklonálních protilátek pro diagnostické, ale i léčebné účely. Pomocí genových vektorů kódujících těžké řetězce humánních protilátek lze myší protilátky produkované hybridomem dále upravit. Výsledkem tohoto postupu je vytvoření chimérických protilátek, v nichž ta malá část imunoglobulinu zodpovědná za vazbu na antigen je myšího původu, zatímco zbytek molekuly imunoglobulinu je původu lidského. Pokud je na protilátce navázána další molekula (např. radioizotop, toxin apod.), hovoříme o protilátce konjugované.
V roce 2005 se stává oblast terapeuticky testovaných monoklonálních protilátek poměrně nepřehlednou. Proto zde uvedeme obecný úvod s následným výčtem několika protilátek, které se již používají v rámci standardní léčby nebo se při této léčbě velmi pravděpodobně brzy používat budou. Záměrně pomineme velké množství protilátek, které jsou ve fázi preklinického či klinického výzkumu a jejichž popis by činil text nepřehledným.
Účinnost monoklonální protilátky závisí na homogenitě antigenu, na míře jeho exprese neboli na hustotě antigenů na povrchu maligní buňky. Účinnost monoklonální protilátky může být negativně ovlivněna přítomností volných antigenů v extracelulární tekutině, špatným krevním zásobením tumoru a velikostí tumoru. Z tohoto pohledu je nutno volit antigeny, proti nimž jsou namířeny připravované monoklonální protilátky [29, 46].
Myší monoklonální protilátky
Myší monoklonální protilátky jsou obvykle východiskem pro vytvoření humanizované protilátky. Získávají se po stimulaci myšího imunitního systému vybranými antigeny. Myší protilátky jsou často používány v prvních fázích klinického výzkumu s cílem zodpovědět otázku, zda protilátka dosáhne léčebné odpovědi. Jejich obecnou nevýhodou je fakt, že jde o bílkovinu cizorodou pro člověka, proti níž se vytvoří protilátky.
Zavedení genových čipů znamená i akceleraci vývoje pro oblast monoklonálních protilátek. Čipová technologie umožňuje detekci zvýšeně exprimovaných genů a jejich proteinů a nasměrování výroby monoklonálních protilátek právě proti nim a následné ověřování jejich účinnosti [29, 46].
Humanizované monoklonální protilátky
Humanizované monoklonální protilátky nekonjugované s dalšími látkami jsou dnes nejvíce používány. Po aplikaci těchto humanizovaných protilátek se nevytvářejí protilátky. Principem účinku nekonjugovaných protilátek jsou následující imunologické procesy ústící v destrukci buňky:
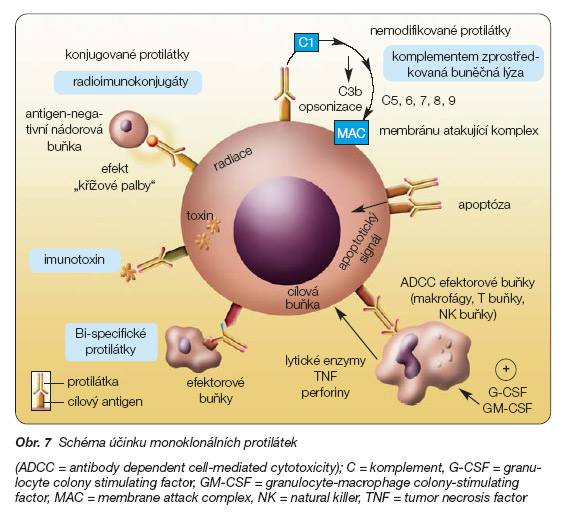
a) ‑aktivace buněčné cytotoxicity ADCC (antibody dependent cellular cytotoxicity). Tato reakce je zahájena navázáním efektorových buněk na Fc protilátky.
b) aktivace komplementové kaskády.
c) přímý účinek.
Mimo tyto základní mechanismy účinku byly prokázány in vitro další účinky související s funkcí proteinu, proti němuž je protilátka zaměřena [29, 46].
Humanizované protilátky s konjugovaným radioaktivním izotopem
Příprava humanizované protilátky s navázaným radioizotopem je nejjednodušší konjugační reakcí. Tyto látky se používají jak pro diagnostiku, tak pro terapii. Navázaný radioizotop umožňuje cytotoxicky působit také na nádorové buňky uvnitř chudě vaskularizovaných nádorů. Monoklonální protilátka může způsobovat podobnou cytotoxickou reakci jako způsobují nekonjugované protilátky, a navíc radiaktivní izotop emitující záření b může letálně poškodit sousední nádorové buňky, na něž se pro špatné cévní zásobení protilátka nenavázala. Protilátky s navázaným radioizotopem jsou nejúčinnější pro radiosenzitivní krevní choroby (maligní lymfomy).
Problémem této terapie je však nespecifická vazba radioaktivních protilátek v jiných tkáních. Pouze část aplikovaného množství je deponována v maligní tkáni, zbytek je nespecificky vychytán v plicích, slezině či játrech vazbou Fc struktury radiokonjugátu na Fc receptory. To způsobuje nežádoucí účinky a snižuje účinek terapie. V zemích EU je zatím standardně používána monoklonální protilátka, z níž byl chimerizací odvozen rituximab, konjugovaná s b-zářičem yttriem – ibritumomab tiuxetan [46].
Humanizované protilátky konjugované s imunotoxiny
Existují mnohé toxiny, které mají letální účinek na buňky a které nelze jinou formou léčebně použít (například toxicita ricinu je tak vysoká, že jej lze použít jako zbraně hromadného ničení). Pro léčbu byly připraveny četné konjugáty humanizovaných monoklonálních protilátek proti určitému antigenu s toxinem (pseudomonádový exotoxin, difterický toxin, ricin, saponin) nebo proti toxickým antibiotikům (calicheamicin). Na rozdíl od nekonjugovaných monoklonálních protilátek, které jsou účinné při vazbě na povrchové antigeny, musí tyto protilátkové nosiče toxinů zaručit dopravení toxinu do nitra buňky. Teprve po vstupu konjugátu do nitra buňky může dojít k jeho uvolnění z vazby. Po disociaci toxinu od protilátky dochází teprve k cytotoxickému působení toxinu, obvykle na struktury DNA či na proteosyntézu. Při použití těchto imunotoxinových konjugátů dochází často k nežádoucím účinkům limitujícím zvyšování dávek (napříkad vascular leak syndrome) a dále také ke stimulaci tvorby protilátek. Ze všech imunotoxinů je nejvíce pozornosti věnováno gemtuzomab ozogamicinu [46].
Bispecifické protilátky
Jsou syntetizovány za účelem aktivizace a namíření imunitní cytotoxické reakce proti nádorové buňce. Jedna tato uměle vytvořená molekula je schopna navázat se jednou svojí strukturou na maligní buňku a druhou strukturou na imunokompetentní buňku a případně ji aktivovat.
V klinické praxi jsou testovány monoklonální protilátky zaměřené na antigeny Fc receptoru CD64, CD16, CD89 v kombinaci se zaměřením proti antigenu maligní buňky, CD20, CD30 a CD33. Například u Hodgkinova lymfomu je testována protilátka s antigenní determinantou zaměřenou proti antigenu Hodgkinových buněk CD33 a s antigenní determinantou proti CD64 (Fc receptor). Touto chimérickou uměle vytvotřenou molekulou je možné zacílit buněčnou imunitu, na níž je tato molekula navázána svojí anti-CD33 částí. Bispecifické látky však jsou ve fázi klinického výzkumu a zatím nepatří do standardní léčby, proto se o nich více nezmiňujeme [46].
Mechanismy působení monoklonálních protilátek ilustruje obr. 7.
Toxicita monoklonálních protilátek
– Akutní cytokinová reakce při nebo po infuzi
Vyvolává ji uvolněný interleukin-6 a tumor nekrotizující faktor (tumour necrosis factor, TNF). Tato reakce se vyskytuje u 50–90 % nemocných po prvním podání látky. Způsobuje také teplotu, třesavku, nevolnost. Při opakovaných aplikacích se postupně snižuje. Tuto reakci lze zmírnit premedikací antihistaminiky a antipyretiky. Vzácnější formou této reakce je bronchospasmus, pruritus a urtika.
– Deplece fyziologických buněk exprimujících stejný antigen
V případě protilátky proti anti-CD20 následuje snížení počtu B lymfocytů, klinicky závažnější je však důsledek aplikace protilátky anti-CD52, po níž následuje pokles počtu T lymfocytů a B lymfocytů čili globální imunosuprese.
– Vznik protilátek
Proti nekonjugovaným terapeuticky podaným protilátkám vznikají protilátky poměrně vzácně, častější je tato reakce při podání protilátek konjugovaných s imunotoxiny. Tato reakce snižuje účinnost opakovaných aplikací těchto protilátek.
– Toxické projevy na protilátku navázaného toxinu
I při veškeré snaze nelze omezit působení toxinu pouze na maligní buňky, je nutno vždy počítat s určitou necílenou toxicitou. Nejčastěji dochází k poškození endotelu cév, což se projeví hypoalbuminémií, periferním a plicním otokem, hypotenzí a v případě gemtuzumab ozogamicinu také poškozením jater.
Přehled nejčastěji používaných monoklonálních protilátek
Protilátka anti-CD20 – rituximab
Rituximab je složen z lidského těžkého řetězce IgG1, z lidské konstantní části lehkého řetězce k, pouze variabilní část lehkého řetězce k je myšího původu. Tato látka se ukázala přínosem pro maligní lymfoproliferace s expresí CD20 antigenu. Je účinná v monoterapii, častěji se však dnes používá v kombinaci s chemoterapií. Její aplikace je vyjma časné cytokinové reakce poměrně velmi dobře tolerována a je velkým přínosem pro léčbu maligních B-lymfoproliferativních chorob [29].
Protilátka anti-CD52, alemtuzumab
Antigen CD52 je přítomen na fyziologických i maligních T lymfocytech a B lymfocytech (ne však na plazmocytech), na eozinofilních granulocytech, na monocytech a makrofázích a na některých epitelových buňkách mužského reprodukčního systému, není však přítomen na hematopoetických kmenových buňkách. Tuto protilátku lze použít pro léčbu chronické B-lymfocytární leukémie, ale také T-prolymfocytární leukémie, případně další maligní T-lymfoproliferace [42, 46].
Protilátka anti-CD33, gemtuzumab ozogamicin
U akutních myeloidních leukémií byly zkoušeny různé protilátky proti struktuře CD33. Ta je exprimována na většině leukemických buněk. Gemtuzumab ozogamicin je preparát nyní registrovaný pro léčbu starších nemocných v relapsu leukémie, kteří nejsou kandidáty pro klasickou chemoterapii a jejichž blasty exprimují CD33. Lék lze ovšem obstarat i v ČR. Jde o humanizovanou rekombinantní anti-CD33 protilátku spojenou s potentním antitumorózním antibiotikem calicheamicinem. Nežádoucí účinky však nejsou způsobeny pouze neselektivním působením na buňky myeloidní řady. Lék po uvolnění z vazby na monoklonální protilátku působí systémově, což se projeví dominantně poškozením jater. K výraznému zvýšení hladiny bilirubinu a transamináz (stupeň III a IV) dochází u 26 % léčených. Vážným nežádoucím účinkem je vznik venookluzní choroby jater (s bolestivou hepatomegalií, žloutenkou a retencí tekutin). Tato komplikace postihuje asi 2 % léčených. Počet fatálních forem této komplikace se odhaduje na méně než 1 % ze všech léčených [46].
Protilátka RFB4(dsFv)-PE38
Jiným novým imunokonjugátem značeným RFB4(dsFv)-PE38 (BL22) dle Developmental Therapeutic Program, National Cancer Center Bethesda, je protilátka anti-C D22 nazývaná RFB4 s navázaným fragmentem pseudomonádového exotoxinu s názvem PE38. Exprese antigenu CD22 je poměrně vysoká na nádorových buňkách u vlasatobuněčné leukémie. První klinické zkoušky prokázaly poměrně vysokou účinnost této látky (69 % kompletních remisí) při poměrně dobré toleranci. Z nežádoucích účinků byla pozorována hypoalbuminémie, zvýšení transamináz, nevolnost po podání, edémy, mírné zvýšení kreatininu v séru. Výjimečnou komplikací byl hemolyticko-uremický syndrom, který byl však reverzibilní [46].
Denileukin diftitox
Tento preparát není sice monoklonální protilátkou, ale je vyroben na podobném principu, proto jej na tomto místě také zmíníme. Jde o rekombinantní fúzní protein sestávající z části difterického toxinu a interleukinu 2. Nedávno jej FDA schválila k léčbě nemocných s rekurentními nebo přetrvávajícími formami kožních T-buněčných lymfomů, jejichž buňky exprimují CD25 (receptor pro IL-2). Tato látka dosahuje asi 30 % léčebných odpovědí [46].
Antiangiogenní terapie u nádorů
Angiogeneze je novotvorba cév. Fyziologicky se uplatňuje při embryogenezi, hojení ran a v ovariích a děložní sliznici při menstruačním cyklu. Souvislost nádorového bujení a angiogeneze byla objevena Folkmanem v roce 1971. Cílem následných výzkumů bylo detailnější poznání mechanismu regulace angiogeneze a jeho využití při terapii nádorů a jiných onemocnění závislých na angiogenezi. Od druhé poloviny devadesátých let 20. století lze pozorovat nástup klinických studií využívajících antiangiogenní léky. V současné době je zkoušeno více než 40 látek s antiangiogením účinkem, z nichž některé již podstupují fázi III klinických studií. Nelze si nepovšimnout skutečnosti, že u řady dobře známých léčiv (například u bisfosfonátů a interferonu) je nyní nově dokladován i antiangiogenní účinek a znovu je ověřována jejich protinádorová aktivita.
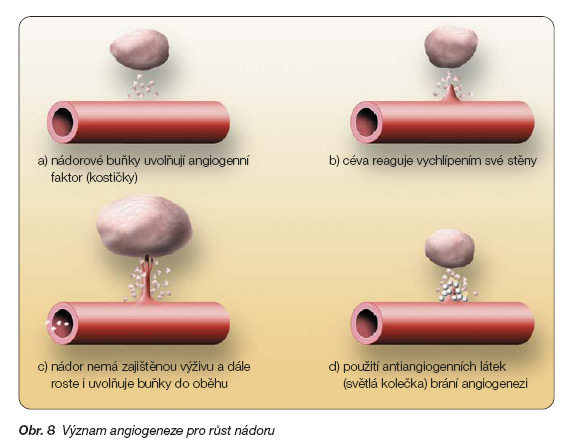
Původní Folkmanova hypotéza (obr. 8), že nádorový růst je závislý na angiogenezi a každé zvýšení objemu nádoru je úzce spojeno s růstem nových kapilár, byla opakovaně experimentálně potvrzena. Růst nádoru nezbytně vyžaduje dostatečné zásobení živinami a kyslíkem, které zajišťují nově vytvořené cévy. Původně se předpokládalo, že antiangiogenní léky je možno využít jen u solidních nádorů, pro jejichž růst je kritickým faktorem dostatečné cévní řečiště. Překvapivě však angiogeneze hraje významnou roli i u hematologických malignit.
Nádorové buňky stimulují proliferaci endotelových buněk, ale zároveň endotelové buňky působí parakrinně na vlastní nádorové buňky. Stimulace je tedy oboustranná – reciproční. Angiogeneze je velmi složitý proces, ve kterém je zapojeno obrovské množství genů a produktů těchto genů z nádorových i normálních tkání. Za hlavní iniciátory angiogeneze se považují vaskulární endotelový růstový faktor (VEGF), bazický fibroblastový růstový faktor (bFGF) a hepatocytární růstový faktor (HGF). Existuje však řada dalších aktivních látek, které se mohou podílet na udržení rovnováhy mezi inhibitory a aktivátory angiogeneze. Patří sem onkogeny a supresorové geny, růstové faktory a endogenní inhibitory, proteázy a proteázové inhibitory, stopové prvky a další. Podle výsledné převahy jednotlivých zapojených faktorů je angiogeneze tlumena, nebo aktivována. Důležitou úlohu zde hrají proteázy, zvláště MMP (matrixové metaloproteázy), které se podílejí na regulaci migrace endotelových buněk a také na regulaci migrace a šíření nádorových buněk. Většina antiangiogenních léků má proto rovněž účinek antimetastatický a antiinvazivní [13].
Největší význam pro proces angiogeneze má vaskulární endotelový růstový faktor (VEGF), který reguluje vaskulární proliferaci i permeabilitu, funguje jako endotelově specifický mitogen a rovněž jako antiapoptotický faktor v endotelových buňkách novotvořených cév. Je známo celkem šest členů rodiny VEGF – VEGF A–E a placentární růstový faktor. VEGF se uplatňuje ve všech procesech angiogeneze. Jeho exprese je zesílena mnoha různými faktory, mezi které patří hypoxie. Při zvýšené produkci VEGF je zvýšena permeabilita cév, což vede k úniku plazmatických proteinů a vytvoření tzv. extravaskulárního fibrinového gelu, který funguje jako substrát pro růst endotelových a nádorových buněk. Biologický účinek VEGF je zprostředkován tyrozinkinázovými receptory VEGFR1 (Ftl1), VEGFR2 (Flk1/KDR), NP1, a VEGFR3. Exprese VEGF je asociována s nádorovým růstem, angiogenezí a metastazováním, a proto je hladina VEGF důležitým prognostickým faktorem u mnoha lidských nádorů. Exprese VEGF je např. asociována se zhoršenou prognózou u akutní myeloidní leukémie, karcinomu prsu, karcinomu tlustého střeva, hepatocelulárního karcinomu, bronchiálních tumorů a ovariálního karcinomu. U pacientů s primárním plicním nádorem činil medián přežití u nemocných s nízkou hladinou VEGF 151 měsíců ve srovnání s 8 měsíci u těch, kteří měli vysokou hladinu VEGF. Tyto skutečnosti vedou k snahám o cílenou inhibici VEGF jako prostředku protinádorové terapie.
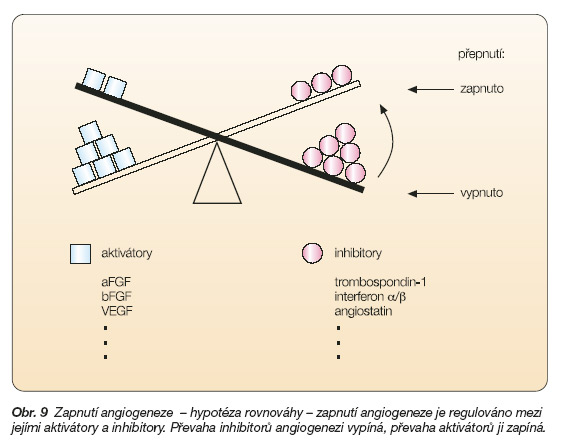
Angiogeneze je fyziologicky tlumena jedním nebo více endogenními inhibitory, jako např. endostatinem, trombospondinem, angiostatinem nebo tkáňovými inhibitory proteáz (TIMP). Existují také endogenní látky, které mohou působit jako stimulátory i jako inhibitory. Důležitým kofaktorem růstových faktorů zapojených do regulace angiogeneze je měď. Nedostatek mědi angiogenezi brzdí a tohoto pozorování se snaží současné výzkumy využít i pro klinické aplikace. Důležitým proteinem, který se rovněž podílí na řízení angiogeneze, je nádorový supresor p53. Mutace genu p53 koreluje se sníženou expresí trombospondinu, zvýšenou angiogenezí a maligní progresí. Za přítomnosti nemutovaného p53 je naopak novotvorba cév inhibována. Skutečnost, zda dochází či nedochází k novotvorbě cév, je vysvětlována hypotézou rovnováhy (obr. 9) [47].
Antiangiogenní léčiva mají několik odlišností ve srovnání s klasickou cytostatickou léčbou. Obecně účinkují pomaleji a jsou lépe tolerována. Při jejich použití však může být narušeno hojení ran a fertilita. Terapie není orgánově specifická a je možné ji kombinovat s ostatními protinádorovými léčebnými postupy. Protože antiangiogenní terapie nemusí nutně zasahovat nádorové buňky, není pro hodnocení léčebné odpovědi nejpodstatnější redukce objemu nádoru, ale čas k progresi, případně délka přežití. Velkou výhodou je, že doposud nebyl popsán vznik rezistence na antiangiogenní agens. Léky inhibující angiogenezi mohou účinkovat dvěma způsoby: blokovat účinek stimulátorů angiogeneze nebo zvyšovat aktivitu endogenních inhibitorů angiogeneze.
V současnosti je klinicky nejdůležitějším inhibitorem angiogeneze bevacizumab. A dále se zmíníme o thalidomidu a jeho derivátech. Ostatní antiangiogenní léky nemají v současnosti větší klinicky význam.
RhuMAb-VEGF (bevacizumab)
Tato látka představuje první klinicky zkoušenou antiangiogenní monoklonální protilátku. Rekombinantní humanizovaná monoklonální protilátka anti-VEGF nazvaná bevacizumab prošla nyní řadou klinických zkoušek fáze III. Uzavřeny jsou klinické zkoušky u kolorektálního karcinomu. Přidání k paliativní chemoterapii výrazně zvýšilo počet léčebných odpovědí a prodloužilo délku remise. Na základě těchto zkoušek schválila v USA agentura FDA bevacizumab pro léčbu metastatického kolorektálního karcinomu v rámci 1. linie chemoterapie, podání této léčby je možné i v ČR. Prodloužení celkové doby přežití při přidání bevacizumabu k standardním chemoterapeutickým protokolům oproti standardním chemoterapeutickým protokolům se pohybuje v řádu několika málo měsíců. V literatuře lze n
Seznam použité literatury
- [1] Adam Z, Ševčík P, Vorlíček J, et al. Nádorová kostní choroba. Praha, Grada, 2004.
- [2] Adam Z, Vorlíček J, Koptíková J, et al. Obecná onkologie. Praha, Grada, 2003.
- [3] Adam Z, Vorlíček J, Vaníček J, et al. Diagnostické a léčebné postupy u maligních chorob. II. aktualizované a doplněné vydání. Praha, Grada, 2004.
- [4] Adams J, Palombella VJ, Sausville EA, et al. Proteasome inhibitors: a novel class of potent and effective antitumor agents. Cancer Res 1999; 59: 2615–2622.
- [5] Aghajanian C, Soignet S, Dizon DS, et al. A Phase I Trial of the Novel Proteasome Inhibitor PS341 in Advanced Solid Tumor Malignancies. Clin Cancer Res 2002; 8: 2505–2511.
- [6] Albanell J, Gascon P. Small molecules with EGFR-TK inhibitor activity. Curr Drug Targets 2005; 6 (3): 259–274.
- [7] Badros A, Porter N, Zimrin A. Bevacizumab therapy for POEMS syndrome. Blood. 2005; 106 (3): 1135.
- [8] Baselga R. Anti-EGFR therapy: A new targeted approach to cancer treatment. Oncology Biotherapeutics 2002; 2: 1–36.
- [9] Bianco R, Daniele G, Ciardiello F. Monoclonal antibodies targeting the epidermal growth factor receptor. Curr Drug Targets 2005; 6 (3): 275–287.
- [10] Buske C, Dreyling M, Unterhalt M. Isoprenylation of intracellular proteins as a new target for the therapy of human neoplasms: preclinical and clinical implications. Curr Drug Targets 2005; 6 (3): 301–323.
- [11] Coors EA, Von den Driesch P. Treatment of mycosis fungoides with bexarotene and psoralen plus ultraviolet. A Br J Dermatol 2005; 152 (6): 1379–1381.
- [12] Doll RJ, Kirschmeier P, Bishop WR. Farnesyltransferase inhibitors as anticancer agents: critical crossroads. Curr Opin Drug Discov Devel 2004; 7 (4): 478–486.
- [13] Frank RE, Saclarides TJ, Leurgans, S et al. Tumour angiogenesis as a predictor of recurrence and survival in patients with node-negative colon cancer. Ann Surg 1995; 222: 695–699.
- [14] Fukuoka M, Yano S, Giacone G, et al. A multi-institutional randomized phase II trial of gefitinib for previously treated patients with advanced non-small-cell lung cancer (the IDEAL 1 trial). J Clin Oncol 2003; 21: 2237–2246.
- [15] Giaccone G. Epidermal growth factor receptor inhibitors in the treatment of non-small-cell lung cancer. J Clin Oncol 2005; 23 (14): 3235–3242.
- [16] Goldberg RM. Cetuximab. Nat Rev Drug Discov 2005; (Suppl): 10–11.
- [17] Gottlib J, Cools J, Malone M, et al. The FIP1L1-PDGFR alfa fusion tyrosine kinase in hypereosinofilic syndrome and chronic eosinophilic leukemia: implication for diagnosis, classification and management. Blood 2004; 103 (8): 2879–2891.
- [18] Graaf MR, Richel DJ, van Noorden CJ. Effects of statins and farnesyltransferase inhibitors on the development and progression of cancer. Cancer Treat Rev 2004; 30 (7): 609–641.
- [19] Grimm CF, Blum HE, Geissler M. [Tyrosine kinase inhibitors in tumour therapy – part 2. Current position and perspectives]. Dtsch Med Wochenschr 2005; 130 (23): 1438–1442.
- [20] Hájek R, Maisnar V, Krejčí M. Thalidomid. Klin Farmakol Farm 2005; 19: 43–46.
- [21] Head J, Johnston SR. New targets for therapy in breast cancer: farnesyltransferase inhibitors. Breast Cancer Res 2004; 6 (6): 262–268.
- [22] Hedrick E, Hurwitz HI, Sarkar S, et al. Post-progression therapy (PPT) effect on survival in AVF2107, a phase III trial of bevacizumab in first-line treatment of metastatic colorectal cancer (mCRC). Proc Am Soc Clin Oncol 2004; 23: 249a.
- [23] Hideshima T, Mitsiades C, Akiyama M, et al. Molecular mechanisms mediating antimyeloma activity of proteasome inhibitor PS-341. Blood 2003; 101: 1530–1534.
- [24] Hurwitz HI, Fehrenbacher L, Novotny W, et al. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med 2004; 350: 2335–2342.
- [25] Isobe T, Herbst RS, Onn A. Current management of advanced non-small cell lung cancer: targeted therapy. Semin Oncol 2005; 32 (3): 315–328.
- [26] Jagannath S, Barlogie B, Berenson J, Siegel D, Irwin D, Richardson PG, et al. A phase 2 study of two doses of bortezomib in relapsed or refractory myeloma. Br J Haematol 2004; 127: 165–172.
- [27] Koziner B. Potential therapeutic applications of oblimersen in CLL. Oncology 2004; 18 (13 Suppl 10): 32–38.
- [28] Lokhorst HM, Breitkreuz B, van der Holt E, et al. First intermin analysis of the joint HOVON-50/GMMG-HD3 randomized study effect of thalidomide combined with adriamycin, dexamethasone and HD melphalan in patients wit multiple myeloma. Haematologica 2005; 90: Suppl. 1, PL10.06.
- [29] Mayer J. Klinické využití monoklonální protilátky Rituximab. Brno, Masarykova univerzita 2004.
- [30] McFarlane V, Friedmann PS, Illidge TM. What´s new in the management of cutaneous T-cell lymphoma? Clin Oncol (R Coll Radiol) 2005; 17 (3): 174–184.
- [31] Minna JD, Dowell J. Erlotinib hydrochloride. Nat Rev Drug Discov 2005; (Suppl): S14–15.
- [32] Morrow PK, Kim ES. New biological agents in the treatment of advanced non-small cell lung cancer. Semin Respir Crit Care Med 2005; 26 (3): 323–332.
- [33] Mulcahy MF, Benson AB. Bevacizumab in the treatment of colorectal cancer. Expert Opin Biol Ther 2005; 5 (7): 997–1005.
- [34] Normanno N, Bianco C, Strizzi L, et al. The ErbB receptors and their ligands in cancer: an over-view. Curr Drug Targets 2005; 6 (3): 243–257.
- [35] Nygren P, Sorbye H, Osterlund P, et al. Targeted drugs in metastatic colorectal cancer with special emphasis on guidelines for the use of bevacizumab and cetuximab. Acta Oncol 2005; 44 (3): 203–217.
- [36] Palumbo A, Bertola A, Cavallo F, et al. Low-Dose Thalidomide and Dexamethasone Improves Survival in Advanced Multiple Myeloma. Blood 2002; 100: 211a.
- [37] Panwalkar A, Verstovsek S, Giles F. Nuclear factor-kappaB modulation as a therapeutic approach in hematologic malignancies. Cancer 2004; 100: 1578–1589.
- [38] Pardanani A, Tefferi A. Imatinib targets other then bcr/abl and thair clinical relevance in myeloid disorders. Blood 2004; 104 (7): 1931–1939.
- [39] Richardson PG, Sonneveld P, Schuster MWA, et al. Assessment of Proteasome Inhibition for Extending Remissions (APEX) Investigators. Bortezomib or high-dose dexamethasone for relapsed multiple myeloma. N Engl J Med 2005; 24: 2487–2498.
- [40] Richardson PG, Barlogie B, Berenson J, Singhal S, Jagannath S, Irwin D, et al. A phase 2 study of bortezomib in relapsed, refractory myeloma. N Engl J Med 2003; 348: 2609–2617.
- [41] Richardson PG, Hideshima T, Anderson KC. Bortezomib (PS-341): a novel, first-in-class proteasome inhibitor for the treatment of multiple myeloma and other cancers. Cancer Control 2003; 10: 361–369.
- [42] Robak T. Alemtuzumab in the treatment of chronic lymphocytic leukemia. BioDrugs 2005; 19 (1): 9–22
- [43] Ruhl R. Induction of PXR-mediated metabolism by beta-carotene. Biochim Biophys Acta 2005; 1740 (2): 162–169.
- [44] Singhal S, Mehta J, Desikan R, et al. Antitumour activity of thalidomide in refractory multiple myeloma. N Engl J Med 1999; 1565–1571.
- [45] Slamon DJ, Leyland-Jones B, Shak S, Fuchs H, Paton V, Bajamonde A, et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. N Engl J Med 2001; 344: 783–792.
- [46] Stern M, Herrmann R. Overview of monoclonal antibodies in cancer therapy: present and promise. Crit Rev Oncol Hematol 2005; 54 (1): 11–29.
- [47] Šmardová J, Pacholíková K. Molekulární podstata kancerogeneze: in: Adam Z, Vorlíček J, Koptíková J, et al. Obecná onkologie. Praha, Grada, 2003.
- [48] Špička I, Hájek R, Kleibl R. Bortezomibum. Remedia 2005; 15: (3) 196–204.
- [49] Tagliaferri P, Tassone P, Blotta S, et al. Antitumour therapeutic strategies based on the targeting of epidermal growth factor-induced survival pathways. Curr Drug Targets 2005; 6 (3): 289–300.
- [50] Tefferi A. Modern diagnosis and treatment of primary eosinophilia. Acta Haematol 2005; 114 (1): 52–60.
- [51] Thomas M. Cetuximab: adverse event profile and recommendations for toxicity management. Clin J Oncol Nurs 2005; 9 (3): 332–338.
- [52] Thomas X, Elhamri M. [Farnesyltransferase inhibitors: preliminary results in acute myeloid leukemia. Bull Cancor 2005; 92 (3): 227–238.
- [53] Tibes R, Trent J, Kurzrock R. Tyrosine kinase inhibitors and the dawn of molecular cancer therapeutics. Annu Rev Pharmacol Toxicol 2005; 45: 357–384.
- [54] Tsai DE, Aqui NA, Vogl DT, et al. Successful treatment of T-cell post-transplant lymphoproliferative disorder with the retinoid analog bexarotene. Am J Transplant 2005; 5 (8): 2070–2273.
- [55] Vallbohmer D, Lenz HJ. Epidermal growth factor receptor as a target for chemotherapy. Clin Colorectal Cancer 2005; 5 (Suppl 1): S19–27.
- [56] van Spronsen DJ, de Weijer KJ, Mulders PF, et al. Novel treatment strategies in clear-cell metastatic renal cell carcinoma. Anticancer Drugs 2005; 16 (7): 709–717.
- [57] Wiedmann MW, Caca K. Molecularly targeted therapy for gastrointestinal cancer. Curr Cancer Drug Targets 2005; 5 (3): 171–193.
- [58] Wojcik C, DeMartino GN. Intracellular localization of proteasomes. Int J Biochem Cell Biol 2003; 35: 579–589.
- [59] Xia W, Lau YK, Zhang HZ, et al. Combination of EGFR, HER-2/neu, and HER-3 is a s tronger predictor for the outcome of oral squamous cell carcinoma than any individual family members. Clin Cancer Res 1999; 5: 4164–4174.
- [60] Yen WC, Lamph WW. The selective retinoid X receptor agonist bexarotene (LGD1069, Targretin) prevents and overcomes multidrug resistance in advanced breast carcinoma. Mol Cancer Ther 2005; 4 (5): 824–834.