Co by měl kardiolog vědět o léčbě cévních onemocnění
Kardiolog se ve své ambulantní praxi setkává nejčastěji s obliterující tepennou chorobou a léčbou akutní flebotrombózy, antikoagulační léčbou brání systémové embolizaci u rizikových nemocných, předchází tedy vzniku akutní tepenné ischemie. Méně často řeší stavy žilní hypertenze s jejich průvodními kožními změnami a otoky, povrchovou tromboflebitidu nebo lymfedém. Při výskytu Raynaudova syndromu je nutné vyloučení jiné systémové nemoci, sama léčba je často svízelná. A u nemocných se systémovými projevy zánětu je třeba pomyslet na možný přibývající výskyt vaskulitid velkých tepen, zasahujících i aortu. U situací emergentních je důležité myslet na aortální disekci v diferenciální diagnostice bolestí na hrudi.
Prevence a léčba žilní trombózy, sekundární profylaxe jejího vzniku
V roce 2012 vyšla nová, světově uznávaná doporučení týkající se prevence a léčby tromboembolické nemoci (TEN), publikovaná v časopisu Chest. V těchto 9. ACCP (American College od Chest Physicians) Guidelines se objevují některé nové léčebné přípravky a postupy. Zejména jde o zavedení nových perorálních přímých inhibitorů koagulace, které jsou označovány jako NOAC (New Oral AntiCoagulants), do praxe [1]. Řadíme sem přímý inhibitor trombinu (dabigatran etexilát) a přímé inhibitory faktoru Xa – xabany (rivaroxaban a apixaban). Všechny tři nové přípravky jsou schváleny v prevenci TEN, zatím pouze v ortopedii, po náhradách velkých kloubů. Rivaroxaban je jako jediný registrován navíc i v léčbě akutní žilní trombózy a v sekundární prevenci jejího vzniku.
V posledních dvaceti letech se tedy spektrum antikoagulancií utěšeně rozrůstá: od devadesátých let minulého století, kdy jsme začali rutinně užívat nízkomolekulární hepariny (LMWH), se objevily přímé trombinové inhibitory k parenterální aplikaci (bivalirudin, lepirudin, desirudin, argatroban, které jsou nicméně užívány vzácně), v tomto miléniu přibyl také nový nepřímý inhibitor X. koagulačního faktoru – pentasacharid fondaparinux. Všechny tyto léky mají ale nevýhodu spočívající v nutnosti parenterální aplikace. Další jistou nevýhodou je pak u většiny nutná přítomnost antitrombinu k dosažení účinku a omezení představuje také nemožnost zásahu vůči již vázanému trombinu v trombu. Vývoj jednoznačně směřuje k přímým (tj. na antitrombinu nezávislým) inhibitorům trombinu či faktoru Xa, s možností perorálního podání.
Nicméně dosud je základem prevence i léčby TEN ve většině situací aplikace některého z LMWH. Novinkou je, že hlavní užívané substance ze skupiny „parinů“ (enoxaparin, nadroparin i bemiparin) jsou distribuovány v síle umožňující léčebnou aplikaci jedenkrát denně. Toto je v souladu s doporučeními léčit žilní trombózu pokud možno ambulantně (pokud zasahuje nejvýše femorální žílu a nemocný je schopen přiměřené spolupráce v domácím režimu), a to přípravky s možností aplikace jedenkrát denně. U menší části nemocných (mladších, bez zvýšeného rizika krvácení, tedy s méně komorbiditami) a při lokalizaci trombózy proximálně – ilikofemorálně – léčíme trombolytikem, případně doplňujeme po rekanalizaci žíly ošetření reziduální stenózy implantací stentu. Lékem volby je rekombinantní tkáňový aktivátor plazminogenu (alteplasa), optimálně aplikovaný katétrem cestou podkolenní žíly, což umožňuje podat nižší dávku. V případě hemodynamicky významné plicní embolizace (na základě klinických známek, echokardiografického nálezu dysfunkce pravé komory, pozitivních laboratorních markerů srdečního přetížení a poškození myokardu) je alteplasa podávána systémově, nejčastěji v dvouhodinové infuzi, s následnou léčbou heparinem.
Novinky v prevenci TEN
Efektivita prevence se zvyšuje kombinací léčebných postupů. Tromboprofylaxe nespočívá jen ve farmakoterapii, ale má více složek. Je však velmi málo hospitalizovaných nemocných, u kterých po pečlivém vyhodnocení rizik vzniku trombózy můžeme volit jen fyzikální prostředky prevence – hydrataci, časnou mobilizaci a elastickou kompresi končetin. U nemocných se rozhodujeme dle rozsahu přítomné trombofilie (vrozené nebo získané).
 Kromě toho, že se objevily v ortopedii nové přípravky, změnila se i strategie délky nutné profylaxe jejich podávání – po náhradách velkých kloubů jde o minimálně 10–14denní aplikaci, ale po náhradě kyčle je doporučena léčba trvající až 35 dnů (tab. 1). Co se týká účinnosti, je největší redukce symptomatických tromboembolických příhod pozorována při léčbě rivaroxabanem a apixabanem (série studií RECORD a ADVANCE). Nové přípravky se liší v době doporučeného zahájení jejich aplikace po operaci: dabigatran je možno podat již 1–4 hodiny po operaci, rivaroxaban 4–10 hodin a oddálená aplikace (12–24 hod.) je možná u apixabanu. S ohledem na míru renálního vylučování (nejvyšší u dabigatranu, nejnižší u apixabanu) se ortoped rozhoduje mezi těmito NOAC i dle stavu renálních funkcí operanta [2–5].
Kromě toho, že se objevily v ortopedii nové přípravky, změnila se i strategie délky nutné profylaxe jejich podávání – po náhradách velkých kloubů jde o minimálně 10–14denní aplikaci, ale po náhradě kyčle je doporučena léčba trvající až 35 dnů (tab. 1). Co se týká účinnosti, je největší redukce symptomatických tromboembolických příhod pozorována při léčbě rivaroxabanem a apixabanem (série studií RECORD a ADVANCE). Nové přípravky se liší v době doporučeného zahájení jejich aplikace po operaci: dabigatran je možno podat již 1–4 hodiny po operaci, rivaroxaban 4–10 hodin a oddálená aplikace (12–24 hod.) je možná u apixabanu. S ohledem na míru renálního vylučování (nejvyšší u dabigatranu, nejnižší u apixabanu) se ortoped rozhoduje mezi těmito NOAC i dle stavu renálních funkcí operanta [2–5].
V interní medicíně se u rizikových nemocných naopak neosvědčilo podání rivaroxabanu (studie MAGELLAN) ani apixabanu (studie ADOPT). Ve srovnání s enoxaparinem byl zjištěn vyšší výskyt krvácení při jinak minimálních rozdílech v účinnosti [6, 7]. Nedoporučuje se zde prolongovaná léčba (např. po ukončení hospitalizace pro akutní onemocnění), stejně tak není rutinní farmakoprofylaxe doporučována u všech nemocných dlouhodobě hospitalizovaných (například v zařízeních následné péče). Vždy je nutno posoudit individuálně.
Rutinní farmakoprofylaxe není indikována ani u všech onkologických nemocných, stejně tak není namístě u nemocných, kteří jsou několik hodin imobilizováni v dopravním prostředku, byť s vyjádřenými riziky tromboembolismu. Tito pacienti by měli být poučeni především o možnostech nefarmakologické prevence TEN (hydratace, pohyb končetinami i vsedě, netísnící oblečení). Opět je nutno postupovat individuálně.
Shrneme-li současná doporučení, pak u nemocných se středním a vyšším rizikem vzniku tromboembolické příhody (např. při kumulaci více faktorů malého či středního rizika nebo při výskytu jednoho faktoru vysokého rizika) je farmakologická tromboprofylaxe TEN nutná. Zlatým standardem pro iniciaci léčby či pro krátkodobou léčbu byly dosud LMWH. S nástupem přímých inhibitorů trombinu typu gatranů či přímých inhibitorů faktoru Xa typu xabanů je však stále větší část ortopedických nemocných profylakticky léčena některým z těchto přípravků.
Novinky v léčbě akutní žilní trombózy (a plicní embolie)
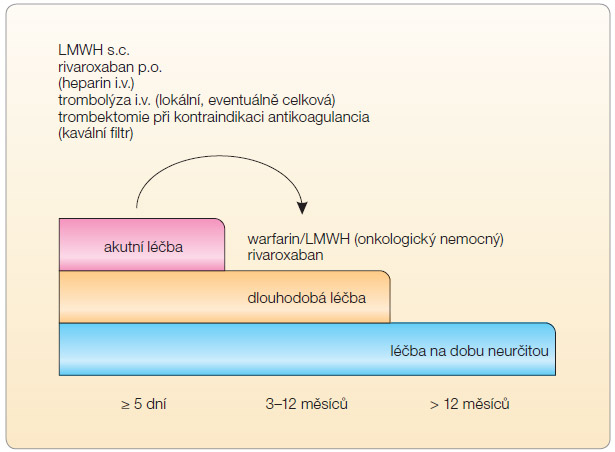 V léčbě akutní žilní trombózy a hemodynamicky stabilní plicní embolie je – dle dosud platných doporučení – základem parenterální podání heparinu (nejčastěji LMWH), a sice po dobu minimálně 5 dnů. Současně je od 1.–2. dne zahajována léčba warfarinem (obr. 1). Pouze menší část nemocných s proximální flebotrombózou léčíme trombolytiky, optimálně v redukované dávce aplikované lokálně do postižené končetiny. Celkově podaná trombolýza je metodou volby u hemodynamicky destabilizující plicní embolie (masivní rozsahem a s hemodynamickým dopadem), s vysokým rizikem smrti.
V léčbě akutní žilní trombózy a hemodynamicky stabilní plicní embolie je – dle dosud platných doporučení – základem parenterální podání heparinu (nejčastěji LMWH), a sice po dobu minimálně 5 dnů. Současně je od 1.–2. dne zahajována léčba warfarinem (obr. 1). Pouze menší část nemocných s proximální flebotrombózou léčíme trombolytiky, optimálně v redukované dávce aplikované lokálně do postižené končetiny. Celkově podaná trombolýza je metodou volby u hemodynamicky destabilizující plicní embolie (masivní rozsahem a s hemodynamickým dopadem), s vysokým rizikem smrti.
Zkušenosti s dabigatran etexilátem (léčebná dávka 2krát denně 150 mg): v indikaci akutní hluboké žilní trombózy byla s dabigatranem provedena studie RE-COVER. Dabigatran v této indikaci potvrdil noninferioritu proti konvenčnímu enoxaparinu, nicméně v akutní fázi (prvních 5–11 dnů) byli nemocní i v dabigatranové větvi léčeni LMWH [8]. Další navazující dvě studie s dabigatranem doložily snížení rizika rekurence TEN proti placebu (RE-
-SONATE) a noninferioritu proti warfarinu (RE-MEDY) při prolongovaném podávání dabigatranu přesahujícím šest měsíců. Riziko významného krvácení se ve srovnání s placebem zvýšilo, oproti warfarinu bylo ale významně nižší. Shrneme-li, pak účinnost dabigatranu v této indikaci ve srovnání s warfarinem byla obdobná a bezpečnost byla vyšší [9].
Účinnost rivaroxabanu byla v indikaci léčby akutní TEN prověřována v sérii studií EINSTEIN – EINSTEIN-DVT, EINSTEIN-PE a EINSTEIN-EXT. Byla doložena noninferiorita rivaroxabanu oproti warfarinu v léčbě flebotrombózy a plicní embolie. V posouzení kombinace cíle účinnosti a bezpečnosti (vyjádřeno parametrem „net clinical benefit“, který byl významně nižší při podávání rivaroxabanu – 2,9 %, oproti warfarinu – 4,2 %) prokázal rivaroxaban superioritu nad stávající léčbou při srovnatelné (resp. mírně nižší) incidenci významného krvácení. Při prodloužené době podávání byl rozdíl ve srovnání s placebem ještě větší (1,3 % vs. 7,1 % symptomatických příhod), výskyt krvácení se však rovněž mírně zvýšil [10, 11].
S apixabanem byla zatím publikována pouze studie AMPLIFY-EXT, která srovnávala efekt prodloužení léčby apixabanem (dvě větve aktivní léčby: 2krát denně 2,5 mg a 2krát denně 5 mg) proti placebu po skončení několikaměsíční antikoagulační léčby. Ve srovnání s placebem bylo doloženo snížení rizika rekurence symptomatické tromboembolie nebo úmrtí o dvě třetiny, stejně jako rizika rekurence kompozitního ukazatele (rekurence žilní tromboembolické příhody – VTE, smrti z důvodu VTE, infarktu myokardu, iktu nebo kardiovaskulárního úmrtí) o téměř 80 %. Riziko krvácení se nezvýšilo [12]. Výsledek léčby akutní flebotrombózy (ve srovnání se standardní léčbou) se očekává v letošním roce (již ukončená studie AMPLIFY je ve stadiu
vyhodnocování).
Pokud bychom shrnuli výsledky výše uvedených studií v léčbě akutní žilní trombózy, lze říci, že dabigatran a rivaroxaban prokázaly srovnatelnou účinnost (v parametru rekurence) i bezpečnost (zejména s ohledem na riziko krvácení) oproti konvenční stávající léčbě (LMWH/warfarin). Rivaroxaban navíc navodil méně velkých krvácení ve srovnání se standardním režimem léčby a skýtá větší možnost pro ambulantní léčbu, protože umožňuje výlučně perorální medikaci od začátku léčby: fixní užívaná dávka 2krát denně 15 mg je po prvních třech týdnech léčby následována dávkováním 20 mg 1krát denně.
 Pro porovnání rizika rekurence VTE při prolongovaném podávání antikoagulancia proti placebu byl ukázán přínos jak dabigatranu, tak rivaroxabanu i apixabanu ve snížení četnosti rekurencí tromboembolických příhod. Zásadní roli hraje bezpečnost léčby, přičemž podávání apixabanu se ukázalo stejně bezpečným jako podávání placeba.
Pro porovnání rizika rekurence VTE při prolongovaném podávání antikoagulancia proti placebu byl ukázán přínos jak dabigatranu, tak rivaroxabanu i apixabanu ve snížení četnosti rekurencí tromboembolických příhod. Zásadní roli hraje bezpečnost léčby, přičemž podávání apixabanu se ukázalo stejně bezpečným jako podávání placeba.
V léčbě hluboké žilní trombózy rozlišujeme dva základní přístupy: u rozsáhlých ilikofemorálních trombóz zvažujeme léčbu intervenční – trombolytickou (v nepřítomnosti kontraindikace jejího podání) a v konzervativní léčbě můžeme podat buď LMWH a warfarinizovat nebo podávat od začátku rivaroxaban (první tři týdny ve vyšší dávce 2krát denně 15 mg, dále v dávce 20 mg 1krát denně). Délka následné antikoagulační léčby se řídí trváním rizik vzniku trombózy a rizikem krvácení u daného pacienta, minimem jsou tři měsíce u trombózy, jejíž vyvolávající faktor pominul (tab. 2).
Novinky v léčbě povrchové tromboflebitidy
Tromboflebitida je charakteristická kombinací trombózy a zánětu, vzniká přitom parciální nebo úplný trombotický uzávěr epifasciálně uložené žíly se současným nebakteriálním zánětem okolí (periflebitida). Nejčastější formou je varikoflebitida, kdy je ve většině případů postižena velká saféna. U rozsáhlých flebitid na stehně nebo lýtku je nutno pomocí duplexní sonografie vyloučit propagaci trombu do hlubokého žilního řečiště (rozsah flebitidy, byť viditelné, nelze odečíst pouze fyzikálním vyšetřením!). V případě (variko)flebitid, hrozících přestupem nebo do hluboké žíly již zasahujících, je indikována antikoagulační léčba – buď LMWH (častěji v dávce terapeutické) s přechodem na podávání warfarinu nebo samotným LMWH po dobu trvání stavu nebo léčba fondaparinuxem (v dávce 2,5 mg denně s.c.). Délka trvání antikoagulační léčby u tromboflebitidy se řídí stavem „zánětu“, nepřekračuje většinou dobu 6–8 týdnů.
Jiné formy flebitid postihují žíly nezměněné a zde nutno pomýšlet na možnost druhotného vzniku (při malignitě, sepsi či autoimunitní chorobě). Základem terapie povrchových flebitid je komprese a pohyb, ke zmírnění subjektivních obtíží jsou indikovány lokální heparinoidy a/nebo nesteroidní antirevmatika (lokálně i celkově jako protizánětlivé léky). Antibiotika nejsou součástí medikace, podáváme je výjimečně při výrazných známkách zánětu, pokud existuje reálná možnost zanesení infekce zvnějšku nebo při sepsi či přestupem bakteriálního zánětu z okolí [13, 14].
Novinky v léčbě symptomatické chronické žilní nemoci/žilní insuficience
Chronická žilní onemocnění zahrnují jakoukoliv viditelnou abnormitu povrchové žíly a okolí (teleangiektazie, retikulární varixy, kmenové varixy, kožní změny z žilní hypertenze), dále sem patří potrombotické stavy s různým stupněm rekanalizace hluboké žíly a všechny stavy spojené s abnormální funkcí žilního systému (ve smyslu patologického návratu, žilní hypertenze). Varixy mohou být tzv. nekomplikované (bez kožních změn či edému) nebo komplikované (jsou vyjádřeny intermitentní nebo stálé otoky, kožní změny charakteru hyperpigmentací, indurace po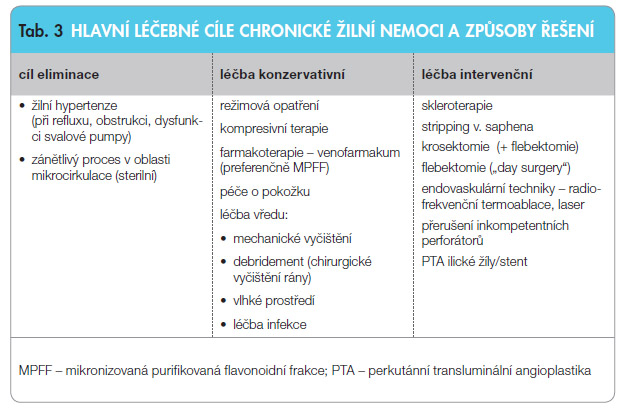 dkoží či okrskové atrofie, případně vzniká ulcerace). Míra potíží nekoreluje přesně s rozsahem viditelných změn.
dkoží či okrskové atrofie, případně vzniká ulcerace). Míra potíží nekoreluje přesně s rozsahem viditelných změn.
Pokud nenastane dostatečný efekt tzv. konzervativní léčby, sestávající z režimových opatření, kompresivní léčby a aplikace účinného venofarmaka (za prokázaně nejúčinnější je mezinárodně považována mikronizovaná frakce diosminu s hesperidinem v dávce 2krát denně 500 mg), přistupujeme k úvaze o radikální léčbě – eliminaci varixů (tab. 3). Zjednodušeně lze o radikálních výkonech říci, že abnormálně dilatované žíly lze odstranit buď chemicky, chirurgicky nebo tepelnou energií. Máme tedy tři základní možnosti odstranění varixů: skleroterapii, klasickou chirurgii varixů a moderní metody endovenózní ablace (laserem či termoablačně). Jakékoliv intervenci na varixech má předcházet podrobné mapování žilního řečiště pomocí duplexní ultrasonografie, která by však měla být provedena vždy, pokud nemocný trpí výraznými obtížemi (otoky apod.), má kožní změny, nebo dokonce již vřed. Hlavní role duplexní sonografie spočívá v určení průchodnosti žilního řečiště, zpřesnění anatomických poměrů, určení lokalizace a velikosti refluxu [15, 16].
Skleroterapie je indikována jako prvotní léčba zejména při výskytu metliček, drobnějších varixů, perforátorů, či menších hemangiomů, druhotně pak jako doplňková léčba k chirurgickým postupům, případně při recidivách varikozity. Nejužívanější injikovanou substancí je polidocanol, použité množství a koncentrace závisí na kalibru vény. V současnosti je preferována sklerotizace pěnou za kontroly duplexní sonografií. Klasická chirurgická léčba spočívá obvykle v krosektomii safenofemorální nebo safenopopliteální junkce (pokud se prokáže její insuficience, což bývá asi u 50 % nemocných s kmenovými varixy), v indikovaných případech bývá doplněna strippingem postiženého kmene safény a excizí varikózních větví. Je tendence k zachování nepostižených úseků velké safény pro možnost jejího použití jako bypassu. Endovaskulární uzávěry safény představují méně invazivní zákroky, které vedou k obliteraci nedomykavé safény endovazálně fibrotizací. Tyto ambulantní výkony jsou prováděny v lokální anestezii za kontroly ultrazvukem. Klasická i endovaskulární termická ablace přinášejí přibližně stejné výsledky z hlediska recidiv (0–30 % podle různých studií). Laser a radiofrekvenční ablace jsou lépe hodnoceny z hlediska bolestivosti, kosmetického efektu a pro výraznější zkrácení doby rekonvalescence [17].
Endovaskulární léčba trombotizované hluboké žíly, působící omezení krevního návratu z končetiny a potíže plynoucí z žilní hypertenze, spočívá v provedení balonkové angioplastiky a implantace stentu. Je proveditelná v pánevním řečišti u některých nemocných se sonograficky nebo flebograficky zjištěnou stenózou nebo krátkým uzávěrem pánevní žíly. Stenóza ilické žíly může být nejen následkem neúplné rekanalizace hluboké žilní trombózy, ale může být způsobena útlakem zevně nebo být následkem fibroprodukce navozené např. léčebným ozářením pánve.
Disekce aorty
Podstatné je na tuto jednotku myslet, protože mnohem častěji se pacient pro bolest na hrudi dočká selektivní koronarografie než zobrazení aorty (akutní koronární syndrom však může být komplikací disekce). Mezi základní diagnostické techniky dosud řadíme elektrokardiogram, skiagram hrudníku (pokud nezdržuje další vyšetření), transtorakální a zejména transezofageální echokardiografické vyšetření, počítačovou tomografii nebo magnetickou rezonanci. Aortografie zůstává standardní metodou při endovaskulárních intervencích v rámci terapie.
Léčbu vedeme stále dle lokalizace – podle typu disekce: u akutní disekce aorty typu A (ascendentní aorta a oblouk) je indikována okamžitá kardiochirurgická léčba k odstranění aortální regurgitace, stabilizaci aorty a řešení případné srdeční tamponády. U akutní disekce typu B (postižení descendentní aorty) volíme převážně konzervativní postup. Okamžitá léčebná opatření mají za cíl snížení krevního tlaku a snížení srdečního výdeje. Základními léky, kromě analgetik, jsou nitroprusid sodný a betablokátory (esmolol a další parenterální betablokátory) s cílem udržení systolické tenze na hodnotách 100–120 mm Hg. Tento postup volíme iniciálně i u nemocných s disekcí typu A, navíc v případě hypotenze způsobené srdeční tamponádou či rupturou aorty provádíme volumoexpanzi, podáváme noradrenalin, eventuálně malé dávky dopaminu.
Chirurgická terapie u pacientů s disekcí typu B je indikována při vzniku komplikací (retrográdní extenze disekce do ascendentní aorty, perzistující bolest, hematom periaortálně, periferní ischemické projevy). V dané chvíli by vždy měl být konzultován intervenční endovaskulární specialista (angiolog/rentgenolog/kardiolog) s otázkou možnosti implantace stentgraftu k překrytí proximální intimální trhliny a umožnění trombotizace falešného lumen, ošetření stenotických odstupů tepen z aorty. Endovaskulární intervence u disekce typu A při nemožnosti léčit chirurgicky jsou velmi složité – grafty jsou hůře ukotvitelné a musí být fenestrované či větvené, případně jinak složitě konstruované [18].
Neinfekční aortitida a arteriitida velkých tepen
Po stanovení diagnózy některé z velkobuněčných vaskulitid (v dnešní době nejčastěji pomocí pozitronové emisní t omografie-počítačové tomografie, PET-CT), ať již typu Takayasuovy arteriitidy (TA), nebo temporální arteriitidy, zahajujeme imunosupresivní terapii. Iniciální dávka je 40–60 mg prednisonu denně nebo 1 mg/kg. V průběhu týdnů se snažíme o snížení dávky podle aktivity onemocnění, posuzované mírou symptomů, laboratorních markerů zánětu (které jsou méně validní u TA) a pomocí zobrazovacích metod. U nemocných podáváme současně léky bránící vzniku osteoporózy nebo gastroduodenálních ulcerací, monitorujeme případný vznik poruchy glukózové tolerance, arteriální hypertenze nebo katarakty. V některých případech pro možnost podání nižší dávky kortikosteroidů a navození/udržení remise volíme kombinovanou imunosupresivní medikaci – nejčastěji přidáním azathioprinu, méně často přidáním methotrexátu nebo mykofenolát mofetilu k léčbě (tab. 4). Z novějších přípravků je u těžkých forem ke zvážení léčba anti-TNF (tumor necrosis factor) – např. infliximabem.
omografie-počítačové tomografie, PET-CT), ať již typu Takayasuovy arteriitidy (TA), nebo temporální arteriitidy, zahajujeme imunosupresivní terapii. Iniciální dávka je 40–60 mg prednisonu denně nebo 1 mg/kg. V průběhu týdnů se snažíme o snížení dávky podle aktivity onemocnění, posuzované mírou symptomů, laboratorních markerů zánětu (které jsou méně validní u TA) a pomocí zobrazovacích metod. U nemocných podáváme současně léky bránící vzniku osteoporózy nebo gastroduodenálních ulcerací, monitorujeme případný vznik poruchy glukózové tolerance, arteriální hypertenze nebo katarakty. V některých případech pro možnost podání nižší dávky kortikosteroidů a navození/udržení remise volíme kombinovanou imunosupresivní medikaci – nejčastěji přidáním azathioprinu, méně často přidáním methotrexátu nebo mykofenolát mofetilu k léčbě (tab. 4). Z novějších přípravků je u těžkých forem ke zvážení léčba anti-TNF (tumor necrosis factor) – např. infliximabem.
Pokud se vyskytují vaskulární komplikace manifestující se ischemií příslušné oblasti, je namístě zvážit možnosti provedení revaskularizace – přednostně endovaskulárně (u renálních tepen, periferních), optimálně až po navození remise. U TA je nutno myslet na možnost spolupostižení koronárních, plicních a renálních tepen s průvodními jevy (ischemie myokardu, plicní hypertenze, renovaskulární hypertenze). I po endovaskulární nebo chirurgické revaskularizaci je u vaskulitid vysoké riziko vzniku restenózy [19].
Léčba aterotrombózy periferních tepen
Antitrombotická léčba komplikací periferní aterosklerózy
Strategie léčby a profylaxe aterotrombotických příhod periferních tepen zahrnuje tři postupy: zastavení progrese aterogeneze (zejména úpravou rizikových faktorů, tj. životosprávou a farmakoterapií), antitrombotickou léčbu (dominuje protidestičková léčba) a úpravu případných poruch cirkulace vedoucích k ischemii (revaskularizací či podáváním vazoaktivních léčiv).
U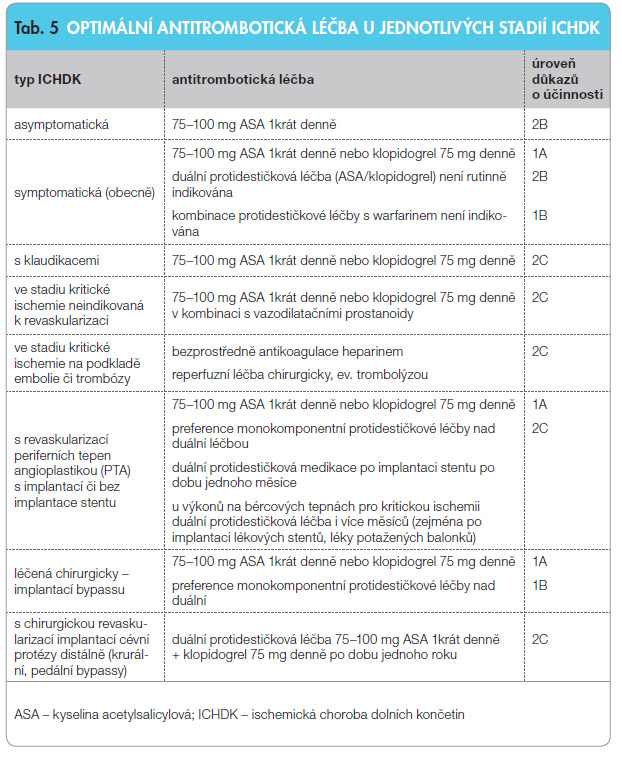 ischemické choroby dolních končetin (ICHDK), jako nejčastější lokalizace periferní aterosklerózy, je antitrombotická léčba postavena na protidestičkové léčbě. Pouze při vysokém riziku trombózy (např. po uzávěru cévní spojky) či po proběhlé tromboembolizaci do periferní arterie je podávána antikoagulační medikace. Současná protidestičková léčba je zvažována v kontextu celkového tepenného postižení. Základem protidestičkové medikace je kyselina acetylsalicylová (ASA) v dávce 75–100 mg, alternativou je klopidogrel v dávce 75 mg (tab. 5). V porovnání s ASA má klopidogrel výraznější efekt na pokles výskytu trombotických komplikací při srovnatelném riziku krvácivých komplikací. Dlouho očekávaný, dosud však v České republice neregistrovaný lék cilostazol (s vazodilatačním, protidestičkovým i mírným hypolipidemickým účinkem) je nejistou nadějí. Inhibitory glykoproteinových receptorů IIb/IIIa v léčbě ICHDK nepoužíváme. Nové blokátory ADP receptorů trombocytů – tikagrelor a prasugrel – nemají zatím průkaz účinnosti v indikaci léčby ICHDK.
ischemické choroby dolních končetin (ICHDK), jako nejčastější lokalizace periferní aterosklerózy, je antitrombotická léčba postavena na protidestičkové léčbě. Pouze při vysokém riziku trombózy (např. po uzávěru cévní spojky) či po proběhlé tromboembolizaci do periferní arterie je podávána antikoagulační medikace. Současná protidestičková léčba je zvažována v kontextu celkového tepenného postižení. Základem protidestičkové medikace je kyselina acetylsalicylová (ASA) v dávce 75–100 mg, alternativou je klopidogrel v dávce 75 mg (tab. 5). V porovnání s ASA má klopidogrel výraznější efekt na pokles výskytu trombotických komplikací při srovnatelném riziku krvácivých komplikací. Dlouho očekávaný, dosud však v České republice neregistrovaný lék cilostazol (s vazodilatačním, protidestičkovým i mírným hypolipidemickým účinkem) je nejistou nadějí. Inhibitory glykoproteinových receptorů IIb/IIIa v léčbě ICHDK nepoužíváme. Nové blokátory ADP receptorů trombocytů – tikagrelor a prasugrel – nemají zatím průkaz účinnosti v indikaci léčby ICHDK.
Terapeutickým cílem sekundární prevence, tj. podávání protidestičkové léčby u osob s přítomností choroby na bázi aterotrombózy, je funkční blokáda 60–90 % trombocytů. Nedostatečná inhibice při léčbě je spojena s rizikem trombotických komplikací, naopak příliš vysoká inhibice je spojena s rizikem krvácení.
Postavení ASA bylo zkoumáno v rámci metaanalýz ATC (Antithrombotic Trialists’ Collaboration). Publikace z roku 2002 uvádí, že v podskupině více než 9 tisíc nemocných zařazených na základě přítomnosti periferně lokalizovaného aterosklerotického postižení (zejména typu ICHDK) snížila protidestičková léčba riziko recidivy iktu, infarktu myokardu nebo úmrtí z vaskulární příčiny o 23 % (p < 0,004). Obdobný efekt byl doložen v kohortě nemocných s klaudikacemi (pokles o 23 %) či po periferní revaskularizaci (při revaskularizaci angioplastikou o 29 %, při revaskularizaci bypassem o 22 %). Nedostatkem této metaanalýzy je skutečnost, že nešlo výlučně o léčbu ASA [20]. Ačkoliv jsou data pro nemocné s ICHDK slabší oproti údajům o léčbě nemocných s ischemickou chorobou srdeční, z důvodu předpokládané generalizované aterosklerózy alespoň u části pacientů podáváme ASA rutinně i nemocným s ICHDK [21]. Nejasnou podskupinou pro léčbu ASA jsou pak nemocní s asymptomatickou ICHDK definovanou poklesem ABI (Ankle-Brachial Index) pod hodnotu 0,9. Zde vyvstává otázka, zda jim máme také podávat ASA. Jediná studie – The Aspirin for Asymptomatic Atherosclerosis trial – se zabývala efektem ASA u nemocných se sníženým ABI. Bohužel hodnota indexu ABI ≤ 0,95 potřebná pro zařazení do studie byla příliš vysoká, a zkoumaná populace tak neodpovídala běžně uznávané definici asymptomatické ICHDK. Rovněž roční incidence kombinovaného ukazatele (fatální i nefatální vaskulární příhoda či nutnost revaskularizace) představovala přibližně 1,2 %, byla tedy příliš nízká, než aby odpovídala skupině s přítomnou ICHDK. Absence efektu ASA na morbiditu či mortalitu v této studii proto nepřekvapuje [22]. U těchto nemocných je protidestičková léčba ASA alternativou ke zvážení, v kontextu přítomnosti dalších rizik (arteriální hypertenze, diabetes mellitus, …).
Jako alternativa ASA může v léčbě ICHDK sloužit některý z inhibitorů receptorů P2Y12 pro adenosindifosfát (ADP) – ale racionální je v současnosti pouze užití klopidogrelu (dochází k zřetelnému ústupu od užívání tiklopidinu, a to pro jeho nižší bezpečnost, u prasugrelu nebo tikagreloru zatím chybějí data). Účinek ireverzibilního blokátoru ADP receptorů klopidogrelu byl v indikaci profylaxe cévních příhod u nemocných s ICHDK prověřován jak v monoterapii proti ASA, tak v kombinaci s ASA. Nejrozsáhlejší studií prověřující efekt monoterapie klopidogrelem proti ASA byla CAPRIE v indikaci sekundární prevence aterotrombotických příhod. Ve třech podskupinách po téměř 8 tisících nemocných (po infarktu myokardu, po iktu, s anamnézou ICHDK) byl prověřován účinek obou léků na pokles kardiovaskulární mortality a morbidity. Zásadně pozitivní efekt klopidogrelu byl potvrzen právě u skupiny nemocných zařazených do studie pro diagnózu periferní aterosklerózy (pokles počtu závažných cévních příhod byl významně větší) [23]. Klopidogrel je tak v profylaxi závažných aterotrombotických komplikací u nemocných s periferní aterosklerózou mírně účinnější než ASA při srovnatelné bezpečnosti. Jeho úhrada v této indikaci je však omezena na nemocné s doloženou nesnášenlivostí či kontraindikací podání ASA.
Studie CHARISMA nedoložila naopak pozitivní efekt duální léčby u nemocných s chronickými formami aterosklerózy – u všech byl zjištěn jen minimální pokles počtu příhod, přínos byl zcela eliminován vzestupem výskytu krvácivých komplikací. Podskupina nemocných s ICHDK nebyla separátně hodnocena. Na základě této studie je pravděpodobné, že duální protidestičková léčba kombinací ASA s klopidogrelem u nemocných s ICHDK není indikována pro trvalou léčbu [24]. Duální antiagregační medikaci podáváme pouze krátkodobě, a sice po dobu jednoho měsíce po implantaci stentů v ilickém řečišti, případně pokud dojde při rekanalizaci tepen ke komplikující disekci. Po angioplastikách a implantaci stentů do bércového řečiště pro kritickou končetinovou ischemii je ke zvážení i medikace trvající více měsíců, nicméně jde pouze o extrapolaci dat z koronárního řečiště.
Shrneme-li, pak u nemocných s ICHDK nemáme k dispozici samostatnou robustní studii, která by sledovala efekt nejběžnější medikace – tedy ASA u nemocných s ICHDK. Nicméně řada metaanalýz dokládá příznivý efekt ASA na pokles výskytu aterotrombotických příhod v dané indikaci. Deváté doporučení ACCP, v pořadí zatím poslední, jednoznačně doporučuje podávání ASA v dávce 75–100 mg denně (či alternativně podávání klopidogrelu v dávce 75 mg denně) a hodnotí prospěch na úrovni 1A [25]. S délkou a intenzitou antitrombotické léčby narůstá riziko krvácení, není přitom patrný výrazný rozdíl mezi jednotlivými léky (výskyt krvácení při užití ASA je srovnatelný s výskytem při léčbě blokátory ADP receptorů či s antikoagulancii).
Vazoaktivní medikace v léčbě periferní ischemie?
Vazoaktivní léky jsou heterogenní skupinou léčiv, u kterých se kombinuje vazodilatační mechanismus působení s hemoreologickým, případně antitrombotickým působením. V klinickém užívání zůstaly v angiologických indikacích dva přípravky s komplexním působením – naftidrofuryl a pentoxifylin. Jejich hlavní indikací je prodloužení klaudikačního intervalu u nemocných s ICHDK ve stadiu krátkých klaudikací, tj. ve stadiu IIb dle Fontainea. Skupina prostanoidů je naopak indikována až ve stadiích pozdějších, tedy ve stadiu klidových bolestí a trofických změn (stadium III a IV). Inhibitor fosfodiesterázy III cilostazol, indikovaný ve všech stadiích ICHDK, zejména však u klaudikantů, není v ČR dostupný.
Naftidrofuryl i pentoxifylin mají sice obdobné indikace, každý však působí jiným mechanismem účinku. Předpokládá se však, že pentoxifylin (inhibitor fosfodiesterázy I) působí především jako reologikum (pro klinický účinek má zřejmě největší význam zvýšení deformability erytrocytů a leukocytů a inhibice agregace trombocytů). V indikaci léčby ICHDK ve stadiu klaudikací žádná z provedených studií neprokázala přesvědčivý účinek. Jejich metaanalýza pak dokumentovala prodloužení bezbolestného klaudikačního intervalu pouze o několik procent, v absolutní vzdálenosti o 21 m (95% CI: 0,7–41,3 m), bezbolestná klaudikační vzdálenost vzrostla o 44 m (95% CI: 14,1–73,6 m). Též další analýzy docházejí k závěru, že účinek pentoxifylinu na prodloužení klaudikační vzdálenosti není přesvědčivě dokumentován [26]. Podobně nebyl pozorován vzestup kotníkových tlaků (což není ale doloženo ani při podávání prostanoidů), tedy ani objektivní sledování poruchy prokrvení neprokázalo zlepšení. Jedinou výjimkou, kdy byl podán validní průkaz o účinku pentoxifylinu, je zrychlení hojení bércových vředů. Metaanalýza Cochraneova institutu z roku 2007 doložila významné urychlení zhojení bércových vředů o 70 % oproti placebu. V kombinaci s kompresní léčbou (standardní postup) byl efekt ještě výraznější a počet zhojených vředů vzrostl na více než dvojnásobek [27].
Druhým léčivem s podobnými indikacemi je naftidrofuryl – antagonista účinku serotoninu. Inhibicí serotoninových receptorů působí snížení tonu hladké svaloviny stěny cévní a snižuje odezvu na vazokonstrikční podněty. Farmakodynamické působení je komplexní – spočívá ve zvýšení deformability erytrocytů a v mírném vazodilatačním účinku (nepřímý blokátor vápníkového kanálu). Naftidrofuryl se používá převážně při poruchách prokrvení v oblasti končetin a mozkové cirkulace. Nutno upozornit, že v praxi se podává zpravidla v subterapeutických dávkách a z tohoto tzv. poddávkování plyne určitá skepse k jeho účinku. Nicméně při správném podávání a správné indikaci má léčba naftidrofurylem své opodstatnění. Jeho indikace však zdaleka není plošná a racionální je selekce nemocných podle stadia choroby i podle výsledného terapeutického účinku. Na základě výsledků klinických studií a zejména jejich metaanalýz je možno konstatovat při podávání standardní dávky 3krát denně 200 mg po dobu několika měsíců středně významné prodloužení bezbolestné klaudikační vzdálenosti řádově o třetinu a maximálního klaudikačního intervalu asi o 40 %. Tato analýza vychází z hodnocení Cochraneova institutu z roku 2008, které zahrnulo 7 studií kontrolovaných placebem, provedených u 1266 nemocných. Bylo doloženo prodloužení bezbolestného klaudikačního intervalu o 37 % po půl roce léčby ve srovnání s placebem. Maximální klaudikační vzdálenost se prodloužila o 40 % [28]. Z klinického hlediska je prodloužení bezbolestné i maximální vzdálenosti středně významné. Ke zlepšení stavu nedošlo zdaleka u všech nemocných – k prodloužení nejméně o polovinu bezbolestné klaudikační vzdálenosti došlo u necelé čtvrtiny nemocných (22,3 %). Je nutno léčit 4–5 nemocných po dobu přibližně 6 měsíců, abychom u jednoho z nich docílili skutečně významného efektu, tj. prodloužení klaudikační vzdálenosti nejméně o polovinu.
Který léčebný postup je pro klaudikanta nejúčinnější? Existuje studie porovnávající u nemocných s klaudikacemi přímo naftidrofuryl s pentoxifylinem a cilostazolem. Během 24 týdnů léčby byly vzájemně postupně porovnávány všechny tři léky. Pentoxifylin prodloužil maximální klaudikační vzdálenost o 45 %, naftidrofuryl zvýšil vzdálenost o 57 % a cilostazol o 75 %. Tedy naftidrofuryl prodloužil maximální klaudikační interval více než pentoxifylin a méně než cilostazol [29]. Porovnáme-li však vazoaktivní farmakoterapii u klaudikantů s režimovou léčbou – pravidelnou chůzí, je fyzický trénink výrazně účinnější. V metaanalýze řady studií vzrostla bezbolestná klaudikační vzdálenost téměř na trojnásobek – konkrétně se prodloužila o 179 % [30, 31].
Jaké je poselství z těchto studií pro praxi? Optimální léčbou nemocného s ICHDK tedy nejsou vazoprotektiva, ale chůze vedoucí opakovanou ischemií k rozvoji kolaterál. Z farmakoterapie jistě budeme volit postupy snižující riziko vzniku aterotrombotických komplikací, tedy antitrombotickou (protidestičkovou) léčbu, statiny a podporu, která usnadňuje odvykání kouření.
K léčbě pokročilých stadií ICHDK se již dlouho užívají vazodilatačně působící prostaglandiny – zejména prostaglandin E1 alprostadil, jeho analog limaprost a prostaglandin I2 prostacyklin. Za významnější účinek těchto prostaglandinů je pokládána vazodilatace a úprava endoteliální dysfunkce. Inhibice agregace trombocytů je rovněž významná. Ani tento způsob léčby nepřináší 100% odpověď na léčbu: podíl respondérů dosahuje přibližně 50 % – u těchto pacientů tato nákladná léčba brání progresi ischemie a může vést k její záchraně. Základním postupem u léčby kritické končetinové ischemie je vždy pokus o revaskularizaci – endovaskulárně nebo chirurgicky.
Léčba Raynaudova syndromu
Raynaudův syndrom (nebo Raynaudův fenomén, RF) je záchvatovité onemocnění na podkladě vazospasmu periferních arteriol projevující se náhlou změnou barvy prstů rukou (méně často nohou), nejčastěji evokované chladem. U primárního onemocnění, které lze charakterizovat pouze zvýšenou tendencí k vazospasmům na podkladě zvýšené sympatikotonie, často vystačíme v léčbě s režimovými opatřeními a choroba může zcela vyhasnout. U sekundárního RF je podkladem systémové onemocnění (nejčastěji systémová sklerodermie) nebo různé typy poškození tepenného systému (profesní, vaskulitidy apod.).
Základem diagnostiky je typický klinický obraz, další vyšetření směřují k vyloučení celkového onemocnění (základem je stanovení sedimentace erytrocytů, krevního obrazu, antinukleárních protilátek a přínosné je provedení kapilaroskopie). Pacient by měl zůstat ve sledování angiologa, který vyloučí makroangiopatii, nebo revmatologa, který nemocného dispenzarizuje a sleduje, zda v čase nedojde k manifestaci revmatologického autoimunního onemocnění.
Blokátory kalciového kanálu (historicky nifedipin, nyní spíše další léky této skupiny s příznivějším farmakologickým profilem) jsou dosud léky prvé volby. Jejich použití je však limitováno sklonem k hypotenzi u řady nemocných s RF. Z nových léků se jeví jako nadějné v prevenci vzniku ulcerací u systémové sklerodermie a ovlivnění tendence k vazospasmům antagonisté receptorů pro endotelin (např. bosentan je registrován v léčbě ulcerací u systémové sklerodermie) a inhibitory fosfodieterázy-5 (např. sildenafil, vardenafil). U nejtěžších případů, kde dochází na základě protrahovaných vazospasmů až k akrálním ulceracím, podáváme parenterálně prostaglandin E1 a zvažujeme chemickou nebo chirurgickou sympatektomii [32].
Závěr
Závěrem je možno říci, že diagnostika a léčba nejběžnějších diagnóz v angiologii by měla být chápána jako součást kompetencí obecného internisty i kardiologa. Nicméně se vzácnějšími a složitějšími stavy již nemusí tito odborníci přicházet tak často do styku, proto je vhodné, aby se počty atestovaných angiologů rozrůstaly. U akutních stavů rozsáhlé flebotrombózy, tepenné ischemie, akutních aortálních syndromů nebo pro léčbu iktů by měla být v každém kardiovaskulárním centru dostupná trvalá služba erudovaného intervenčního angiologa. V angiologii je také důležitá propracovaná spolupráce mezioborová – jak mezi angiology a radiology, tak mezi cévními chirurgy, v některých situacích pak i spolupráce mezi dermatology nebo revmatology.
Článek vznikl za podpory programu PRVOUK-P35/LF1/5.
Seznam použité literatury
- [1] Weitz JI, Eikelboom JW, Samama MM. New Antithrombotic Drugs: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines CHEST 2012; 141 (2 suppl): e120S–e151S.
- [2] Turpie AG, Lassen MR, Eriksson BI, et al. Rivaroxavaban for the prevention of venous thromboembolism after hip or knee arthroplasty. Pooled analysis of four studies. Thromb Haemost 2011; 105: 444–453.
- [3] Wolowacz SE, Roskell NS, Plumb JM, et al. Efficacy and safety of dabigatran etexilate for the prevention of venous thromboembolism following total hip or knee arthroplasty. A meta-analysis. Thromb Haemost 2009; 101: 77–85.
- [4] Friedman RJ, Dahl OE, Rosencher N, et al. Dabigatran versus enoxaparin for prevention of venous thrombembolism after hip or knee arthroplasty: a pooled analysis of three trials. Thromb Res 2010; 126: 175–182.
- [5] Deeks ED. Apixaban: a review of its use in the prevention of venous thromboembolism after knee or hip replacement surgery. Drugs 2012; 72: 1271–1291.
- [6] Cohen AT for the MAGELLAN Investigators. Rivaroxaban compares favorably with enoxaparin in preventing venous thrombembolism in acutelly ill patients without showing a net clinical benefit. ACC Congress 2011, New Orleans, US.
- [7] Goldhaber SZ, Leizorovicz A, Kakkar AK, et al. ADOPT Trial Investigators. Apixaban versus enoxaparin for thromboprophylaxis in medically ill patients. N Engl J Med 2011; 365: 2167–2177.
- [8] Schulman S, Kearon C, Kakkar AK, et al. Dabigatran versus Warfarin in the Treatment of Acute Venous Thromboembolism. NEJM 2009; 361: 2342–2352.
- [9] Schulman S, Kearon C, Kakkar AK, et al. RE-MEDY Trial Investigators; RE-SONATE Trial Investigators. Extended use of dabigatran, warfarin, or placebo in venous thromboembolism. N Engl J Med 2013; 368: 709–718.
- [10] EINSTEIN Investigators. Bauersachs R, Berkowitz SD. Oral rivaroxaban for symptomatic venous thromboembolism. NEJM 2010; 363: 2499–2510.
- [11] Cohen AT, Dobromirski M. The use of rivaroxaban for short- and long-term treatment of venous thromboembolism. Thromb Haemost 2012; 107: 1035–1043.
- [12] Agnelli G, Buller HR, Cohen A, et al. Apixaban for extended treatment of venous thromboembolism. N Engl J Med 2013; 368: 699–708.
- [13] Štvrtinová V, Dukát A, Džupina A, et al. Povrchová tromboflebitída – diagnostika a liečba. Vaskulárna Medicína 2011; 3 (S1): 1–16.
- [14] Hirmerová J. Povrchová tromboflebitida, neprávem podceňovaná choroba – je čas změnit názor? Vnitř Lék 2012; 58: 647–653.
- [15] Nicolaides A, et al. Management of Chronic Venous Disorders of the Lower Limbs: Guidelines According to Scientific Evidence. Int Angiol 2008; 27: 1–59.
- [16] Karetová D, Seifert B, Vojtíšková J, et al. DP Chronická žilní onemocnění. CDP-PL, Společnost všeobecného lékařství, 1. vydání, 2011.
- [17] Veverková L, Kalač J, Konečný J, et al. Chirurgická léčba varixů a endovenózní terapie. Dermatol praxi 2011; 5: 192–195.
- [18] Kölbel T, Diener H, Larena-Avellaneda A, et al. Advanced endovascular techniques for thoracic and abdominal aortic dissections. Cardiovasc Surg 2013; 54 (Suppl 1): 81–90.
- [19] Luqmani R. Large vessel vasculitides: update for the cardiologist. Curr Opin Cardiol 2012; 27: 578–584.
- [20] Antithrombotic Trialists’ Collaboration. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ 2002; 324: 71–86.
- [21] Berger JS, Krantz MJ, Kittelson JM, Hiatt WR. Aspirin for the prevention of cardiovascular events in patients with peripheral artery disease: a meta-analysis of randomized trials. JAMA 2009; 301: 1909–1919.
- [22] Fowkes FG, Price JF, Stewart MC, et al. Aspirin for prevention of cardiovascular events in a general population screened for a low ankle brachial index: a randomized controlled trial. JAMA 2010; 303: 841–848.
- [23] CAPRIE Steering Committee. A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). Lancet 1996; 348: 1329.
- [24] Bhatt DL, Fox KA, Hacke W, et al. CHARISMA Investigators. Clopidogrel and aspirin versus aspirin alone for the prevention of atherothrombotic events. N Engl J Med 2006; 354: 1706.
- [25] Alonso-Coello P, Bellmunt S, McGorrian C, et al. Antithrombotic therapy in peripheral artery disease: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. CHEST 2012; 141 (2 Suppl): e669S–6690S.
- [26] De Backer TL, Vander Stichele RH, Warie HH, Bogaert MG. Oral vasoactive medication in intermittent claudication: utile or futile? Eur J Clin Pharmacol 2000; 56: 199–206.
- [27] Jull A, Arroll B, Parag V, Waters J. Pentoxifylline for treating venous leg ulcers. Cochrane Database Syst Rev 2007; (3): CD001733.
- [28] De Backer T, Vander Stichele R, Lehert P, Van Bortel L. Naftidrofuryl for intermittent claudication: meta-analysis based on individual patient data. BMJ 2009; 338: 603.
- [29] Guest JF, Davie AM, Clegg JP. Cost effectiveness of cilostazol compared with naftidrofuryl and pentoxifylline in the treatment of intermittent claudication in the UK. Curr Med Res Opin 2005; 21: 817–826.
- [30] Girolami B, Bernardi E, Prins MH, et al. Treatment of intermittent claudication with physical training, smoking cessation, pentoxifylline, or nafronyl: a meta-analysis. Arch Intern Med 1999; 159: 337–345.
- [31] Gardner AW, Poehlman ET. Exercise rehabilitation programs for the treatment of claudication pain. A meta-analysis. JAMA 1995; 274: 975–980.
- [32] Karetová D. Raynaudův fenomén a periferní ischemické syndromy. Čes Revmatol 2012; 20: 54–61.