Enterosolventní forma kyseliny acetylsalicylové – ano, či ne?
Souhrn:
V posledních letech přibývá stále více dokladů o nižší biologické dostupnosti kyseliny acetylsalicylové v enterosolventní lékové formě (ecASA). Paralelně je dokládán nižší efekt až absence účinku ecASA v profylaxi aterotrombotických příhod. Navzdory těmto datům je tato léková forma plátci zdravotní péče preferována formou pozitivních listů.
Key words: acetylsalicylic acid – salicylic acid – enterosolvent drug form – prophylaxis of atherothrombotic events.
Summary:
In the last years, evidence showing lower bioavailability of enterosolvent acetylsalicylic acid (ecASA) has accumulated. At the same time, lower to absent prophylactic antithrombotic effect of ecASA has been documented. Despite these data, ecASA is preferred by many health care payers in their positive lists.
Úvod
Problematika sekundární i primární prevence aterotrombotických příhod je, vedle intervence rizikových faktorů, řešena též protidestičkovou léčbou. Dominantní strategií je pak terapie kyselinou acetylsalicylovou (ASA), která blokádou cyklooxygenázy (především cyklooxygenázy 1 – COX 1) v trombocytu inhibuje syntézu tromboxanu A2 (TXA2). Souhrnná analýza klinických studií sledující efekt ASA dokládá pokles kardiovaskulární mortality a kardiovaskulární morbidity o 20‒25 % [1]. Podávání ASA v profylaxi aterotrombotických komplikací je jednou z nejčastěji užívaných strategií – v České republice podstupuje tuto terapii asi 8 % populace, ve vyspělých zemích se preskripce ASA pohybuje mezi 6‒10 %. Uvědomíme li si účinnost léčby a její rozšířenost, pak bychom měli mít informace o tom, zda též u nových lékových forem ‒ konkrétně u enterosolventní ASA (ecASA) ‒ platí závěry klinických studií provedených s lékovými formami ASA rozpustnými v žaludku.
Tato otázka je velice aktuální, neboť ecASA (Stacyl 100 mg) zařadily zdravotní pojišťovny na pozitivní list a počítačové programy lékové preskripce jej nabízejí jako lék doporučený. Neoznačíme li symbolem klasickou, rychle rozpustnou formu ASA (např. Godasal či Anopyrin) pokynem „nezaměňovat“, zpravidla také lékárník vydá formu enterosolventní. Problematika má celospolečenskou rovinu ‒ v rámci sekundární prevence bylo v roce 2015 léčeno ecASA více než 100 000 nemocných. Pokud by tato enterosolventní forma byla jen o polovinu méně účinná, pak by při 20% snížení relativního rizika a 10% roční incidenci příhody nebylo každoročně zabráněno více než stovce velkých kardio a cerebrovaskulárních příhod.
K pochopení důvodů zpochybňujících efekt ASA podávané v enterosolventní formě na ireverzibilní inhibici cyklooxygenázové cesty aktivace trombocytů je vhodné uvést jak farmakodynamický účinek ASA, tak i jejího metabolitu – kyseliny salicylové. Podobně jsou významné farmakokinetické vlastnosti ASA a konečně data z klinického hodnocení při užití různých lékových forem ASA.
Účinek ASA a jejího aktivního metabolitu kyseliny salicylové
Protidestičkový efekt ASA, jak jej
v současné době chápeme, je dán snížením nabídky
TXA2 na úrovni trombocytu. Tromboxan A2
má protrombotický účinek – aktivuje trombocyt a indukuje
expresi vazných glykoproteinových receptorů IIb/IIIa i účinek
vazokonstrikční. Oba efekty jsou zprostředkovány inhibicí
adenylátcyklázy a snížením nabídky cyklického
adenosinmonofosfátu (cAMP). Jednou působí v trombocytu,
podruhé v hladké svalovině cévní stěny. Poklesu aktivity
TXA2 lze dosáhnout různým způsobem ‒ snížením
syntézy (zpravidla inhibicí aktivity klíčového enzymu COX),
urychlením degradace TXA2 (např. zvýšením koncentrace
lipoproteinu HDL) či blokádou tromboxan/prostaglandinového
receptoru β (např. pikotamidem). Prakticky jedinou
užívanou strategií je inhibice syntézy TXA2.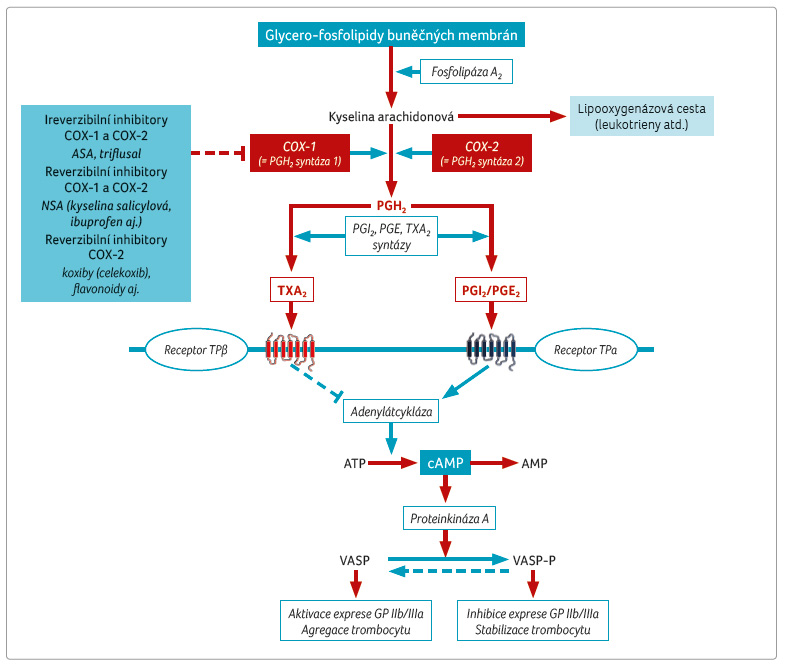
Acetylsalicylová kyselina inhibuje syntézu TXA2 v trombocytu, čímž po degranulaci trombocytu klesá jeho nabídka. Mechanismem účinku je pokles aktivity obou enzymů cyklooxygenázy (COX 1 i COX 2). Tyto izoenzymy katalyzují konverzi kyseliny arachidonové na prekurzory prostanoidů – prostaglandiny G2 a H2. V trombocytu je z těchto prekurzorů syntetizován vazokonstrikčně a trombogenně působící TXA2 a v endoteliích vazodilatačně a antitrombogenně působící prostanoidy: prostacyklin (PGI2) či prostaglandin E2 (obr. 1). Vlastní protidestičkové působení ASA je dáno inhibicí izoenzymu COX 1, zánětem indukovatelná varianta COX 2 se v trombocytu neuplatňuje.
Vlastní inhibice cyklooxygenáz je dána dvojím způsobem ‒ inhibicí aktivity obou izoenzymů, jak jejich ireverzibilní blokádou, tak snížením jejich exprese na úrovni genomu. První účinek, tj. acetylace serinu v katalytickém centru enzymu s nevratnou blokádou funkce, je zprostředkován vlastní ASA. Druhý je dán aktivním metabolitem, tj. kyselinou salicylovou. Ta inhibuje nabídku COX reverzibilně, snížením její exprese v tkáních přímým působením na genom. Protizánětlivý účinek salicylátů je dán z velké části touto reverzibilní inhibicí syntézy řady prostaglandinů, nejen TXA2. Jak ASA, tak kyselina salicylová ve výsledku sice snižují syntézu prostanoidů (prostaglandinů i TXA2), zásadním rozdílem však je, že ASA působí na syntézu TXA2 ireverzibilně a ochromí destičkové funkce po celou dobu cirkulace trombocytu. Naopak kyselina salicylová snižuje syntézu TXA2 vratně, tedy jen krátkodobě. Efekt ASA je omezen na trombocyty a na portální cirkulaci, naopak kyselina salicylová působí systémově i na ostatní tkáně.
Klasickou koncepcí účinku ASA je inhibice aktivity COX na podkladě blokády její katalytické funkce. V oblasti aktivního místa se ASA kovalentně váže na serin a acetyluje jej. Konformační změny v katalytickém centru tak zabrání oxidaci kyseliny arachidonové a vytvoření prekurzorů prostanoidů – prostaglandinů H2 a G2. Díky kovalentní vazbě je účinek ireverzibilní. Jako bezjaderná buňka si trombocyt nemůže syntetizovat nový enzym, a efekt tak přetrvává po celou dobu přežívání trombocytu v krevním oběhu (tj. 5–7 dní). K ochromení primární hemostázy je potřeba funkčně vyřadit 60‒80 % trombocytů, při denní obnově 10‒20 % destiček trvá plný účinek asi 48 hodin, zcela funkční však je hemostáza až za 4–5 dní po ukončení podávání léčiva.
Vlastní acetylace COX v trombocytu probíhá převážně v portálním oběhu, po průchodu játry je již většina ASA deacetylována na kyselinu salicylovou. Při aplikaci nízkých dávek ASA, které užíváme v rámci protidestičkového působení, je kapacita pro acetylaci COX v systémové cirkulaci nedostatečná. Z důvodu této nízké systémové dostupnosti ASA je COX v endoteliích cév systémového oběhu inhibována minimálně, a nabídka PGI2 v cévní stěně tak významně neklesá.
Druhým účinkem ASA, zprostředkovaným jejím aktivním metabolitem kyselinou salicylovou, je potlačení exprese izoenzymů COX v řadě tkání, tedy nikoliv ireverzibilní blokáda COX 1 v trombocytu. Mechanismus účinku není plně objasněn, nicméně je doloženo potlačení syntézy COX působením na úrovni genomu. Jedním z mechanismů je přímá inhibice transkripčního faktoru NF κB, který řídí přepis DNA řady „defenzivních“ genů, tedy genů účastnících se na obranyschopnosti [2]. Výsledné snížení nabídky COX na této úrovni trvá kratší dobu, je reverzibilní, není omezeno na trombocyty, ale objevuje se v celé systémové cirkulaci. Systémovým účinkem je potlačena syntéza celé řady prostanoidů, dominuje efekt antiflogistický. Při krátkém poločasu plazmatické eliminace kyseliny salicylové (při užití nízkých dávek pouze 2‒3 h) je dlouhodobé ovlivnění destičkových funkcí nepravděpodobné [3]. Do jaké míry se uplatní účinek non trombocytární na poklesu výskytu aterotrombotických příhod, není zřejmé. Díky tomu, že reverzibilní inhibice COX, navozená nesteroidními antiflogistiky, naopak riziko kardiovaskulárních příhod zvyšuje, je významný pozitivní účinek kyseliny salicylové v sekundární prevenci nepravděpodobný. Také nepřesvědčivé výsledky studií s ecASA, kdy dochází k deacetylaci ASA ještě v lumen střeva, svědčí ve prospěch klasické koncepce, tedy významu ireverzibilní inhibice COX acetylací serinu přímo v katalytickém centru.
K doložení velké plasticity obrazu je dobré uvést, že účinek ASA zdaleka není omezen na izoenzym COX, její efekt je daleko širší. Je doložena acetylace celé řady enzymů a je dokumentováno významné pleiotropní působení [4]. Podobně i kyselina salicylová působí na úrovni biologických systémů (živočišných i rostlinných) v širším rozsahu. Aktivuje celé spektrum defenzivních genů, a zvyšuje tak rezistenci na řadu nox [5]. Kyselina salicylová, lék, který v odvaru vrbové kůry užíval již Hippokrates, tak může ještě překvapit a je velkou otázkou, zda efekt v profylaxi aterotrombotických příhod je dán pouze účinkem protidestičkovým. Využití ASA (či jejího metabolitu kyseliny salicylové) v řadě dalších indikací – v onkologii (profylaxe tumorů trávicího traktu či prostaty), neurologii (léčba extrapyramidových poruch) a v celé řadě jiných oblastí – je intenzivně prověřováno.
Farmakokinetika ASA v rychle rozpustné formě a v enterosolventních tabletách
Farmakokinetika ASA je problematická ‒ jako ostatní slabé lipofilní kyseliny je absorbována v nedisociovaném stavu pasivní difuzí. Nedisociována je pouze v kyselém prostředí. Vzhledem k disociační konstantě 3,5 je vstřebávána při hodnotě pH ≤ 3,5 – tedy v žaludku a v proximálním duodenu. Biologická dostupnost je tak závislá na lékové formě a na aktuálním pH v žaludku.
V rychle rozpustné lékové formě (kdy se ASA uvolňuje v žaludku) a při fyziologickém pH (< 3,5) je ASA rychle a téměř kompletně absorbována do portálního oběhu. Nástup účinku (měřeno inhibicí funkce trombocytů) je rychlý, do 20 minut. Vzhledem k tomu, že dále je ASA z rozhodující části transformována deacetylací v játrech na kyselinu salicylovou, je maximální (účinné) koncentrace ASA dosaženo v portálním oběhu. Zde probíhá vlastní působení, tj. acetylace COX v trombocytu (obr. 2a). Systémová expozice ASA je při užívání „protidestičkových“ dávek nízká, a není tak dostatečná kapacita pro významné uplatnění acetylace izoenzymů COX v endotelu a ke snížení nabídky prostacyklinu.
Při nitrožilním podání ASA
nastupuje účinek během několika minut; poločas plazmatické
eliminace je kolem 15 minut. Díky ireverzibilní blokádě COX však
tento údaj není významný.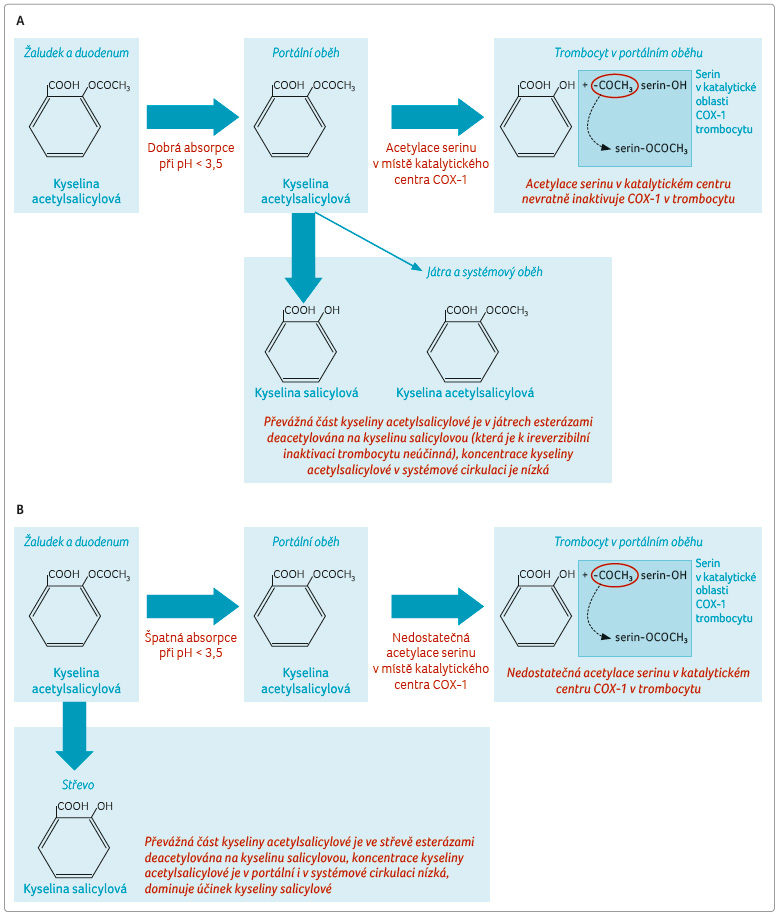
Při užití enterosolventních tablet či při vzestupu hodnoty pH v žaludku (například u osob léčených inhibitory protonové pumpy, IPP) se ASA v žaludku neabsorbuje, dostává se do střeva, kde je z velké části deacetylována esterázami (tzv. aspirinovými esterázami, zejména karboesterázou 2 ‒ CES 2) a absorbována je převážně jako kyselina salicylová (obr. 2b). Dostupnost aktivního metabolitu zodpovědného za antiflogistický účinek, tj. kyseliny salicylové, je vysoká (kolem 80 %) a není výrazně závislá na lékové formě a aciditě v žaludku. Kyselina salicylová je eliminována zejména játry, poločas plazmatické eliminace je variabilní, v nízkých dávkách (užívaných k protidestičkovému účinku) je kolem 2 hodin, v dávkách antiflogistických je kolem 10 hodin.
Shrneme li, pak je vysoce pravděpodobné, že ireverzibilní blokáda funkce trombocytů je dána účinkem vlastní ASA. Je pravděpodobné, že též kyselina salicylová může snížit nabídku COX v trombocytu, ale jen na dobu přechodnou. Není známo, zda snížení exprese COX se podílí na protidestičkovém efektu. Argumentace, že ecASA též snižuje odpad metabolitů TXA2 do moče, jen ukazuje na neznalost problematiky. Je pouze málo situací, kdy léková forma zásadním způsobem ovlivní efekt léčiva, bohužel v případě ecASA je rozdíl v účinku pravděpodobný.
Účinek ecASA či kombinace s IPP při sledování reaktivity trombocytů in vitro
Sledování reziduální reaktivity trombocytů při protidestičkové léčbě je významným ukazatelem, který nás informuje o účinnosti terapie. Vysoké procento aktivních trombocytů při léčbě (high on treatment platelet reactivity) totiž odráží zvýšené riziko vzniku aterotrombotických příhod, a může proto sloužit jako validní ukazatel při absenci „tvrdých“ dat, tj. mortality a morbidity. Systematická analýza dat ze 102 studií s více než 44 000 nemocných léčených ASA, kde byly destičkové funkce sledovány různými metodami (VerifyNow, Multiplate analyser aj.), doložila, že vyšší reaktivita trombocytů při léčbě ASA s sebou nese více než dvojnásobné kardiovaskulární riziko (HR [hazard ratio, poměr rizik] = 2,09; 95% CI [confidence interval, interval spolehlivosti] 1,77‒2,47). Vyšší reaktivita byla zaznamenána u pětiny nemocných [6]. Vyšší výskyt špatně odpovídajících nemocných byl spojen zejména se zhoršenou dostupností ASA (podávání enterosolventních tablet či při současné léčbě IPP), s vyšším obratem trombocytů (při diabetu, u akutních vaskulárních příhod či při obezitě) nebo s léčbou nesteroidními antirevmatiky, která kompetují s ASA na úrovni COX. Řada přehledů věnovaných variabilitě účinku ASA se shoduje ve zjištění, že na předním místě se při selhání léčby (měřeno vysokou reaktivitou destiček) objevuje léčba ecASA či komedikace IPP [7‒9]. Data z metaanalýz se překvapivě shodují, jen procento pacientů odpovídajících na terapii nedostatečně kolísá podle užité laboratorní techniky a podle sledované populace.
Poslední, zcela recentní analýza porovnávající účinek dvou rychle rozpustných forem ASA s ecASA v dávce 325 mg denně byla provedena u diabetiků [10]. Také v této práci autoři doložili nižší účinek enterosolventní formy. Nedostatečný útlum tvorby TXA2 (měřený koncentrací stabilního degradačního produktu TXB2) byl zaznamenán u dvou různých rychle se uvolňujících lékových forem v 15,8 % a v 8,1 %, zato u ecASA (navíc ve vyšší dávce, než je užívána v Evropě) byl výskyt vysoké reaktivity při léčbě 52,3 %, tedy trojnásobně až šestinásobně vyšší. Autoři i zde uzavírají, že „snížená dostupnost ecASA vede k aspirinové rezistenci“.
Účinek ecASA či kombinace s IPP v profylaxi aterotrombotických příhod
Téměř veškeré doklady o snížení kardiovaskulární mortality a morbidity (pokles výskytu velkých vaskulárních příhod) v sekundární i v primární prevenci byly pořízeny s ASA podávanou v rychle působících tabletách. Analýza ATC doložila pokles výskytu kardiovaskulárních příhod při léčbě jak u akutních, tak i u chronických stavů, jak u postižení koronárního, tak i mozkového či periferního řečiště při léčbě ASA. Doložena je účinnost – pokles výskytu příhod o 20‒25 % v rozmezí dávek 80‒375 mg denně při užití rychle rozpustných lékových forem [1]. Pouze několik klinických hodnocení proběhlo s enterosolventní lékovou formou, zde však byly výsledky odlišné.
První byla studie ISIS 2 (Second
International Study of Infarct Survival) u nemocných v akutní
a v subakutní fázi infarktu myokardu [11]. Tato studie,
která v jedné větvi sledovala efekt 163 mg ecASA
u akutního infarktu myokardu po dobu jednoho měsíce,
doložila 23% pokles vaskulární mortality. Když se však podíváme
do metodiky studie, zjistíme, že enterosolventní tablety byly
při prvním podání rozmělněny, žvýkány a rozkousány,
tedy jejich léková forma byla zásadním způsobem narušena.
V kritickém období akutní fáze tudíž byly vytvořeny
podmínky, které umožnily absorpci a působení ASA. Z tohoto
důvodu uvedené hodnocení o efektu ecASA mnoho nevypovídá,
navíc je lze jen obtížně vydávat za ty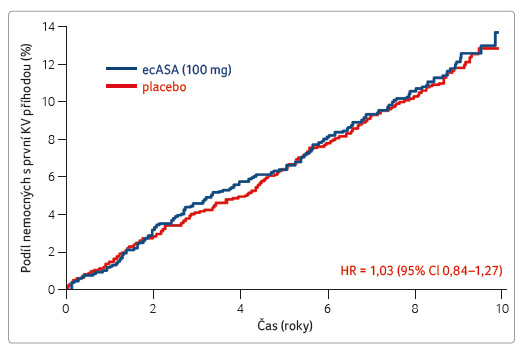 pickou sekundárně
preventivní studii.
pickou sekundárně
preventivní studii.
Druhou sekundárně preventivní studií je AAA (Aspirin for Asymptomatic Atheroscelosis) s více než 3 000 nemocnými s asymptomatickou aterosklerózou doloženou sníženým kotníkovým indexem (ankle brachial index, ABI) ≤ 0,95 [12]. Také tato studie trvající více než osm let nedoložila účinek ecASA podávané v dávce 100 mg denně (graf 1). Nedošlo k poklesu výskytu velkých vaskulárních příhod (fatální či nefatální infarkt myokardu či iktus), relativní riziko proti placebu se nezměnilo (RR [risk ratio] = 1,03; CI 0,84‒1,27). Podobně nebyl ovlivněn ani výskyt jakékoliv cévní příhody (RR = 1,00; CI 0,85‒1,17).
Třetí velká studie (JPPP, Japanese Primary Prevention Project) s ecASA v porovnání s placebem proběhla v Japonsku [13]. Efekt 100 mg ecASA byl prověřován u téměř 15 000 seniorů sledovaných v rámci dvojitě zaslepené studie více než pět let. Toto klinické hodnocení mělo charakter primárně preventivní, zařazeni byli probandi s vícečetnými rizikovými faktory aterogeneze. Primárním ukazatelem účinku byl výskyt fatální či nefatální cévní příhody (infarktu myokardu, iktu ischemického či hemoragického nebo jiné závažné cévní příhody). Pro absenci rozdílu mezi větvemi ‒ 56 fatálních příhod v obou režimech, resp. 114 všech příhod při léčbě ecASA a 108 při podávání placeba (HR = 0,94; 95% CI 0,77‒1,15) ‒ byla studie etickou komisí předčasně ukončena (graf 2).
V uvedeném přehledu bohužel
chybí studie v dominantní indikaci, tj. v sekundární
prevenci u pacientů po infarktu myokardu či po ischemické
mozkové příhodě. Uvedená studie AAA, v níž byla podávána
ecASA u asymptomatických osob s hraničně sníženým
kotníkovým indexem ABI ≤ 0,95 (tedy s indexem
ještě nikoliv patologickým), nereprezentuje typickou cílovou
indikaci pro protidestičkovou léčbu.![GRAF 2 výskyt primárního cílového ukazatele účinku (tj. fatálních i nefatálních velkých vaskulárních příhod – infarktu myokardu či iktu) v primárně preventivní studii Jppp provedené u seniorů; podle [13 ] – ikeda, et al., 2014. není rozdíl v incidenci velkých příhod mezi větví léčenou ecasa a placebem. Ci – interval spolehlivosti, confi dence interval; ecasa – enterosolventní léková forma kyseliny acetylsalicylové; hr – poměr rizik, hazard ratio; kv – kardiovaskulární](https://www.remedia.cz/photo-a-31115---.jpg)
V současné době není v registrech klinických studií uvedeno žádné sekundárně preventivní hodnocení s ecASA. Jedinou velkou studií je ASPREE – ASPirin in Reducing Events in the Elderly Study [14]. Bohužel i toto sledování u téměř 20 000 zdravých seniorů léčených 100 mg ecASA není cíleno na klíčovou populaci. Ačkoliv studie byla zahájena před více než deseti lety, nejsou k dispozici žádné výsledky.
Analogická situace jako u ecASA je u kombinace ASA s IPP. I v tomto případě se ASA v nedostatečně kyselém prostředí špatně absorbuje a protidestičkový účinek je snížen či selhává. První prací, která vzbudila pochybnosti o vhodnosti komedikace IPP k léčbě ASA, byla analýza Dánského národního registru nemocných po infarktu myokardu [15]. Do retrospektivní analýzy mortality a morbidity bylo zařazeno téměř 20 000 pacientů po prvním infarktu myokardu, kteří nebyli léčeni duální protidestičkovou léčbou, ale pouze ASA v dávce 75 mg. Ve skupině pacientů léčených ASA v kombinaci s IPP se objevilo 987 (22,9 %) příhod typu MACE (úmrtí z kardiovaskulárních příčin, infarkt myokardu či iktus), ve skupině neléčené IPP se těchto komplikací objevilo 2 378 (15,2 %). Při analýze rizika pomocí Coxova modelu byl doložen vzestup kardiovaskulárního rizika o 46 % (HR = 1,46, 95% CI 1,33‒1,61, p < 0,001), absolutní riziko vzrostlo o významně o 7,7 %. Vzhledem k tomu, že příhod bylo téměř 3 500, je analýza dostatečně robustní. Nemocní, kteří byli léčeni inhibitory H2 receptorů (kdy pH v žaludku nestoupá nad hodnotu 3,5), neměli prognózu ovlivněnu.
Na základě této analýzy byl proveden rozbor dopadu podávání IPP ve čtyřech megastudiích s ASA, s klopidogrelem a s kombinační léčbou [1]. Analýza dat u 27 000 pacientů ve větvích léčených pouze ASA bez kombinace s jiným protidestičkovým léčivem doložila, že kombinace s IPP měla negativní dopad na prognózu. Výskyt velkých vaskulárních příhod (MACE) byl významně ‒ o 16 % ‒ vyšší (HR = 1,16; 95% CI 0,98‒1,38). Předností analýzy byla adjustace výsledků na nerovnoměrný výskyt rizikových faktorů v obou skupinách (IPP‒/IPP+). Nevýhodou obou sledování byl jejich retrospektivní charakter, prospektivní randomizovaná studie pro kombinaci ASA s IPP chybí. Nicméně oba výsledky studií s IPP podporují představu, že v prostředí s hodnotou pH vyšší než 3,5 se ASA vstřebává nedostatečně a její efekt na výskyt aterotrombotických příhod je omezen. Nález je tak v souladu se studiemi provedenými s ecASA.
Závěr
Uvedený přehled má za cíl upozornit na skutečnost, že ecASA podávaná v indikaci protidestičkové léčby, tedy v sekundární i v primární prevenci aterotrombotických příhod, nemá validní data o účinku. Nesplňuje nároky kladené na léčbu v rámci medicíny založené na důkazech. Dostupná klinická hodnocení, stejně jako laboratorní testování, dokonce svědčí proti validnímu efektu. Příčinou nižší účinnosti je pravděpodobně nižší biologická dostupnost této lékové formy, kdy se absorbuje již kyselina salicylová. V indikaci protizánětlivé a analgetické je enterosolventní forma účinná, v této indikaci však je mechanismus účinku založen nikoliv na acetylaci katalytického místa cyklooxygenázy v trombocytu vlastní ASA, ale na aktivaci transkripčních faktorů řídících defenzivní odpověď na patogeny ‒ tedy na farmakodynamickém efektu kyseliny salicylové. Přehled se nezabývá odpovědí, zda je esASA bezpečnější, zda je léčba zatížena menším výskytem krvácení. Některé práce nižší výskyt dokládají, jiné nikoliv. Tato „přednost“ však může odrážet jen to, že protidestičkový účinek je významně redukován. Mechanismus krvácení není dán kontaktem tablet ASA se sliznicí žaludku (jaký byl názor před desítkami let, kdy byly enterosolventní tablety vyvinuty), ale předpokládá se snížená obranyschopnost sliznice při potlačení syntézy vazodilatačně a protektivně působících prostaglandinů řady I a E.
Na klíčovou otázku, zda je racionální preferovat v profylaxi aterotrombotických příhod ecASA, si musí na základě předložených dat každý odpovědět sám. Především by se však k této problematice měli jasně postavit regulační orgány a plátci péče a zvážit případnou změnu pozitivních listů, které preferují užívání Stacylu 100 mg či jiné enterosolventní lékové formy ASA. Otázka používání těchto forem, stejně jako kombinace ASA s IPP, bude definitivně zodpovězena až prospektivními kontrolovanými studiemi. Současně je však nutno zpochybnit validitu studií s protidestičkovou léčbou, v jejichž kontrolních větvích byla užita ecASA či ASA v kombinaci s IPP. To však je jiná kapitola.
Podpořeno Kardiovaskulárním výzkumným programem Univerzity Karlovy – Progres Q38.
Seznam použité literatury
- [1] Antithrombotic Trialists’ Collaboration. Collaborative meta‑analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ 2002; 324: 71–86.
- [2] Kopp E, Ghosh S. Inhibition of NF‑kappa B by sodium salicylate and aspirin. Nature 1998; 396: 77–80.
- [3] Levy G. Pharmacokinetics of salicylate elimination in man. J Pharmacol Sci 1965; 54: 959–967.
- [4] Gilroy DW. New insights into the anti‑inflammatory actions of aspirin‑induction of nitric oxide through the generation of epi‑lipoxins. Mem Inst Oswaldo Cruz 2005; 100(Suppl 1): 49–54.
- [5] Blanco F, Salinas P, Cecchini NM, et al. Early genomic responses to salicylic acid in Arabidopsis. Plant Mol Biol 2009; 70: 79–102.
- [6] Wisman PP, Roest M, Asselbergs FW, et al. Platelet‑reactivity tests identify patients at risk of secondary cardiovascular events: a systematic review and meta‑analysis. J Thromb Haemost 2014; 12: 736–747.
- [7] Rocca B, Petrucci G. Variability in the responsiveness to low‑dose aspirin: pharmacological and disease‑related mechanisms. Thrombosis 2012; 376: 721.
- [8] Würtz M, Grove EL. Proton pump inhibitors in cardiovascular disease: drug interactions with antiplatelet drugs. Adv Exp Med Biol 2017; 906: 325–350.
- [9] Würtz M. Aspirin in coronary artery disease: an appraisal of functions and limitations. Dan Med J 2015; 62: B5011.
- [10] Bhatt DL, Grosser T, Dong JF, et al. Enteric coating and aspirin nonresponsiveness in patients with type 2 diabetes mellitus. J Am Coll Cardiol 2017; 69: 603–612.
- [11] ISIS‑2 (Second International Study of Infarct Survival) Collaborative Group: Randomized trial of intravenous streptokinase, oral aspirin, both, or neither among 17,187 cases of suspected acute myocardial infarction: ISIS‑2. J Am Coll Cardiol 1988; 12(6Suppl A): 3A–13A.
- [12] Fowkes FG, Price JF, Stewart MC et al. Aspirin for Asymptomatic Atherosclerosis Trialists. Aspirin for prevention of cardiovascular events in a general population screened for a low ankle brachial index: a randomized controlled trial. J Am Med Assoc 2010; 303: 841–848.
- [13] Ikeda Y, Shimada K, Teramoto T, et al. Low‑dose aspirin for primary prevention of cardiovascular events in Japanese patients 60 years or older with atherosclerotic risk factors: a randomized clinical trial. JAMA 2014; 312: 2510–2520.
- [14] McNeil JJ, Woods RL, Nelson MR, et al. Baseline Characteristics of Participants in the ASPREE (ASPirin in Reducing Events in the Elderly) Study. J Gerontol A Biol Sci Med Sci 2017: 1–8. doi: 10.1093/gerona/glw342
- [15] Charlot M, Grove EL, Hansen PR, et al. Proton pump inhibitor use and risk of adverse cardiovascular events in aspirin treated patients with first time myocardial infarction: nationwide propensity score matched study. BMJ 2011; 342: d2690.
- [16] Dunn SP, Steinhubl SR, Bauer D, et al. Impact of Proton Pump Inhibitor Therapy on the Efficacy of Clopidogrel in the CAPRIE and CREDO Trials. J Am Heart Assoc 2013; 2: e004564. doi:10.1161/JAHA.112.004564