Imunosupresivní terapie v transplantologii
Souhrn:
Úspěch transplantací orgánů závisí do značné míry na podávaném imunosupresivním režimu. Všem nemocným je dnes doporučeno podávat indukční imunosupresi s monoklonálními protilátkami proti receptoru pro interleukin 2 nebo s polyklonálními králičími antithymocytárními globuliny. Jako udržovací léčbu většina nemocných dlouhodobě užívá takrolimus v kombinaci s přípravky mykofenolové kyseliny a s malou dávkou kortikosteroidů. Belatacept jako biologický přípravek pro udržovací léčbu se doposud užívá výjimečně. V případě rejekcí je léčba založena buď na odstraňování protilátek, nebo na účinné depleci lymfocytů rituximabem nebo polyklonálními protilátkami. Nové trendy v imunosupresi budou zaměřeny na blokádu komplementové kaskády a blokádu interleukinu 6 s cílem omezit vznik chronické rejekce.
Key words: transplants, immunosuppression, rATG, basiliximab, rituximab, IVIG.
Summary:
The success of organ transplants depends, to a great extent, on the immunosuppressive regimen used. According to the current recommendations, all patients should undergo initial immunosuppression with monoclonal antibodies against the interleukin‑2 receptor or with polyclonal rabbit antithymocyte globulins. The maintenance therapy usually consists of tacrolimus combined with mycophenolic acid derivatives and low‑dose corticosteroids. Maintenance biological therapy with belatacept has been used only exceptionally until now. In cases of rejection, the treatment is based either on the removal of antibodies or on effective lymphocyte depletion achieved with rituximab or polyclonal antibodies. New trends in immunosuppression are associated with the blockage of the complement cascade and of interleukine‑6 and are supposed to prevent the development of chronic rejection.
Úvod
Úspěšná transplantace závisí především na dvou faktorech – na chirurgickém zákroku a na potlačení rejekce štěpu imunosupresivní léčbou. Imunosuprese používaná v současnosti je spojena s výborným jednoročním přežíváním štěpů (například 95‒97 % v případě primárních transplantací ledvin) i s přežíváním nemocných, v delším odstupu od transplantace se přežití štěpů pochopitelně zkracuje. Například střední doba přežití transplantované ledviny od kadaverózního dárce je 13 let. Jednotlivé imunosupresivní režimy se mezi orgánovými transplantacemi jenom nepatrně liší a většina zásadních informací pochází ze studií u transplantací ledvin.
Indukční imunosuprese
Jako indukční léčba je označována velmi intenzivní imunosuprese v časném období po transplantaci. Jejím cílem je zabránit rejekci štěpu v období, kdy je imunitní odpověď na aloantigen nejintenzivnější. Vždy se při samotné transplantaci aplikuje metylprednisolon (500 mg) před reperfuzí a většina center aplikuje stejnou nebo nižší dávku i první pooperační den. V principu jsou k dispozici dvě možnosti indukční imunosuprese, polyklonální a monoklonální protilátky [1].
Králičí polyklonální protilátky proti T lymfocytům (antithymocytární globuliny, rabbit anti thymocyte globulin, rATG) působí depleci T lymfocytů v periferní krvi i ve štěpu. Tento režim je vyhrazen pro nemocné ve vysokém imunologickém riziku (předchozí transplantace, vysoká frekvence anti HLA protilátek). Mechanismus účinku rATG spočívá především v depleci T lymfocytů. Podané protilátky se vážou na velké množství povrchových znaků lymfocytů, po opsonizaci jsou lymfocyty lyzovány buď klasicky komplementem, nebo prostřednictvím Fc receptoru buňkami retikuloendotelového systému. V současnosti je známo, že rATG zvyšuje tvorbu regulačních T lymfocytů (Treg) charakterizovaných jako CD4+CD25+FoxP3+. Tyto buňky jsou schopny potlačit funkci efektorových T lymfocytů odpovědných za rejekci.
Současné režimy používají rATG po 3‒7 dní pro profylaxi rejekce [2] anebo pro léčbu rejekcí rezistentních na kortikosteroidy či vaskulárních rejekcí. Nedostatečná specificita a velká účinnost způsobující až týdny trvající thymocytární depleci v periferní krvi zvyšuje riziko vzniku oportunních infekcí a malignit v delším odstupu od léčby. První dávka je spojena se vznikem syndromu z uvolnění cytokinů (tumor nekrotizujícího faktoru alfa [TNFα], interferonu gama [IFNγ]) projevujícího se horečkou, zimnicí a třesavkou. V průběhu terapie se často vyskytuje trombocytopenie a leukopenie následkem zkřížené reakce těchto protilátek s xenospecifickými znaky na povrchu destiček a bílých krvinek. V současné době jsou k dispozici králičí přípravky Thymoglobulin a Grafalone. Jejich dávkování je 1,0‒1,5 mg/kg/den u Thymoglobulinu, respektive 3–5 mg/kg/den v případě Grafalone. Oba přípravky se liší svým výrobním postupem, a proto je různé i jejich dávkování.
V USA je rATG používán až u 60 % všech transplantací ledvin, a to z důvodů dalšího snížení výskytu akutních rejekcí, plánovaného ukončení podávání kortikosteroidů anebo minimalizace léčby inhibitory kalcineurinu. V ČR se rATG používá u nemocných se zjevným rizikem vzniku rejekce, což představují opakované transplantace, senzitizace (přítomnost anti HLA protilátek) a použití ledvin od starších dárců.
Indukce s basiliximabem,
monoklonální protilátkou proti znaku CD25 ‒ receptoru pro
interleukin 2 (IL 2R) – se používá jako posílení
udržovací imunosuprese u nemocných v nízkém
imunologickém riziku. Basiliximab je rekombinantní chimérická
IgG1 monoklonální protilátka mířená proti
α peptidovému řetězci IL 2R na povrchu
aktivovaných T lymfocytů. Tento antigen je znám také jako
CD25 a je vysoce exprimován na povrchu aloantigenem
aktivovaných T lymfocytů. Basiliximab selektivně potlačuje
funkci těch CD3+ a CD4+ lymfocytů, které exprimují
receptor IL 2Rα. Tím, že basiliximab vysoce selektivně váže
právě tento receptor a znemožňuje jeho obsazení IL 2,
zabrání proliferaci T lymfocytů. Tento krok je přitom
zásadní při buněčné aloantigenní odpovědi. Kromě lymfocytů
basiliximab váže receptory také na monocytech a makrofázích.
Basiliximab má nízkou imunogenicitu, a to znamená, že proti
němu obtížně vznikají protilátky. Poznatky z metaanalýz
hovoří o tom, že přidání basiliximabu do imunosupresivního
režimu sníží výskyt akutních rejekcí do 6. měsíce
po transplantaci, ale dlouhodobé výsledky (> 12 měsíců
po transplantaci) zůstávají podobné [3]. V prospektivní
mezinárodní studii u nemocných v riziku rejekce byl
výskyt akutní rejekce a rejekce rezistentní k léčbě
kortikosteroidy vyšší ve skupině s basiliximabem oproti
rATG [4]. Je zajímavé, že nebyl pozorován žádný rozdíl
v opožděném rozvoji funkce štěpu a také nebyl žádný
rozdíl v přežití štěpů u pacientů léčených
basiliximabem a rATG (tab. 1).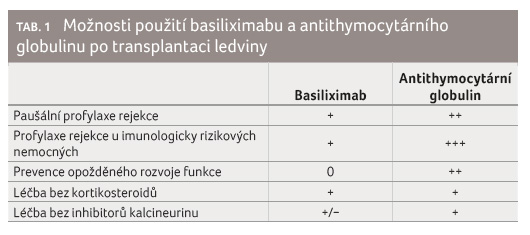
V klinických studiích a v některých amerických centrech se do roku 2012 používala monoklonální protilátka anti CD52 (Campath 1H, alemtuzumab). Alemtuzumab je humanizovaná IgG1 monoklonální protilátka proti znaku CD52, glykoproteinu, který exprimují cirkulující mononukleární buňky včetně T i B lymfocytů a NK (tzv. natural killers) buněk. Tato monoklonální protilátka má silné depleční účinky na cirkulující lymfocyty. V současné době se alemtuzumab používá nejčastěji v USA i v Evropě jako indukční imunosupresivum po transplantaci ledviny u nemocných, u nichž není možné podat rATG, v okrajových indikacích jej lze použít k léčbě rejekce refrakterní k antithymocytárnímu globulinu. Je třeba poznamenat, že alemtuzumab nemá oficiální indikace mimo hematoonkologii a recentně je jeho dostupnost v Evropě velmi omezená, v ČR je možno jej podat v rámci specifického léčebného programu.
Monoklonální protilátka proti B lymfocytům (anti CD20, rituximab) se v současnosti uplatňuje v režimech potlačujících humorální rejekci (při plánované transplantaci ledviny od žijícího dárce s inkompatibilní krevní skupinou nebo při přítomnosti anti HLA protilátek před transplantací, které jinak transplantaci od žijícího nebo zemřelého dárce vylučují) [5]. Rituximab se v transplantačních indikacích podává v jedné nebo dvou dávkách po 375 mg/m2. Je třeba poznamenat, že tento přípravek není registrován pro transplantační léčbu a používá se v centrech zaměřených na léčbu rizikových pacientů.
Udržovací imunosuprese
Cílem udržovací imunosuprese je profylaxe akutní rejekce. Jednotlivá imunosupresiva se kombinují, nejčastěji v trojkombinaci. Vždy jsou alespoň zpočátku přítomny inhibitory kalcineurinu (recentně výhradně takrolimus, v minulosti cyklosporin A), které jsou oprávněně považovány za základní stavební kámen imunosuprese po orgánových transplantacích. Tato léčiva se většinou kombinují s přídatným imunosupresivem (nejčastěji mykofenolát mofetil nebo entericky potažený mykofenolát sodný) a s kortikosteroidy [6]. Imunosupresiva se kombinují proto, aby byly zasaženy různé úrovně imunitní odpovědi a aby se jednotlivé léky mohly podávat v takových nízkých dávkách, které nezpůsobí nežádoucí účinky. Dávky imunosupresiv se postupně snižují a v případě nežádoucích účinků (nejčastěji při myelotoxicitě nebo opakovaných infekcích) se trojkombinace mění na dvojkombinaci, nebo dokonce na monoterapii. Přídatná imunosupresiva je možno měnit podle výskytu nežádoucích účinků, stejně tak lze podle nežádoucích účinků zaměnit jeden kalcineurinový inhibitor za druhý.
Takrolimus a cyklosporin A představují základní stavební kameny imunosuprese po orgánových transplantacích. Jejich účinek spočívá především v inhibici syntézy IL 2 mechanismem obsahujícím blokádu kalcineurinu. Bylo prokázáno, že na molekulární úrovni je takrolimus 20‒30násobně účinnější, a proto se podává v daleko menší dávce než cyklosporin A. Biologickou dostupnost takrolimu a cyklosporinu A ovlivňují zejména enzymatický systém cytochromu P450 a membránového transportéru glykoproteinu P v játrech a ve střevě. Oba léky se váží na buňky a komponenty plazmy (cyklosporin na lipoproteiny a takrolimus na albumin), takže pro měření jejich koncentrací se musí použít plná krev. Takrolimus a cyklosporin A se vyznačují úzkým terapeutickým oknem a významnými interindividuálními rozdíly v biologické dostupnosti. Takrolimus se podává ihned po nástupu peristaltiky, úvodní dávky jsou 0,2 mg/kg v jedné dávce (Advagraf [7]) nebo ve dvou dávkách (Prograf, Tacni a další generika) s tím, že úvodní údolní hodnoty takrolimu odebrané před podáním ranní dávky jsou doporučovány mezi 10‒15 ng/ml. V delším časovém úseku po transplantaci mají být údolní hodnoty nižší – 5‒7 ng/ml. Recentně byla uvedena na trh nová formulace takrolimu, LCP tacro (Envarsus), která se podává jednou denně a má lepší biologickou dostupnost a stejné výsledky jako u původních formulací takrolimu. Podává se v dávkách přibližně o 30 % nižších k dosažení stejné plazmatické koncentrace takrolimu [8]. Ukazuje se, že nemocní, kteří vyžadují vysoké dávkování takrolimu (pro svou genetickou výbavu, index koncentrace/dávka je u nich < 1), mohou mít prospěch právě z léčby tímto přípravkem.
Zásadně se oba přípravky liší ve skladbě svých nežádoucích účinků. Dlouhou dobu je známo, že léčba takrolimem je spojena s významně vyšším rizikem nově vzniklého diabetes mellitus po transplantaci ledviny. Na druhou stranu je léčba cyklosporinem A spojena s vyšším výskytem hyperlipidemií a hypertenze, rovněž častěji bývá při léčbě cyklosporinem A popisován výskyt hyperurikemie. Léčba takrolimem je spojena s vyšším výskytem tremoru jako projevu na dávce závislé neurotoxicity, léčba cyklosporinem A je zase provázena vznikem kosmetických abnormalit – gingivální hyperplazie, hirsutismu a faciálního dimorfismu. Vyskytnou li se tyto komplikace, je možno změnit léčbu cyklosporinem A za takrolimus, v případě nově vzniklého diabetu je možno zase takrolimus zaměnit za cyklosporin A, to samé platí pro BK virovou (polyomavirovou) nefropatii ve štěpu. V recentní praxi ovšem k těmto změnám příliš často nedochází, především proto, že je cyklosporin A považován za slabší imunosupresivum, a proto se používá minimálně. Oba léky mohou při vyšším dávkování způsobit trombotickou mikroangiopatii ve štěpu. Inhibitory kalcineurinu také působí nefrotoxicky. Funkční nefrotoxicita má vztah k jejich dávce, může být vratná, když se podávání léku zastaví, a je spojena s poškozením renální hemodynamiky a glomerulární filtrace. V nedávné minulosti byla nefrotoxicita přeceňována a nemocní byli zbytečně poddávkováni. Léčba bez inhibitorů kalcineurinu je vždy spojena s vyšším výskytem rejekcí a s horšími dlouhodobými výsledky.
Velká metaanalýza 30 provedených studií porovnala oba inhibitory kalcineurinu, takrolimus a cyklosporin A. Léčba takrolimem byla spojena se snížením rizika selhání štěpu v 6. měsíci a ve 3. roce po transplantaci téměř na polovinu, podobně bylo pozorováno snížení rizika akutní rejekce během prvního roku po transplantaci. Na druhou stranu byl doložen téměř dvojnásobný výskyt potransplantačního diabetu. Léčba 100 pacientů takrolimem místo cyklosporinem A tak zabrání vzniku akutní rejekce u 12 nemocných a dvěma ztrátám štěpů, na druhou stranu pět nemocných bude léčeno pro potransplantační diabetes [9].
Mykofenolát mofetil (MMF) se rychle stal standardním imunosupresivním lékem, který ve svých indikacích nahradil azathioprin. Řada studií totiž prokázala, že jeho zavedení bylo oproti azathioprinu spojeno se signifikantním snížením výskytu akutní rejekce a s prodloužením přežití transplantovaných ledvin. MMF je ester mykofenolové kyseliny, antimetabolitu produkovaného během fermentace různých druhů Penicillium. Mechanismus účinku mykofenolové kyseliny spočívá v inhibici enzymu IMPDH (inosin monofosfát dehydrogenázy), který je nezbytný k de novo syntéze purinů během buněčného dělení. Mykofenolová kyselina přednostně působí na proliferující lymfocyty, protože na rozdíl od většiny jiných buněk jsou lymfocyty plně závislé na de novo cestě syntézy purinů. Vedle zabránění proliferaci T a B lymfocytů mykofenolová kyselina také inhibuje tvorbu protilátek. MMF má vyšší biologickou dostupnost než mykofenolová kyselina a je in vivo deesterifikován za vzniku aktivní substance – mykofenolové kyseliny.
Obvyklé dávkování je od 250 mg do 1,5 g dvakrát denně podle míry rizika rejekce a tolerance léčby pacientem. V případě pochybností o účinnosti nebo toxicitě MMF je možno se zorientovat o expozici mykofenolové kyselině změřením plochy pod křivkou plazmatické koncentrace. Za normální je možno považovat 30‒60 ng/ml. V případě léčby cyklosporinem A by dávky MMF měly zůstat 2× 1 000 mg, protože je známo, že cyklosporin snižuje koncentrace mykofenolové kyseliny. V případě léčby takrolimem je možno po 6–8 týdnech začít snižovat až na 2× 500 mg, protože podobná interakce popsána nebyla. Entericky potažený mykofenolát sodný představuje alternativu k MMF. Mykofenolát mofetil je k dispozici jako originální přípravek (Cellcept), ale na trhu je již i řada generik (Myfenax, Myclausen a další). Mykofenolát sodný je prodejný jako přípravek Myfortic, generika teprve na trh přicházejí.
Hlavní nežádoucí účinky léčby MMF představují gastrointestinální komplikace, nejčastějšími jsou průjmy, nauzea, zvracení, ulcerace v ústech a ulcerace v tlustém střevě. Leukopenie a anémie se vyskytují poměrně často. MMF nemůže být podáván těhotným pacientkám pro svou prokázanou teratogenitu.
Kortikosteroidy představují základní léky pro udržovací i antirejekční imunosupresi. Prednison, prednisolon a metylprednisolon se rychle vstřebávají a mají krátký poločas v plazmě, avšak dlouhý biologický poločas. Účinek kortikosteroidů spočívá v kombinaci protizánětlivých a imunosupresivních účinků. Imunosupresivní účinek kortikosteroidů je komplexní a zahrnuje potlačení produkce cytokinů, adhezních molekul ovlivňujících apoptózu a aktivaci zánětlivých buněk. Kortikosteroidy se podávají jako indukční léky v perioperačním období (metylprednisolon v dávkách 250–1 000 mg). Poté se podávají v sestupných dávkách (z obvyklých 20–30 mg/den na 2,5‒5 mg/den). Řada transplantačních center odstraňuje kortikosteroidy z imunosupresivního režimu s cílem omezit jejich nežádoucí účinky. Hlavní indikací pro režim bez kortikosteroidů jsou transplantace u dětí, u dospělých nemocných s chronickou hepatitidou C nebo s výraznou obezitou. Na druhou stranu, někteří nemocní reagují na pozdní ukončení podávání kortikosteroidů rejekcí. Bohužel však neumíme odlišit, kdo z pacientů bude v tomto případě reagovat rejekcí štěpu. Proto by podávání kortikosteroidů nemělo být přerušováno u nemocných po opakovaných transplantacích, s anamnézou glomerulonefritidy, ve vysokém imunologickém riziku anebo při anamnéze akutní rejekce. Dnes jednoznačně víme, že léčba na úvod zcela bez kortikosteroidů je spojena s vyšším výskytem rejekce [10], tudíž zbývá vyřešit zdánlivě jednoduchou otázku: u koho a kdy je možno užívání kortikosteroidů bezpečně ukončit.
Sirolimus a everolimus (derivát sirolimu) jsou makrolidová imunosupresiva a vzhledem k mechanismu svého účinku jsou označovány jako mTOR (mammalian target of rapamycin) inhibitory. Jsou to antiproliferačně působící látky. Četné nežádoucí účinky a slabá imunosupresivní schopnost mTOR inhibitorů omezily jejich rozšíření. Přesto se ukazuje, že mají v imunosupresivních režimech své místo, zvláště v léčbě nemocných s anamnézou malignity (především renálního karcinomu) jako alternativa takrolimu nebo cyklosporinu A. Everolimus se podává dvakrát denně, v případě sirolimu postačí jedna denní dávka. Celková denní dávka a údolní hodnoty jsou v obou případech stejné. Léčba je zahajována dávkou 3‒4 mg/den. První údolní hodnoty má smysl měřit po 5‒7 dnech, kdy je dosaženo ustáleného stavu. Cílové hodnoty mTOR inhibitoru sirolimu by měly být udržovány mezi 4‒8 ng/ml. Recentně byly publikovány výsledky velké studie porovnávající kombinační léčbu kalcineurinovými inhibitory s everolimem oproti MMF. Výsledky v prvním roce svědčí pro podobnou funkci transplantované ledviny, ale pro odlišný výskyt nežádoucích účinků [11].
Belatacept (Nulojix) je jediným přípravkem, který se v posledních letech dostal od klinického hodnocení až ke klinické praxi. Bohužel na trhu v ČR zatím není běžně dostupný. Jedná se o fúzní protein CTLA 4, který blokuje kostimulační signál v aktivaci T lymfocytů. Belatacept je alternativou k inhibitorům kalcineurinu a je určen pro dlouhodobou imunosupresivní léčbu. Výsledky studie [12] ukázaly na poněkud vyšší výskyt akutních rejekcí, ale na lepší renální funkci během sledování, navíc léčení nemocní měli nižší krevní tlak a hyperlipidemii. Jeho výhodou je parenterální aplikace v měsíčních intervalech, což znamená i 100% compliance s léčbou. Na druhou stranu však více zatěžuje poskytovatele zdravotní péče. Jako přídatnou terapii nemocní užívají MMF a kortikosteroidy. O tom, že jde o potentní imunosupresivum, svědčí i to, že byl pozorován častější výskyt závažných potransplantačních lymfoproliferací u nemocných, kteří byli před transplantací EBV (virus Epsteina‒Barrové) séronegativní. V poslední době se zdá, že si belatacept nachází místo v léčbě nemocných, kteří netolerují takrolimus nebo cyklosporin A.
Antirejekční terapie
Antirejekční terapie by se vzhledem ke svým nežádoucím účinkům měla vždy užívat se znalostí histologického nálezu, který je rozhodující pro zvolení optimální léčby [1]. V případě biopticky ověřené akutní celulární rejekce se používají opakované pulzy metylprednisolonu, v případě rezistence rejekce ke kortikosteroidům se používají rATG. Vaskulární rejekce jsou rovněž většinou léčeny rATG. Akutní humorální rejekce se léčí kombinací plazmaferéz a intravenózních globulinů (IVIG), alternativně je možno použít imunoadsorpce. Intravenózní imunoglobuliny (Kiovig, Gammagard a další) velmi efektivně blokují humorální imunitní odpověď po transplantaci. Používají se spolu s aferetickými metodami buď u nemocných před transplantací při pozitivitě dárcovsky specifických anti HLA protilátek (desenzitizační terapie), anebo po transplantaci ledviny při profylaxi anebo léčbě akutní protilátkami zprostředkované rejekce. Dosavadní studie u orgánových transplantací prokázaly, že léčba IVIG rychle, účinně a dlouhodobě snižuje koncentraci anti HLA protilátek. Mechanismus účinku je pravděpodobně komplexní a není přesně znám, zahrnuje blokádu Fc receptoru interferencí s aktivací komplementu a cytokinové aktivity a účinku antiidiotypových protilátek. Pro léčbu rejekce je významná i schopnost IVIG vychytávat komplement. Při terapii humorální rejekce se IVIG užívají v dávkách 0,2‒0,5 g/kg. V případě desenzitizačních protokolů se v některých centrech používají dávky 2 g/kg. Nežádoucí účinky spojené s podáním IVIG jsou mírné, i když se může vyvinout anafylaktická reakce při podání cizorodé bílkoviny. Z vážnějších potíží byly popsány trombotické komplikace. Nevýhodou IVIG je jejich vysoká cena a omezená dostupnost na trhu vyplývající z malých zásob, takže je stále nutné pečlivě vážit indikace jejich aplikace.
V případě rezistence k této léčbě je možno použít kombinaci podání rituximabu následovaného cykly léčby proteazomovým inhibitorem – bortezomibem. Recentní studie ovšem ukázala, že tento postup není účinný v případě chronické humorální rejekce [13].
Experimentální imunosuprese
Ekulizumab (Soliris) je rekombinantní humanizovaná monoklonální IgG2/4κ protilátka cílená proti C5 složce komplementu odpovědné za aktivaci terminální části komplementové kaskády. Podmínkou podání je proběhlé očkování proti meningokokové meningitidě a vysoké opatrnosti je potřeba u infekcí Streptococcus pneumoniae a Haemophilus influenzae. Léčba ekulizumabem je indikována pro atypický hemolyticko-uremický syndrom (aHUS) a paroxysmální noční hemoglobinurii. Pro transplantaci ledviny je indikován v prevenci a léčbě rekurence trombotické mikroangiopatie při aHUS. Recentní klinické studie s ekulizumabem ukázaly, že tento přípravek není přínosem pro prevenci rejekce zprostředkované akutními protilátkami u HLA inkompatibilních transplantací ledvin ani nezabrání opožděnému rozvoji funkce štěpu. V současnosti proběhly další klinické studie [14,15] s blokátory komplementu (anti C1), které je však předčasné hodnotit (fáze I klinického zkoušení).
Tocilizumab (RoActemra) je humanizovaná IgG1 monoklonální protilátka blokující receptor pro interleukin 6 (IL 6R). Receptor pro IL 6 se mimo jiné uplatňuje v T i B buněčné imunitní odpovědi proti alogennímu štěpu. V současnosti je kromě svých primárních indikací v revmatologii zkoušen také v desenzitizačních režimech u nemocných s anti HLA protilátkami a v prevenci a léčbě chronické humorální rejekce – transplantační glomerulopatie. Jedná se však teprve o informace z klinického výzkumu [16], v praxi se tento přípravek zatím nepoužívá, a to ani off label. S velkými nadějemi je očekávána nová klinická studie s klazakizumabem, monoklonální protilátkou blokující IL 6, v léčbě chronické aktivními protilátkami zprostředkované rejekce.
Imunoglobulin G degradační enzym Streptococcus pyogenes (IdeS) je enzym, který specificky štěpí IgG a je tak možno inaktivovat patogenní IgG. IdeS navozená degradace IgG tak může představovat nové směry léčby některých onemocnění, a to včetně transplantačních indikací, především u senzitizovaných nemocných s anti HLA protilátkami. První informace svědčí pro účinnost této terapie u nemocných s pozitivním cytotoxickým crossmatch, kdy transplantaci bylo možno po aplikaci IdeS provést a výskyt akutní humorální rejekce byl přijatelný [17]. Samozřejmě jde opět o lék, jehož uplatnění v klinické praxi musejí ověřit další rozsáhlejší studie.
Seznam použité literatury
- [1] Kidney Disease: Improving Global Outcomes (KDIGO) Transplant Work Group. KDIGO clinical practice guideline for the care of kidney transplant recipients. Am J Transplant 2009; 9(Suppl 3): S1‒155.
- [2] Gaber AO, Matas AJ, Henry ML, et al. Thymoglobulin Antibody Immunosuppression in Living Donor Recipients Investigators. Antithymocyte globulin induction in living donor renal transplant recipients: final report of the TAILOR registry. Transplantation 2012; 94: 331‒337.
- [3] Adu D, Cockwell P, Ives NJ, et al. Interleukin‑2 receptor monoclonal antibodies in renal transplantation: meta‑analysis of randomised trials. BMJ 2003; 326: 789‒793.
- [4] Brennan DC, Daller JA, Lake KD, et al. Rabbit antithymocyte globulin versus basiliximab in renal transplantation. N Engl J Med 2006; 355: 1967‒1977.
- [5] Macklin PS, Morris PJ, Knight SR. A systematic review of the use of rituximab for desensitization in renal transplantation. Transplantation 2014; 98: 794‒805.
- [6] Ekberg H, Tedesco‑Silva H, Demirbas A, et al.; ELITE‑Symphony Study. Reduced exposure to calcineurin inhibitors in renal transplantation. N Engl J Med 2007; 357: 2562‒2575.
- [7] Trunečka P. Once‑daily tacrolimus in liver transplantation: a “me‑too drug”, or a therapeutic advantage. Curr Opin Organ Transplant 2017; 22: 118‒122.
- [8] Budde K, Bunnapradist S, Grinyo JM, et al.; Envarsus study group. Novel once‑daily extended‑release tacrolimus (LCPT) versus twice‑daily tacrolimus in de novo kidney transplants: one‑year results of Phase III, double‑blind, randomized trial. Am J Transplant 2014; 14: 2796‒2806.
- [9] Webster AC, Woodroffe RC, Taylor RS, et al. Tacrolimus versus ciclosporin as primary immunosuppression for kidney transplant recipients: meta‑analysis and meta‑regression of randomised trial data. BMJ 2005; 331: 810.
- [10] Mourad G, Glyda M, Albano L, et al.; Advagraf‑based immunosuppression regimen examining new onset diabetes mellitus in kidney transplant recipients (ADVANCE) study investigators. Incidence of Posttransplantation Diabetes Mellitus in De Novo Kidney Transplant Recipients Receiving Prolonged‑Release Tacrolimus‑Based Immunosuppression With 2 Different Corticosteroid Minimization Strategies: ADVANCE. A Randomized Controlled Trial. Transplantation 2017; 101: 1924‒1934.
- [11] Pascual J, Berger SP, Witzke O, et al.; TRANSFORM Investigators. Everolimus with Reduced Calcineurin Inhibitor Exposure in Renal Transplantation. J Am Soc Nephrol 2018; 29: 1979‒1991.
- [12] Vincenti F, Larsen C, Durrbach A, et al.; Belatacept Study Group. Costimulation blockade with belatacept in renal transplantation. N Engl J Med 2005; 353: 770‒781.
- [13] Eskandary F, Regele H, Baumann L, et al. A Randomized Trial of Bortezomib in Late Antibody‑Mediated Kidney Transplant Rejection. J Am Soc Nephrol 2018; 29: 591‒605.
- [14] Eskandary F, Jilma B, Mühlbacher J, et al. Anti‑C1s monoclonal antibody BIVV009 in late antibody‑mediated kidney allograft rejection‑results from a first‑in‑patient phase 1 trial. Am J Transplant 2018; 18: 916‒926.
- [15] Mühlbacher J, Jilma B, Wahrmann M, et al. Blockade of HLA Antibody‑Triggered Classical Complement Activation in Sera From Subjects Dosed With the Anti‑C1s Monoclonal Antibody TNT009‑Results from a Randomized First‑in‑Human Phase 1 Trial. Transplantation 2017; 101: 2410‒2418.
- [16] Choi J, Aubert O, Vo A, et al. Assessment of Tocilizumab (Anti‑Interleukin‑6 Receptor Monoclonal) as a Potential Treatment for Chronic Antibody‑Mediated Rejection and Transplant Glomerulopathy in HLA‑Sensitized Renal Allograft Recipients. Am J Transplant 2017 Feb 15; doi: 10.1111/ajt.14228.
- [17] Jordan SC, Lorant T, Choi J, et al. IgG Endopeptidase in Highly Sensitized Patients Undergoing Transplantation. N Engl J Med 2017; 377: 442‒453.