Integrace nových biologických přípravků do léčby spinocelulárních karcinomů hlavy a krku
Biologická cílená léčba představuje netoxickou alternativu protinádorové terapie. Na základě vysoké exprese EGFR u karcinomů hlavy a krku byly zahájeny studie s mnoha inhibitory tohoto receptoru. Současně se rozvíjí i výzkum prediktivních markerů směřující k individualizaci terapie.
Úvod
Mezi maligními nádory hlavy a krku mají nejvýznamnější zastoupení nádory dýchacích a polykacích cest, histologicky se v převážné většině případů jedná o spinocelulární karcinomy (head and neck squamous cell carcinoma, HNSCC). V časných stadiích těchto nádorů bývá léčba účinná, avšak výrazná část pacientů je zachycena až ve stadiích pokročilých. V problematice léčby onemocnění karcinomy hlavy a krku lze v současné době sledovat 3 trendy:
– snaha o zachování orgánu u lokálně pokročilých onemocnění;
– zařazení biologických přípravků do léčby inoperabilních onemocnění;
– snaha o nalezení prediktivních faktorů chování nádorového onemocnění.
Jedním z nejvíce diskutovaných témat v oblasti terapie i prediktivní onkologie se stal význam receptoru pro epidermální růstový faktor (epidermal growth factor receptor, EGFR, známý také jako ErbB-1 nebo HER1).
EGFR jako cíl protinádorové léčby
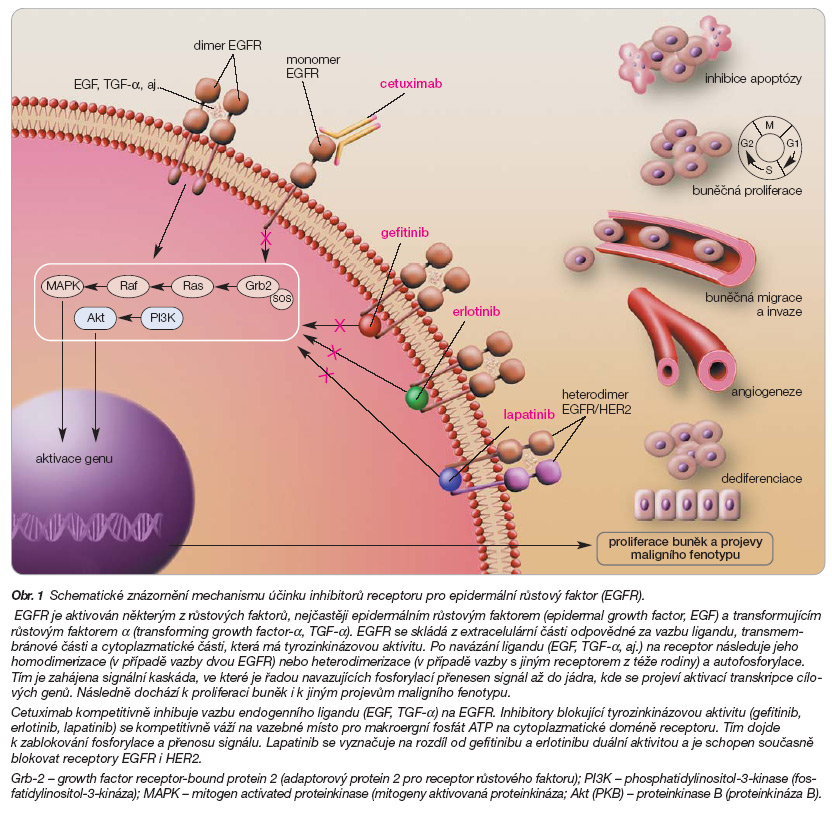
V léčbě karcinomů hlavy a krku se vedle operačního řešení široce využívá i možností radioterapie a chemoterapie. Jednou z nevýhod chemoterapie je však nedostatek její selektivity a toxicita. V posledních letech se díky velkému pokroku ve výzkumu molekulární biologie nádorů zaměřila pozornost na léčebné využití specifických inhibitorů signální soustavy nádorové buňky, jejichž podávání provází výrazně nižší toxicita ve srovnání s léčbou klasickými cytostatiky. Do metod této tzv. cílené terapie (targeted therapy) se zařazují inhibitory receptoru pro epidermální růstový faktor. EGFR (HER1) patří do rodiny transmembránových receptorů pro růstové faktory Erb/HER, kam dále patří HER2 (HER2/neu, ErbB-2), HER3 (ErbB-3) a HER4 (ErbB-4). EGFR obsahuje extracelulární doménu, určenou pro vazbu ligandu, a intracelulární doménu, která vykazuje tyrozinkinázovou aktivitu a zodpovídá za transdukci signálu do buňky. Nejčastějšími ligandy jsou epidermální růstový faktor (epidermal growth factor, EGF) a transformující růstový faktor a (transforming growth factor-a, TGF-a). Po navázání ligandu na receptor následuje jeho homodimerizace (v případě vazby dvou EGFR) nebo heterodimerizace (v případě vazby s jiným receptorem z téže rodiny), autofosforylace a přenos signálu až do buněčného jádra, kde dochází k transkripci cílových genů. EGFR hraje klíčovou roli v kancerogenezi, jeho signální cesta vede u nádorů k aktivaci buněčného dělení, k angiogenezi, metastazování a k inhibici apoptózy, zaznamenána byla i rezistence na radioterapii, chemoterapii a hormonální terapii (obr. 1). Mezi negativními prognostickými markery byly v souvislosti s výzkumem tohoto receptoru u HNSCC prokázány mutace v signální cestě EGFR (např. mutace k-ras genu, EGFRvIII, amplifikace EGFR genu) [1], zvýšená exprese TGF-a s EGFR, ale také heterodimerizace EGFR s HER2, při které dochází ke zvýšení vazebné afinity přirozených ligandů a ke stabilizaci a recyklaci heterodimerů. Všechny výše uvedené možnosti vedou k aberantní zesílené EGFR signalizaci. Zvýšená exprese EGFR byla detekována především u nádorů epiteliálního původu, u HNSCC se dle mnoha zdrojů udává v 70–100 % případů (vzhledem k nezanedbatelnému riziku falešně negativních výsledků imunohistochemické detekce se zde skutečné hodnoty předpokládají spíše v rozmezí 90–100 %). Oproti normálnímu epitelu byl v nádorové tkáni EGFR detekován v mnohem vyšších hladinách, z toho důvodu se stal specifickým terčem protinádorové léčby.
Inhibitory EGFR se rozdělují do 2 skupin podle svojí vazby na extracelulární či intracelulární úrovni (obr. 1). V rámci preklinického výzkumu byla vyzkoušena celá řada blokátorů EGFR, patří mezi ně monoklonální protilátky pro intravenózní podání cetuximab C 225, matuzumab EMD 72000, h-53, ABX-EFG a nízkomolekulární inhibitory tyrozinkinázy pro perorální podání gefitinib ZD 1839, erlotinib OSI 774, lapatinib GW 572016, PKI 166, canertinib Cl 1033 aj. Do vlastních klinických studií se však dostala pouze část z nich. Z extracelulárních blokátorů se v léčbě pacientů s karcinomy hlavy a krku osvědčila monoklonální protilátka cetuximab, jejíž účinek je založen na kompetitivní inhibici na vazebném místě přirozených ligandů. Předmětem klinických studií s intracelulárními blokátory se staly inhibitory tyrozinkinázy gefitinib, erlotinib a lapatinib.
Kombinace podání cetuximabu s chemoterapií či radioterapií se ukázala jako výhodná vzhledem k supraaditivnímu efektu, kdy dochází k potenciaci léčebného účinku bez zvyšování nežádoucích účinků spojených se standardní terapií. Cetuximab již byl schválen a zařazen do léčebných protokolů kolorektálního karcinomu a v nedávné době i do léčebných protokolů spinocelulárních karcinomů hlavy a krku. První práce, které sledovaly možnosti využití inhibitorů EGFR, přinesly zajímavé výsledky v terapii recidivujícího a metastatického onemocnění. Přínos se očekává především ve zvýšení účinku léčby u nemocných s vysokou pravděpodobností onkologické recidivy a ve snížení toxicity léčby spojené s klasickými cytostatiky [2–5]. Většina studií je zaměřena na terapii pokročilých a inoperabilních onemocnění, navíc se však diskutuje i o možnosti využití těchto látek v rámci záchovného protokolu u karcinomů zasahujících larynx a hypofarynx s cílem vyhnout se rozsáhlé mutilující operaci [6]. Vzhledem k prokázané účinnosti, relativně vysoké specifitě a nízké toxicitě by inhibitory EGFR nepochybně mohly získat v terapii karcinomů hlavy a krku důležité místo, v této oblasti však bude třeba uskutečnit ještě další klinické studie.
EGFR v prognóze karcinomu hlavy a krku a v predikci terapeutické odpovědi na cílenou léčbu
Výzkumy v oblasti EGFR jsou zaměřeny nejen na jeho využití jako cíle protinádorové léčby, ale i na jeho prediktivní význam. Zkoumají se jak možnosti predikce terapeutické odpovědi na inhibitory EGFR, tak i možnosti vývoje samotného maligního onemocnění. V oblasti hledání nových prognostických markerů se zdá slibné zaměření se na koexpresi EGFR s dalšími faktory ovlivňujícími chování nádorů a na genetické alterace způsobující změny v EGFR signální kaskádě. Snahy o predikci chování maligního onemocnění na molekulárněgenetické úrovni, především ve smyslu odhadu rizika recidivy onemocnění, by mohly v budoucnu představovat významný krok k individualizaci onkologické terapie.
Pro praxi je v souvislosti s terapií monoklonálními protilátkami důležitou skutečností, že nebyla nalezena přímá úměra mezi stupněm intenzity exprese EGFR a účinností této léčby. U karcinomu hlavy a krku je pozitivita EGFR velmi vysoká, navíc i u nádorů s nízkým stupněm exprese byla opakovaně zaznamenána velmi dobrá účinnost, proto bylo upuštěno od individuálního imunohistochemického stanovování intenzity exprese EGFR v nádorových buňkách jako zařazovacího kritéria pacientů s HNSCC do této léčby. Přesný molekulární mechanismus odpovědi na terapii inhibitory EGFR je v mnoha aspektech stále předmětem studií. O markerech terapeutické odpovědi či rezistence se vedou diskuse. V souvislosti s mechanismem rezistence na inhibitory EGFR se předpokládá konstitutivní aktivace signální cesty nezávisle na EGFR a přítomnost genetických aberací způsobujících dysregulaci buněčného cyklu [7]. Vzhledem k faktu, že imunohistochemická detekce intenzity exprese EGFR neprokázala přínos pro predikci účinnosti léčby, hledání prediktivních markerů se přesunulo na úroveň genetických alterací. U karcinomu hlavy a krku se v souvislosti s terapií cetuximabem zdá slibná mutace EGFRvIII, která je nalézána pouze u nádorových buněk. Její charakteristikou je chybění extracelulární domény receptoru, a tím nemožnost navázání extracelulárních inhibitorů. EGFRvIII má schopnost dimerizace i bez navázání ligandu. Mírný stupeň autofosforylace u tohoto receptoru dostačuje k aktivaci signální cesty, ale ne k vyvolání jeho internalizace (down-regulace receptoru) [8]. Tímto mechanismem zde dochází ke kontinuální aktivaci signální cesty. Při přítomnosti EGFRvIII byla v preklinických studiích prokázána kromě rezistence na monoklonální protilátky i snížená odpověď na cisplatinu [9]. V rámci markerů negativní odpovědi na inhibitory EGFR budí pozornost i mutace k-ras, způsobující kontinuální aktivaci EGFR signální cesty nezávisle na aktivaci nebo inhibici receptoru (ras protein je jedním z intracelulárních přenašečů v EGFR signální cestě). Tato mutace je častěji detekována u kuřáků a u pacientů ze západních zemí. Naopak jako marker pozitivní terapeutické odpovědi se jeví slibná amplifikace EGFR genu. Klinicky je lepší terapeutická odpověď na inhibitory EGFR, podobně jako u standardní protinádorové terapie, zjišťována u nekuřáků, určitou specifitou je např. lepší účinnost některých intracelulárních inhibitorů u asijské populace, což má svůj genetický podklad. V neposlední řadě je zajímavostí často uváděná přímá souvislost intenzity kožních nežádoucích účinků s pozitivní terapeutickou odpovědí [10].
Inhibitory EGFR v léčbě spinocelulárních karcinomů hlavy a krku
Cetuximab
Cetuximab je monoklonální protilátka třídy IgG1, která se váže na extracelulární doménu EGFR s vyšší afinitou než přirozené ligandy, a tím způsobuje kompetitivní inhibici tohoto receptoru s jeho internalizací bez aktivace (obr. 1). Kromě samotné blokády EGFR je protinádorový účinek monoklonálních protilátek založen i na aktivaci na protilátkách závislé buněčné cytotoxicity (Antibody-Dependent Cell-mediated Cytotoxicity, ADCC), z čehož lze usuzovat, že výsledek léčby zde do jisté míry ovlivňuje i individuální cytotoxická imunitní odpověď, spuštěná navázáním protilátky na nádorovou buňku. Tato aktivace imunitního systému proti nádoru je však specifická pouze pro terapeutický účinek monoklonálních protilátek, neplatí to tedy pro intracelulární inhibitory.
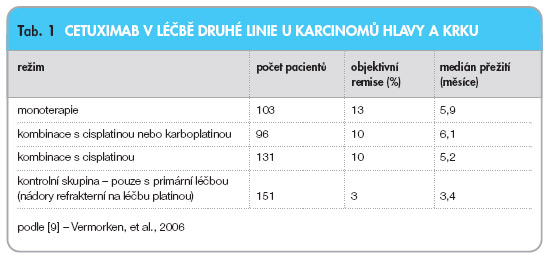
Iniciální studie byly zaměřeny na otázku, zda by přidání cetuximabu k léčbě mohlo vést k překonání rezistence na chemoterapii. U pacientů s pokročilým progredujícím onemocněním, refrakterním na léčbu platinovými deriváty, vedlo přidání cetuximabu ke stejné dávce platiny, po které pacienti již dříve progredovali, k 10 % objektivních remisí s mediánem přežití přibližně 6 měsíců. Vermorken uvádí souhrnné výsledky při podání cetuximabu pacientům, jejichž onemocnění progredovalo po primární léčbě platinovým derivátem (tab. 1) [11].
V podobné populaci nemocných bylo u pacientů, jejichž onemocnění po chemoterapii progredovalo, zaznamenáno po podání cetuximabu v monoterapii 12 % objektivních remisí. To vedlo k otázce, zda by režim se samotným cetuximabem nebyl podobně účinný a méně toxický než jeho kombinace s platinou. Výsledky byly stejné jako při terapii cytostatiky druhé řady. Baselga zaznamenal při léčbě kombinací cetuximabu s cisplatinou 10 % objektivních remisí u recidivujících/metastatických forem karcinomů hlavy a krku [12]. Burtnessová uvádí při podání této kombinace dokonce 26,3 % objektivních remisí oproti 9,8 % remisí při léčbě samotnou cisplatinou [13].
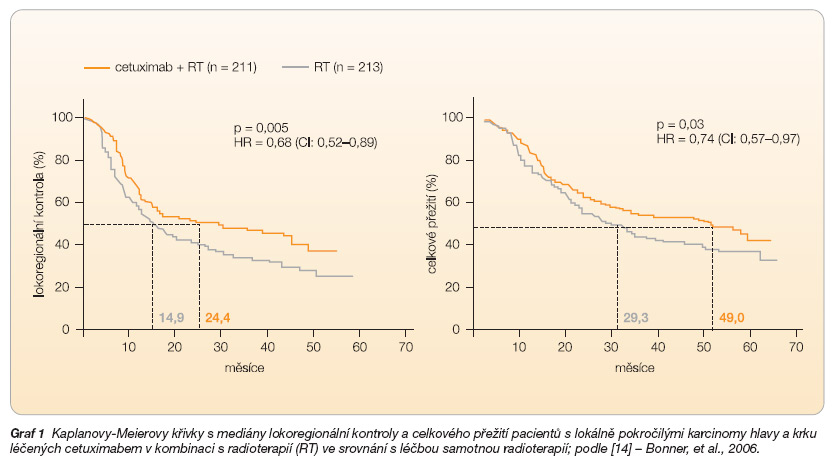
Jednou z nejvýznamnějších a nejvíce citovaných studií týkajících se léčby cetuximabem je studie Bonnera a kol. [14]. Do této studie bylo zahrnuto 424 pacientů s lokálně pokročilými karcinomy hlavy a krku, kteří byli randomizováni do 2 skupin, v nichž byli léčeni cetuximabem s radioterapií versus radioterapií samotnou. Výsledkem bylo 2leté přežití 56 % pacientů léčených cetuximabem v kombinaci s radioterapií vs. 48 % pacientů léčených radioterapií, celkové přežití 54 vs. 28 měsíců. Léčba cetuximabem v kombinaci s radioterapií ve srovnání se samotnou radioterapií významně zlepšila celkové přežití, výsledky lokoregionální kontroly a období bez progrese onemocnění (graf 1).
Těchto výsledků bylo dosaženo pouze při minimálním zvýšení toxicity léčby. Nezanedbatelnou součástí Bonnerovy studie byla i analýza využití kombinace cetuximabu s radioterapií v rámci tzv. orgán záchovného protokolu u karcinomů laryngu a hypofaryngu. Zachování hrtanu bylo zaznamenáno ve 2. roce v 90 % případů u nemocných léčených radioterapií s cetuximabem vs. v 80 % případů při samotné radioterapii, ve 3. roce činil tento poměr 87 % vs. 77 %. Metaanalýzy studií ukazují, že kombinace radioterapie s cetuximabem dosahuje lepších terapeutických výsledků a nižší toxicity než chemoradioterapeutické protokoly.
Účinnost cetuximabu v kombinaci s dalšími cytostatiky a radioterapií byla potvrzena i mnoha jinými autory [15–17].
Shrnutí současného hodnocení přínosu cetuximabu v léčbě HNSCC:
– léčba cetuximabem vede k regresi u 10–20 % pokročilých onemocnění při výrazném procentu stabilizace onemocnění;
– cetuximab v kombinaci s radioterapií nebo chemoterapií prokázal významný klinický účinek jak u dosud neléčených, tak u nemocných předléčených platinovými cytostatiky;
– cetuximab v kombinaci je vhodný především u nemocných s kontraindikací nebo s refrakterností na léčbu cisplatinou.
Na kongresu ASCO 2006 bylo uveřejněno několik nových zpráv o podání cetuximabu nemocným s karcinomy hlavy a krku. Kies použil v neoadjuvanci kombinaci cetuximabu s paklitaxelem/karboplatinou v týdenním podání [18]. Po 6 týdnech terapie následovala operace +/- adjuvantní radioterapie nebo konkomitantní chemoradioterapie. U 41 pacientů bylo hodnoceno na primárním nádoru 17 % parciálních a 83 % kompletních remisí. U 44 pacientů bylo dosaženo v lymfatické oblasti postižené nádorem 70 % parciálních a 27 % kompletních remisí. Celkem ze 45 hodnocených nemocných bylo bez známek onemocnění 24 %. Těžká kožní vyrážka byla zaznamenán u 50 % nemocných. Vermorken zařadil do studie fáze III celkem 440 pacientů s HNSCC, podávána byla cisplatina/karboplatina + 5-fluorouracil s cetuximabem nebo cisplatina/karboplatina + 5-fluorouracil. Studie je stále aktivní, nejčastější zaznamenaná toxicita byla neutropenie stupně 3–4 [19]. De La Garza uvedl předběžné výsledky studie fáze II, ve které podal cetuximab s gemcitabinem a následně radioterapii [20]. Zhodnocena byla zatím účinnost terapie u 19 pacientů, kteří dosáhli 76,5 % kompletních a 23,5 % parciálních remisí. Toxicita se objevila ve formě mukozitidy stupně 3–4 u 8 pacientů a kožní vyrážky stupně 3 u 4 pacientů. Režim je předběžně hodnocen jako bezpečný a vysoce účinný. Gemcitabin nezvyšuje místní toxicitu. Licitra podal cetuximab pacientům s recidivujícími a metastatickými nádory slinných žláz [21]. Do studie fáze II zařadil 30 pacientů, cetuximab byl podáván až do progrese onemocnění anebo do doby, kdy se projevila toxicita léčby. Kožní vyrážka stupně 2 byla zaznamenána u 24 pacientů, léčebná odpověď u 11 pacientů se stabilizovaným onemocněním.
Evropská komise schválila v březnu 2006 cetuximab v kombinaci s radioterapií pro léčbu první linie lokálně pokročilých spinocelulárních karcinomů hlavy a krku. Dosavadní klinické výsledky řadí cetuximab mezi účinná léčiva v léčbě místně pokročilých, recidivujících či metastatických karcinomů hlavy a krku. Velkou pozornost vzbuzují práce, které při použití kombinace cetuximabu s radioterapií uvádějí zlepšené výsledky v zachování laryngu a hypofaryngu [14].
V současnosti probíhají studie fáze III s kombinací cetuximabu, cisplatiny a radioterapie u lokálně pokročilých nepředléčených HNSCC.
Gefitinib
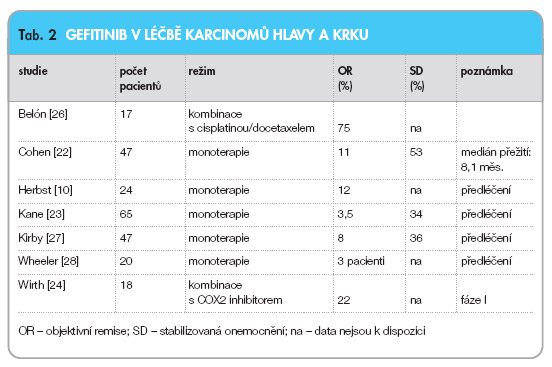
Gefitinib je syntetický chinazolin ze skupiny selektivních inhibitorů receptorů EGFR na úrovni tyrozinkinázové domény (obr. 1). Je určen pro perorální podání v jedné denní dávce. Gefitinib prokázal určitou aktivitu v několika studiích v léčbě recidivujících/metastatických HNSCC. Cohen uvádí 11 % objektivních remisí při mediánu přežití 8 měsíců u 47 pacientů, kteří dostávali gefitinib v monoterapii [22]. Kane ve studii s 65 pacienty zaznamenal nízkou toxicitu, ale zároveň i nízký účinek: pouze 3,5 % remisí, 43 % nemocných však bylo intenzivně předléčeno cytostatiky [23]. Wirth v malé studii fáze I u pacientů s neresekabilními karcinomy předléčenými chemoterapií či chemoradioterapií podal kombinaci gefitinibu s inhibitorem cykolooxygenázy typu 2 (gefitinib 250 mg 1krát denně, celekoxib 200 mg 2krát denně), u 4 z 18 hodnocených pacientů byla zaznamenána částečná odpověď [24]. Cohen uveřejnil v roce 2005 zajímavou studii, ve které je použita kombinace paklitaxelu s karboplatinou jako indukce s následnou konkomitantní chemoradioterapií s fluorouracilem, hydroxyureou a gefitinibem [25]. Poté byla zahájena udržovací terapie gefitinibem po dobu 2 let. Předběžné výsledky léčby 42 pacientů zaznamenávají 88 % objektivních remisí. Přehled studií s podáváním gefitinibu a jejich výsledky jsou uvedeny v tab. 2.
Toxicita byla ve většině prací stupně 1–2, nejčastěji se vyskytovala kožní vyrážka, dále průjmy a nauzea. V řadě studií byla zaznamenána souvislost mezi intenzitou kožní reakce a pozitivním efektem léčby.
Erlotinib
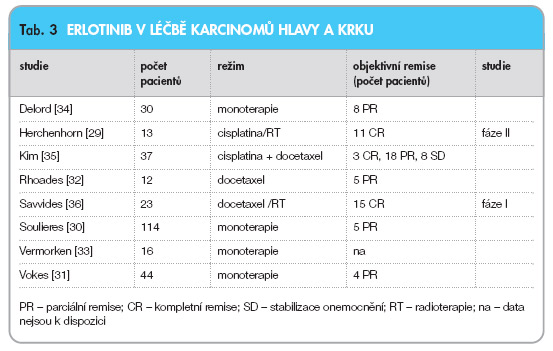
Erlotinib je malá molekula působící jako inhibitor tyrozinkinázy (obr. 1). Je určena pro perorální podání. V monoterapii i v kombinaci s cytostatiky prokázal erlotinib ve fázi II zajímavou účinnost v léčbě karcinomů plic a pankreatu. První studie ukazují na určitý stupeň účinnosti i u pokročilých HNSCC. Někteří autoři upozorňují na možný synergický účinek s docetaxelem či cisplatinou. Herchenhorn zařadil do studie fáze I/II pacienty ve stadiu III a IV [29]. Pacienti byli léčeni radioterapií a cisplatinou, erlotinib byl podáván v celém průběhu radioterapie. Ze 13 pacientů, u nichž bylo možno hodnotit účinnost léčby, bylo zaznamenáno 11 kompletních remisí. Soulieres podal erlotinib v monoterapii 115 předléčeným nemocným s recidivujícím/metastatickým onemocněním, z toho 47 % pacientů dostalo dávku 150 mg denně v průběhu celé studie, u 6 % pacientů byla dávka eskalována a 46 % vyžadovalo redukci nebo ukončení léčby [30]. U 5 pacientů (4,3 %) z těch, u nichž bylo možno hodnotit průběh léčby, bylo dosaženo parciální remise s mediánem trvání 16 týdnů při mediánu celkového přežití 6 měsíců. Stabilizace onemocnění byla zaznamenána u 44 pacientů (38,3 %). Kožní vyrážka a průjmy se vyskytly u 79 % a u 37 % nemocných. Autoři zdůrazňují, že intenzita kožní toxicity je odrazem intenzity léčebných výsledků. Vokes uvádí při monoterapii erlotinibem parciální remise u 4 (9 %) z celkového počtu 44 pacientů s pokročilým onemocněním [31]. Rhoades a kol. použili kombinaci erlotinib a docetaxel v léčbě 12 nemocných a u 5 z nich zaznamenali parciální remisi [32]. Vermorken a kol. ve své studii podali 16 nemocným kombinaci erlotinib s cisplatinou a docetaxelem, výsledky jejich studie však zatím nejsou k dispozici [33]. Delord léčil erlotinibem (150 mg denně) v neoadjuvanci pacienty s resekabilními karcinomy hlavy a krku, doba terapie byla v průměru 21 dní (až do doby operace). Zhodnoceno bylo 30 pacientů: u 8 byla odpověď hodnocena jako dobrá (30–80% zmenšení nádoru). Kožní toxicita se projevila v 11 případech. Všechny nádory vykazovaly pozitivitu EGFR exprese, její intenzita však nebyla v přímé úměře s léčebným efektem [34]. Autor zdůrazňuje důležitost výběru vhodných pacientů, pro které bude mít terapie dostatečný klinický efekt. Kim uvádí dobré výsledky při použití léčby erlotinibem u řady nádorů, preklinické údaje demonstrovaly i možný synergismus s platinou a taxany [35]. Ve studii s 37 pacienty s pokročilými nádory hlavy a krku byla započata léčba docetaxelem 75 mg/m2 a cisplatinou 75 mg/m2 ve třítýdenních intervalech a erlotinibem v dávce 150 mg denně. Objektivních remisí bylo zaznamenáno 66 %; 3 pacienti dosáhli kompletní a 18 pacientů parciální remise, ke stabilizaci onemocnění došlo v 8 případech. Kožní toxicita 2. stupně byla zaznamenána u 2 pacientů. Dobrá tolerance a zajímavé výsledky léčby touto kombinací vybízejí k dalším studiím. Savvides použil kombinaci s týdenním podáním docetaxelu, standardním ozářením a denní dávkou erlotinibu 150 mg až po dobu 2 let u 23 dosud neléčených nemocných. Kompletní remisi zaznamenal u 15 pacientů [36]. Studie kombinace denního podání erlotinibu, týdenního podání docetaxelu a radioterapie u nemocných stadia III/IVB je stále aktivní. V tab. 3 je uveden přehled studií s podáváním erlotinibu a jejich výsledky.
Lapatinib
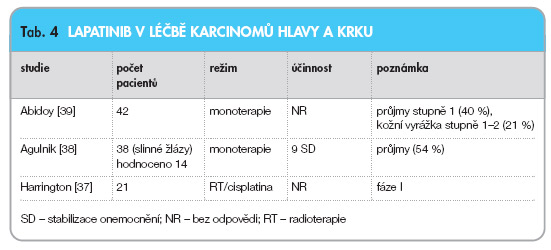
Lapatinib ditosylát je určen pro perorální použití. Jedná se o malou molekulu, která se od ostatních zde uvedených inhibitorů tyrozinkinázy liší svojí schopností současně blokovat receptory EGFR i HER2 (obr. 1). Jak již bylo zmíněno výše, existuje předpoklad horší prognózy maligního onemocnění při koexpresi EGFR a HER2, jejichž signální cesta je zodpovědná za vystupňovanou buněčnou proliferaci a další procesy stimulující nádorovou progresi, invazivitu a metastazování. Racionálnost použití lapatinibu je založena na blokádě obou typů receptorů, která by v terapii měla vykazovat lepší klinické výsledky než inhibice na jednom místě signální cesty. Harrington ve studii fáze I použil lapatinib u HNSCC v kombinaci s konkomitantní chemoradioterapií [37]. Inhibice EGFR v kombinaci s frakcionovanou radioterapií zvyšuje radiosenzitivitu a inhibici buněčné proliferace včetně urychlené repopulace během léčby. Použitý režim spočíval v aplikaci radioterapie 66–70 Gy během 6–7 týdnů při 2 Gy denně a podání cisplatiny 100 mg/m2 den 1, 22 a 43 s lapatinibem v dávce 500, 1000 a 1500 mg denně (7 pacientů dostalo 500 mg, 7 pacientů 1000 mg a 3 pacienti 1500 mg lapatinibu). Předběžné výsledky ukazují na dobrou tolerabilitu lapatinibu s konkomitantní chemoradioterapií. Optimální se ukázal režim použití 1500 mg lapatinibu denně, který bude dále použit ve studii fáze II. Agulnik se ve studii fáze II zaměřil na protinádorovou aktivitu lapatinibu u pokročilých/metastatických nádorů slinných žláz [38]. Pacienti byli léčeni dávkou 1500 mg lapatinibu denně po dobu 4 týdnů. Do studie bylo zařazeno 38 pacientů předléčených chemoterapií nebo radioterapií. Toxicita se projevila ve formě průjmů u 54 %, v podobě bolesti u 52 %, únavou trpělo 52 % pacientů, lymfopenie byla zaznamenána u 39 %, anémie u 38 % a hyperglykémie u 38 % pacientů. Jen v 8 případech se jednalo o příznaky 3. stupně, stupeň 4 se nevyskytl. Ze 14 hodnocených pacientů dosáhlo 9 nemocných stabilizace onemocnění, objektivní remise zaznamenány nebyly. Abidoye zařadil do studie jak pacienty již léčené inhibitory EGFR, tak i pacienty dosud inhibitory neléčené [39]. Všichni dostali dávku 1500 mg lapatinibu denně, do léčby bylo zařazeno celkem 42 nemocných. Toxicita byla mírná a nevyžadovala redukci dávky. Nejčastějšími vedlejšími účinky byly průjmy – vyskytly se ve 40 %, únava ve 21 % a kožní vyrážka ve 21 %. Pouze u 2 pacientů došlo k toxicitě stupně 3 (1krát průjem a 1krát zvracení). U pacientů nedošlo k žádné léčebné odpovědi. Medián doby do progrese (progression-free survival, PFS) byl 1,7 a 1,6 měsíců. Tolerance léčby lapatinibem byla sice dobrá, ale nepodařilo se zde prokázat její protinádorový efekt. Další studie s lapatinibem pokračují. Dosavadní výsledky studií s podáváním lapatinibu shrnuje tab. 4.
Závěr
Zavádění inhibitorů EGFR do léčby karcinomů hlavy a krku bylo provázeno velkým entuziazmem, což bylo podloženo vysokou expresí EGFR u těchto nádorů a bohatými preklinickými údaji. Z mnoha zkoušených inhibitorů však studií fáze II a III dosáhlo jen několik preparátů. Do vlastní klinické praxe pro léčbu druhé i první linie byla zaregistrována pouze monoklonální protilátka cetuximab. Exprese EGFR zde neprokázala přínos jako prediktor efektivity léčby. Markery pozitivní a negativní odpovědi na léčbu inhibitory EGFR zůstávají stále předmětem výzkumu, pozornost je v současnosti zaměřena na genetickou úroveň.
Seznam použité literatury
- [1] Chung CHH, Ely K, McGavran L, et al. Increased epidermal growth factor receptor gene cpy number is associated with poor prognosis in head and neck squamous cell carcinomas. J Clin Oncol 2006; 25: 4170–4176.
- [2] Grandis JR, Melhem MF, Holding WE, et al. Levels of TGF-alpha and EGFR protein in head and neck squamous cell carcinoma and patients survival. J Nat Cancer Inst 1998; 90: 824–828.
- [3] Cohen EEW. Novel Therapeutic Targets in Squamous Cell Carcinoma of the Head and Neck. Sem Oncol 2005; 31: 755–769.
- [4] Cutsem EV, Cunningham D (edits). Cetuximab (Erbitux in the treatement of cancer. Oncol Bio-therapeutics 2005; 3: 8–14.
- [5] Huang SM, Bock JM, Harari PM. Epidermal growth factor receptor blockade with C255 modulates proliferation, apoptosis, and radiosensitivity in squamous cell carcinoma of the head and neck. Cancer Res 1999; 549: 1935–1940.
- [6] Bonner JA, et al. Improved larynx preservation with the addition of Erbitux (cetuximab) to radio-therapy for carcinoma of the larynx and hypo-pharynx. ASCO 2005.
- [7] Kalyankrishna S, Grandis JR. Epidermal Growth Factor Receptor Biology in Head and Neck Cancer. J Clin Oncol 2006; 24: 2666–2672.
- [8] Pedersen MW, Meltoron M, Damstrup L, et al. The type III epidermal growth factor receptor mutation. Biological significance and potential target for anti-cancer therapy. Annals of Oncology 2001; 12: 745–760
- [9] Sok JC, Coppelli FM, Thomas SM, et al. Mutant epidermal growth factor receptor (EGFRvIII) contributes to head and neck cancer growth and resistance to EGFR targeting. Clinical Cancer Research 2006; 12, 5064–5073.
- [10] Herbst RS, Arquette M, Shin DM, et al. Phase II multicenter study of the epidermal growth factor receptor antibody cetuximab and cisplatin for recurrent and refractory squamous cell carcinoma of head and neck. J Clin Oncol 2005; 23: 5578–5587.
- [11] Vermorken J, et al. Erbitux in patients with recurrent and /or metastatic squamous cell carcinoma of the head and neck progressing on platinum-based chemotherapy. J Clin Oncol 2005; 23: 501. Head and Neck Cancer Symposium, Amsterdam March 2006, Anet. 7.
- [12] Baselga J, Trigo JM, Bourhis J, et al. Phase II Multicenter Study of the Antiepidermal Growth Factor Receptor Monoclonal Antibody Cetuximab in Combination with Platinum Based Chemotherapy in Patients with Platinum-Refractory Metastatic and/or Recurrent Squamous Cell Carcinoma of the Head and Neck. J Clin Oncol 2005; 23: 5568–5577.
- [13] Burtness BA. Cetuximab and Cisplatin for Chemotherapy-Refractory Squamous Cell Carcinoma of the Head and Neck. J Clin Oncol 2005; 24: 5440–5442.
- [14] Bonner JA, Harari PM, Giralt J, et al. Radiotherapy plus cetuximab for squamous-cell carcino ma of the head and neck. N Engl J Med. 2006; 354: 567–578.
- [15] Bourhis J, Rivera F, Mesia R, et al. Phase I/II study of cetuximab on combination with cisplatin or carboplatin and flurouracil in patients with recurrent or metastatic squamous cell carcinoma of the head and neck neck. J Clin Oncol 2006; 24: 2866–2872.
- [16] Trigo J,Hitt R, Koralewski E, et al. Cetuximab monotherapy is active in patients with platinum refractory recurrent/metastatic squamous cell carcinoma of the had and neck. Results of a phase II study. Proc ASCO 2004; Abstr. 5505.
- [17] Pfister DG, Aliff TB, Kraus DH, et al. Concurrent cetuximab, cisplatin, and concomitant boost radiation therapy for locoregionally advanced squamous cell head and neck cancer. Proc ASCO 2004; 22: Abstr. 1993.
- [18] Kies MS, Garden AS, Holsinger C, et al. Induction chemotherapy with weekly paclitaxel, carboplatin and cetuximab for squamous cell carcinoma of the head and neck. Proc ASCO 2006; Abst 5520.
- [19] Vermorken JB, Mesia R, Vega-Villegas ME, et al. Cetuximab in combination with cisplatin or carboplatin and 5-fluorouracil in the first-line treatment of patients with recurrent and/or metastatic sqaumous cell carcinoma of the head and neck. Proc ASCO 2006; Abstr. 5537.
- [20] De La Garza, Granados M, Aguillar JL, et al. Phase II clinical trial preliminary report: Cetuximab, gemcitabin and simultaneous radiotherapy for locally advanced head and neck cancer: Preliminary report. Proc ASCO 2006; Abstr. 15502.
- [21] Licitra LF, Locati LD, Potepan P, et al. Cetuximab in recurrent and/or metastatic salivary gland carcinoma: A monoinstitutional phase II study. Abst ASCO 2006; Abstr. 5547.
- [22] Cohen EE, Kane MA, List MA, et al. Phase II trial of gefitinib 250 mg daily in patients with recurrent or metastatic squamous cell carcinoma of the head and neck. Clin Cancer Res 2005; 11: 8418–8424.
- [23] Kane MA, Cohen E, List M, et al. Phase II Study of 250 mg Gefitinib in Advanced Squamous Cell Carcinoma of the Head and Neck. Proc ASCO 2004; Abstr. 5586.
- [24] Wirth LI, Haddad RI, Lindeman NI, et al. Phase I Study of Gefitinib Plus Celecoxib in Recurrent or Metastatic Squamous Cell Carcinoma of the Head and Neck. J Cin Oncol 2005; 23: 6971–6976.
- [25] Cohen EEW, Haraf DJ, Stenson KM, et al. Integration of gefitinib into a concurrenrt chemoradiation regimen followed by gefinitib adjuvant therapy in patients with locally advanced head and neck cancer: a Phase II trial. Proc ASCO 2005; Abstr. 5506.
- [26] Belón J, Irigoyen A, Rodriguez, et al: Preliminary results of a phase II study to evaluate gefitinib combined with docetaxel and cisplatin in patients wit recurrent and/or metastatic squamous carcinoma of the head and neck. Proc ASCO 2005; Abst 5563.
- [27] Kirby AM, A´hern RP, D´ambrosio C, et al. Gefitinib as paliative treatment in recurrent or metastatic head and neck cancer. BR J Cancer 2006; in press.
- [28] Wheeler RH, Jones D, Sharma R, et al. Clinical and molecular phase II study of gefitinib in patients with recurrent squamous cell cancer of the head and neck. Proc ASCO 2005; Abstr. 5531.
- [29] Herchenhorn D, Dias FL, Ferreira CG, et al. Phase I/II of erlotinib combined with cisplatin and radiotherapy for locally advanced squamous cell carcinoma of the head and neck. Proc ASCO 2006; Abstr. 5575.
- [30] Soulieres D, Senzor NN, Vokes E, et al. Multicenter phase II study of erlotinib, an oral epidermal growth factor receptor tyroxin kinase inhibitor, in patients with recurrent or metastatic squamous cell cancer of the head and neck. J Clin Oncol 2004; 22: 77–85.
- [31] Vokes E. Current treatment and promising investigation in a multidisciplinary setting. Ann Oncol 2005; 16: 25–30.
- [32] Rhoades CA, Kraut E, Schiller D, et al. Phase I and II study of OSI 774 and docetaxel in squamous cell carcinoma of the head and neck. Proc ASCO 2003; Abstr. 5541.
- [33] Vermorken JB. Medical treatment in head and neck cancer. Ann Oncol 2005; 16 (Suppl. 2): 258–264.
- [34] Delord J, Thomas F, Benlyazid A. et al. Neo-adjuvant treatment with erlotinib in squamous cell carcinoma head and neck patients before surgery provides an opportunity to find predictive factors of response. Proc ASCO 2006; Abstr. 31213.
- [35] Kim ES, Kies MS, Glison BS, et al. Phase II study of combination cisplatin, docetaxel and erlotinib in patients with metastatic/recurrent head and neck squamous cell carcinoma. Proc ASCO 2006; Abstr. 31564.
- [36] Savvides P, Agarwala SS, Greskovich J, et al. Phase I study of the EGFR tyroxin kinase inhibitor erlotinib in combination with docetaxel and radiation in locally advanced squamous cell cancer of the head and neck. Proc ASCO 2006; Abstr. 32744.
- [37] Harrington KJ, Bourhis J, Nutting CM, et al. A phase I, open-label study of lapatinib plus chemoradiation in patients with locally advanced squamous cell carcinoma of the head and neck. Proc ASCO 2006; Abstr. 33944.
- [38] Agulnik M, Cohen EE, Cohen RB, et al. A phase II study of lapatinib in recurrent or metastatic EGFR and/or ErbB2 expressing adenoid cystic and non-ACC malignant tumor of the salivary gland. Proc ASCO 2006; Abstr. 31579.
- [39] Abidoye OO, Cohen EE, Wong SJ, et al. A phase II study of lapatinib (GW572016) in recurrent/metastatic squamous cell carcinoma of the head and neck. Proc ASCO 2006; Abstr. 32889.