Kombinace antitrombotik
Trombotické cévní komplikace jsou vedoucí příčinou nemocnosti a úmrtnosti v industriální společnosti. Trombóza je nejen rozhodující příčinou aterotrombotických nemocí, jako je infarkt myokardu, mozková mrtvice či kritická končetinová ischémie, ale uvolněný trombus v periferním žilním řečišti či v srdečních síních je podkladem obávané plicní nebo systémové embolie. Trombotické komplikace se týkají každého z nás. Každoročně způsobují jedno úmrtí na plicní embolii, 2–4 úmrtí na mozkovou příhodu a asi 5 úmrtí na infarkt myokardu na 1000 obyvatel. Riziko trombózy dramaticky stoupá s věkem. Příčin tohoto vzestupu je více: stoupá prevalence aterosklerotického postižení tepenného řečiště, při inaktivitě či při fibrilaci síní se objevuje stáza krve, negativně se uplatňují též hormonální změny, imobilizace či nádorové onemocnění vedou k hyperkoagulačnímu stavu. Všichni víme, že naše populace výrazně stárne a riziko výskytu trombotických komplikací stále roste. Také proto je účinná antitrombotická léčba tolik důležitá. Jednou z perspektivních možností, jak lépe předcházet trombotickým příhodám, je kombinace různých léčebných postupů. Kombinace je sice lákavá, vždy si však musíme uvědomit, že na jedné straně nás vábí nymfa Scylla účinnější prevencí trombotické příhody, na straně druhé je otevřený chřtán Charybdy v podobě život ohrožujícího krvácení. Proplout zrádnými vodami by měl pomoci tento přehled.
Hemostáza, aterogeneze a zánět
Hemostáza je jedním ze základních fyzio-logických procesů, které umožňují vyšší formy života. Zajištění integrity cév je ne-opominutelnou podmínkou cirkulace krve. Proto tento systém vznikal již v časných fázích evoluce – před 1,5 miliardou let, tj. v době, kdy primitivní obratlovci s vyvíjejícím se krevním oběhem potřebovali k přežití funkční mechanismus zabraňující ztrátě krve při poškození cév. Hemostatický systém se vyvíjel ze společného základu se systémem imunitním. Není proto náhodné, že buněčné elementy i enzymatické kaskády hemostatických i imunitních procesů jsou často shodné a působí v souhře. Příkladem takovéto synergie může být důležitý systém kontrolující jak zánětlivé děje, tak hemostázu – komplex CD40-CD40L. Zatímco transmembránový protein CD40 (z rodiny tumor necrosis factor – TNF) je exprimován na povrchu endotelií, buněk hladké svaloviny či makrofágů, je ligand CD40L syntetizován a uvolněn do plazmy či tkání aktivovanými trombocyty a T-lymfocyty. Vzájemná interakce receptoru s ligandem spouští zánětlivou kaskádu reprezentovanou zejména produkcí vazoadhezivních molekul a následnou akumulací leukocytů v cévní stěně. Současně kontakt CD40-CD40L na povrchu endotelií vede k nadprodukci tkáňového faktoru, a tak zvyšuje trombogenicitu. Podobně vazba CD40 s CD40L v makrofágu stimuluje uvolnění metaloproteináz rozrušujících kryt případného aterosklerotického plátu. V trombocytu se naopak ligand CD40L váže na receptory GP IIb/IIIa, a stabilizuje tak vlastní trombus. Takovýchto „duálních" systémů bychom našli mnoho, stačí jen připomenout prostanoidy, leukotrieny či systém RANTES. Pro klinika má znalost těchto pochodů praktický význam: antagonisté receptorů ADP typu clopidogrelu například úspěšně inhibují expresi CD40L a vedle protidestičkové aktivity tak mohou ovlivnit i zánětlivé pochody v cévní stěně. Podobné antikoagulační a protizánětlivé působení má heparin či protidestičkový a antiflogistický efekt mají některá analgetika, zejména kyselina acetylsalicylová. Málo je též známo, že antagonista receptorů IIb/IIIa abciximab vedle toho, že brzdí agregaci trombocytů, též cestou inhibice vitronectinu tlumí odpověď buněčných elementů účastnících se zánětu (makrofágy i buňky hladké svaloviny) na stimulaci zánětlivými cytokiny, zejm. interferonem g [1–3]. V místě aterosklerotického plátu tak například tlumí též nežádoucí zánětlivou reakci. Z tohoto pohledu můžeme považovat řadu našich léčebných postupů užívaných v léčbě trombogenních stavů za duální terapii – antitrombotickou i protizánětlivou/antiaterogenní.
Prolínání destičkové hemostázy a hemokoagulace
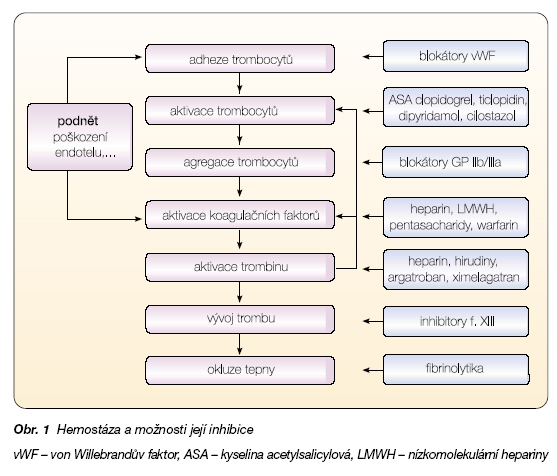
Cílem tohoto přehledu je ozřejmit kombinační přístup k léčbě aterotrombotických a tromboembolických příhod. Vlastní hemostáza má několik funkčních rovin: antitrombotickou roli intaktního endotelu, destičkovou hemostázu, koagulační kaskádu ústící v polymerizaci fibrinogenu a fibrinolýzu (obr. 1).
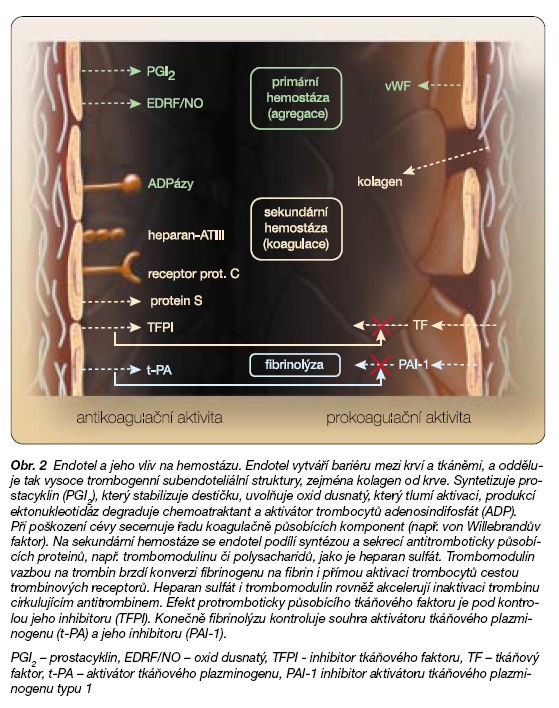
Funkční endotel inhibuje aktivaci trombocytů (např. uvolněním NO a prostacyklinu), koagulační kaskádu (např. sekrecí trombomodulinu, heparan sulfátu či inhibitoru tkáňového faktoru – TFPI) i stimuluje fibrinolýzu (tvorbou aktivátoru tkáňového plazminogenu – t-PA) (obr. 2).
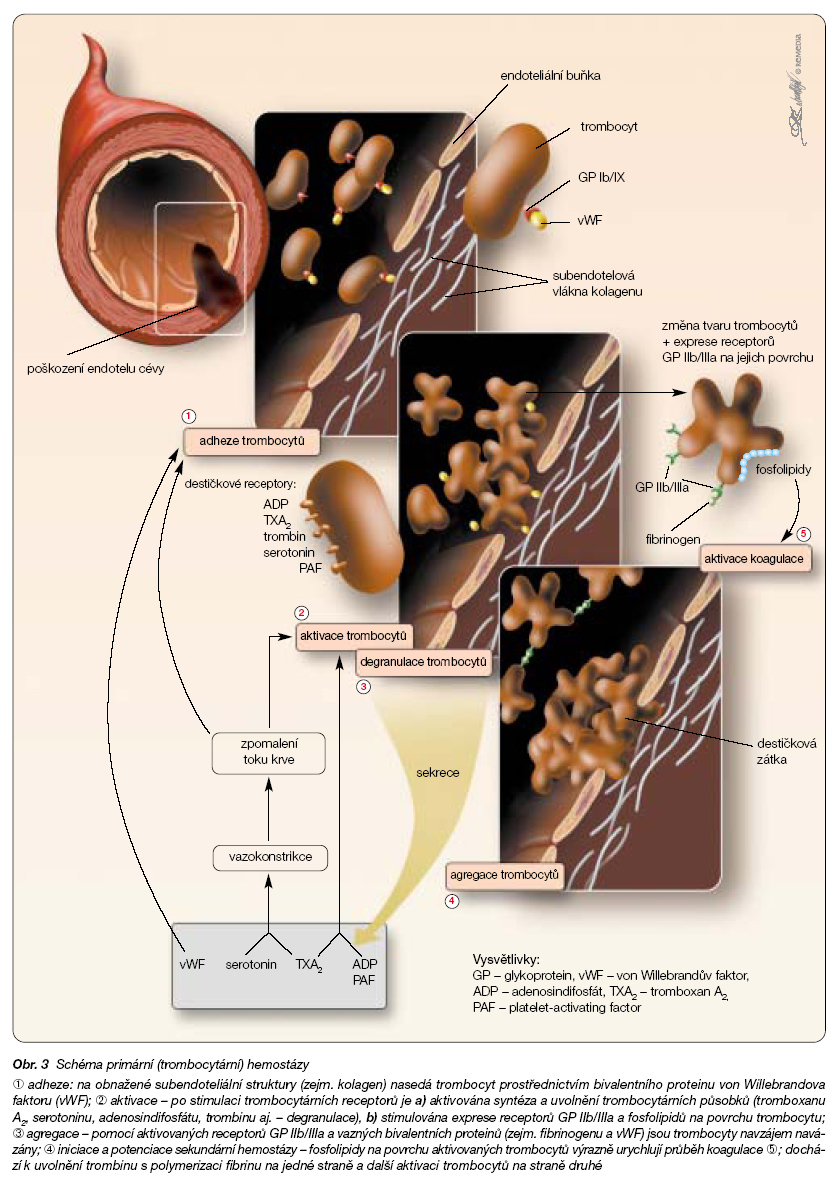
Destičková zátka vzniká všude tam, kde dojde k odhalení subendoteliálních struktur a dojde k navázání trombocytárních receptorů pomocí adhezivních receptorů na kolagenní vlákna. Vedle aktivace trombocytů a sekrece řady protrombotických substancí má klíčovou roli ve vývoji destičkového trombu vzájemná vazba trom-bocytů pomocí receptorů IIb/IIIa a adhezivních proteinů, zejména fibrinogenu. Zajímavé je, že vazba na kolagen i na fibrinogen je si velmi blízká, jak kolagen, tak fibrinogen překvapivě mají obdobnou strukturu, oba se totiž vyvíjely ze stejného primitivního výchozího proteinu. Vznik primárního destičkového trombu akceleruje souběžně aktivovanou koagulační kaskádu, protože na povrchu aktivované destičky dojde k exprimaci fosfolipidů katalyzujících koagulaci a urychlujících celý proces až o dva řády.
Primárním podnětem koagulace je uvolnění tkáňového faktoru (TF) z hlubších struktur cévní stěny, tj. z adventicie. Proto také hlubší léze, například ruptura plátu, je provázena aktivací sekundární hemostázy, a naopak povrchní cévní poškození, například eroze plátu, indukuje především hemostázu primární. Tkáňový faktor je uvolněn z rezidenčních monocytů/makrofágů i buněk hladké svaloviny. I zde se prolíná zánět s hemostázou: zánětlivý protein akutní fáze – CRP – je totiž mohutným stimulátorem uvolnění TF. Vytvoření prvotního protrombinového komplexu TF/f.VIIa/f.Xa generuje malé množství trombinu, díky němuž se vlastní kaskáda rozběhne. Výsledkem této amplifikační fáze je dostatečná nabídka aktivního trombinu katalyzujícího vývoj polymerové fibrinové sítě, která trombus stabilizuje. Paralelně uvolněný trombin aktivuje trombocyty a urych-luje destičkovou fázi hemostázy [1].
Jak je patrné z tohoto velmi zkráceného popisu, jsou jednotlivé kroky úzce vzájemně propojeny, na většině úrovní existují alternativní kroky. Zablokování jednoho místa proto nemusí mít dostatečný léčebný efekt. Tak například k aktivaci trombocytů po inhibici daného např. tromboxanového receptoru zbývají k iniciaci primární hemostázy funkční receptory trombinové, ADP či serotoninové (obr. 3).
Situace je dále komplikována skutečností, že většina trombocytárních glykoproteinových receptorů (např. Ib, Ia/IIa, GP1ba či IIb/IIIa) je polymorfních. Populace je tak mozaikou lidí s různě namíchanými hyper- i hypofunkčními receptory. Proto i terapeutická odpověď na protidestičkové léky je interindividuálně variabilní. Podobně známe alternativní cesty amplifikace koagulační kaskády včetně polymorfismu na úrovni pro- i antikoagulačních systémů. Většinu funkčně významných polymorfismů jsme sice schopni v individuálních případech stanovit, avšak limitující překážkou je naše neschopnost výslednou mixáž polymorfismů správně interpretovat. Chceme-li u trombofilních stavů spolehlivě léčebně zasáhnout, je logické, že optimálním postupem bude kombinovat antitrombotika jak na úrovni protidestičkových léčiv (s různým mechanismem účinku), tak kombinovat protidestičkové léky s antikoagulancii.
Kombinační léčba na úrovni inhibice primární (trombocytární) hemostázy
Již od zavedení protidestičkových léků k prevenci aterotrobotických příhod vidíme prvé snahy o kombinaci. Pravděpodobně první studie byly provedeny s kombinací acetylsalicylové kyseliny (ASA) a dipyridamolu. Dnes je užíván dipyridamol s ASA v profylaxi recidivy mozkové příhody. Později, se zavedením thienopyridinových blokátorů receptorů pro ADP, byla ukázána prospěšnost kombinace clopidogrelu s ASA. Tato léčba je dnes považována u akutních a subakutních koronárních příhod za zlatý standard.
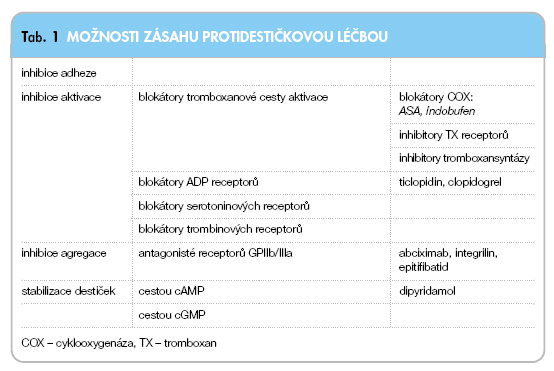
Jaké je teoretické zázemí kombinační léčby protidestičkovými léky? Protidestičkové léky mohou působit na různých etážích, tj. inhibují adhezi, aktivaci či agregaci (tab. 1).
Ovlivnění účinku na různých etážích užíváme například u kombinace ASA s dipyridamolem, kdy acetylsalicylová kyselina ireverzibilně inhibuje cyklooxygenázu, a utlumí tak syntézu důležitého aktivátoru destiček – tromboxanu A2 (TXA2). Dipyridamol naopak reverzibilně inhibuje destičkovou fosfodiesterázu, která degraduje cyklický adenosinmonofosfát (cAMP) a cyklický guanosinmonofosfát (cGMP), dva důležité „druhé posly" stabilizující trombocyt. Podobně je racionální například kombinace ASA či clopidogrelu s inhibitory destičkových receptorů GP IIb/IIIa, které tlumí primární hemostázu ve fázi agregace. Zde blokátory aktivace destiček zabrání nežádoucímu uvolnění destičkových proagregačních a vazokonstrikčních působků a antagonisté GP IIb/IIIa účinněji zamezí agregaci trombocytů aktivovaných jinými receptory.
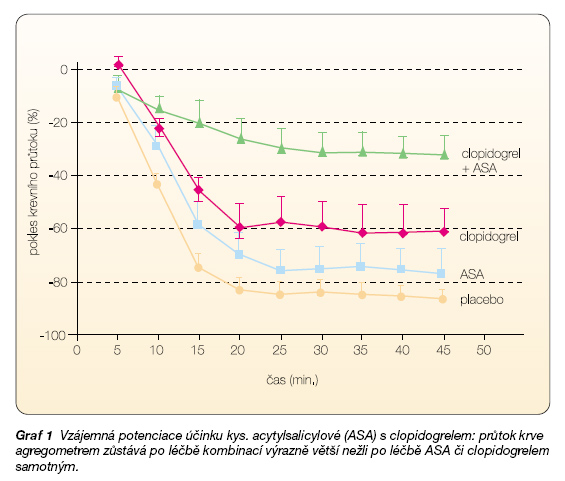
Kombinace protidestičkových léků může být účinná také na úrovni samotné aktivace. Jedním předpokladem pro kombinaci je vzájemná potenciace účinku, tak jak byla ukázána experimentálně pro ASA a clopidogrel. Ireverzibilní inhibitor destičkových adenozinových receptorů P2Y12 – clopidogrel – blokuje aktivaci trombocytů po uvolnění adenozinu (ADP). Efekt není pouze aditivní, ale dochází k jeho násobení (graf 1).
Druhým důvodem pro kombinaci je skutečnost, že jak při léčbě ASA, tak při léčbě clopidogrelem je významné procento nemocných k protidestičkovému působení rezistentních (5–20 %) či reagujících na běžné dávky suboptimálně [4]. Bohužel řada nemocných s rezistencí na ASA je též rezistentních k působení clopidogrelu, pro tyto nemocné je pak řešením kombinace s antikoagulanciem [5]. Testování této geneticky podmíněné snížené terapeutické odpovědi je dostupné, ale v praxi málo prováděné. Proto bývá prvním projevem rezistence na ASA či clopidogrel selhání terapeutického efektu, tedy objevuje se koronární či mozková příhoda. Současné podání léku s jiným mechanismem účinku zásadním způsobem potlačí riziko klinických důsledků rezistence.
Co nám o kombinaci protidestičkových léků říká medicína založená na důkazech? Nejvíce dokladů o efektu máme pro současné podávání ASA s clopidogrelem, event. s ticlopidinem. Tato kombinace je logická, oba léky interferují s aktivací trombocytů na různých místech, a tak působí vzájemně se doplňujícím způsobem. Obdobně máme řadu důkazů o výhodnosti kombinace antagonistů receptorů GP IIb/IIIa s ASA a clopidogrelem či ticlopidinem u akutních koronárních syndromů a při intervenčních zákrocích v koronárním řečišti. Daleko méně informací máme o současném podávání ASA s dipyridamolem, z dnešního pohledu náročnějším kritériím vyhovuje pouze evropská studie ESPS2 u nemocných po mozkové příhodě.
Kombinační léčba u akutních koronárních syndromů a u intervencí v koronárním řečišti
U akutních koronárních syndromů hraje primární (destičková) hemostáza rozhodující úlohu. Není proto překvapením, že se v této indikaci osvědčila řada protidestičkových postupů, příkladem mohou být desítky studií s ASA či s clopidogrelem, kdy byly přípravky užity v monoterapii. Dále máme k dispozici i menší studie svědčící pro efekt ostatních, méně užívaných léčiv inhibujících aktivaci či agregaci trombocytů, např. ticlopidinu (STAMI), tri-flusalu (TIM) nebo antagonistů receptorů GP IIb/IIIa (INTRO AMI aj.) [6, 7].
Vzhledem k tématu článku se zaměříme na kombinační léčbu. Máme výsledky řady klinických studií svědčících o racionálnosti současného podávání ASA s clopidogrelem. Nejvýznamnější je všeobecně známá studie CURE, která prověřovala efekt samotné ASA proti její kombinaci s clopidogrelem [6–7]. Zařazeni byli nemocní s akutními koronárními příhodami bez elevace úseku ST, tj. typu NSTEMI (nestabilní angina a non-Q infarkt myokardu) první rok po příhodě. Studie dokumentovala významný pokles primárního ukazatele při kombinaci (souhrn kardiovaskulární mortality, infarktu myokardu a iktu) o relativních 20 %, absolutní pokles byl 2,1 % (9,3 % vs 11,4 %). Největší efekt byl pozorován v prvních měsících po příhodě. Výskyt zá-važnějšího krvácení při kombinaci bohužel stoupl z 2,7 % na 3,7 %, tj. o 1 %. Při analýze období, kdy bylo podání clopidogrelu nejúspěšnější, se ukázalo, že maximálního dopadu na pokles mortality, infarktu či iktu bylo dosaženo již v prvních hodinách léčby; tento kombinovaný ukazatel již po 24 hodinách poklesl o třetinu, tj. z 2,1 % při podávání samotné ASA na 1,4 % při léčbě kombinací ASA s clopidogrelem.
Pro naši populaci, kde je většina nemocných s koronární příhodou léčena přímou koronární intervencí, je důležitější výsledek studie PCI-CURE [6–7]. Též u nemocných, u nichž byla provedena koronární intervence angioplastikou a k základní léčbě ASA byl přidán clopidogrel, klesl primární ukazatel účinku (kardiovaskulární úmrtí či infarkt myokardu) o 34 %, tj. byl zaznamenán pokles z 4,4 % na 2,9 %. Tento rozdíl dále při pokračování výrazněji nestoupal a na konci studie (v průměru po 8 měsících) se udržoval na absolutních 2 %. Samotná kardiovaskulární úmrtnost klesla nevýznamně. I tato podstudie ukázala, že kombinace ASA s clopidogrelem snižuje zejména výskyt infarktu myokardu, maximálního efektu je dosaženo v prvním měsíci po intervenci. Studie PCI-CURE má omezenou platnost, nedává totiž odpověď na přínos kombinované protidestičkové léčby u nemocných s implantací koronárního stentu. Z etických důvodů byla totiž tato podskupina léčena automaticky též clopidogrelem.
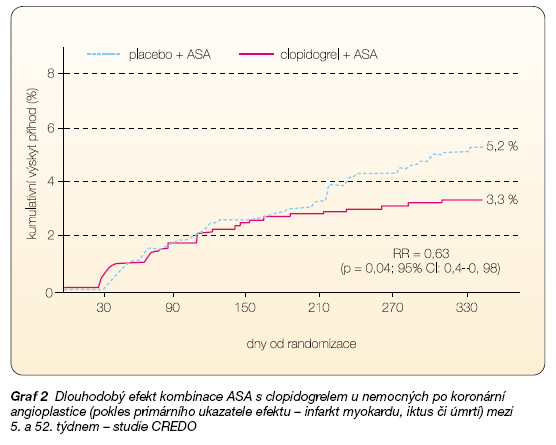
Abychom se přiblížili skutečné klinické praxi, byla navržena studie CREDO [6, 7]. Ta měla odpovědět na otázku, zda prodloužení léčby clopidogrelem na 12 měsíců sníží riziko úmrtí či závažné kardiovas-kulární příhody. V této zaslepené studii byli první měsíc po koronární angioplastice léčeni všichni nemocní kombinací ASA + clopidogrel, poté randomizovaně byla jedna část nemocných léčena pouze ASA, druhá pokračovala v léčbě původní kombinací. Prolongace kombinované léčby na rok vedla k vysoce významnému snížení výskytu kombinovaného ukazatele (úmrtí, infarkt myokardu či iktus) z 5,2 % na 3,3 %, tj. došlo k poklesu o 37 % (graf 2).
Pokles byl dán zejména snížením výskytu infarktu myokardu (z 2,8 % na 1,7 %), mortalita klesla pouze málo významně (z 1,9 % na 1,7 %). Riziko významné krvácivé příhody očekávaně stouplo asi o třetinu (z 3,1 % na 4,1 %).
Pozorování studie CREDO potvrdila také méně známá studie u čtyř tisíc nemocných po implantaci koronárního stentu – pacientů vybraných z databáze Duke Information System for Cardiovascular Care (DISCC) [8]. Předností této studie je, že odpovídá skutečné klinické praxi – pacienti nebyli selektováni a jejich rizikové skóre bylo významně vyšší. Též v této studii byli nemocní po měsíci kombinační léčby randomizováni do větve dále rok pokračující v léčbě ASA s clopidogrelem a do větve léčené pouze ASA. Prodloužení kombinační léčby snížilo výskyt infarktu myokardu skoro o polovinu, tj. z 5,8 % klesl na 3,2 %. Při analýze dopadu prolonga-ce léčby na predefinovanou, vysoce rizikovou skupinu nemocných s diabetem či po intervenci na více tepnách byl přínos ještě významnější: v relativních procentech poklesl výskyt infarktu myokardu opět téměř o polovinu, absolutní zisk však byl významně vyšší, rozdíl byl totiž 8,0 % proti 4,5 %, tj. bylo zabráněno 3–4 infarktům na každých 100 léčených! Ekonomická analýza nákladů vynaložených na prevenci jednoho infarktu ukázala, že u této rizikové populace je efektivita trojnásobná (22 tis. USD) proti populaci nízkorizikové (60 tis. USD).
Shrneme-li, pak u nemocných po koronární příhodě vede kombinovaná proti-destičková léčba ASA s clopidogrelem k významnému snížení výskytu kardiovas-kulárních příhod, zejména recidiv infarktu myokardu. Efekt je doložen jak při krátkodobé léčbě v subakutním období příhody, tak i při prodloužení léčby na jeden rok. Z farmakoekonomického pohledu je léčba kombinací ASA s clopidogrelem vysoce atraktivní zejména v akutní a subakutní fázi, nicméně analýzy efektivity pokládají za racionální i prodloužení léčby až na dobu jednoho roku. Dlouhodobý efekt po provedené koronární angioplastice je významným přínosem zejména pro rizikové nemocné, tj. pro diabetiky či po výkonu na více tepnách.
Poslední zajímavou skupinou užívanou do kombinace protidestičkových léků jsou inhibitory destičkových receptorů IIb/IIIa. Jejich doménou je zejména prevence a léčba trombotických komplikací provázejících intervenční výkony v koronárním řečišti či léčba akutních koronárních syndromů. Vzhledem k tomu, že v léčbě akutních forem ICHS je tato skupina z farmakoekonomického hlediska málo výhodná, a není proto u nás v této indikaci samostatně užívána, dotkněme se pouze možnosti kombinační léčby u koronárních intervencí. Již mnoho let je s úspěchem užívána v profylaxi či v léčbě trombotických koronárních komplikací v průběhu intervencí kombinace inhibitorů receptorů GP IIb/IIIa s ASA a s heparinem. V řadě studií (např. ESPRIT, ADMIRAL či TARGET) s parenterálně podávanými inhibitory abciximabem, tirofibanem či s epti-fibatidem byl dokumentován příznivý efekt na pokles výskytu kardiovaskulárních příhod i mortality při léčbě touto velmi účinnou kombinací [6, 7].
Kombinační léčba u nemocných po mozkové příhodě
Řada studií doložila pozitivní efekt protidestičkové léčby acetylsalicylovou kyselinou (např. SALT, UK-TIA, Dutch-TIA), clopidogrelem (CAPRIE), ticlopidinem (CATS, TASS, AAASPS) či triflusalem (TACIP) v prevenci recidivy mozkové příhody [6, 7]. Daleko méně studií se věnovalo kombinační léčbě.
První větší kombinační studie se věnovaly potenciaci účinku ASA dipyridamolem. Nejrozsáhlejší je studie ESPS2, do které bylo zařazeno 6600 nemocných po mozkové příhodě [6]. Ve dvojitě zaslepeném provedení byli nemocní léčeni ASA, dipyridamolem (v retardované podobě), kombinací ASA s dipyridamolem, či ke stávající léčbě bylo přidáno placebo. Ve větvi s kombinací ASA + dipyridamol bylo o pětinu méně závažných kardiovaskulárních příhod oproti léčbě samotnou ASA a o třetinu méně oproti kontrolní skupině. Recidiva mozkové příhody poklesla o 22 %, výskyt infarktu o 5 % a kardiovaskulární mortalita nevýznamně, tj. o 2 %, stoupla. Studie ESPS2 však má jednu závažnou slabinu: užitá dávka 2x denně 25 mg ASA rozhodně není dávkou optimální, dokonce ani není dávkou, která vykazuje doklady o účinku. Pro efekt ASA je důležitá vrcholová koncentrace léku, té však 25 mg ASA nedosahuje. Naopak její podání ve dvou denních dávkách může déletrvajícím útlumem prostacyklinu efekt snížit. Proto má řada autorů k této studii výhrady. Autoři prestižní Cochrane Review, kteří analyzovali účinek dipyridamolu v metaanalýze několika desítek studií, ve kterých se nepodařilo dojít k pozitivnímu závěru, uzavírají: „Pro nemocné, kteří prodělali cévní příhodu, není dokladu o tom, že by dipyridamol samotný či v kombinaci s jiným protidestičkovým lékem (zejména s ASA) snížil riziko kardiovaskulární mortality, i když snad může snížit riziko recidivy cévní příhody."[9] Definitivní rozhodnutí o dopadu léčby kombinací ASA s dipyridamolem dá pravděpodobně až výsledek nezávislé evrop- sko-australské studie ESPRIT.
Efekt clopidogrelu v indikaci recidivy kardiovaskulárních příhod u nemocných po iktu byl sledován ve studii CAPRIE [6, 7]. V celé kohortě sledovaných nemocných byl efekt srovnatelný s ASA. Pokud však byla vybrána pouze podskupina vysoce rizikových nemocných (tj. s předchozí aterotrombotickou příhodou v jiné lokalizaci), byl významnější efekt clopidogrelu prokazatelný, výskyt příhod klesl proti ASA o relativních 9 %, absolutní výskyt klesl z 6,1 na 5,6 %. Otázku kombinace obou protides-tičkových léků u nemocných po iktu či TIA řeší několik studií. Prvou byla MATCH, kdy byla k bazální léčbě clopidogrelem přidávána ASA [6, 7]. Výskyt závažných cévních příhod sice během 1–2letého sledování nevýznamně klesl (o relativních 6,4 %, absolutní 1 %), ale současně stoupl výskyt závažných krvácivých příhod, který přínos převážil. Pouze při předdefinované analýze účinku v čase se ukázal být větší efekt kombinace v prvních třech měsících léčby, zatímco krvácení se objevovalo až v měsících pozdějších. Na ověření, zda je racionální podávat kombinaci clopidogrel + ASA pouze v prvních třech měsících po mozkové příhodě, bude nutno ještě počkat.
Kombinační léčba u nemocných s vysokým aterotrombotickým rizikem
Populace se zvýšeným rizikem aterotrombotické příhody při kumulaci riziko-vých faktorů či již dokumentovaným aterosklerotickým postižením v koronárním, mozkovém povodí či v periferních tepnách dosud nebyla specificky z hlediska efektu kombinační léčby ASA s clopidogrelem prověřována. Teprve recentně zveřejněná, zatím nejrozsáhlejší aterotrombotická studie CHARISMA přináší odpověď na řadu otázek o tom, jaký je efekt v primární prevenci u rizikových nemocných, zejména u diabetiků, a jaký u chronicky nemocných s aterosklerotickým postižením v různých lokalizacích.
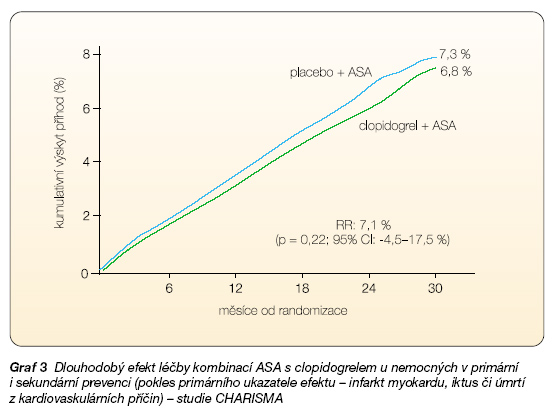
Vzhledem k tomu, že studie CHARISMA byla publikována teprve v březnu 2006, a není proto ještě dostatečně známa, ne-uškodí udat základní charakteristiku [10]. Ve dvojitě zaslepeném uspořádání byl porovnáván efekt 75–162 mg ASA samotné či v kombinaci se 75 mg clopidogrelu. Do studie bylo zařazeno téměř 16 tisíc nemocných: 3 tisíce v rámci primární prevence – zejména pacienti s diabetem, 6 ti-síc s chronickými formami ICHS, 4 tisíce s mozkovou a 3 tisíce s periferní aterosklerózou. Na základě charakteristik se tedy jednalo o zatím nejméně rizikovou populaci – během 2–3 let léčby nepřesáh-la celková mortalita 5 %! Tomuto faktu také odpovídají zjištěné výsledky: v celé kohortě nemocných se kombinovaný ukazatel – kardiovaskulární mortalita, infarkt myokardu či iktus – významně nelišil, při léčbě ASA se objevil v 7,3 %, při léčbě kombinací léků v 6,8 %, relativní rozdíl byl 7,1 % (graf 3).
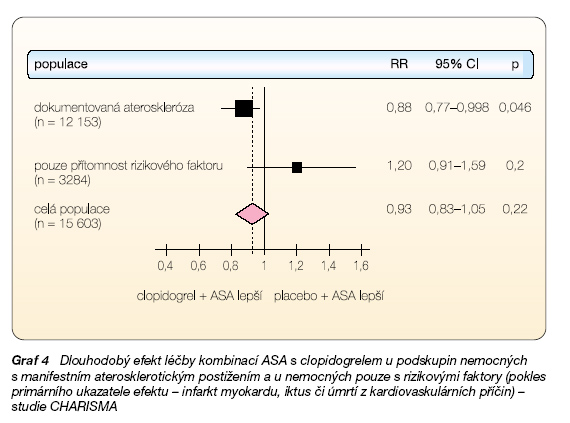
Podobně se nelišily výsledky ani při sledování sekundárních ukazatelů účinku, například mortalita byla v obou skupinách 4,8 %. V podskupinové analýze efektu kombinační léčby se ukázala jediná, předem definovaná podskupina, která z kombinační léčby profitovala. Nemocní se symptomatickým aterosklerotickým postižením měli významný o 12 % nižší výskyt výše zmíněného kombinovaného ukazatele (graf 4).
Závažných, život ohrožujících krvácení bylo ve studii málo, středně významná krvácení se objevila při léčbě ASA v 1,3 %, při kombinaci ve 2,1 %. Shrneme-li předložená data, můžeme konstatovat, že v rámci léčby rizikové populace bez manifestního aterosklerotického postižení je kombinační léčba nevhodná. U nemocných symptomatických s prokázaným cévním postižením snižuje kombinace ASA s clopidogrelem i při dlouho-dobém užití výskyt kardiovaskulárních komplikací, avšak je při zvažování ceny a efektu relativně nákladná. Měla by proto být rezervována pro nemocné s vysokým rizikem trombotické komplikace (např. při anamnéze častějších recidiv příhod či při prokázané rezistenci na jinou protides-tičkovou léčbu).
Kombinační protidestičková léčba u nemocných s fibrilací síní
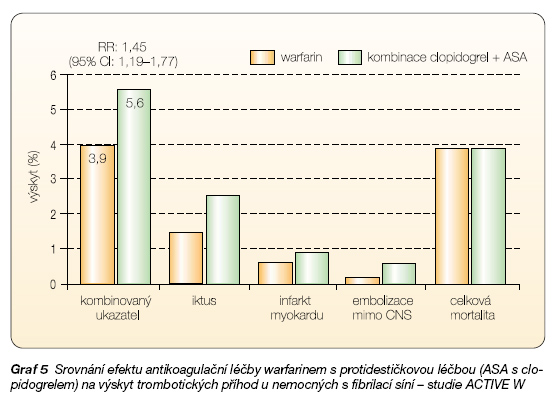
V indikaci prevence tromboembolické příhody, zejména příhody mozkové, dominuje u nemocných s fibrilací síní antiko-agulační terapie. Nicméně řada studií testovala efekt kombinované protidestičkové léčby. Nejreprezentativnější výsledek přináší nedávno předčasně ukončená studie ACTIVE W. V této studii byl porovnáván účinek dlouhodobé antikoagulační léčby warfarinem s léčbou kombinací ASA a clopidogrelu. Ve všech sledovaných ukazatelích byla lege artis prováděná antikoagulace antivitaminem K účinnější: kombinovaný ukazatel (iktus, infarkt myokardu, embolizace mimo CNS či celková mortalita) se objevil při podávání warfarinu v 3,9 % a při podávání kombinace v 5,6 %, tj. antiko-agulace byla o 45 % v profylaxi účinnější (graf 5). Protidestičková léčba, byť potencovaná kombinací, rozhodně není rovnocenná účinkem léčbě antikoagulancii.
Kombinační léčba na úrovni inhibice primární i sekundární hemostázy
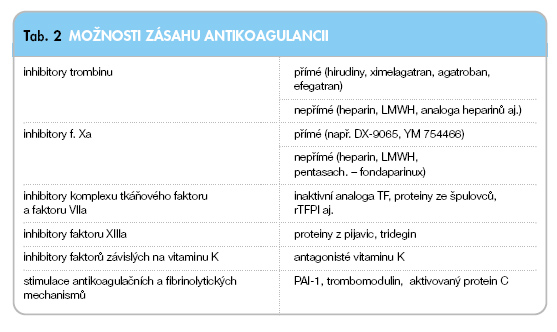
V současné době máme řadu možností, jak zabrzdit sekundární hemostázu, žádná však není ideální. Dostupné přímé i nepřímé inhibitory trombinu či faktoru Xa jsou k dispozici pouze v parenterálně účinných formách (tab. 2).
Jediným perorálním antikoagulans po stažení ximelagatranu je warfarin. Jeho variabilita intra- i interindividuálního efektu je všeobecně známa. Nicméně i při těchto nedostatcích je antiko-agulační léčba významným přínosem v péči o nemocné s trombofilními stavy. Podávání antikoagulancií, ať již nefrakcionovaného či nízkomolekulárního heparinu v kombinaci s protidestičkovými léky, konkrétně s ASA a s clopidogrelem, je dnes již akceptovanou a běžně užívanou léčbou u akutních koronárních příhod. Jejich nepodání při ošetření akutní příhody koronární angio-plastikou by se dalo označit jako postup non lege artis.
V jiných indikacích však jsme s podáváním kombinace antikoagulancia a protidestičkového léku daleko zdrženlivější. Podívejme se, jaká jsou fakta.
Kombinace antikoagulancia a protidestičkové léčby po akutních koronárních příhodách
Dlouhodobá antitrombotická léčba po infarktu myokardu či po jiné akutní koronární příhodě je zpravidla omezena na podávání nižších dávek ASA, v prvém roce po příhodě optimálně na kombinaci ASA s clopidogrelem. Existuje však i alternativa tohoto zavedeného postupu: kombinace antikoagulancia, dnes zpravidla warfarinu, s ASA či s clopidogrelem.
V prvních studiích hodnotících kombinaci warfarin + ASA u nemocných po infarktu myokardu je patrná snaha udržet pod kontrolou riziko krvácení, a proto byl warfarin významně poddávkováván. Tak například ve studiích OASIS-p1, CHAMP či CARS byla podávána nízká fixní dávka 3 mg warfarinu nebo byla nízko postavena cílová hodnota INR [6, 7]. V tomto uspořádání studie, tj. při suboptimální dávce antikoagulancia, se kombinace neukázala být přínosem. Letošní velká metaana-lýza srovnávající studie podle dosažených hodnot INR ukazuje, že v 15 studiích (s 25 tisíci pacienty) s nízkou cílovou hodnotou INR vedla kombinace warfarinu s ASA pouze k 4% poklesu kardiovaskulárních příhod proti samotné ASA [11]. Nízká dávka warfarinu, byť v kombinaci s ASA, není účinná!
Teprve v další fázi byly testovány „optimální" dávky warfarinu v kombinaci s „optimální" dávkou ASA (80–325 mg denně). Opět máme velmi kvalitní metaanalýzu z loňského roku [12]. Autoři získali k zajištění homogenity dat i nepublikované výsledky z primárních center. Navíc byly vynechány klinické studie s nízkou spoluprací nemocných (např. z programu OASIS nebyly zařazeny výsledky ze zemí s menší než 70% compliance), studie s dosaženým INR pod 2 a studie zařazující nemocné s diagnózami s výhodnějším způsobem léčby (např. stavy po PTCA s implantací stentu). Celkem bylo do analýzy zařazeno 6 tisíc nemocných po překonaném infarktu myokardu či po jiné akutní koronární příhodě sledovaných déle než rok a celkem analyzováno více než 11 tisíc tzv. pacientoroků. Výsledky léčby byly hodnoceny do ukončení studie, nejdříve po 3 měsících, nejdéle po 4 letech, nejčastěji po roce.
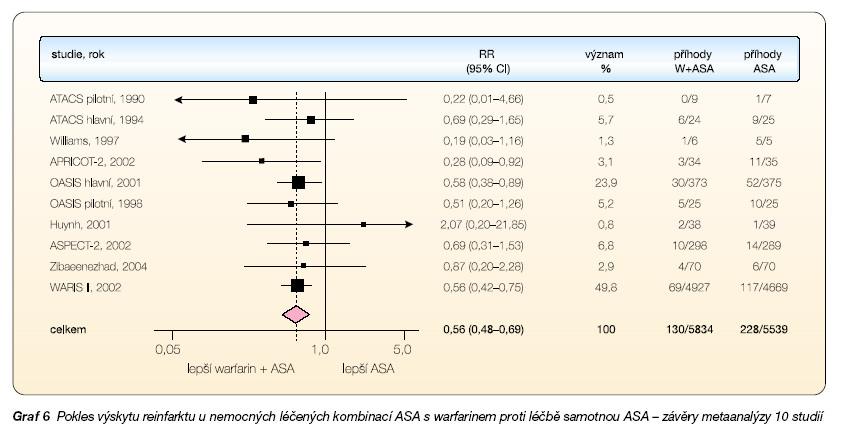
Prvým hodnoceným parametrem byla recidiva infarktu myokardu. Snížení výskytu reinfarktu bylo klinicky i statisticky výrazně významné, pokles činil 44 %, v absolutních procentech byla diference 2,2 % vs 4,1 % (graf 6).
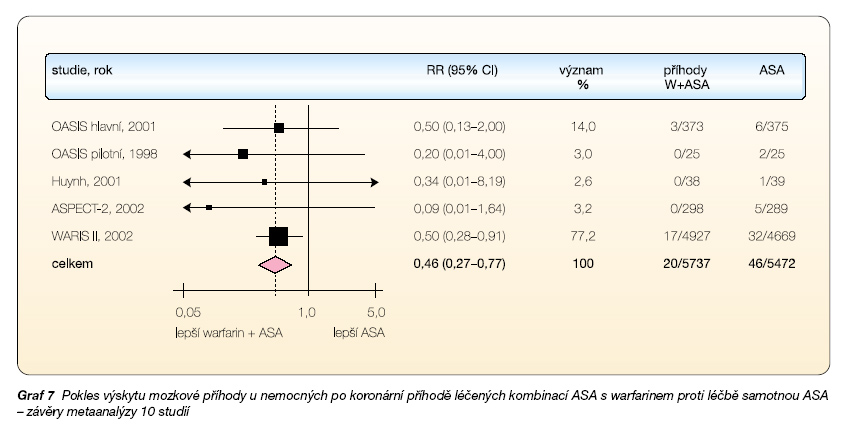
Dvě studie – WARIS II s poklesem o 44 % a OASIS-main s poklesem o 42 % – byly natolik silné, že každá samostatně prokázala významnost kombinační léčby [6, 7]. Efekt, tedy další divergenci křivek, bylo možno v dlouhodobých studiích dokumentovat po celou dobu sledování. Druhým ukazatelem byl výskyt mozkových příhod. I zde byla prokázána výhodnost kombinace warfarin + ASA, celkový pokles iktů byl 54 %, opět v absolutních procentech 0,4 % vs 0,8 % (graf 7). Při hodnocení snížení mortality byl ve warfarinové větvi pozorován pouze nevýznamný pokles o 4 % (2,6 % vs 2,7 %). Celkem tedy při kombinaci warfarinu s ASA proti samotné ASA poklesl sledovaný ukazatel (mortalita, IM, iktus) z 7,6 % na 5,2 %, tedy o 32 %. Výsledek jistě přesvědčivý!
Podívejme se však i na rub problému, tedy na riziko krvácení. To bylo obecně častější v prvých třech měsících, tj. v době zavádění antikoagulační léčby, u lidí starších a u nemocných s komorbiditami. Ve warfarinové větvi se objevilo klinicky významné krvácení v 1,5 %, ve větvi se samotnou ASA v 0,6 %. Budeme-li hodnotit celkový efekt léčby kombinace warfarin s ASA proti ASA, bude účelné sečíst přínos a ztrátu na každé straně, tj. od poklesu mortality/morbidity odečíst krvácení. Čistý netto efekt kombinované léčby je tedy 6,7 % proti 8,2 % při léčbě ASA neboli pokles kombinace: mortalita, infarkt, iktus a významné krvácení o 18 %. Z pohledu Evidence Based Medicine je tedy kombinace ASA s warfarinem u rizikových nemocných po koronární příhodě postupem racionálním.
Budeme-li se ptát, proč se kombinace ASA s warfarinem nerozšířila, pak jedním z hlavních důvodů je obava každého z nás z porušení příkazu „nihil nocere". Dospěje-li nemocný k recidivě infarktu myokardu, pak se spíše jedná o přirozený průběh choroby, naopak objeví-li se krvácení po léku, pak je „na vině" lékař. Na druhé straně nezvážit kombinaci ASA a warfarinu u nemocného s vysokým rizikem recidivy aterotrombotické příhody při nízkém riziku krvácení může vést k nepřímému poškození nemocného z pohledu nevyčerpání všech léčebných možností. Navíc naše dnešní schopnost farmakogenetického testování a určení typu metabolismu warfarinu (polymorfismem CYP2C9) a schůdnost domácího monitorování INR ještě více sníží již tak nízké absolutní riziko krvácení. Druhým důvodem, proč si lékaři neosvojili tento léčebný postup, je určitá nechuť k neustálému sledování intenzity antiko-agulace. Averze je jistě i na straně pacienta. Je přece pohodlnější vzít svou tabletu, než chodit pravidelně na kontroly INR.
O správnosti cesty kombinace anti-trombotik z protidestičkové řady s antikoagulancii v sekundární prevenci máme ještě druhý, i když dnes již neaktuální příklad. Neaktuální proto, že velmi nadějný přímý inhibitor trombinu ximelagatran byl počátkem letošního roku stažen z používání. Nicméně ve studii ESTEEM byl porovnáván efekt kombinace ASA s ximelagatranem proti samotné ASA u nemocných s recentním infarktem myokardu [6, 7]. Také zde snížil ximelagatran kombinovaný ukazatel (úmrtí či akutní koronární příhoda) z 16,3 % na 12,7 %, tedy pokles o 24 %. I v této studii se zdvojnásobil výskyt významného krvácení (1,8 % proti 0,9 %). Závěry této studie podporují trend ke kombinaci protidestičkové léčby s antikoagulanciem u osob s vysokým rizikem aterotrombotické příhody.
Kombinace antikoagulancia a protidestičkové léčby při akutních koronárních příhodách
Vzhledem k tomu, že u akutních koronárních příhod hraje rozhodující úlohu aktivace primární a později sekundární hemostázy, není divu, že v této oblasti je kombinační léčba již dlouhodobě etablována. Lékem prvé volby z oblasti protides-tičkové terapie je ASA, optimálně v kombinaci s clopidogrelem nebo inhibitory receptorů GP IIb/IIIa. Antikoagulační léčbu volíme v první fázi parenterálně aplikovanou – nefrakcionovaný či nízkomolekulární heparin, později přecházíme na warfarin. Alternativou heparinů, která se však zatím pro vysoké náklady neujala, mohou být v budoucnosti hirudiny.
Efekt kombinované léčby clopidogrelem s ASA a heparinem u nemocných s akutním infarktem myokardu byl doložen ve studii CLARITY [6, 7]. Zde přidání clopidogrelu k základní léčbě ASA s heparinem snížilo riziko reokluze trombolýzou zprůchodněné tepny, infarktu či úmrtí o 20 %. Doporučené postupy preferují podání ASA, clopidogrelu a nefrakcionovaného či frakcionovaného heparinu již v prehospitalizační fázi infarktu myokardu.
S inhibitory receptorů GP IIb/IIIa je situace složitější. I když máme plejádu studií (např. ADMIRAL, EPIC, EPILOG, EPISTENT, CAPTURE, PRISM, RESTORE či IMPACT II) s inhibitory receptorů GP IIb/IIIa – abciximabem, tirofibanem či eptifibatidem v kombinaci s různými antikoagulancii, které dokumentovaly efekt léčby, není tento léčebný postup rozšířen [6, 7]. Důvodem je srovnatelná účinnost s méně nákladnými inhibitory aktivace trombocytů. Nicméně skupina inhibitorů GP IIb/IIIa ještě zdaleka neřekla své poslední slovo. Ve vývoji je další, již třetí generace perorálně účinných léků.
Závěr
Lze říci, že vývoj spěje ke kombinační léčbě i v oblasti antitrombotik. V řadě indikací, např. v časném období po překonaném infarktu myokardu, již zdomácněla kombinace ASA s clopidogrelem. V akutním stadiu koronárních příhod s výhodou již léta podáváme kombinaci protidestičkových léků s antikoagulancii. Větší rozšíření v nejbližších letech lze očekávat v oblasti kombinace protidestičkových léků s warfarinem u mladších nemocných s vysokým rizikem recidivy aterotrombotické příhody po infarktu myokardu. V dohledné době se jistě objeví výhodnější perorální antikoagulans, které nahradí problematický warfarin. Pak by již kombinaci protides-tičkových léků s dlouhodobou antikoagulační léčbou nemělo nic stát v cestě. Doufejme, že brzy zdomácní duální či triální léčba, obdobně jako je tomu v léčbě hypertenze a jak se prosazuje i v léčbě dyslipidémie.
Seznam použité literatury
- [1] Colman RW, Hirsh J, Marder VJ, et al. Hemostasis and thrombosis, Lippincott Williams and Wilkins, 2001.
- [2] Heeschen C, Dimmeler S, Hamm CW, et al. Soluble CD40 ligand in acute coronary syndromes. N Engl J Med 2003; 348: 1104–1111.
- [3] Gawaz M. Blood platelets. Stutgart, Georg Thie-me Verlag, 2001.
- [4] Ivandic BT, et al. Determination of Clopidogrel Resistance by Whole Blood Platelet Aggregometry and Inhibitors of the P2Y12 Receptor. Clin Chem 2006; 52: 383–388.
- [5] Lev EI, et al. Aspirin and clopidogrel drug re-sponse in patients undergoing percutaneous coronary intervention: the role of dual drug resistance. J Am Coll Cardiol 2006; 47: 27–33.
- [6] What is what, Sweden 2004; přehled klinických studií.
- [7] Kloner RA, et al. Cardiovascular Trials Review, USA.
- [8] Cowper PA, et al. Economic effects of prolonged clopidogrel therapy after percutaneous coronary intervention. J Am Coll Cardiol 2005; 45: 369–376.
- [9] De Schryver EL, et al. Cochrane review: dipyridamole for preventing major vascular events in patients with vascular disease. Stroke. 2003; 34: 2072–2080.
- [10] Bhatt DL, et al. A global view of atherothrombosis: baseline characteristics in the Clopidogrel for High Atherothrombotic Risk and Ischemic Stabilization, Management, and Avoidance (CHARISMA) trial. Am Heart J 2005; 150: 401.
- [11] Andreotti F, et al. Aspirin plus warfarin compared to aspirin alone after acute coronary syndromes: an updated and comprehensive meta-analysis of 25,307 patients. Eur Heart J 2006; 27: 519–526.
- [12] Rothberg MB, et al. Warfarin plus aspirin after myocardial infarction or the acute coronary syndrome: meta-analysis with estimates of risk and benefit. Ann Intern Med 2005; 143: 241–250.