Kombinační léčba srdečního selhání
Chronické srdeční selhání je dnes nazýváno epidemií 21. století a přes velký rozvoj farmakologické i nefarmakologické léčby je stále spojeno s velmi špatnou prognózou. Základem farmakoterapie systolického srdečního selhání je kombinovaná blokáda systému renin-angiotenzin-aldosteron (RAAS) pomocí inhibitorů ACE a/nebo blokátorů angiotenzinu II na AT1 receptoru a blokáda sympatického systému pomocí B-blokátorů. K této kombinaci přidáváme blokátory aldosteronu. U diastolického srdečního selhání je základem léčby kontrola krevního tlaku, srdečního rytmu a tepové frekvence, proto jsou na prvním místě B-blokátory, ke kterým látky blokující RAAS přidáváme. U všech léčiv začínáme podáváním nízkých dávek, které postupně titrujeme do dávek pacientem nejlépe tolerovaných, pouze při léčbě blokátory aldosteronu zůstáváme na počátečních nízkých dávkách. Nadále nejasné zůstává postavení antiagregační, antikoagulační a hypolipidemické léčby. Digoxin podáváme nemocným s fibrilací síní.
Chronické srdeční selhání (CHSS) se v evropských zemích vyskytuje u 0,4–2 % populace s výrazným nárůstem ve vyšších věkových skupinách. Na základě výsledků průzkumu EUROHEART Survey je pro východní Evropu udávána prevalence 1,3 % [1]. Zlepšená léčba akutních stavů (hlavně akutního infarktu myokardu) umožňuje, aby více nemocných dospělo do chronického srdečního selhání. Onemocnění má špatnou prognózu, diagnostika i léčba jsou náročné, a to nejen medicínsky, ale i ekonomicky.
Přístup k nemocnému se srdeční insuficiencí se během posledního desetiletí výrazně změnil. Současná terapie je zaměřena nejen na ovlivnění symptomů, ale především na ovlivnění výskytu a progrese srdečního selhání a na snížení úmrtnosti. O zlepšení a prodloužení života se snaží neustále se vylepšující farmakoterapie společně s velmi rychle postupující nefarmakologickou léčbou, především resynchronizační terapií a implantabilními kardio-vertery.
Nejčastější příčinou chronického srdečního selhání u nás je ischemická choroba srdeční (ICHS), často ve spojení s hypertenzí, a to obzvláště ve vyšším věku. Na druhém místě stojí dilatační kardiomyo-patie, ostatní choroby jsou méně časté. Srdeční selhání je syndromem a je třeba vždy stanovit základní diagnózu, která k tomuto stavu vedla. Pokud není možná léčba kauzální – revaskularizace u ICHS a korekce vady u chlopenních vad – jsou základní principy léčby stejné, bez ohledu na etiologii, a liší se spíše podle tíže onemocnění (diastolické vs systolické selhání, akutní vs chronické selhání) a podle doprovodné doporučované medikace (antiagregace, statiny atd.) [2–5].
Základem léčby chronického srdečního selhání, lehkého i těžkého, je blokáda systému renin-angiotenzin-aldosteron (RAAS) a systému sympatického.
Tohoto dosahujeme 4 skupinami léčiv:
– ihibitory ACE
– blokátory angiotenzinu II (ARB )
– blokátory aldosteronu
– b-blokátory.
Inhibitory angiotenzin-konvertujícího enzymu
Inhibitory ACE nepochybně představují největší pokrok v léčbě chronického srdečního selhání v posledním desetiletí [6]. Jsou dnes při chronickém srdečním selhání i při asymptomatické systolické dysfunkci levé komory léky první volby. Pro málokterou skupinu léčiv existují tak jednoznačné a přesvědčivé důkazy prospěšnosti jako pro inhibitory ACE v léčbě srdečního selhání. Metaanalýza klinických studií ukázala, že průměrný pokles mortality je o 23 % a průměrný pokles součtu mortality a morbidity (vyjádřené počtem hospitalizací) dokonce o 35 %. Vyjádříme-li to jinak, pak léčením 1000 nemocných se srdečním selháním inhibitory ACE po dobu jednoho roku se zabrání 13 úmrtím, 65 hospitalizacím pro zhoršení srdečního selhání a 99 hospitalizacím z jakéhokoliv důvodu.
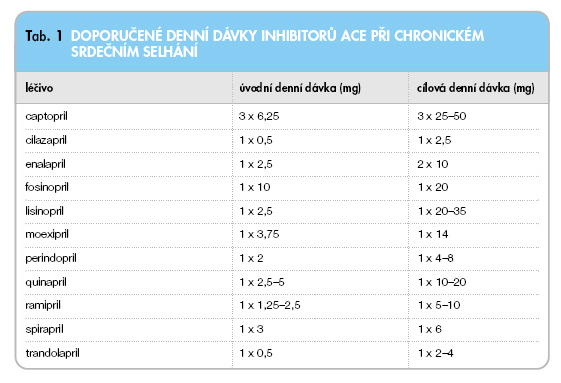
Na našem trhu je k dispozici řada inhibitorů ACE lišících se především farmakokinetickými vlastnostmi. Tak např. capto-pril má krátkodobý účinek a je ho třeba podávat 3x denně, enalapril se podává 2x denně, ostatní se podávají pouze 1x denně. Rozdíly v jejich účincích a ve výskytu nežádoucích účinků jsou však nepodstatné. Vzhledem k individuální hypotenzní odpovědi nemocných a možnému zhoršení renálních funkcí (zejména u starších nemocných s preexistující chronickou renální insuficiencí) je nutné léčbu zahajovat malou, tzv. testovací dávkou a dávku postupně zvyšovat až do maximální tolerované. Přehled u nás dostupných inhibitorů ACE a jejich doporučené dávkování při chronickém srdečním selhání jsou uvedeny v tab. 1.
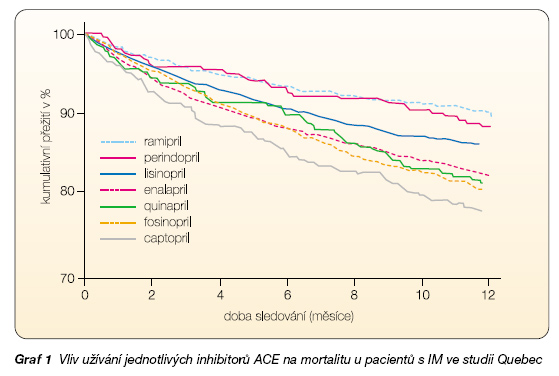
Doporučujeme podávat ty inhibitory ACE, které se dávkují 1krát denně a mají prokazatelná mortalitní data u srdečního selhání nebo ICHS bez selhání, což je lisinopril (studie ATLAS) [7], perindopril (studie EUROPA a PREAMI) [8], ramipril (studie HOPE a AIRE) [9] a trandolapril (studie PEACE a TRACE). V epidemiologickém retrospektivním sledování zahrnujícím 18 453 pacientů po infarktu myokardu byla zjištěna nejnižší mortalita u ramiprilu a perindoprilu (graf 1).
7512 účastníků studie užívalo inhibitor ACE minimálně po dobu 1 roku, srovnáváno bylo všech 7 inhibitorů ACE v té době používaných. Sledování proběhlo v letech 1996 až 2000 ve 109 nemocnicích v Quebecu.
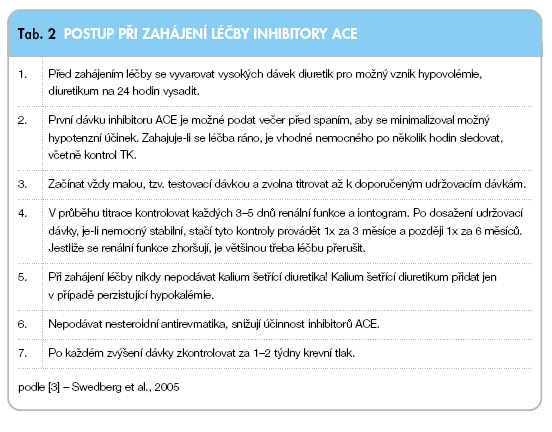
Inhibitory ACE jsou indikovány u každého nemocného se symptomatickým CHSS, které vzniklo na podkladě systolické dysfunkce levé komory, pokud nemá kontraindikace nebo je netoleruje. Samozřejmě by jimi měli být léčeni všichni nemocní, kteří užívají diuretika. U nemocných s asymptomatickou systolickou dysfunkcí levé komory zmenšují pravděpodobnost rozvoje srdečního selhání. Při středně těžkém a těžkém CHSS výrazně zmenšují potíže nemocných, zvyšují jejich toleranci zátěže, snižují počet nutných hospitalizací pro zhoršení srdečního selhání či z jiných kardiovaskulárních důvodů a významně snižují mortalitu. Tab. 2 ukazuje postup při zahájení léčby inhibitory ACE (podle doporučení Evropské kardiologické společnosti, 2005) [3].
Blokátory AT1-receptorů pro angiotenzin II (ARB)
Blokáda renin-angiotenzinového systému inhibitory ACE má několik limitací. Především je to častý výskyt suchého dráždivého kašle jako důsledek zpomalené degradace bradykininu, další nevýhodou je možná aktivace non-ACE cest konverze angiotenzinu I na angiotenzin II (chymázová cesta a další), což vede k poklesu účinku ACEI. Tyto cesty jsou aktivovány především při dlouhodobém podávání ACEI. Navíc inhibitory ACE blokují aktivitu především plazmatického ACE, mnohem méně již tkáňového ACE. V poslední době se dále zdůrazňuje význam jednotlivých receptorů pro angiotenzin II.
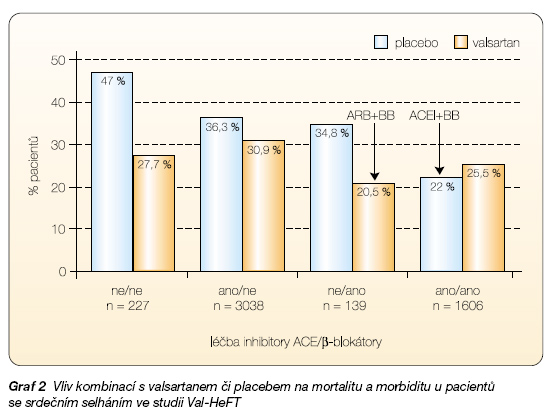
První klinické studie s ARB u chronického srdečního selhání prokázaly zlepšení hemodynamických parametrů a zlepšení tolerance zátěže. Další studie prokázaly srovnatelný efekt ARB na mortalitu a morbiditu nemocných jako bylo zjištěno u ACEI. Přidání ARB k ACEI již k dalšímu snížení mortality nevedlo. Studie Val-Heft jasně prokázala, že nejnižší mortalitu mají nemocní, kteří užívají kombinaci ACEI nebo ARB s b-blokátorem (graf 2).
Dosavadní poznatky o blokátorech receptoru AT1 pro angiotenzin II u srdečního selhání a po infarktu myokardu můžeme shrnout:
– ‑Indikace ARB jsou shodné s indikacemi pro ACEI.
– ‑Nemáme důkaz, že ARB jsou lepší než ACEI, proto jsou lékem volby u srdečního selhání jen při intoleranci ACEI (studie ELITE II, VALIANT, OPTMAAL) [10, 11].
– ‑Výhody vlivu kombinační léčby ACEI a ARB na snížení úmrtnosti nebyly potvrzeny (studie VALIANT a Val-Heft) [11]. Kombinační léčba by u nemocných tolerujících současnou blokádu ACEI + ARB + b-blokátor mohla vést ke snížení morbidity – počtu hospitalizací (studie CHARM added) [12, 13].
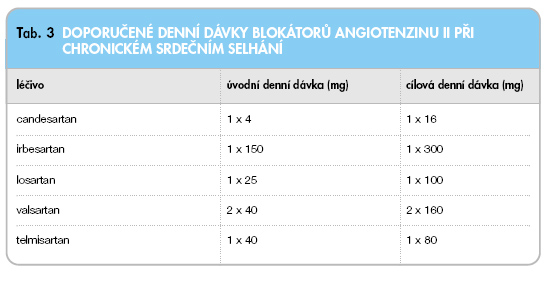
Doporučené dávky ukazuje tab. 3.
ß-blokátory
Na základě výsledků klinických studií US Carvedilol Trials, CIBIS II, MERIT-HF, COPERNICUS, CAPRICORN a SENIORS se b-blokátory staly součástí standardní léčby chronického srdečního selhání. Příznivě ovlivňují klinický stav nemocných, snižují jejich morbiditu a hlavně snižují mortalitu o 34 %, což představuje zabránění jednomu úmrtí na 25 nemocných léčených po dobu jednoho roku. Takřka 70 % všech úmrtí, kterým b-blokátory zabrání, představuje náhlá srdeční smrt. Ovlivnění mortality b-blokátory je aditivní k účinkům inhibitorů ACE. Nejde tedy o konkurenční skupiny léčiv, optimální je jejich kombinace. Příznivý účinek b-blokátorů je vysvětlován především snížením napětí sympatoadrenálního systému, snížením srdeční frekvence, prodloužením diastolické periody a účinkem antiarytmickým.
Léčba b-blokátory by měla být u těžšího srdečního selhání zahájena a vedena pod dohledem zkušeného kardiologa. Zhruba asi u 25 % nemocných totiž dochází v prvních týdnech k přechodnému hemodynamickému a symptomatickému zhoršení. Může se zhoršit dušnost, otoky, výkonnost nemocného apod. Na to je třeba reagovat úpravou medikace, např. zintenzivněním diuretické léčby. Léčba se musí zahajovat u klinicky stabilizovaného nemocného velmi nízkými dávkami a dávka se pak zvolna a opatrně titruje, obvykle tak, že se zdvojnásobuje každé dva týdny až do dosažení cílové udržovací dávky. Doporučené počáteční a cílové dávky b-blokátorů při srdečním selhání jsou uvedeny v tab. 4 (pozn.: neretardovaný metopro-lol tartarát na základě studie COMET do léčby srdečního selhání nepatří! [14]).
Léčba b-blokátory je indikována u ne-mocných ve funkční třídě NYHA II–IV a u asymptomatické komorové dysfunkce po prodělaném infarktu myokardu, u kterých jsou standardní součástí sekundární prevence. Kontraindikacemi podávání b-blo-kátorů jsou bradykardie ≤ 50/min, hypotenze se systolickým tlakem ≤ 90 mmHg a asthma bronchiale. Diabetes mellitus kontraindikací není!
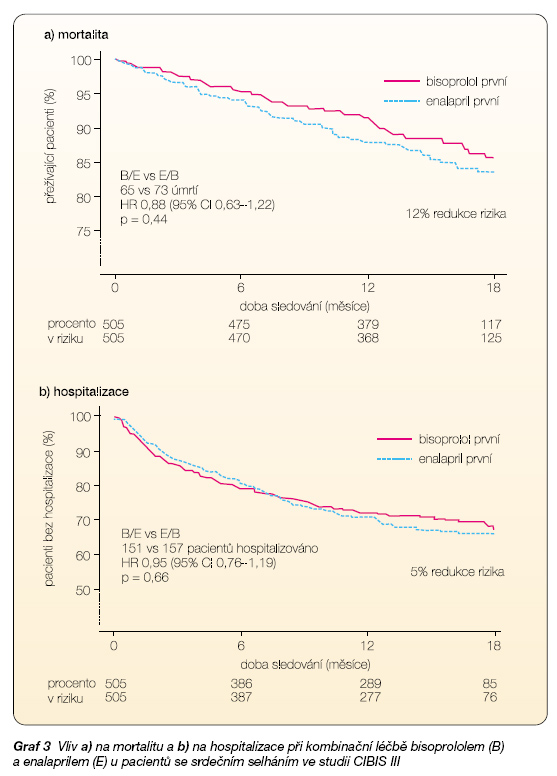
Dnes není jasné, zda léčba srdečního selhání má být zahájena blokátorem RAAS (ACEI nebo ARB), nebo b-blokátorem. Na základě výsledků studie CIBIS III je ponecháno rozhodnutí na lékaři, který léčí konkrétního nemocného (graf 3).
Jisté je, že pokud nemocný léčbu toleruje, měl by mít po určité době oba typy blokády, kombinace blokády RAAS a b-blokády je dnes upřednostňována před titrací jedné lékové skupiny do maxima, i když důkazy z velkých klinických studií o správnosti tohoto postupu nejsou.
Blokátory aldosteronu
V současnosti zažívá renesanci v léčbě srdečního selhání spironolacton. Přidání malé dávky spironolactonu (25–50 mg denně) ke standardní léčbě (inhibitor ACE + kličkové diuretikum + event. digoxin) vede k poklesu mortality nemocných s těžkým srdečním selháním o 27 % (studie RALES). Spironolacton je dobře snášen, nejčastějším nežádoucím účinkem je gynekomastie u 10 % mužů, významná hyperkalémie je vzácností. Možných vysvětlení tohoto příznivého efektu je několik. Aldosteron hraje v patofyziologii srdečního selhání daleko významnější úlohu jako promotor myokardiální fibrózy, než se předpokládalo. Inhibitory ACE neblokují úplně syntézu aldosteronu, která je kromě angio-tenzinu II stimulována také jinými faktory, např. zvýšenou sympatickou stimulací nebo plazmatickou hladinou draslíkových iontů.
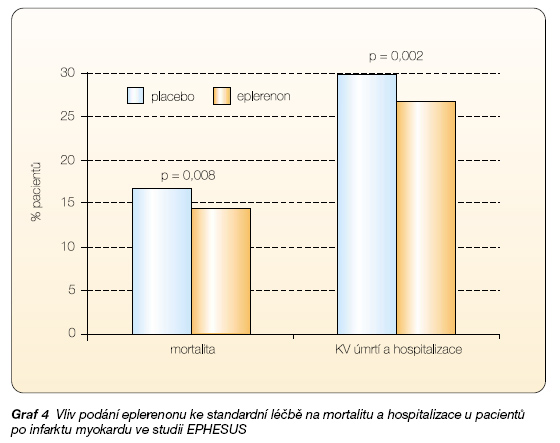
Do klinického zkoušení se dostal nový přípravek eplerenon, který je specifickým blokátorem receptorů pro aldosteron a jehož antiandrogenní účinek je zanedbatelný. Eplerenon má prokázaný efekt na snížení celkové mortality i kardiovaskulárních úmrtí a hospitalizací (studie EPHESUS) u pacientů se systolickým srdečním selháním (ejekční frakce < 40 %) po infarktu myokardu [15] (graf 4).
Jednalo se o dvojitě slepou studii u 6632 nemocných se systolickým srdečním selháním po infarktu myokardu, kdy v průběhu 3–14 dní po akutním IM byl ke stávající léčbě přidán eplerenon 25–50 mg, nebo placebo. Doprovodná medikace splňovala současná doporučení – 87 % nemocných užívalo inhibitory ACE, 75 % b-blokátory, 89 % kyselinu acetylsalicylovou a 47 % statin.
Blokátory aldosteronu můžeme tedy považovat za základní lékovou skupinu u systolického srdečního selhání spolu s ACEI, ARB a b-blokátory. Hlavní výhodou eplerenonu oproti spironolactonu je malý výskyt nežádoucích účinků.
Systolická dysfunkce
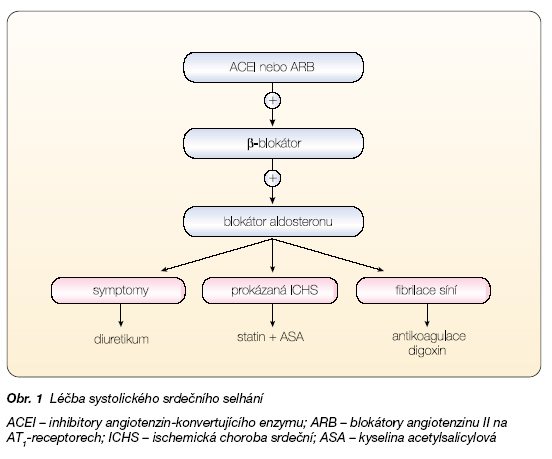
O léčbě systolického srdečního selhání jsou popsány stohy papírů, tisíce článků a stovky knih. Existují americká, evropská i česká doporučení pro léčbu systolického srdečního selhání a všechna se shodují, že základem léčby je kombinace inhibitor ACE a b-blokátor nebo kombinace ARB a b-blokátor [3, 4]. K této dvojkombinaci přidáváme blokátor aldosteronu. Diuretika indikujeme podle obtíží nemocného, při fibrilaci síní podáváme digoxin. Pacienti s ischemickou etiologií by měli užívat kyselinu acetylsalicylovou (případně clopidogrel) a statiny, přesné indikace má antikoagulační léčba.
Doporučení pro léčbu systolického srdečního selhání ukazuje obr. 1 [3, 4].
Diastolická dysfunkce
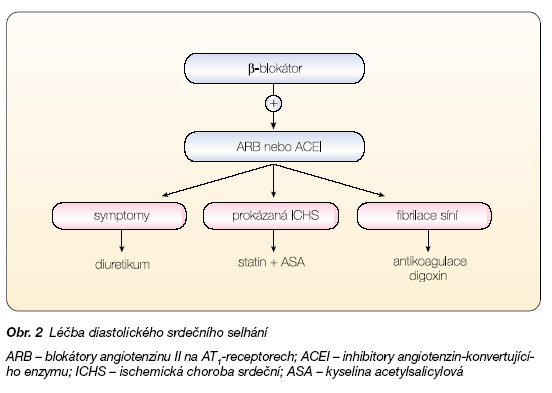
O léčbě diastolického srdečního selhání bylo až do konce 20. století napsáno jen minimum článků a léčba byla pouze empirická [16–18]. V prvních letech 21. století začaly probíhat první větší – mortalitní studie a výsledky prvních dvou jsou již známy (SENIORS s nebivololem a CHARM s candesartanem) a další budou ukončeny v nejbližších 2–3 letech [19, 20]. V léčbě diastolického srdečního selhání dnes doporučujeme následující [21] (obr. 2):
– ‑Prvořadým cílem je léčit základní onemocnění, především hypertenzi (ARB, ACEI, b-blokátory) a ischemickou chorobu srdeční (včetně revaskularizace) [22–24]. Je nutno rozpoznat onemocnění perikardu, hypertrofickou kardiomyopatii, restriktivní kardiomyopatii a další.
– ‑Je třeba udržet sinusový rytmus a odstranit arytmie (b-blokátory, bradykardizující blokátory vápníkových kanálů, amiodaron, kardioverze). b-blokátor s vazodilatačním účinkem – nebivolol – ve studii SENIORS vedl ke snížení mortality i morbidity.
– ‑K omezení remodelace a subendokardiální fibrózy se podávají ARB, inhibitory ACE, případně spironolacton (definitivní průkaz prospěchu však chybí, cande-sartan ve studii CHARM vedl ke snížení počtu hospitalizací [25]).
– ‑Městnavé symptomy léčíme opatrným užitím malých dávek diuretik, případně nitrátů.
– ‑Pozitivně inotropní látky nejsou indikovány.
– ‑U kombinovaného systolického a diastolického selhání je nutno volit postup individuálně s přihlédnutím k zásadám platným pro každý z typů.
Seznam použité literatury
- [1] Cleland JG, Swedberg K, Follath F, et al. The EuroHeart Failure survey programme-a survey on the quality of care among patients with heart failure in Europe. Part 1: Patient characteristics and diagnosis. Eur Heart J 2003; 24: 442–463.
- [2] Nieminen MS, Boehm M, Cowie MR, et al. Executive summary of the guidelines on the diagnosis and treatment of acute heart failure. Eur Heart J 2005; 26: 383–416.
- [3] Swedberg K, Cleland J, Dargie H, et al. Guidelines for the diagnosis and treatment of chronic heart failure. Eur Heart J 2005; 26: 1115–1140.
- [4] Špinar J, Hradec J, Málek I, Toman J. Doporučení pro diagnostiku a léčbu chronického srdečního selhání. Cor et Vasa 2001; 6: K123–138.
- [5] Vítovec J, Špinar J. Framakoterapie kardiovas-kulárních onemocnění. Praha, Grada 2004.
- [6] Braunwald E. ACE inhibitors: a cornerstone of the treatment of heart failure. N Engl J Med 1991; 325: 351–353.
- [7] Packer M, Poole-Wilson PA, Armstrong PW, et al. Comparative effects of low and high doses of the angiotensin-converting enzyme inhibitor, lisinopril, on morbidity and mortality in chronic heart failure. ATLAS Study Group. Circulation 1999; 100: 2312–2318.
- [8] The EURopean trial On reduction of cardiac events with Perindopril in stable coronary Artery disease Investigators: Efficacy of perindopril in reduction of cardiovascular events among patients with stable coronary artery disease: randomised, double-blind, placebo-controlled, multicentre trial (the EUROPA study). Lancet 2003; 362: 782–788.
- [9] Špinar J, Vítovec J. Ramipril v klinických studiích. Kardiologická revue 2005; 7: 156–160.
- [10] Dickstein K, Kjekshus J, and OPTIMAAL Study Group. Effects od losartan nad captopril on mortality and morbidity in high-risk patients after acute myocardial infarction: the OPTIMAAL randomised trial. Lancet 2002; 360: 752–760.
- [11] Pfeffer MA, McMurray JJV, Velazquez EJ, et al. for VALIANT Investigators: Valsartan, Captopril, or Both in Myocardial Infarction Complicated by Heart Failure, Left Ventricular Dysfunction, or Both. N Engl J Med 2003; 349: 1893–1906.
- [12] McMurray JJ, Ostergen J, Swedberg K, et al. Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function taking angiotensin-converting-enzyme inhibitors: the CHARM-Added trial. Lancet 2003; 362: 767–771.
- [13] Pfeffer MA, Swedberg K, Granger CB, et al. Effects of candesartan on mortality and morbidity in patients with chronic heart failure: the CHARM-Overall programme. Lancet 2003; 362: 759–766.
- [14] Poole-Wilson PA, Swedberg K, Cleland JGF, Di Lenarda A, for the COMET investigators. Comparison of carvedilol and metoprolol on clinical outcomes in patients with chronic heart failure in the Carvedilol Or Metoprolol European Trial (COMET): randomised controlled trial. Lancet 2003; 362: 7–13.
- [15] Pitt B, Wiliams G, Remme W, et al. The EPHESUS trial: eplerenon in patients with heart failure due to systolic dysfunction complicating after myocardial infarction. N Engl J Med 2003; 348: 1309–1321.
- [16] Arronow WS, Athn C, Kronzon I. Effect of propranolol versus no propranolol on total mortality plus non fatal myocardial infarction in older patients with prior myocardial infarction, congestive heart failure, and left vetricular ejection fraction > or 40 % treated with diuretics plus angiotensin converting enzyme. Am J Cardiol 1997; 80: 207–209.
- [17] Arronow WS, Kronzon I. Effect of enalapril on congestive heart failure treated with diuretics in elderly patients with prior myocardial infarction and normal left ventricle ejection fraction. Am J Cardiol 1993; 71: 602–604.
- [18] Aurigemma GP, Gaasch WH. Diastolic Heart Failure. N Engl J Med 2004; 351: 1097–1105.
- [19] Hradec J. Diastolické srdeční selhání. Diagnostika, epidemiologie, prognóza. Kardiologická re-vue 2004; 4: 156–161.
- [20] Hradec J. Diastolické srdeční selhání. Remedia 2004; 14: 121–125.
- [21] Špinar J, Vítovec J. Diastolické srdeční selhání. Léčba. Kardiologická revue 2004; 4: 162–166.
- [22] Widimský P. Studie EUROPA: Úspěch perindoprilu a české kardiologie. Cor Vasa 2004; 46: 7–8.
- [23] Yusuf S, Sleight P, Pogue J, et al. The Heart Outcomes Prevention Evaluation Study Investigators. Effects of an angiotensin-converting-enzyme inhibitor, ramipril, on cardiovascular events in high-risk patients. N Engl J Med 2000; 342: 145–153.
- [24] Zanchetti A, for the guidelines committee: 2003 European Society of Hypertension – European Society of Cardiology guidelines for the management of arterial hypertension. Journal of Hypertension 2003; 21: 1011–2023.
- [25] Yusuf S, Pfeffer MA, Swedberg K, et al. Effects of candesartan in patients with chronic heart failure and preserved left-ventricular ejection fraction: the CHARM-Preserved Trial. Lancet 2003; 362: 777–781.