Koxiby a kardiovaskulární riziko
Nesteroidní antirevmatika inhibují cyklooxygenázu s následným omezením syntézy prostaglandinů. Existují 2 izoformy cyklooxygenázy. Specifické inhibitory cyklooxygenázy 2 – koxiby – byly upřednostňovány pro svůj výrazný protizánětlivý efekt s nižším výskytem nežádoucích účinků typu gastroduodenálního vředu a jeho komplikací (perforace, krvácení). V ČR bylo zaregistrováno celkem 5 látek typu koxibů (celecoxib, rofecoxib, valdecoxib s proléčivem parecoxibem, etoricoxib). Rofecoxib byl k 30. 9. 2004 zcela stažen z trhu pro významné zvýšení kardiovaskulárních komplikací – především infarktu myokardu a trombotických mozkových cévních příhod. Výsledky vyplynuly z analýzy 3letých dat studie APPROVe – kumulativní výskyt kardiovaskulárních příhod 7,5/1000 léčených u placeba oproti 15 u rofecoxibu. Na možné nepříznivé kardiovaskulární působení léků vzbuzovaly podezření již dříve publikované studie VIGOR (pětinásobné zvýšení výskytu infarktu myokardu po rofecoxibu, ale i vyšší riziko iktů, hypertenze a flebotrombózy) a studie CLASS s celecoxibem (až po zhodnocení dlouhodobých retrospektivních dat). Ve studii TARGET s lumiracoxibem byl nepříznivý vliv pozorován především u nemocných, kteří neužívali současně aspirin. Poslední publikované studie s celecoxibem u nemocných se střevní adenomatózou, rofecoxibem – studie APPROVe, s valdecoxibem a parecoxibem u nemocných po aortokoronárním bypassu též ukázaly zvýšené kardiovaskulární riziko u těchto nemocných. Všechny tyto důkazy vyústily v silný tlak regulačních autorit, který zatím vyústil v rozhodnutí farmaceutické firmy o stažení dalšího koxibu – valdecoxibu – z trhu. Výše uvedené nepříznivé účinky jsou pravděpodobně společné všem typům koxibů, ale u celecoxibu a lumiracoxibu se kardiovaskulární riziko jeví jako nižší, což bude vyžadovat další klinické sledování.
Nesteroidní antirevmatika (NSA) jsou používána jako analgetické, protizánětlivé a antipyretické léky. Velmi hojně jsou podávány u řady bolestivých onemocnění, jako jsou polyartralgie, revmatická a infekční artritida, dnavá artritida, dysmenorea, bolesti zubů, hlavy, a u dalších stavů. Jejich dlouhodobé užívání je však spojeno se závažnými nežádoucími účinky, jako je krvácení do zažívacího traktu při erozivní ulceraci žaludeční či střevní sliznice. Po dlouhodobém užívání NSA může dojít k zhoršení ledvinných funkcí z důvodu poklesu průtoku renálními tepnami a následkem poklesu glomerulárního tlaku. Snížení plazmatických koncentrací vazodilatačních prostaglandinů způsobuje zvýšení krevního tlaku, rozvoj srdečního selhání či jeho zhoršení při stávající léčbě inhibitory angiotenzin konvertujícího enzymu a b-blokátory. V neposlední řadě také mohou NSA zvýšit jaterní enzymy [1, 13].
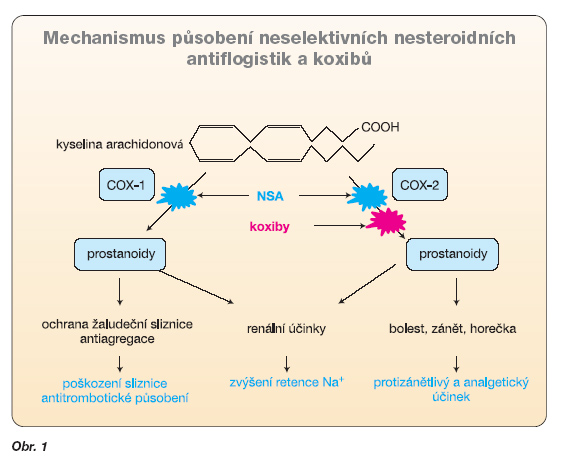
Mechanismus účinku všech NSA spočívá v inhibici cyklooxygenázy (COX), čímž dochází k zásahu do tvorby prostaglandinů. Inhibice syntézy prostaglandinů vede na jedné straně k potlačení zánětu, na druhé straně však snižuje tvorbu prostaglandinů obecně, což vede ke vzniku řady nežádoucích účinků [2, 8]. Syntéza prostaglandinů je zajištěna dvěma izoenzymy cyklooxygenázy, označovanými jako COX-1 a COX-2. COX-1 (tzv. konstituční) hraje roli při syntéze prostaglandinů, které plní fyziologické funkce (buňky žaludeční sliznice, ledviny), a COX-2 (tzv. indukovatelná) hraje roli při rozvoji lokální zánětlivé reakce (podání inhibitorů COX-2 vede k selektivnějšímu útlumu lokální zánětlivé reakce) (obr. 1) [1, 12, 24].
K nejpoužívanějším NSA patří v současné době deriváty arylalkanových kyselin – kyseliny octové (např. diclofenac, indometacin) a kyseliny propionové (např. ibuprofen, naproxen a další). V revmatologii nacházejí uplatnění díky svému protizánětlivému účinku, jejich analgetického účinku se využívá i v neurologii, gynekologii, stomatologii a v pooperační péči, některé deriváty kyseliny propionové se uplatňují též jako antipyretika. Další skupinou NSA jsou oxikamy (např. piroxicam, meloxicam), které mají na rozdíl od derivátů arylalkanových kyselin dlouhý biologický poločas a obvykle se podávají pouze v jedné denní dávce. Jejich použití je užší, protože se v klinické praxi jen omezeně používají jako analgetika (ačkoli jsou analgeticky velmi dobře účinné). Velmi dobrý analgetický a protizánětlivý účinek mají také fenamáty a nimesulid [1].
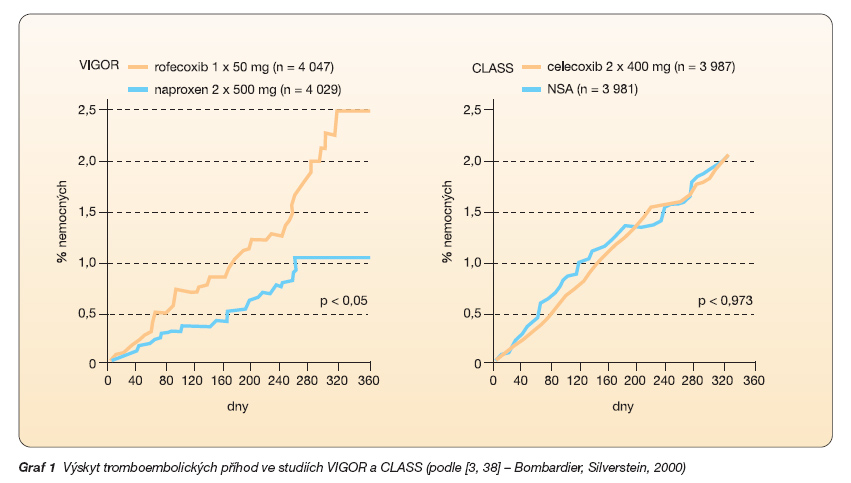
Snaha redukovat vedlejší účinky nespecifických NSA na GIT vedla k objevu nové skupiny antirevmatik a analgetik – koxibů (celecoxib, rofecoxib, valdecoxib a jeho proléčivo parecoxib, etoricoxib a lumiracoxib), které inhibují pouze COX-2. Jejich vývoj byl založen na hypotéze, že COX-2 byla zdrojem prostaglandinů PGE2 a PGI2, které přispívají k zánětu, a že cyklooxygenáza 1 (COX-1) byla zdrojem stejných prostaglandinů v epitelu žaludeční sliznice, kde poskytují cytoochranu. Prostaglandin E2 má vazodilatační účinky, zvyšuje permeabilitu cév, má chemotaktický efekt na leukocyty, zvyšuje produkci kolagenázy v makrofázích, zvyšuje osteoklastickou aktivitu, vyvolává horečku, senzibilizuje receptory pro bolest. Prostacyklin (PGI2) inhibuje shlukování krevních destiček a způsobuje vazodilataci se zábranou proliferace hladkých buněk cévní stěny in vitro. Předpokládalo se, že PGI2 byl odvozen hlavně z COX-1, cyklooxygenázy zastoupené v podstatné míře v buňkách endotelu. Tento předpoklad se později ukázal jako nesprávný, protože studie na myších i lidech ukázaly, že COX-2 byla dominantním zdrojem. Jednotlivé kardiovaskulární účinky PGI2 in vitro kontrastují s účinky tromboxanu A2 (TXA2) v krevních destičkách, který způsobuje jejich shlukování, vazokonstrikci a cévní proliferaci. Zatímco kyselina acetylsalicylová (ASA) a klasická NSA inhibují jak tvorbu TXA2, tak PGI2, koxiby neovlivňují vznik TXA2. Odrážejí tak nepřítomnost COX-2 v krevních destičkách. Snížení tvorby PGI2, a tím narušení rovnováhy působení PGI2 a TXA2 může zvyšovat krevní tlak, urychlit aterogenezi a u nemocných, kteří užívají koxiby, vést k zvýšené trombotické odezvě při ruptuře aterosklerotického plátu [5, 7, 14, 24, 25, 35]. Čím vyšší je riziko kardiovaskulárního postižení, tím pravděpodobnější je, že se toto riziko projeví vznikem komplikací. Proto původně příznivý předpoklad nižší incidence GIT komplikací po podání koxibů je postupně převažován ostražitostí nad zvýšeným výskytem kardiovaskulárních příhod. Až koncem září 2004 byl stažen rofecoxib z trhu po předčasném ukončení studie s názvem Adenomatous Polyp Prevention on Vioxx (APPROVe). V dubnu 2005 následovalo stažení valdecoxibu. Studie APPROVe byla prováděna k určení preventivního vlivu rofecoxibu na vznik kolorektálního karcinomu u nemocných s potvrzenou střevní adenomatózou. Rozhodnutí přerušit studii bylo přijato kvůli výraznému zvýšení výskytu závažných tromboembolických nežádoucích případů (faktor 3,9) ve skupině, která dostávala 25 mg rofecoxibu denně, ve srovnání se skupinou, která užívala placebo. Krevní tlak se brzy po zahájení studie zvýšil u pa-cientů, kteří užívali rofecoxib, ale výskyt infarktu myokardu a trombotické CMP se začaly v těchto dvou skupinách postupně odlišovat po léčbě trvající 18 měsíců a déle. Signály o vyšším kardiovaskulárním riziku byly publikovány již v roce 2001 [27], kde autoři rozebrali studie VIGOR (Vioxx Gastrointestinal Outcomes Research Study – 8 076 nemocných) a CLASS (Celecoxib Long-term Arthritis Safety Study – 8 059 nemocných) [3, 38]. Obě studie zkoumaly výskyt gastrointestinálního postižení. Ve studii VIGOR byla míra závažných gastrointestinálních komplikací po rofecoxibu poloviční ve srovnání s těmi, kteří dostávali klasický NSA – naproxen – 2 % ve srovnání se 4 %. Avšak bylo zjištěno zvýšení kardiovaskulárních příhod (infarkt myokardu, nestabilní angina pectoris, srdeční trombus, resuscitace pro srdeční zástavu, náhlé úmrtí, ischemická cévní mozková příhoda) ve skupině léčené rofecoxibem ve srovnání s naproxenem (RR 2,38; 95% CI 1,39–4,0) (graf 1).
Tento fakt sice vzbudil pozornost, ale objevily se námitky založené na předpokladu kardioprotektivního účinku naproxenu. Tento předpoklad vzbuzující pochybnosti však nebyl nikdy prokázán a je s podivem, že byl tolik let tiše akceptován [33, 46, 48]. Definitivně vyvrácen byl nedávno publikovanými daty, prokazujícími zvýšení kardiovaskulárního rizika samotným naproxenem [49].
Ve studii CLASS byl celecoxib porovnáván s ibuprofenem nebo diclofenakem. Zdálo se, že celecoxib měl příznivější gastrointestinální profil a nebylo zjištěno žádné zvýšení kardiovaskulárního rizika. Avšak tato zpráva obsahovala pouze polovinu údajů (pouze za šest měsíců z roční studie); když byl k dispozici celý soubor údajů, bylo zřejmé, že celecoxib se nelišil od klasických NSAID ve svých účincích na předem definované gastrointestinální cíle. Opravdu nejvýraznější důkaz, který podporuje názor, že celecoxib předčí klasická NSAID co se týče gastrointestinálních účinků, se opírá o následnou analýzu údajů ze studie CLASS u pacientů, kteří neužívali aspirin [38]. Avšak obdobný retrospektivní přístup k údajům rovněž ukazuje na vyšší výskyt kardiovaskulárního rizika. Studie TARGET (Therapeutic Arthritis Research and Gastrointestinal Event Trial) porovnávala lumiracoxib s naproxenem nebo ibuprofenem. Prvotním cílem byl výskyt závažných gastrointestinálních případů, jejichž počet se výrazně snížil u pacientů, kteří dostávali lumiracoxib. Avšak tento rozdíl byl pozorován pouze u pacientů, kteří nebrali ASA. U těch nemocných, kteří neužívali ASA, se objevilo více kardiovaskulárních příhod ve skupině užívající lumiracoxib než v jiné skupině (0,26 vs 0,18 na 100 nemocných za rok, HR 1,47), rozdíl však nebyl významný a autoři uzavírají, že lumiracoxib je u nemocných s osteoartritidou a malou dávkou ASA bezpečným koxibem [10].
To vše vedlo k velmi vášnivé odborné diskusi o tom, zdali náhlé stažení rofecoxibu bylo opožděné a zdali existuje tzv. class efect koxibů, nebo je rizikový jen rofecoxib, pokud jde o kardiovaskulární komplikace [19 – 21, 30, 31, 37, 43]. Než budeme komentovat níže uvedené studie, máme jednu připomínku k této diskusi. Každý lék má svá rizika a lékař by je měl brát v úvahu a vždy u nemocného zvážit prospěch léčby a její riziko. Platí to pro koxiby stejně jako pro jiné léky a léčebné postupy [36]. V případě koxibů nelze jednostranně zdůrazňovat jen jejich potenciální kardiovaskulární rizika. Je nutno vzít v potaz i situace, kdy je pacient ohrožen závažnými gastrointestinálními komplikacemi, které prakticky znemožňují podání běžných nesteroidních antirevmatik. V případě nejdříve a nejvíce kritizovaného léku (již staženého z trhu) – rofecoxibu – by pak srovnání s naproxenem jen v podskupině nemocných ohrožených komplikacemi z GIT vyšlo pravděpodobně ve prospěch rofecoxibu, zvláště jednalo-li by se o pacienty bez kardiovaskulárního rizika. Jistě je nutno zavrhovanému rofexocibu dále přiznat, že je jediným koxibem, který není kontraindikován u nemocných s alergií na sulfonamidy a který je indikován u nemocných s juvenilní revmatoidní artritidou. Některé revmatologické zdroje upozorňují i na skutečnost, že jde o lék s nejvýraznějším analgetickým účinkem u revmatologických onemocnění provázených krutými bolestmi [1, 13].
Důležitou roli v ovlivnění výskytu gastroduodenálních vředů sehrává selektivita jednotlivých preparátů. Nejvyšší stupeň selektivity COX-2 inhibitorů vykazují etoricoxib, lumiracoxib a rofecoxib, střední stupeň pak celecoxib, nesteroidní antirevmatika typu ibuprofenu a naproxenu nevykazují prakticky žádnou selektivitu. Je pravděpodobné, že se tato selektivita (i když opačným způsobem) promítá i do nežádoucích kardiovaskulárních účinků [9, 11, 15, 42, 48].
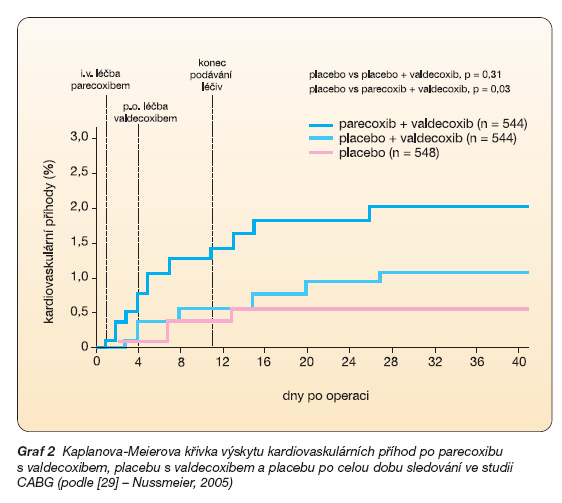
Na počátku letošního roku byly v New England Journal of Medicine publikovány závěrečné výsledky tří studií: s valdecoxibem a jeho prolékovou formou parecoxibem po aortokoronáním bypassu (studie CABG), kde kombinace nitrožilního parecoxibu s následným podáním valdecoxibu byla srovnávána s placebem a valdecoxibem a samotným placebem. Výsledkem je, že v obou skupinách s aktivně podávaným koxibem byl vyšší výskyt kardiovaskulárních komplikací (placebo 4,0 %, placebo + valdecoxib 7,4 % a parecoxib a valdecoxib 7,4 %). Zdá se však, že podávání koxibů po jiných než kardiochirurgických operacích není sdruženo s významnějším rizikem (jistě však předpokládáme, že nejde a priori o pacienty s kardiovaskulárním rizikem) (graf 2) [29].
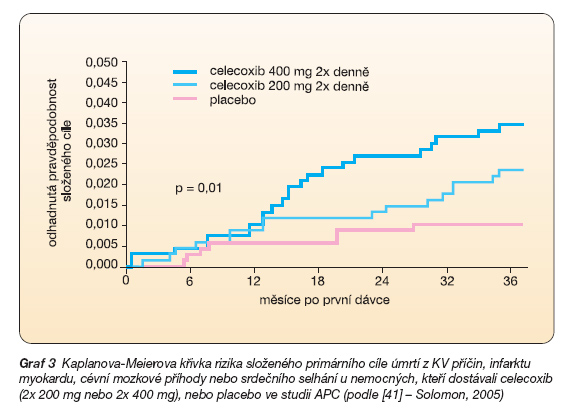
Další studie APC s celecoxibem v prevenci kolorektálního karcinomu opět ve třech skupinách – celecoxib 2 x 200 mg a 2 x 400 mg, nebo placebo – také ukázala vyšší riziko KV komplikací (placebo 1,0 %, celecoxib 2 x 200 mg 2,3 % a celecoxib 2 x 400 mg 3,4 %) (graf 3) [41].
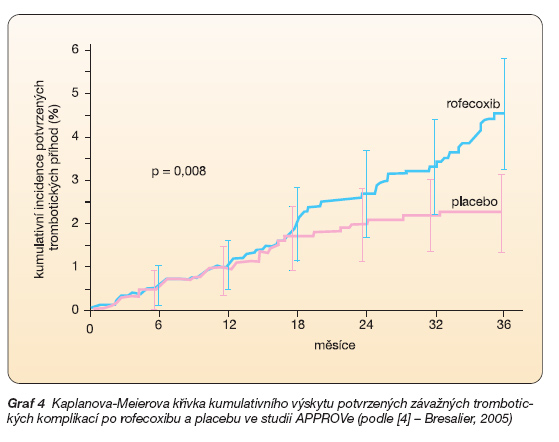
Poslední studie, již výše zmíněná APPROVe, s rofecoxibem v prevenci kolorektálního karcinomu, kdy bylo srovnáváno 25 mg rofecoxibu s placebem, byla předčasně ukončena pro vyšší výskyt KV příhod po rofecoxibu (placebo 2,0 % a rofecoxib 3,6 %, kdy se rozdíl začal projevovat až po 18 měsících léčby (graf 4) [4].
Před zveřejněním výsledků výše uvedených studií se zdálo, že vědecké důkazy o gastrointestinálním přínosu koxibů podle výsledků testování v rámci studií VIGOR a TARGET převážily nad důkazy o kardiovaskulárním riziku. Nyní máme zřejmý důkaz o zvýšení kardiovaskulárního rizika, který se projevil způsobem, který je v souladu s klinickým výkladem vztahujícím se na všechny koxiby. Tyto nové skutečnosti by měly být promítnuty do doporučení pro lékaře a samozřejmě by o nich měli být informováni všichni pacienti, kteří koxiby užívají. Selektivní inhibitory COX-2 zůstávají racionální volbou analgetické léčby pro nemocné s nízkým kardiovaskulárním rizikem, kteří měli závažné gastrointestinální problémy, zejména pokud již užívali klasická NSA. Měly by však být podávány jen krátkodobě, spíše v nižším dávkování a nejlépe v kombinaci s jinou analgetickou léčbou.
Editorial Erica J. Topola dost ostře reaguje na proces, který vedl k pozdnímu stažení rofecoxibu, a především kritizuje FDA (Food and Drug Administration) v procesu schvalování léků [43]. Racionální základ pro pochopení kardiovaskulárních účinků koxibů léků byl v posledních pěti letech znám i přesto, že nejzákladnější otázka nebyla přímo nastolena [8, 9]. Mnohé informace mohly být odvozeny z pečlivých klinických studií na malém počtu pacientů a dobrovolníků [12, 23].
Avšak farmaceutické společnosti se řídí při navrhování studií, jako je např. TARGET, současnými požadavky na schvalování léků [10, 29]. Tato nejnákladnější a nejrozsáhlejší výsledková studie zahrnula více než 18 000 pacientů, kteří užívali po jeden rok lumiracoxib. Tím byl položen základ pro schválení tohoto koxibu, ale tato studie nenastolila důležité otázky o kardiovaskulárním riziku, na které poukázalo testování v rámci VIGOR a jiné epidemiologické studie [3, 18, 34, 39, 44]. Kardiovaskulární riziko je pravděpodobně společným nežádoucím účinkem celé třídy koxibů, ale v určité míře by se zde však mohl promítat stupeň selektivity jednotlivých preparátů, a tudíž rozdílný vliv na výskyt kardiovaskulárních komplikací [20, 22, 26, 32, 45, 47, 49]. Jak naznačují srovnávací studie, je kardiovaskulární riziko jednotlivých koxibů rozdílné, což však musí potvrdit další dvojitě slepé studie [49].
Pozorování, že současným podáváním ASA lze do jisté míry omezit nežádoucí kardiovaskulární působení koxibů, má jen omezenou platnost. Významným způsobem totiž narůstá riziko gastrointestinálních ulcerací, hlavní výhoda podávání koxibů (snížené riziko krvácení z GIT) tedy přestává být aktuální [6, 17].
Závěrem lze shrnout současné poznatky o koxibech. Jde o skupinu preparátů s potenciálním nepříznivým působením na kardiovaskulární systém, které je závislé na dávce a délce podávání. V žádném případě je proto nepoužijeme u nemocných s vyšším stupněm kardiovaskulárního rizika (ICHS, iktus, hypertenze, flebotrombóza, stavy po bypassech apod.), je nutno se vždy vyvarovat vyšších dávek a léčba by se měla omezit na nejkratší možnou dobu. S ohledem k nižšímu výskytu gastrointestinálních komplikací (vředová choroba) a příznivému revmatologickému (analgetickému) profilu se k této skupině léků můžeme uchýlit tam, kde bychom požadovali snížení potenciálních nežádoucích účinků na GIT (krvácení) a zvýraznění analgetického působení. Podmínkou je ovšem splnění výše uvedených kautel (pouze u nemocných s minimálním kardiovaskulárním rizikem, nízké dávky podávané co nejkratší dobu). Pacient by měl být v každém případě seznámen s potenciálním kardiovaskulárním rizikem.
Seznam použité literatury
- [1] Anonymous. Koxiby v klinické praxi. Farmakoterap Inform 2002; 9: 1–4.
- [2] Bolli R, Shinmura K, Tang XL, et al. Discovery of a new function of cyclooxygenase (COX)-2: COX-2 is a cardioprotective protein that alleviates ischemia/reperfusion injury and mediates the late phase of preconditioning. Cardiovasc Res 2002; 55: 506–519.
- [3] Bombardier C, Laine L, Reicin A, et al. VIGOR Study Group. Comparison of upper gastrointestinal toxicity of rofecoxib and naproxen in patients with rheumatoid arthritis. VIGOR Study Group. N Engl J Med 2000; 343: 1520–1528.
- [4] Bresalier RS, Sandler RS, Quan H, for the APPROVe Trial Investigators. Cardiovascular Events Associated with Rofecoxib in a Colorectal Adenoma Chemoprevention Trial. N Engl J Med 2005; 352: 1092–1102.
- [5] Burleigh ME, Babaev VR, Oates JA, et al. Cyclooxygenase-2 promotes early atherosclerotic lesion formation in LDL receptor-deficient mice. Circulation 2002; 105: 1816–1823.
- [6] Capone ML, Tacconelli S, Sciulli MG, et al. Clinical pharmacology of platelet, monocyte, and vascular cyclooxygenase inhibition by naproxen and low-dose aspirin in healthy subjects. Circulation 2004; 109: 1468–1471.
- [7] Cipollone F, Prontera C, Pini B, et al. Overexpression of functionally coupled cyclooxygenase-2 and prostaglandin E synthase in symptomatic atherosclerotic plaques as a basis of prostaglandin E2-dependent plaque instability. Circulation. 2001; 104: 921–927.
- [8] Doležal T. Farmakologická podstata kardiovaskulárních účinků coxibů. Lék Listy 2004; 50: 24.
- [9] Drazen JM. COX-2 inhibitors – A Lesson in Unexpected Problems. N Engl J Med 2005; 352: 1131–1132.
- [10] Farkouh ME, Kirshner H, Harrington RA, et al. TARGET Study Group. Comparison of lumiracoxib with naproxen and ibuprofen in the Therapeutic Arthritis Research and Gastrointestinal Event Trial (TARGET), cardiovascular outcomes: randomised controlled trial. Lancet 2004; 364: 675–684.
- [11] FitzGerald GA, Patrono C. The coxibs, selective inhibitors of cyclooxygenase-2. N Engl J Med 2001; 345: 433–442.
- [12] Fitzgerald GA. Coxibs and cardiovascular disease. N Engl J Med. 2004; 351: 1709–1711.
- [13] Forejtová Š, Pavelka K. Kardiovaskulární a renální bezpečnost koxibů. Čes Revmatologie 2004; 12: 145–156.
- [14] Hermann M, Camici G, Fratton A, et al. Differential effects of selective cyclooxygenase-2 inhibitors on endothelial dysfunction in salt-induced hypertension. Circulation. 2003; 108: 2308–2311.
- [15] Chang IJ, Harris RC. Are All COX-2 Inhibitors Created Equal? Hypertension 2005; 45: 178–180.
- [16] Chenevard R, Hurlimann D, Bechir M, et al. Selective COX-2 inhibition improves endothelial function in coronary artery disease. Circulation 2003; 107: 405–409.
- [17] Cheng Y, Austin SC, Rocca B, et al. Role of prostacyclin in the cardiovascular response to thromboxane A2. Science 2002; 296: 539–541.
- [18] Iadecola C, Gorelick PB. The Janus Face of Cyclooxygenase-2 in Ischemic Stroke: Shifting Toward Downstream Targets. Stroke 2005; 36: 182–185.
- [19] Jain, A, Atreja A, Harris CM, Lehmann M, Burns J, Young J. Responding to the Rofecoxib Withdrawal Crisis: A New Model for Notifying Patients at Risk and Their Health Care Providers. Ann Intern Med 2005; 142: 182–186.
- [20] Jerie P. VIOXX odepsán – a co dál? COX-2 inhibitory a kardiovaskulární onemocnění. Čas Lék Čes 2005; 144: 4.
- [21] Kim PS, Reicin AS, Villalba L, et al. Rofecoxib, Merck, and the FDA. N Engl J Med 2004; 351: 2875–2878.
- [22] Kimmel SE, Berlin JA, Reilly M, et al. Pacients exposed to Rofecoxib and celecoxib have Different Odds of Nonfatal Myocardial infarction. Ann Int Med 2005; 142: 157–164.
- [23] Konstam MA, Weir MR, Reicin AS, et al. Cardiovascular thrombotic events in controlled, clinical trials of rofecoxib. Circulation 2001; 104: 2280–2288.
- [24] Lipsky PE, Brooks P, Crofford LJ, et al. Unresolved issues in the role of cyclooxygenase-2 in normal physiologic processes and disease. Arch Intern Med. 2000; 160: 913–920.
- [25] Mamdani M, Rochon P, Juurlink DN, et al. Effect of selective cyclooxygenase 2 inhibitors and naproxen on short-term risk of acute myocardial infarction in the elderly. Arch Intern Med. 2003; 163: 481–486.
- [26] McAdam BF, Catella-Lawson F, Mardini IA, Kapoor S, Lawson JA, FitzGerald GA. Systemic biosynthesis of prostacyclin by cyclooxygenase (COX)-2: the human pharmacology of a selective inhibitor of COX-2. Proc Natl Acad Sci USA 1999; 96: 272–277.
- [27] Mukherjee DM, Nissen SE, Topol EJ. Risk of cardiovascular events associated with selective COX-2 inhibitors. JAMA 2001; 286: 954–959.
- [28] Mysler E. Lumiracoxib a new selective COX-2 inhibitor. Int J Clin Pract. 2004; 58: 606–611.
- [29] Nussmeier NA, Whelton AA, Brown MT, et al. Complications of the COX-2 Inhibitors Parecoxib and Valdecoxib after Cardiac Surgery. N Engl J Med 2005; 352: 1081–1091.
- [30] Pavelka K. Coxiby – poslední vývoj. Lék Listy 2004; 50: 22–23.
- [31] Psaty BM, Furberg CD. Cox-2 Inhibitors – Lesson in Drug Safety. N Engl J Med 2005; 352: 1133–1135.
- [32] Rabausch K, Bretschneider E, Sarbia M, et al. Regulation of Thrombomodulin Expression in Human Vascular Smooth Muscle Cells by COX-2-Derived Prostaglandins. Circulation Research 2005; 96: e1-e6.
- [33] Rahme E, Pilote L, LeLorier J. Association between naproxen use and protection against acute myocardial infarction. Arch Intern Med 2002; 162: 1111–1115.
- [34] Ray WA, Stein CM, Daugherty JR, Hall K, Arbogast PG, Griffin MR. COX-2 selective non-steroidal anti-inflammatory drugs and risk of serious coronary heart disease. Lancet. 2002; 360: 1071–1073.
- [35] Reicin A, Shapiro D, Sperling RS, et al. Comparison of cardiovascular thrombotic events in patients with osteoarthritis treated with rofecoxib versus nonselective nonsteroidal anti-inflammatory drugs (ibuprofen, diclofenac, and nabumetone). Am J Cardiol 2002; 89: 204–209.
- [36] Riley J, Wilton LV, Shakir SA. A post-marketing observational study to assess the safety of mibefradil in the community in England. Int J Clin Pharmacol Ther 2002; 40: 241–248.
- [37] Roden DM. An Underrecognized Challenge in Evaluating Postmarketing Drug Safety. Circulation 2005; 111: 246–248.
- [38] Silverstein FE, Faich G, Goldstein JI, et al. Gastrointestinal Toxicity With Celecoxib vs Nonsteroidal Anti-Inflammatory Drugs for Osteoarthritis and Rheumatoid Arthritis. The CLASS study: a randomized controlled study. JAMA 2000; 284: 1247–55.
- [39] Solomon DH, Glynn RJ, Levin R, et al. Nonsteroidal anti-inflammatory drug use and acute myocardial infarction. Arch Intern Med 2002; 162: 1099–1104.
- [40] Solomon DH, Karlson EW, Rimm EB, et al. Cardiovascular morbidity and mortality in women diagnosed with rheumatoid arthritis. Circulation 2003; 107: 1303–1307.
- [41] Solomon SD, McMurray JJV, Pfeffer MA for the APC Study Investigatros. Cardiovascular Risk Associated with Colorectal Adenoma Prevention. N Engl J Med 2005; 352: 1071–1080.
- [42] Title LM, Giddens K, McInerney MM, et al. Effect of cyclooxygenase-2 inhibition with rofecoxib on endothelial dysfunction and inflammatory markers in patients with coronary artery disease. J Am Coll Cardiol 2003; 42: 1747–1753.
- [43] Topol EJ. Failing the public health – rofecoxib, Merck, and the FDA. N Engl J Med 2004; 351: 1707–1709.
- [44] Topol EJ. Arthritis Medicines and Cardiovascular Events –"House of Coxibs". JAMA 2005; 293: 366–368.
- [45] Topper JN, Cai J, Falb D, et al. Identification of vascular endothelial genes differentially responsive to fluid mechanical stimuli: cyclooxygenase-2, manganese superoxide dismutase, and endothelial cell nitric oxide synthase are selectively up-regulated by steady laminar shear stress. Proc Nat Acad Sci U S A. 1996; 93: 10417–10422.
- [46] Watson DJ, Rhodes T, Cai B, et al. Lower risk of thromboembolic cardiovascular events with naproxen among patients with rheumatoid arthritis. Arch Intern Med 2002; 162: 1105–1110.
- [47] Whelton A, White WB, Bello AE, et al, for the SUCCESS-VII Investigators. Effects of celecoxib and rofecoxib on blood pressure and edema in patients > or =65 years of age with systemic hypertension and osteoarthritis. Am J Cardiol 2002; 90: 959–963.
- [48] White WB, Faich G, Whelton A, et al. Comparison of thromboembolic events in patients treated with celecoxib, a cyclooxygenase-2 specific inhibitor, versus ibuprofen or diclofenac. Am J Cardiol 2002; 89: 425–430.
- [49] Graham DJ, Campen D, Hui R, et al. Risk of acute myocardial infarction and sudden cardiac death in patients treated with cyclooxygenase 2 selective and non-selective non-steroidal anti-inflammatory drugs: nested case-control study. Lancet 2005; 365: e1–e7.