Léčba chronické bolesti
Souhrn:
Chronická bolest představuje významný celospolečenský socioekonomický problém. Výraznou měrou se podílí na invalidizaci obyvatelstva vyspělých zemí světa a nepříznivě ovlivňuje kvalitu života. Strategie léčby chronické bolesti je multimodální; zahrnuje farmakoterapii, rehabilitační léčbu, psychoterapii, invazivní metody a některé další léčebné možnosti. Základní strategie léčby bolesti vychází z třístupňového analgetického žebříčku Světové zdravotnické organizace (WHO). Základem léčby chronické bolesti jsou neopioidní analgetika, dle intenzity bolesti kombinovaná se slabými nebo silnými opioidy. Tato léčba může být doplňována adjuvantní analgetickou medikací.
Key words: chronic pain – treatment strategy – pharmacological treatment – invasive treatment.
Summary:
Chronic pain is a significant and widespread socioeconomic problem. It contributes strongly to the invalidation of populations in developed countries and decreases the quality of life. The strategy of chronic pain treatment if multimodal, comprising pharmacotherapy, rehabilitation, psychotherapy, invasive methods, and some other treatment options. The basic approach to pain treatment mirrors the three step analgesic ladder of WHO. The cornerstone of chronic pain treatment is represented by non opioid analgesics, combined with weak of strong opioids depending on the intensity of pain. This treatment can be also combined with adjuvant analgesic medication.
Bolest je jedním z prvních vjemů, s nímž se člověk ve svém životě setkává a který ho doprovází po celou dobu jeho existence. Světová zdravotnická organizace (World Health Organization, WHO) i Mezinárodní organizace pro studium bolesti (International Association for the Study of Pain, IASP) definují bolest jako „nepříjemný senzorický a emocionální prožitek spojený se skutečným či možným poškozením tkání nebo zážitek, který je v termínech takového poškození popisován; bolest je vždy subjektivní“.
Chronická bolest patří k nejrozšířenějším medicínským problémům současnosti s výrazným socioekonomickým dopadem. Prevalence chronické bolesti v ekonomicky vyspělých státech se udává kolem 20 %. Frekvence výskytu chronické bolesti v jednotlivých evropských zemích se liší jen mírně. Jedna z mála celoevropských studií, provedená v roce 2006 v 15 evropských zemích a v Izraeli, prokázala, že 19 % dospělého obyvatelstva má zkušenosti s dlouhodobou bolestí. Studie ze severských zemí hovoří o 24,2% výskytu chronické bolesti v Norsku a 20,2% výskytu ve Švédsku. Nejnižší výskyt je ve Španělsku, Irsku a ve Velké Británii (12–30 %), nejvyšší naopak v Itálii, Polsku a v Norsku (26–30 %). Toto procento se v důsledku stárnutí populace postupně zvyšuje [1,2].
Obdobné výsledky vykazují i studie prováděné u populace v České republice; jedno z mála českých sledování výskytu bolesti uvádí, že bolest je příčinou asi 20 % návštěv u praktického lékaře [3].
Typy bolesti
Pro správnou volbu analgetika nebo analgetické kombinace je důležité rozlišovat mezi bolestí akutní, chronickou, nociceptivní, neuropatickou, psychogenní a smíšenou.
Akutní bolest
Akutní bolest je zpravidla náhle vzniklý bolestivý stav trvající několik hodin, dnů, výjimečně týdnů. Akutní bolest je „fyziologická“, plní svoji základní funkci ochrany organismu, kdy slouží jako signál probíhajícího onemocnění nebo poškození. Akutní bolest bývá dobře lokalizovatelná, ostré až palčivé povahy; řadíme k ní bolest pooperační, traumatickou, porodní a bolest při některých vnitřních onemocněních. Akutní bolest má výrazný vliv na celý organismus: aktivuje sympatikus, neuroendokrinní, imunitní a zánětlivé reakce, katabolismus a imunosupresi, zvyšuje spotřebu kyslíku myokardem, snižuje motilitu gastrointestinálního traktu a podílí se na řadě dalších změn.
Chronická bolest
Zatímco akutní bolest je symptomem probíhajícího onemocnění, chronická bolest se stává sama nemocí – syndromem. Cílem léčebných postupů u chronické bolesti nemusí být nutně úplné uzdravení jedince, ale zvýšení kvality života spočívající především v zajištění spánku nerušeného bolestí a v obnovení funkční zdatnosti v oblasti fyzické, psychické i sociální.
Nociceptivní bolest
Nociceptivní bolest vzniká podrážděním nociceptorů zahrnujících nocisenzory (volná nervová zakončení v tkáních, která se aktivují pouze při bolestivé stimulaci), mechanosenzory (Vaterova–Paciniho tělíska) a polymodální receptory (reagují na teplo a na chlad). Podle umístění receptorů rozlišujeme bolest somatickou a viscerální. K nociceptivní bolesti řadíme bolesti pohybového aparátu (osteoartrózy, artritidy, degenerativní změny páteře), bolesti vnitřních orgánů a většinu stavů akutní bolesti. Ve farmakoterapii nociceptivní bolesti jsou léky první volby analgetika.
Neuropatická bolest
Neuropatická bolest je způsobena lézí nebo dysfunkcí somatosenzorického nervového systému. Podle lokalizace poškození dělíme neuropatickou bolest na centrální, vznikající poškozením centrálního nervového systému (CNS), a periferní, která vzniká v důsledku periferní nervové léze.
Podle jiného dělení rozlišujeme neuropatickou bolest stimulovanou a bolest spontánní. Mezi stimulované bolesti patří alodynie (bolest vyvolaná podnětem, který ji za normálních okolností nevyvolává) a hyperalgezie (snížení prahu pro bolest v postižené oblasti). Spontánní bolestivé stavy dělíme podle průběhu v čase na kontinuální, intermitentní a paroxysmální. Neuropatická bolest je obvykle ohraničena příslušnou inervační oblastí a bývá spojena se senzitivním deficitem, hyperpatií a alodynií. Neuropatická bolest může časově navazovat na neurogenní lézi, stejně tak se však může objevit s časovou prodlevou. Pacienti nejčastěji charakterizují bolest jako ostrou, palčivou, vystřelující nebo bodavou. Velmi často se uvádí noční zhoršení bolesti.
Psychogenní bolest
U psychogenní bolesti převažuje psychická komponenta. Především u depresivních poruch a některých neuróz je bolest somatickou projekcí primárních obtíží. Nejčastěji si pacienti stěžují na bolesti břicha a zad. Základ léčby tvoří psychofarmaka a psychoterapie.
Smíšená bolest
Smíšená bolest zahrnuje stavy, na kterých se podílí více předchozích typů bolesti. V praxi se nejčastěji setkáváme se syndromem bolesti po neúspěšné operaci bederní páteře (failed back surgery syndrome, FBSS). V oblasti zad trpí pacienti nociceptivní složkou bolesti, v distribuční oblasti postižených nervových kořenů naopak převažuje složka neuropatická. Mezi možné etiologické komponenty patří epidurální fibróza a adhezivní arachnoiditida. Léčba se odvíjí od převažující účasti jednotlivých složek, je často velmi složitá a uplatňují se zde i metody invazivní (kaudální blokády, neuromodulace).
Léčba bolesti
Léčba bolesti zahrnuje kombinaci farmakologických a nefarmakologických léčebných postupů.
Základem dobré léčby bolesti je důkladná anamnéza bolesti zahrnující intenzitu, lokalizaci, projekci, vyvolávající nebo zhoršující příčiny, charakter bolesti. Obzvláštní důraz je kladen na farmakologickou anamnézu, fyzikální vyšetření a znalosti všech vyskytujících se onemocnění.
U dlouhodobější intenzivní bolesti s pouhou farmakoterapií zpravidla nevystačíme; je třeba zvolit multidisciplinární a multioborový přístup zahrnující spolupráci odborníků různých specializací. V léčbě uplatňujeme kombinaci farmakoterapie a nefarmakologických léčebných metod, jako jsou invazivní léčebné postupy, psychoterapie, rehabilitace a další.
Multidisciplinární přístup v léčbě bolesti zahrnuje následující složky:
- farmakoterapii,
- rehabilitační postupy,
- psychoterapeutické postupy,
- sociální podporu,
- invazivní postupy,
- paliativní postupy u nemocných s nádorovým onemocněním a léčbu nádorové bolesti,
- popřípadě postupy alternativní medicíny.
Farmakoterapie bolesti
Cílem léčby je zmírnění až odstranění bolesti, zvýšení funkční kapacity, zajištění nerušeného spánku a celkové zlepšení kvality života.
Strategie léčby bolesti vychází z třístu![Obr. 1 Třístupňový analgetický žebříček WHO; podle [5] – World Health Organization, 1986.](https://www.remedia.cz/photo-a-30419---.jpg) pňového analgetického žebříčku WHO (obr. 1), publikovaného poprvé v roce 1986 a původně určeného pro léčbu nádorové bolesti. Záhy byl však přejat též pro léčbu bolesti nenádorové, akutní i chronické. Žebříček je tvořen třemi základními stupni léčby, první stupeň pro nejméně intenzivní bolest zahrnuje neopioidní analgetika, druhý stupeň pro intenzivnější bolest přidává k neopioidním analgetikům slabý opioid a ve třetím stupni je slabý opioid nahrazen opioidem silným. Celou léčbu je možné doplňovat koanalgetiky (antikonvulzivy, antidepresivy) pro léčbu specifických bolestivých stavů a adjuvantní medikací k potlačení nežádoucích účinků analgetik (antiemetiky, laxativy). V indikovaných případech nádorové bolesti lze nově použít systém „výtah“ („elevator“), kdy při velmi intenzivní bolesti a předpokladu rychlého zvyšování dávek analgetik je možné druhý stupeň léčby (slabý opioid plus neopioidní analgetikum) přeskočit a na léčbu neopioidními analgetiky navázat přímo podáváním nízkých dávek silného opioidu [4].
pňového analgetického žebříčku WHO (obr. 1), publikovaného poprvé v roce 1986 a původně určeného pro léčbu nádorové bolesti. Záhy byl však přejat též pro léčbu bolesti nenádorové, akutní i chronické. Žebříček je tvořen třemi základními stupni léčby, první stupeň pro nejméně intenzivní bolest zahrnuje neopioidní analgetika, druhý stupeň pro intenzivnější bolest přidává k neopioidním analgetikům slabý opioid a ve třetím stupni je slabý opioid nahrazen opioidem silným. Celou léčbu je možné doplňovat koanalgetiky (antikonvulzivy, antidepresivy) pro léčbu specifických bolestivých stavů a adjuvantní medikací k potlačení nežádoucích účinků analgetik (antiemetiky, laxativy). V indikovaných případech nádorové bolesti lze nově použít systém „výtah“ („elevator“), kdy při velmi intenzivní bolesti a předpokladu rychlého zvyšování dávek analgetik je možné druhý stupeň léčby (slabý opioid plus neopioidní analgetikum) přeskočit a na léčbu neopioidními analgetiky navázat přímo podáváním nízkých dávek silného opioidu [4].
Neopioidní analgetika
Neopioidní analgetika tvoří chemicky různorodou skupinu (tab. 1). Ta zahrnuje par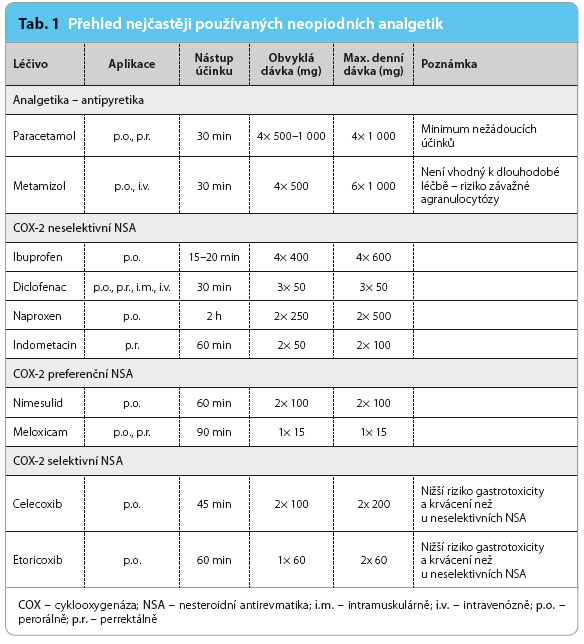 acetamol s metamizolem a skupinu nesteroidních antirevmatik (NSA).
acetamol s metamizolem a skupinu nesteroidních antirevmatik (NSA).
Paracetamol je analgetikum bez protizánětlivého účinku, doporučené dávkování je 500–1 000 mg po 4–6 hodinách. Výraznějšího analgetického účinku dosahuje paracetamol podávaný v jednotlivé dávce 650 mg a vyšší; nižší dávkování má převážně antipyretický účinek. Účinek nastupuje za 30 minut, maximální denní dávka je 4 000 mg. Při vyšším dávkování hrozí riziko hepatotoxicity, která však není vyloučena ani při dlouhodobějším užívání nižších dávek (2–3 g/denně).
Metamizol je analgetikum s nástupem účinku 30 minut; obvyklé dávkování je 500 mg 4× denně. Vzhledem k riziku vzniku agranulocytózy není metamizol vhodný k dlouhodobému podávání.
Nesteroidní antirevmatika
Princip účinku NSA spočívá převážně v blokádě enzymu cyklooxygenázy (COX), která mění kyselinu arachidonovou na prostaglandiny. Existují dva izoenzymy – COX‑1 a COX‑2. Forma COX‑1 je syntentizována v řadě orgánů (játra, ledviny, žaludeční sliznice, krevní destičky) a podílí se na jejich fyziologické funkci.
Dlouhodobé užívání NSA zvyšuje riziko poškození ledvin a vzniku ulcerací a krvácení v trávicím ústrojí. Riziko krvácení je u seniorů čtyřikrát vyšší než u mladší populace; vhodné je souběžné podávání antiulcerózní léčby. Většinou je doporučováno snížení celkové dávky NSA
Pravidla používání neopioidních analgetik:
- Neopioidní analgetika jsou indikována v monoterapii k léčbě mírné a středně silné bolesti. Pro léčbu silné bolesti je třeba vždy kombinace s opioidy.
- Zvyšování dávek neopioidních analgetik nad uvedenou maximální denní dávku obvykle nevede k posílení analgetického účinku, ale ke zvýšení rizika vzniku závažných nežádoucích účinků.
- Existuje velká variabilita účinků (a nežádoucích účinků) jednotlivých analgetik u daného pacienta. Někdy je výhodné vyzkoušet jiné neopioidní analgetikum.
- Kombinace paracetamolu nebo metamizolu s NSA zvyšuje analgetický účinek.
- Kombinace několika NSA není racionální a zvyšuje riziko nežádoucích účinků.
Opioidní analgetika
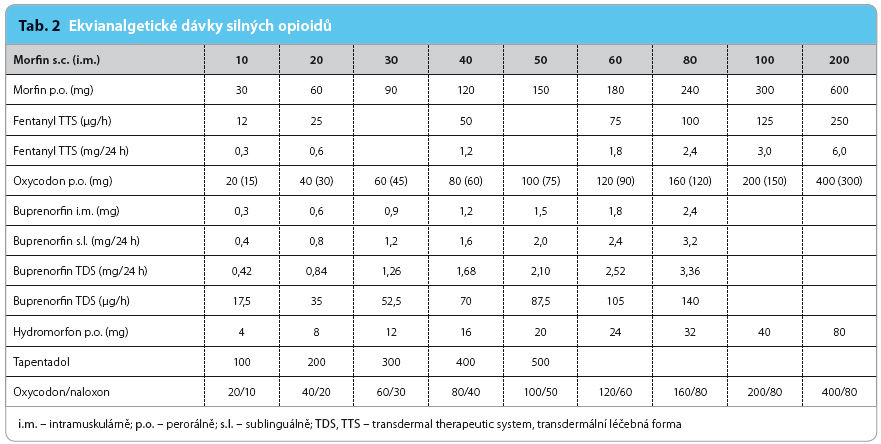
Podle síly analgetického účinku se opioidy dělí na slabé opioidy (dihydrocodein, codein, tramadol) a silné opioidy (morfin, buprenorfin, fentanyl, oxycodon, hydromorfon, tapentadol).
Slabé opioidy
Codein je slabým agonistou na µ‑receptorech. V organismu je biotransformován na morfin. Často se používá v kombinaci s paracetamolem.
Dihydrocodein je semisyntetický analog codeinu. K dispozici je dihydrocodein v retardované formě, který lze podávat v dávkách 60–120 (180) mg po 12 hodinách, popřípadě i v osmihodinových intervalech.
Tramadol vykazuje duální účinek: jednak působí jako slabý agonista na µ‑receptorech, jednak ovlivňuje zpětné vychytávání serotoninu a noradrenalinu v CNS. Na trhu je přítomen v řadě aplikačních forem, od injekční přes čípkovou až po tablety s bifazickým působením a s 24hodinovou účinností.
Kombinace slabých opioidů s neopioidními analgetiky zvyšuje účinek obou léčiv s následnou možností snížení dávky. S tím souvisí omezení nežádoucích účinků závislých na dávce.
Slabé opioidy na rozdíl od silných vykazují farmakologický stropový efekt.
Silné opioidy
Silné opioidy jsou zpravidla agonisty na µ‑receptorech a jsou určeny pro silné, neztišitelné bolesti, které nelze dostatečně zmírnit neopioidními analgetiky nebo slabými opioidy. Maximální denní dávky silných opioidů nejsou striktně určeny a nejsou limitovány stropovým efektem. Postup určují pravidla pro léčbu opioidy u chronické nenádorové bolesti (tab. 2).
V České republice jsou v současné době k dispozici opioidy morfin, fentanyl, hydromorfon, oxycodon, buprenorfin a tapentadol.
Morfin je klasickým standardem v léčbě silné bolesti. Injekční forma je vhodná pro léčbu silné akutní bolesti, perorální formy s postupným uvolňováním (slow‑release, SR) působící 12 hodin nebo až 24 hodin jsou určeny pro léčbu chronické bolesti. Pro léčbu průlomové bolesti je vhodný morfin s bezprostředním uvolňováním (immediate release, IR).
Fentanyl pro léčbu silné chronické bolesti je dostupný v transdermální formě (transdermal therapeutic system, TTS). Výhodou transdermálního aplikačního systému je schopnost dosažení stabilní plazmatické koncentrace a nižší výskyt nežádoucích účinků včetně zácpy. Určité problémy s autoaplikací přípravku ve formě TTS mohou mít senioři trpící poruchami zraku nebo třesem rukou. Fentanyl má 100krát silnější analgetický účinek než morfin.
Hydromorfon je účinný agonista na µ‑receptorech; lze jej uplatnit obecně v rámci rotace opioidů. K dispozici je v retardované 12hodinové formě. Má 5–7krát silnější analgetický účinek než morfin.
Oxycodon je další silný opioid určený pro léčbu silné chronické nenádorové a v některých případech i akutní bolesti. Pravděpodobně díky agonismu i na κ‑receptorech je vhodným opioidem pro léčbu neuropatické bolesti. Velmi dobrý analgetický účinek je však bohužel často doprovázen zácpou. Oxycodon má dvakrát silnější analgetický účinek než morfin.
Buprenorphin je z farmakologického hlediska parciálním agonistou na µ‑receptorech a antagonistou na κ‑receptorech. Přesto je řazen do skupiny silných opioidů, neboť vyšší dávky jsou ekvianalgetické jiným silným opioidům. Trvání účinku je 6–8 hodin (injekční a sublinguální forma). Ve formě TTS se aplikuje na 3,5 dne. Tento opioid lze použít i v rámci rotace silných opioidů.
Tapentadol je nejnovější molekulou ve skupině silných opioidů. Působí jako agonista na µ‑opioidních receptorech a zároveň inhibuje zpětné vychytávání noradrenalinu v buňkách CNS. Charakteristický je pro něj nízký výskyt nežádoucích účinků a velmi dobrá afinita k neuropatické bolesti. V současné době je tapentadol dostupný jak v retardované formě (50–250 mg), tak ve formě rychle působící (50 mg a 75 mg).
Oxycodon/naloxon. Zácpa představuje jeden z nejčastějších nežádoucích účinků spojený s dlouhodobým užíváním opioidní medikace. Je to jediný z nežádoucích účinků, u něhož nedochází v průběhu dlouhodobého podávání opioidů ke vzniku tolerance a pacienti trpí zácpou nebo jinými projevy břišního diskomfortu po celou dobu užívání opioidů. Jedinou možností řešení bylo užívání laxativ nebo snižování dávek až vysazení opioidní medikace. Tuto situaci změnil po svém příchodu na český trh kombinovaný přípravek oxycodonu a naloxonu v poměru 2 : 1. Princip účinku tohoto léku je velmi jednoduchý. Zácpa je z větší části způsobena vazbou opioidu na opioidním receptoru ve střevní stěně. Naloxon při perorálním podání má jako opioidní antagonista schopnost tuto vazbu v gastrointestinálním traktu blokovat, zároveň však podléhá z 98–99 % efektu prvního průchodu játry, tedy podléhá jaternímu metabolismu a do systémového řečiště se jej dostává nevýznamné množství. Tato dávka není schopna ovlivnit vazbu opioidu na opioidních receptorech v centrálním nervovém systému, a tím zrušit žádaný analgetický účinek. Tato kombinace umožňuje stejně dobrý analgetický účinek jako známý oxycodon, naloxon však zároveň antagonizuje vazbu oxycodonu na opioidní receptory v gastrointestinálním traktu, čímž výrazně snižuje výskyt zácpy indukované opioidy. Tento kombinovaný přípravek je určen pro léčbu silné a velmi silné chronické bolesti při léčbě jinými opioidy včetně transdermálních, při které přetrvává střevní dysfunkce indukovaná opioidy. Lék je dostupný v dávkách 10 mg/5 mg, 20 mg/10 mg a 40 mg/20 mg, interval podávání je 1 tableta po 12 hodinách, maximální dávka dle SPC je 80 mg/40 mg 2× denně.
Praktické poznámky k farmakoterapii chronické bolesti
- Léčbu chronické bolesti zahajujeme neopioidním analgetikem. Jako lék první volby je doporučován paracetamol 750 mg 3× denně. Výhodou léčby tímto léčivem je velká terapeutická bezpečnost a minimum nežádoucích účinků. V rámci dlouhodobé bezpečnosti při užívání paracetamolu se doporučuje nepřekračovat denní dávku 2 500 mg.
- Při nedostatečném účinku přidáváme k léčbě NSA. Vzhledem k tomu, že u pacientů s chronickou bolestí předpokládáme nutnost dlouhodobější léčby, volíme přípravky ze skupiny COX‑2 preferenčních NSA. Jako nejbezpečnější v dlouhodobé léčbě se jeví meloxicam, aceclofenac a coxiby (selektivní inhibitory COX-2). Zvýšená opatrnost je nutná u pacientů starších 65 let a u pacientů s kardiovaskulárním nebo s gastrointestinálním onemocněním užívajících kortikoidy nebo antikoagulancia. Nikdy nekombinujeme různá NSA včetně rektálních čípkových forem. Není pravda, že NSA podávaná ve formě čípku jsou šetrnější vůči gastrointestinálnímu traktu.
- V případě přetrvávající bolesti přidáváme k neopioidní medikaci léčivo ze skupiny slabých opioidů; finančně nejdostupnější je na českém trhu tramadol. Vždy začínáme nejnižšími dávkami, tedy 2× 100 mg denně při použití retardovaných forem (resp. 1× 100 mg v případě 24hodinové formy) nebo 3× 50 mg (20 kapek) u forem s rychlým účinkem (IR). Pacienta poučíme o možných nežádoucích účincích léčby (závratě, nauzea, zvracení). Nemocné s horší lékovou snášenlivostí v anamnéze vybavíme metoclopramidem. Pacientům je nutné vysvětlit přechodnost uvedených nežádoucích účinků (1–2 týdny). Pokud je použití opioidů zapotřebí pouze z důvodu občasného zhoršení bolestí, vždy volíme IR formu nebo kombinované léky s paracetamolem. Výhoda léčby opioidy oproti NSA spočívá v téměř nulové orgánové toxicitě. Z hlediska rizikovosti rozvoje psychické závislosti na opioidech je nejrizikovější IR forma tramadolu. V léčbě chronických bolestí není smysluplné používání intramuskulární nebo subkutánní aplikace analgetik.
- Při přetrvávání silných chronických bolestí (hodnocených na Vizuální analogové stupnici bolesti – VAS 0–10 – stupněm vyšším než 4) je indikací k přechodu na silnou opioidní léčbu pouze intenzita bolesti, nikoli její původ (nádorová oproti nenádorové). Výběr silného opioidu je vždy individuální. Obvykle se doporučuje zahajovat léčbu tabletovou formou, která umožňuje rychlejší titraci. Vždy však začínáme nejnižší možnou dávkou a podle reakce na léčbu ji postupně titrujeme až na dávku účinnou. Cílem je dosažení VAS < 4 (na stupnici 0–10). V případě, že se nedaří dosáhnout dostatečné terapeutické odpovědi nebo když v průběhu léčby došlo k rozvoji tolerance (dříve účinná dávka již není k utlumení bolesti dostatečná), volíme rotaci opioidů. Použijeme jinou účinnou látku v ekvianalgetické dávce nebo v dávce nižší o 10–30 %.
- U některých pacientů je zapotřebí podat lék při krátkodobém zhoršení bolestí. Používáme zásadně léčiva s rychlým nástupem účinku, a to jak ze skupiny neopioidních analgetik, tak ze skupiny slabých opioidů (tramadol cps., gtt.) nebo silných opioidů (IR morfin, morfinový sirup, transmukózní fentanyl).
- V případě podávání opioidní medikace pacienta poučíme o možnosti výskytu přechodných nežádoucích účinků (nauzea, zvracení, vertigo, ospalost). Jediným přetrvávajícím nežádoucím účinkem je obstipace. Při výskytu nežádoucích účinků je třeba tyto problémy řešit, nikoli ukončit opioidní medikaci.
- Neuropatickou bolest (postherpetická neuralgie, neuralgie n. trigeminus, radikulopatie, centrální bolesti apod.) léčíme antikonvulzivy. Z léčiv bez preskripčního omezení používáme carbamazepin (s výjimkou neuralgie n. trigeminus se jedná o lék druhé volby, jako jediné antikonvulzivum je však bez preskripčního omezení); účinná dávka je od 2× 200 mg u retardovaných forem a od 3× 200 mg u neretardovaných forem. Gabapentin a pregabalin mají bohužel preskripční omezení odborností (neurologie, algeziologie), pacienty je tedy nutno odeslat na specializované pracoviště. Mezi léky první volby patří i antidepresiva, především první generace (amitriptylin, clomipramin). Účinná antidepresiva tlumící zpětné vstřebávání noradrenalinu a serotoninu (selektivní inhibitory zpětného vychytávání serotoninu a noradrenalinu – reuptake inhibitors, SNRI) mají opět preskripční omezení odborností (psychiatrie, neurologie) [4].
Invazivní metody léčby bolesti
Invazivní metody v léčbě bolestí zad jsou indikovány jako doplněk farmakoterapie bolesti nebo jako další stupeň léčby bolesti u pacientů, u kterých farmakoterapie bolesti nepřináší dostatečný klinický účinek nebo je zatížena výraznými nežádoucími účinky. I při použití invazivních léčebných postupů musí být zachován multidisciplinární přístup, který zahrnuje farmakoterapii, psychoterapii a rehabilitační a fyzikální léčbu. V ordinaci praktického lékaře lze využít infiltraci tzv. spouštěcího bodu („trigger point“).
U pacientů s myofasciálním syndromem (bolest vycházející z měkkých tkání v důsledku svalové dysbalance při špatných pohybových stereotypech) často nacházíme v hypertonickém svalu tzv. spouštěcí body. Palpačně se jedná o místo se zvýšenou citlivostí o velikosti 2–5 mm. Tlak na bod vyvolává intenzivní bolest v místě tlaku nebo bolest přenesenou. Aplikace malého množství lokálního anestetika do těchto bodů přináší velmi dobrou, ale krátkodobou úlevu. Vedle aplikace lokálního anestetika lze použít i metodu „suché jehly“ (mechanické podráždění bez aplikace látky) nebo stimulaci tlakem, ledem či kryosprejem [6].
Seznam použité literatury
- [1] Breivik H, Collett B, Ventafridda V, et al. Survey of chronic pain in Europe: Prevalence, impact on daily life, and treatment. Eur J Pain 2006; 10: 287–333.
- [2] Müller Schwefe G. Make a CHANGE: optimising communications and pain management decisions. Curr Med Res Opin 2011; 2: 481–488.
- [3] Skála B. Doporučené postupy pro farmakoterapii bolesti a jejich dopad v oblasti primární péče. Bolest 2008, 3: 151–155.
- [4] Doležal T, Hakl M, Kozák J, et al. Metodické pokyny pro farmakoterapii bolesti. Bolest (Supl.) 2009; 2: 4–27.
- [5] World Health Organization. Cancer Pain Relief with a guide to opioid availability, 1986.
- [6] Hakl M. Invazivní metody v léčbě chronické bolesti. In: Hakl M, et al. Léčba bolesti. Praha: Mladá fronta, 2011; 79–83.