Pohled na inhibici osy renin-angiotenzin-aldosteron
V roce 1999 byly poprvé prezentovány výsledky studie HOPE, která zahájila „zlatou éru“ inhibitorů ACE podávaných v léčbě po infarktu myokardu. Tato data byla později potvrzena studiemi EUROPA a PEACE. Cíle studie HOPE byly sledovány i ve studii TRANSCEND u nemocných netolerujících inhibitory ACE. V článku podáváme přehled současných poznatků o blokádě systému renin-angiotenzin-aldosteron po infarktu myokardu. Zmíněny jsou zavedené lékové skupiny, inhibitory ACE a sartany. Podrobněji je rozebrána studie HOPE a její extenze.
Data ze studií léčby hypertenze ukazovala na některé přednosti inhibitorů ACE, výsledky přímého srovnání z velkých multicentrických studií však potvrzují předpoklad, že skupiny inhibitorů ACE a sartanů jsou účinné, bezpečné a srovnatelné, není však zřejmě vhodná jejich kombinace. Blokáda systému renin-angiotenzin-aldosteron je dnes základem léčby nemocných po infarktu myokardu a v sekundární prevenci ischemické choroby srdeční, teprve další studie ale ukáží, na které úrovni je celý systém nejvhodnější blokovat.
Již dlouho je známo, že renin-angiotenzinový systém (RAS) hraje významnou roli v řadě homeostatických procesů, především v regulaci krevního tlaku, vodního a minerálního prostředí [1]. Bylo prokázáno, že angiotenzin II se významnou měrou podílí na patofyziologii nejrůznějších kardiovaskulárních onemocnění, především na rozvoji hypertenze a chronického srdečního selhání.
Angiotenzinogen (reninový substrát) je a2-globulin vznikající v játrech. Renin, proteáza produkovaná v juxtaglomerulárních buňkách, štěpí angiotezinogen na dekapeptid angiotenzin I (AI). Ten je účinkem angiotenzin konvertujícího enzymu (ACE) přeměněn na oktapeptid angiotenzin II (AII). ACE je identický s kininázou II, která štěpí vazodilatačně působící bradykinin na neúčinné fragmenty. ACE se vyskytuje v celém organismu, nejvyšší koncentrace je však v endotelu plicních cév. AI může být na AII přeměněn i alternativními cestami, především chymázovou cestou bez aktivity ACE. AII je hlavním mediátorem RAS, má poměrně krátký biologický poločas a je rychle metabolizován. Většina metabolitů je biologicky neaktivní, s výjimkou angiotenzinu III, který vykazuje určitou biologickou aktivitu, a angiotenzinu IV, jenž pravděpodobně působí v CNS. Klinicky nejvýznamnějším, ne však jediným účinkem AII je vazokonstrikce. Z dalších účinků je pak významný vliv na retenci sodíku a vody v ledvinách či vliv na proliferaci srdce i cév.
Systém renin-angiotenzin-aldosteron (RAAS) je velice důležitým regulačním mechanismem k udržení homeostázy a zajištění optimální cirkulace. Bohužel v řadě patologických situací, jakými jsou např. hypertenze, srdeční selhání či diabetes mellitus, je systém hyperaktivován, a je nutno jej tlumit. Chronické zvýšení aktivity RAAS vede totiž ke zhoršení prokrvení životně důležitých systémů, k prohloubení případné myokardiální ischemie, k aktivaci apoptotických procesů, k aktivaci koagulace a v neposlední řadě k akceleraci aterogeneze navozením endoteliální dysfunkce. Z těchto důvodů je nutno hyperaktivovaný RAAS inhibovat.
Výdej reninu můžeme částečně tlumit b-blokátory, přímými inhibitory reninu můžeme jeho účinek inhibovat. Konverzi AI na AII brzdíme inhibitory angiotenzin konvertujícího enzymu (inhibitory ACE). V periferii můžeme zablokovat aktivaci angiotenzinových receptorů typu 1 pro AII pomocí blokátorů receptorů AT1 (sartanů). Mezi blokátory RAAS řadíme i blokátory aldosteronu – spironolakton a eplerenon [1–6]. Vzhledem k tomu, že efekt β-blokátorů je v inhibici RAAS relativně slabý, inhibitory reninu jsou zkoušeny v indikaci srdeční selhání i ischemická choroba srdeční (fáze III) a v České republice mají schválenu indikaci diabetická proteinurie, zůstávají ve středu zájmu dvě skupiny – inhibitory ACE a sartany [7–12].
Inhibitory ACE v sekundární prevenci ischemické choroby srdeční
Na základě studií HOPE, EUROPA a PEACE jsou inhibitory ACE doporučovány i v léčbě asymptomatických forem ischemické choroby srdeční (ICHS) či u nemocných s rizikovými faktory pro ICHS [13–17]. Přelomová byla zejména studie HOPE, poprvé prezentovaná v roce 1999, protože byla vůbec první, která prokázala efekt ramiprilu u nemocných s chronickou formou ICHS a/nebo vysoce rizikových nemocných. Studie HOPE byla publikována v roce 2000 [17].
![Graf 1 Mortalita a kombinovaný primární cíl – infarkt myokardu (IM), cévní mozková příhoda (CMP) a kardiovaskulární (KV) úmrtí – ve studii HOPE; podle [17] – Yusuf, et al., 2000.](https://www.remedia.cz/photo-a-28047---.jpg) Jednalo se o randomizovanou studii s designem 2 x 2 kontrolovanou placebem (druhá větev byla s vitaminem E), která trvala 5 let. Zařazeno bylo 9297 pacientů s vysokým rizikem vzniku kardiovaskulární příhody ve věku 55 let nebo starších, s anamnézou vaskulárního onemocnění nebo s diabetem mellitem nebo s jinými rizikovými faktory kardiovaskulárních onemocnění. Tito pacienti neměli srdeční selhání či známky snížené funkce levé komory. Randomizováni byli k léčbě ramiprilem 10 mg denně nebo k podávání placeba.
Jednalo se o randomizovanou studii s designem 2 x 2 kontrolovanou placebem (druhá větev byla s vitaminem E), která trvala 5 let. Zařazeno bylo 9297 pacientů s vysokým rizikem vzniku kardiovaskulární příhody ve věku 55 let nebo starších, s anamnézou vaskulárního onemocnění nebo s diabetem mellitem nebo s jinými rizikovými faktory kardiovaskulárních onemocnění. Tito pacienti neměli srdeční selhání či známky snížené funkce levé komory. Randomizováni byli k léčbě ramiprilem 10 mg denně nebo k podávání placeba.
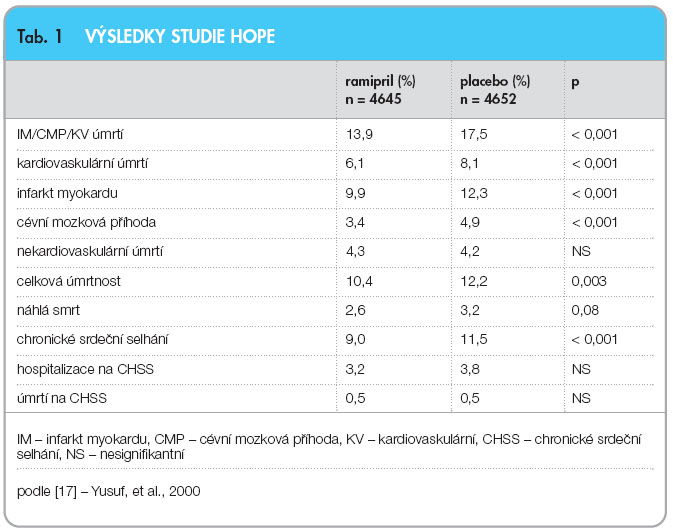 Kombinovaný primární výsledek zahrnoval výskyt infarktu myokardu, cévní mozkové příhody nebo úmrtí z kardiovaskulárních příčin. Celkem 651 pacientů, kteří užívali ramipril (13,9 %), dosáhlo primárního cíle ve srovnání s 826 pacienty, kteří dostávali placebo (graf 1, tab. 1).
Kombinovaný primární výsledek zahrnoval výskyt infarktu myokardu, cévní mozkové příhody nebo úmrtí z kardiovaskulárních příčin. Celkem 651 pacientů, kteří užívali ramipril (13,9 %), dosáhlo primárního cíle ve srovnání s 826 pacienty, kteří dostávali placebo (graf 1, tab. 1).
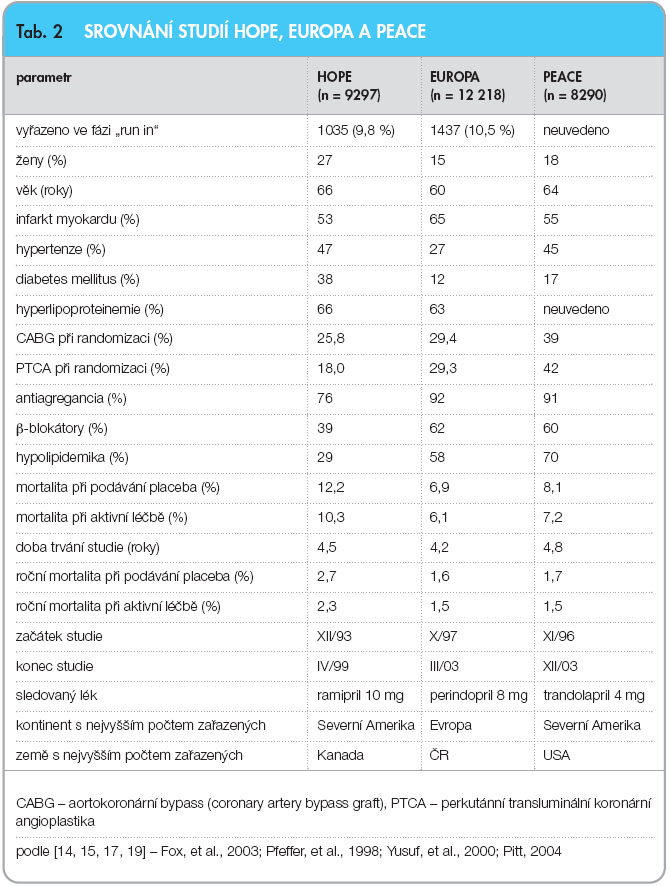
Terapie ramiprilem signifikantně snížila mortalitu, výskyt infarktu myokardu a cévních mozkových příhod. V podskupině nemocných, kde byla známa ejekční frakce vyšší než 40 % (n = ![Graf 2 Snížení mortality podle komedikace kyselinou acetylsalicylovou (ASA) ve studii HOPE; podle [17] – Yusuf, et al., 2000.](https://www.remedia.cz/photo-a-28049---.jpg) 4676), snížil ramipril celkovou mortalitu z 15,8 % na 13,6 % (p = 0,0002), kardiovaskulární mortalitu ze 7,0 % na 5,0 % (p = 0,003), výskyt infarktů myokardu z 13,5 % na 10,3 % (p = 0,01) a cévní mozkové příhody ze 4,2 % na 2,9 % (p = 0,0002). Další zajímavou podskupinou byli nemocní neužívající kyselinu acetylsalicylovou, protože u těchto nemocných byla účinnost ramiprilu dvojnásobně vyšší (graf 2).
4676), snížil ramipril celkovou mortalitu z 15,8 % na 13,6 % (p = 0,0002), kardiovaskulární mortalitu ze 7,0 % na 5,0 % (p = 0,003), výskyt infarktů myokardu z 13,5 % na 10,3 % (p = 0,01) a cévní mozkové příhody ze 4,2 % na 2,9 % (p = 0,0002). Další zajímavou podskupinou byli nemocní neužívající kyselinu acetylsalicylovou, protože u těchto nemocných byla účinnost ramiprilu dvojnásobně vyšší (graf 2).
Studie HOPE pokračovala extenzí, v níž 68 % nemocných v ramiprilové větvi a 67 % nemocných v placebové větvi pokračovalo v otevřené léčbě ramiprilem další 4 roky. Dlouhodobé sledování ukázalo trvalý efekt ramiprilu na kardiovaskulární příhody i na manifestaci nového diabetu mellitu.
 Po studii HOPE následovaly studie EUROPA (s perindoprilem) a PEACE (s trandolaprilem), které měly stejné uspořádání, žádná však již neprokázala ovlivnění celkové mortality. Studie EUROPA prokázala snížení nefatálních kardiovaskulárních příhod, studie PEACE snížení počtu hospitalizací na srdeční selhání a snížení výskytu diabetu mellitu. Vysvětlení, proč jsou výsledky těchto tří studií odlišné, se hledá především v základní charakteristice nemocných [14, 15, 17, 18] (tab. 2).
Po studii HOPE následovaly studie EUROPA (s perindoprilem) a PEACE (s trandolaprilem), které měly stejné uspořádání, žádná však již neprokázala ovlivnění celkové mortality. Studie EUROPA prokázala snížení nefatálních kardiovaskulárních příhod, studie PEACE snížení počtu hospitalizací na srdeční selhání a snížení výskytu diabetu mellitu. Vysvětlení, proč jsou výsledky těchto tří studií odlišné, se hledá především v základní charakteristice nemocných [14, 15, 17, 18] (tab. 2).
Z tab. 2 jsou patrné zásadní rozdíly mezi studiemi [19]. Studie HOPE zařadila nemocné s vysokým rizikem a velkým množstvím přidružených onemocnění, a proto je také její průměrná roční mortalita nejvyšší. V této jediné studii dosáhl rozdíl mezi rameny po 4 letech statistické významnosti (p = 0,003). Do studie EUROPA byli zařazeni nemocní s ICHS, ale s menším množstvím přidružených chorob, kteří byli mnohem intenzivněji léčeni. Při randomizaci bylo 59 % pacientů po revaskularizaci, zatímco ve studii HOPE to bylo jen 47 %, a více než 90 % nemocných užívalo antiagregační léčbu, 62 % pacientů bylo léčeno b-blokátory a 58 % hypolipidemiky. Podávání hypolipidemik stoupalo ještě během studie. Roční mortalita činila 1,6 % při podávání placeba a po více než 4 letech rozdíl nedosáhl statistické významnosti.
Nemocní ve studii PEACE byli intenzivněji léčeni než nemocní ve studii HOPE či EUROPA, při randomizaci bylo 72 % nemocných po revaskularizaci a hypolipidemickou léčbu užívalo 70 % nemocných [20]. Mortalita při podávání placeba i mortalita při aktivní léčbě byly ve studiích EUROPA a PEACE naprosto shodné (roční 1,6 %, resp. 1,7 % při podávání placeba a 1,5 % při aktivní léčbě, obojí statisticky nevýznamné).
Přesto se hledá i další vysvětlení a je možné, že svou roli hraje hladina cholesterolu a podávání hypolipidemik. Inhibitory ACE a statiny mají některé mechanismy účinku podobné, je to především aktivace lecitin-like oxidačního LDL receptoru snižující oxidaci LDL částic. Je-li koncentrace LDL cholesterolu nízká, mohou inhibitory ACE ztrácet svůj antiaterogenní účinek. Tuto teorii potvrzují především výsledky studie TREND s quinaprilem, kde zlepšení endoteliální dysfunkce po léčbě nastalo jen u nemocných s hladinami LDL cholesterolu > 3,0 mmol/l [21].
 Ve studii HOPE mělo 66 % nemocných zvýšenou hladinu celkového cholesterolu a jen 23 % nemocných užívalo hypolipidemika. Ve studii EUROPA mělo 63 % nemocných zvýšený cholesterol a 58 % jich užívalo hypolipidemika. Ve studii PEACE byla průměrná plazmatická koncentrace cholesterolu 4,96 mmol/l a 70 % nemocných užívalo hypolipidemika. Kromě plazmatické koncentrace cholesterolu a užívání hypolipidemik je ještě zajímavé srovnání hodnot krevního tlaku (tab. 3).
Ve studii HOPE mělo 66 % nemocných zvýšenou hladinu celkového cholesterolu a jen 23 % nemocných užívalo hypolipidemika. Ve studii EUROPA mělo 63 % nemocných zvýšený cholesterol a 58 % jich užívalo hypolipidemika. Ve studii PEACE byla průměrná plazmatická koncentrace cholesterolu 4,96 mmol/l a 70 % nemocných užívalo hypolipidemika. Kromě plazmatické koncentrace cholesterolu a užívání hypolipidemik je ještě zajímavé srovnání hodnot krevního tlaku (tab. 3).
Z tab. 3 je patrné, že největší pokles krevního tlaku nastal ve studii EUROPA a nejnižší vstupní hodnoty byly pozorovány ve studii PEACE. Jaká by měla být optimální hodnota krevního tlaku u nemocných s ICHS, není jasné. Z pohledu mortality prokazuje pouze studie HOPE u vysoce rizikových a nedostatečně léčených nemocných efekt inhibitorů ACE. Ovlivnění úmrtí ve studiích EUROPA a PEACE je shodné a statisticky nevýznamné.
Sartany po infarktu myokardu
 Do první mortalitní studie se sartany po infarktu myokardu – OPTIMAAL – bylo zařazeno 5477 nemocných starších 50 let s potvrzeným infarktem myokardu; pacienti byli léčeni kaptoprilem podávaným 3krát denně v dávce 50 mg, nebo losartanem v dávce 50 mg denně [22]. Veškerá další léčba byla povolena (kyselina acetylsalicylová byla podávána v 95,4 %, resp. 95,8 %, b-blokátory v 79,1 %, resp. 78,1 %, a statiny v 30,4 %, resp. 31,0 %). Studie byla ukončena po dosažení 946 úmrtí, průměrná doba sledování byla 2,7 roku. Výsledky ukazuje tab. 4.
Do první mortalitní studie se sartany po infarktu myokardu – OPTIMAAL – bylo zařazeno 5477 nemocných starších 50 let s potvrzeným infarktem myokardu; pacienti byli léčeni kaptoprilem podávaným 3krát denně v dávce 50 mg, nebo losartanem v dávce 50 mg denně [22]. Veškerá další léčba byla povolena (kyselina acetylsalicylová byla podávána v 95,4 %, resp. 95,8 %, b-blokátory v 79,1 %, resp. 78,1 %, a statiny v 30,4 %, resp. 31,0 %). Studie byla ukončena po dosažení 946 úmrtí, průměrná doba sledování byla 2,7 roku. Výsledky ukazuje tab. 4.
Z tab. 4 je patrné, že ve studii OPTIMAAL je naznačen trend u tzv. tvrdých cílů – úmrtnost, resuscitace, reinfarkty či cévní mozkové příhody – ve prospěch kaptoprilu; tento trend však ani v jednom z parametrů nedosáhl statistické významnosti. Ve spodní části tab. 4 jsou uvedeny tři hlavní nežádoucí účinky, kdy ve všech případech byl statisticky významně bezpečnější losartan než kaptopril. V této souvislosti je nejvíce diskutována celková denní dávka, kdy průměrná dávka losartanu představovala 41 mg a kaptoprilu 130 mg. To by odpovídalo srovnání střední a vysoké dávky, čemuž nasvědčuje i častější výskyt hypotenze v kaptoprilové skupině.
Studie OPTIMAAL tedy nepřinesla potvrzení většího prospěchu terapie losartanem než kaptoprilem, ba naopak byl naznačen trend ve prospěch kaptoprilu.
Velká klinická studie VALIANT srovnávala monoterapii sartany a inhibitory ACE s terapií jejich kombinací [23, 24]. V této studii byla srovnávána účinnost valsartanu, kaptoprilu a účinnost kombinace obou léčiv u nemocných v akutním stadiu infarktu myokardu (12 hodin až 19 dnů od vzniku) v případě, že nemocní měli klinické známky 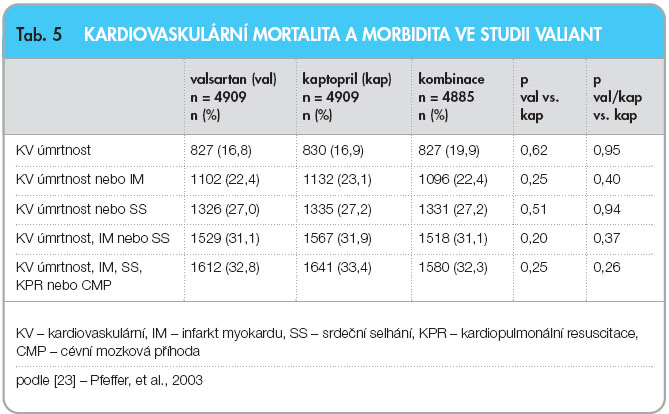 srdečního selhání a/nebo prokázanou systolickou dysfunkci levé komory. Do studie bylo zařazeno 14 703 nemocných, kteří byli randomizováni do tří skupin: valsartan (n = 4909) v cílové dávce 160 mg 2krát denně, kaptopril (n = 4909) v cílové dávce 50 mg 3krát denně nebo kombinace (n = 4885) v cílových dávkách: valsartan 80 mg 2krát denně + kaptopril 50 mg 3krát denně. Jako primární cíl byla určena celková úmrtnost. Studie trvala průměrně 24,7 měsíce a výsledky ukazuje tab. 5.
srdečního selhání a/nebo prokázanou systolickou dysfunkci levé komory. Do studie bylo zařazeno 14 703 nemocných, kteří byli randomizováni do tří skupin: valsartan (n = 4909) v cílové dávce 160 mg 2krát denně, kaptopril (n = 4909) v cílové dávce 50 mg 3krát denně nebo kombinace (n = 4885) v cílových dávkách: valsartan 80 mg 2krát denně + kaptopril 50 mg 3krát denně. Jako primární cíl byla určena celková úmrtnost. Studie trvala průměrně 24,7 měsíce a výsledky ukazuje tab. 5.
Při rozdělení celého souboru podle různých charakteristik, jako je věk, pohlaví, výskyt diabetu, hodnota krevního tlaku, doprovodná léčba atd., nebyl ani v jednom případě nalezen statisticky významný rozdíl mezi léčbou valsartanem a kaptoprilem ani mezi monoterapií a kombinační léčbou. Při kombinační léčbě byl zaznamenán vyšší výskyt nežádoucích účinků než u monoterapie. Výskyt kašle byl významně menší u nemocných léčených pouze valsartanem.
Sartany doporučujeme těm nemocným po infarktu myokardu, u kterých je indikováno podávání inhibitorů ACE, avšak nemocný je netoleruje pro suchý kašel [23, 25–30].
Srovnání sartanů s inhibitory ACE v sekundární prevenci ischemické choroby srdeční
Odpověď, zda v sekundární prevenci infarktu myokardu jsou obě skupiny rovnocenné, nebo je některá výhodnější, přinesla až studie ONTARGET [26, 31, 32]. Studie sledovala 25 577 nemocných s ischemickou chorobou srdeční, s ischemickou chorobou dolních končetin nebo mozku nebo s diabetem a orgánovým poškozením. Studie probíhala ve 40 zemích (včetně ČR), v 733 centrech. Studie začínala tzv. run in periodou, kdy bylo užíváno 2,5 mg ramiprilu, nebo 40 mg telmisartanu denně a byla zjišťována tolerance léčiv. Pokud pacienti léčivo netolerovali, nebyli dále randomizováni. Celkem bylo takto vyloučeno 3399 nemocných, většina pro nedostatečnou compliance, 597 pro hypotenzi, 223 pro hyperkalemii. Nemocní pak byli randomizováni k léčbě ramiprilem 10 mg nebo telmisartanem 80 mg denně nebo k terapii kombinující obě léčiva. Studie byla ukončena v souladu s protokolem po dosažení konečného počtu sledovaných cílů (endpointů). Všichni nemocní dostávali velmi dobrou doprovodnou léčbu.
Za šest týdnů poklesl krevní tlak o 6,4/4,3 mm Hg při léčbě ramiprilem, o 7,4/5,0 mm Hg při léčbě telmisartanem a o 9,8/6,3 mm Hg při léčbě kombinací. Tento trend pokračoval po celou dobu studie, kdy pokles tlaku při léčbě telmisartanem byl o 0,9/0,6 mm Hg větší a při léčbě kombinací o 2,4/1,4 mm Hg větší než při léčbě ramiprilem i na konci studie.
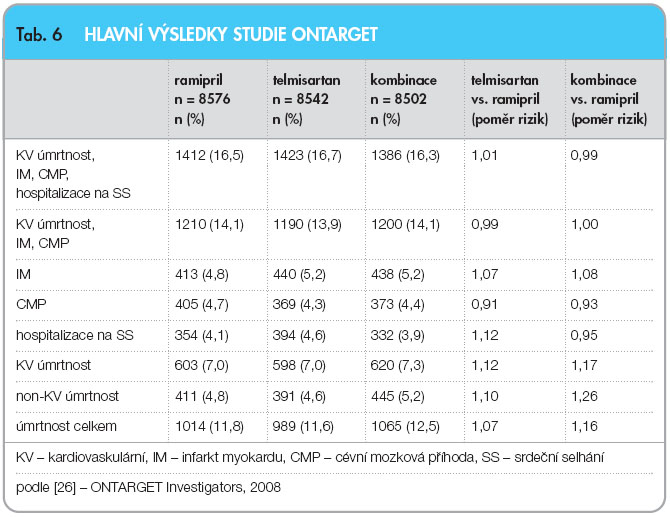 Pro nežádoucí účinky léčby ramiprilem ukončilo studii 2099 (24,5 %) nemocných, ve skupině léčené telmisartanem to bylo 1962 (23,0 %) nemocných a ve skupině léčené kombinací ukončilo účast ve studii 2495 (29,3 %; p < 0,001) nemocných. Hlavní rozdíl byl ve vyšším výskytu hypotenze (p < 0,001), průjmu (p < 0,001) a renální insuficience (p < 0,001) při léčbě kombinací. Hlavní výsledky studie ONTARGET ukazuje tab. 6.
Pro nežádoucí účinky léčby ramiprilem ukončilo studii 2099 (24,5 %) nemocných, ve skupině léčené telmisartanem to bylo 1962 (23,0 %) nemocných a ve skupině léčené kombinací ukončilo účast ve studii 2495 (29,3 %; p < 0,001) nemocných. Hlavní rozdíl byl ve vyšším výskytu hypotenze (p < 0,001), průjmu (p < 0,001) a renální insuficience (p < 0,001) při léčbě kombinací. Hlavní výsledky studie ONTARGET ukazuje tab. 6.
Ani v jednom z parametrů nebylo dosaženo statistické významnosti a z pohledu hlavních cílů je léčba ramiprilem, telmisartanem i jejich kombinací srovnatelná. Z hlediska vedlejších cílů nebyl zaznamenán rozdíl v počtu revaskularizací, v počtu hospitalizací pro anginu pectoris, v počtu případů nově diagnostikovaného diabetu ani v počtu nových srdečních selhání a fibrilace síní. Jediný rozdíl byl ve výskytu renálního selhání, které bylo statisticky významně častější při kombinační léčbě (10,2 % vs. 10,6 % vs. 13,5 %; p < 0,001).
Studie ONTARGET potvrdila rovnocennost telmisartanu a ramiprilu v sekundární prevenci ICHS a zároveň zřetelně upozornila na nebezpečí zhoršení renálních funkcí při léčbě jejich kombinací.
Výsledky studie ONTARGET jsou velmi podobné výsledkům studie VALIANT, obě studie ukazují, že léčba kombinací sartanů a inhibitorů ACE je provázena významným rizikem nežádoucích účinků. Kombinační léčba u nemocných po infarktu myokardu proto není doporučena. Ramipril zůstává zlatým standardem, telmisartan vykazoval srovnatelný efekt jako ramipril, ne však lepší.
Sartany v sekundární prevenci ischemické choroby srdeční
Poslední velkou ukončenou studií u nemocných v sekundární prevenci ICHS je studie TRANSCEND; bylo do ní zařazeno 5926 pacientů, kteří netolerovali inhibitory ACE, a srovnáván byl telmisartan s placebem [33]. Podávání telmisartanu po dobu průměrně 56 měsíců vedlo ke snížení primárního cíle – počtu kardiovaskulárních úmrtí, infarktů myokardu, cévních mozkových příhod a hospitalizací pro srdeční selhání – pouze o 8 % (15,8 % vs. 17,0 % v placebové větvi), což nedosáhlo statistické významnosti (tab. 7). Zajímavé jsou některé vedlejší cíle, především diabetes mellitus nově zjištěný u 209 (11,0 %) pacientů léčených telmisartanem vs. 245 (12,8 %; p = 0,08) pacientů ve skupině s placebem a nově se objevivší hypertrofie levé komory u 128 (5,0 %) pacientů léčených 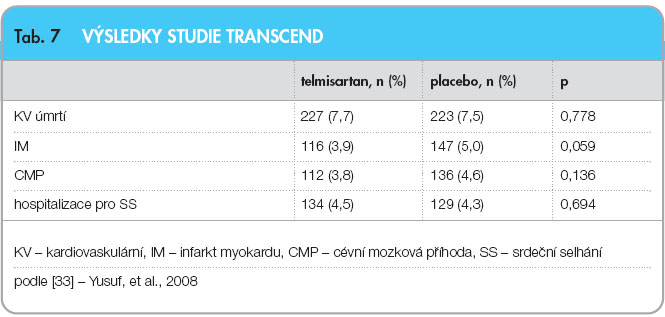 telmisartanem vs. 202 (7,9 %; p < 0,001) pacientů ve skupině s placebem.
telmisartanem vs. 202 (7,9 %; p < 0,001) pacientů ve skupině s placebem.
![Graf 3 Výskyt HOPE primárního cíle (infarkt myokardu, cévní mozková příhoda nebo úmrtí z kardiovaskulárních příčin) ve studii TRANSCEND; podle [33] – Yusuf, et al., 2008; HR – hazard ratio](https://www.remedia.cz/photo-a-28056---.jpg) Studie TRANSCEND je jasným potvrzením výsledků studie PEACE. V dnešní době kvalitní farmakoterapie po infarktu myokardu nelze očekávat další výrazné snižování mortality pomocí žádné nové lékové skupiny. Studie TRANSCEND neprokázala snížení mortality, prokázala však snížení tzv. HOPE primárního cíle (graf 3).
Studie TRANSCEND je jasným potvrzením výsledků studie PEACE. V dnešní době kvalitní farmakoterapie po infarktu myokardu nelze očekávat další výrazné snižování mortality pomocí žádné nové lékové skupiny. Studie TRANSCEND neprokázala snížení mortality, prokázala však snížení tzv. HOPE primárního cíle (graf 3).
Závěr
![Graf 4 Preskripce blokátorů renin-angiotenzin-aldosteronového systému (inhibitorů ACE a sartanů) u pacientů po koronární příhodě ve studiích EUROASPIRE; podle [34, 35] – EUROASPIRE Study Group.](https://www.remedia.cz/photo-a-28057---.jpg) Blokáda osy renin-angiotenzin-aldosteron je v současnosti doporučována všem nemocným po infarktu myokardu. Nejvíce dat prokazujících snížení morbidity a mortality máme dnes pro inhibitory ACE, rovnocenné jsou jim sartany. Kombinace obou skupin však pravděpodobně není vhodná. K těmto lékům přidáváme blokátory aldosteronu v malé dávce za pravidelné kontroly plazmatických hladin draslíku. Přímé inhibitory reninu mají v České republice prozatím schválenu pouze
Blokáda osy renin-angiotenzin-aldosteron je v současnosti doporučována všem nemocným po infarktu myokardu. Nejvíce dat prokazujících snížení morbidity a mortality máme dnes pro inhibitory ACE, rovnocenné jsou jim sartany. Kombinace obou skupin však pravděpodobně není vhodná. K těmto lékům přidáváme blokátory aldosteronu v malé dávce za pravidelné kontroly plazmatických hladin draslíku. Přímé inhibitory reninu mají v České republice prozatím schválenu pouze ![Graf 5 Preskripce u pacientů po infarktu myokardu při propouštění z nemocnice (výsledky analýzy registru BRNO); podle [12] – Špinar, et al., 2009.](https://www.remedia.cz/photo-a-28058---.jpg) indikaci proteinurie u diabetické nefropatie. Studie HOPE nebyla dosud překonána. Všechny následující studie s inhhibitory ACE i sartany potvrzují platnost výsledků studie HOPE. O tom, že zjištění ze studie HOPE významně ovlivnila klinickou praxi, svědčí i výsledky projektu EUROASPIRE 3, kdy preskripce blokátorů RAAS u pacientů po koronární příhodě v evropských zemích dosáhla 80 % (graf 4). Naše vlastní data potvrzují 90% preskripci blokátorů RAAS při propouštění pacientů po infarktu myokardu z nemocnice (graf 5) [12].
indikaci proteinurie u diabetické nefropatie. Studie HOPE nebyla dosud překonána. Všechny následující studie s inhhibitory ACE i sartany potvrzují platnost výsledků studie HOPE. O tom, že zjištění ze studie HOPE významně ovlivnila klinickou praxi, svědčí i výsledky projektu EUROASPIRE 3, kdy preskripce blokátorů RAAS u pacientů po koronární příhodě v evropských zemích dosáhla 80 % (graf 4). Naše vlastní data potvrzují 90% preskripci blokátorů RAAS při propouštění pacientů po infarktu myokardu z nemocnice (graf 5) [12].
Práce byla podpořena grantem IGA MZ 9880-3.
Seznam použité literatury
- [1] Bonvalet JP, Alfaidy N, Farman N, et al. Aldosterone: intracellular receptors in human heart. Eur Heart J 1995; 16 (suppl. N): 92–97.
- [2] Bozkurt B, Agoston I, Knowlton AA. Complications of inappropriate use of spironolactone in heart failure: when an old medicine spirals out of new guidelines. J Am Coll Cardiol 2003; 41: 211–214.
- [3] Farquharson CAJ, Struthers AD. Aldosteron induces acute endothelial dysfunction in vivo in humans: evidence for aldosterone-induced vasculopathy. Clin Sci 2002; 103: 425–431.
- [4] Garthwaite SM, McMahon EG. The evolution of aldosterone antagonists. Molecular and Cellular Endocrinology 2004; 217: 27–31.
- [5] Pitt B, Remme W, Zannad F, et al. Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med 2003; 348: 1309–1321.
- [6] Pitt B, Zannad F, Remme WJ, et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. N Engl J Med 1999; 341: 709–717.
- [7] Borer J. Angiotensin-converting enzyme inhibition: a landmark advance in treatment cardiovascular diseases. Eur Heart J Suppl 2007; 9: B2–B9.
- [8] Braunwald E. ACE inhibitors: a cornerstone of the treatment of heart failure. N Engl J Med 1991; 325: 351–353.
- [9] Souček M, Fráňa P, Plachý M, Řiháček I. Aliskiren. Remedia 2008; 18: 286–272.
- [10] Struthers AD, Mac Donald TM. Review of aldosterone and angiotensin II-induced target organ damage and prevention. Cardiovascular research 2004; 61: 663–670.
- [11] Svensson M, Gustafsson F, Galatius S, et al. How prevalent is hyperkalemia and renal dysfunction during treatment with spironolactone in patients with congestive heart failure? J Card Failure 2004; 10: 297–303.
- [12] Špinar J, Sepši M, Ludka O. Registr Brno – Farmakoterapie po infarktu myokardu. Cor Vasa 2009; 51: 128–130.
- [13] Backer G, Ambrosioni E, Borch-Jonsen K, et al. European guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J 2003; 24: 1601–1610.
- [14] Fox KM; The EURopean Trial On reduction of cardiac events with Perindopril in stable coronary Artery disease Investigators. Efficacy of perindopril in reduction of cardiovascular events among patients with stable coronary artery disease: randomised, double-blind, placebo-controlled, multicentre trial (the EUROPA study). Lancet 2003; 362: 782–788.
- [15] Pfeffer MA, Domanski M, Rosenberg Y, et al. Prevention of events with angiotensin-converting enzyme inhibition (the PEACE study design). Prevention of Events with Angiotensin-Converting Enzyme Inhibition. Am J Cardiol 1998; 82: 25H–30H.
- [16] Widimský P. Studie EUROPA: Úspěch perindoprilu a české kardiologie. Cor Vasa 2004; 46: 7–8.
- [17] Yusuf S, Sleight P, Pogue J, et al. The Heart Outcomes Prevention Evaluation Study Investigators. Effects of an angiotensin-converting-enzyme inhibitor, ramipril, on cardiovascular events in high-risk patients. N Engl J Med 2000; 342: 145–153.
- [18] Špinar J, Vítovec J. Ischemická choroba srdeční. Grada 2003; 360 s.
- [19] Pitt B. ACE inhibitors for patients with vascular disease without left ventricular dysfunction – may they rest in peace? N Engl J Med 2004; 351: 2115–2117.
- [20] The PEACE Trial Investigators. Angiotensin-converting-enzyme inhibition in stable coronary artery disease. N Engl J Med 2004; 351: 2058–2068.
- [21] Mancini GB, Henry GC, Macaya C. Angiotensin-converting enzyme inhibition with quinapril improved endothelial vasomotor dysfunction in patients with coronary artery disease. Circulation 1996; 94: 258–265.
- [22] Dickstein K, Kjekshus J and OPTIMAAL Study Group. Effects od losartan nad captopril on mortality and morbidity in high-risk patients after acute myocardial infarction: the OPTIMAAL randomised trial. Lancet 2002; 360: 752–760.
- [23] Pfeffer MA, McMurray JJV, Velazquez EJ, et al. (for VALIANT Investigators). Valsartan, Captopril, or Both in Myocardial Infarction Complicated by Heart Failure, Left Ventricular Dysfunction, or Both. N Engl J Med 2003; 349: 1893–1906.
- [24] Valsartan Heart Failure Trial Investigators, Cohn JN, Tognoni G. A randomized trial of the angiotensin-receptor blocker valsartan in chronic heart failure. New Engl J Med 2001; 345: 1667–1675.
- [25] Julius S. za řešitele studie VALUE: Outcomes in hypertensive patients at high risk treated with regimens based on valsartan or amlodipine: the VALUE randomised trial. Lancet 2004; 363: 2022–2031.
- [26] ONTARGET Investigators, Yusuf S, Teo KK, et al. Telmisartan, ramipril or both in patients at high risk for vascular events. N Engl J Med 2008; 358: 1547–1559.
- [27] Pitt B, Poole-Wilson PA, Segal R, et al. Effect of losartan compared with captopril on mortality in patients with symptomatic heart failure: randomized trial: the Losartan Heart Failure Survival Study ELITE II. Lancet 2000; 355: 1582–1587.
- [28] Pitt B, Segal R, Martinez FA, et al. Randomized trial of losartan versus captopril in patients over 65 with heart failure (Evaluation of Losartan in the Elderly study, ELITE). Lancet 1997; 349: 747–752.
- [29] Vítovec J, Špinar J. Mohou blokátory receptorů pro angiotenzin II (AIIA) nahradit v léčbě srdečního selhání inhibitory ACE? Cor Vasa 2003; 45: 169–170.
- [30] Vítovec J, Špinar J. Farmakoterapie kardiovaskulárních onemocnění. Grada 2004; 248 s.
- [31] Špinar J, Vítovec J. Inhibitory ACE nebo sartany u ischemické choroby srdeční? Interní medicína pro praxi 2008; 10: 273–276.
- [32] Špinar J, Vítovec J. Inhibitory ACE nebo sartany v léčbě pacientů po infarktu myokardu? Cor Vasa 2009; 51: 103–111.
- [33] Yusuf S for the TRANSCEND investigators. Effects of the angiotensin-receptor blocker telmisartan on cardiovascular event in high risk patients intolerant to angiotensin-converting enzyme inhibitors: a randomised controlled trial. Lancet 2008; 372: 1174–1183.
- [34] EUROASPIRE II Study Group. Lifestyle and risk factor management and use of drug therapies in coronary patients from 15 countries; principal results from EUROASPIRE II Euro Heart Survey Programme. Lancet 2001; 357: 995–1001.
- [35] Kotseva K, Wood D, De Backer G, et al. EUROASPIRE III: a survey on the lifestyle, risk factors and use of cardioprotective drug therapies in coronary patients from 22 European countries. Eur J Cardiovasc Prev Rehabil 2009; 16: 121–137.