Posuzování léčebné odpovědi u zhoubných nádorů a potřeba úpravy kritérií pro hodnocení účinnosti imunoterapie
Odpověď na imunoterapii může být ve srovnání s chemoterapií opožděná a může se dostavit i po přechodném zvětšení nádoru nebo po objevení se nových nádorových lézí. Podle standardních evaluačních kritérií (WHO nebo RECIST) by taková odpověď byla hodnocena jako progrese onemocnění. Výsledky klinických studií s některými inhibitory tyrozinkináz, s použitím protinádorových vakcín a zejména s použitím protilátek proti antigenu CTLA-4 ukázaly objektivní odpověď nebo stabilizaci choroby u nemocných, přestože došlo k přechodnému zvětšení nádoru nebo se objevily nové léze. Proto byla navržena nová pravidla pro hodnocení účinku imunoterapie (irRC – immune-related response criteria).
Postupné zavádění nových prostředků pro léčbu zhoubných nádorů si vynutilo potřebu jednotných a objektivních kritérií pro hodnocení účinnosti. Jejich zavedení mělo umožnit i porovnání léčebných výsledků dosažených na různých pracovištích. Tak již v roce 1981 byla zveřejněna kritéria Světové zdravotnické organizace (WHO), jejichž hlavní principy platí přes drobné úpravy dodnes [1]. Podle těchto kritérií může být odpověď charakterizována ve čtyřech kategoriích. Úplná odpověď (CR = complete remission) znamená vymizení všech měřitelných i neměřitelných známek onemocnění v průběhu nejméně 4 týdnů. U měřitelných ložisek se udávají dva rozměry – největší průměr a největší na něj kolmý rozměr. Za neměřitelné léze se považuje postižení kostí, nádorové výpotky, nádorová lymfangiitida nebo postižení mening. Částečná odpověď (PR = partial remission) znamená změnu měřitelných lézí, která odpovídá jejich zmenšení ve dvourozměrném sledování o 50 % a ústup neměřitelných změn, opět v časovém rozmezí 4 týdnů. Stabilizace choroby (SD = stable disease) odpovídá buď ústupu změn o méně než 50 % nebo jejich progresi o méně než 25 %. Progrese onemocnění (PD = progressive disease) znamená zvětšení existujících měřitelných lézí o více 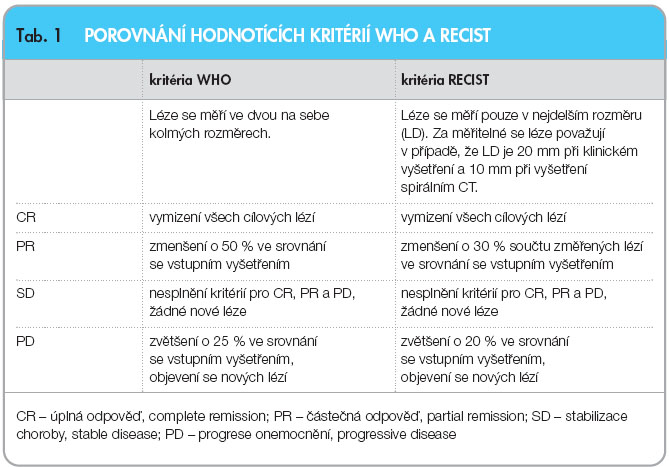 než 25 %, popřípadě objevení se nové, dříve nepoznané léze. Základní principy hodnocení zůstaly zachovány i v navržené modifikaci známé pod zkratkou RECIST (Response Evaluation Criteria in Solid Tumors) [2, 3], podle níž se posuzují všechny měřitelné léze o průměru větším než 20 mm při klinickém vyšetření a větším než 10 mm při vyšetření spirálním CT. Rozdíl je též v posuzování PR a PD. Za PR se považuje zmenšení součtu všech nejdelších průměrů měřitelných lézí o 30 % a za PD nárůst součtu nejdelších průměrů měřitelných lézí o 20 %. I tato klasifikace byla v roce 2009 mírně modifikována [4]. Bližší specifikace a porovnání obou klasifikací uvádí tab. 1.
než 25 %, popřípadě objevení se nové, dříve nepoznané léze. Základní principy hodnocení zůstaly zachovány i v navržené modifikaci známé pod zkratkou RECIST (Response Evaluation Criteria in Solid Tumors) [2, 3], podle níž se posuzují všechny měřitelné léze o průměru větším než 20 mm při klinickém vyšetření a větším než 10 mm při vyšetření spirálním CT. Rozdíl je též v posuzování PR a PD. Za PR se považuje zmenšení součtu všech nejdelších průměrů měřitelných lézí o 30 % a za PD nárůst součtu nejdelších průměrů měřitelných lézí o 20 %. I tato klasifikace byla v roce 2009 mírně modifikována [4]. Bližší specifikace a porovnání obou klasifikací uvádí tab. 1.
Uvedená kritéria umožňují relativně spolehlivě posoudit odpověď na cytotoxickou léčbu, která bez ohledu na chemickou strukturu účinné látky ovlivňuje růst nádoru podobnými mechanismy. Obecně přijímanou premisou je fakt, že má-li dojít k účinné léčbě nádoru, musí být tato léčba doprovázena nejprve zmenšením či vymizením nádorové masy. Pro cytotoxické látky tedy platí, že časné zvětšení nádoru a/nebo objevení se nové léze signalizuje progresi choroby (PD). Tento termín je v podstatě synonymem pro selhání léku a doporučuje se terapii ukončit a pacienta převést na jiný typ terapie či do klinické studie. V posledních letech se však stále častěji uplatňuje u nádorových onemocnění cílená léčba a imunoterapie především monoklonálními protilátkami. Ukazuje se, že striktní posuzování odpovědi podle výše zmíněných kritérií není zcela spolehlivé a může vést k odmítnutí léčiva. Stabilizace onemocnění, které se při hodnocení účinku chemoterapie přikládá malý význam (pro její krátké ![Graf 1 Znázornění možné protinádorové odpovědi po aplikaci imunoterapie v porovnání s chemoterapií; nástup účinku může být pomalejší, a přestože imunoterapie nemusí mít vliv na přežívání bez progrese, může mít příznivý vliv na celkovou dobu přežití (křížek znamená úmrtí); upraveno podle [26] – Wolchok, et al., 2009.](https://www.remedia.cz/photo-a-28152---.jpg) trvání), nabývá po léčbě některými inhibitory tyrozinkináz značného významu [5]. Podobná data se objevují v případě léčby protinádorovými vakcínami nebo při použití imunoterapie blokující CTLA-4 (cytotoxic T-lymphocyte antigen 4). Účinky imunoterapie mohou být na rozdíl od chemoterapie časově opožděné, a proto je třeba pečlivě zvážit čas, kdy se má efekt imunoterapie hodnotit [6]. To je dáno jiným mechanismem působení, kdy musí dojít nejprve k aktivaci buněk imunitního systému, k jejich vycestování do lokální spádové uzliny, k jejich pomnožení, návratu do místa protinádorového účinku a v ideálním případě k napadení a destrukci nádorové tkáně. K tomuto účinku nedojde logicky v řádu dnů či týdnů, ale spíše měsíců, podobně jako je tomu při aplikaci dárcovských lymfocytů (DLI) u relabující chronické myeloidní leukemie. Ukazuje se, že cytogenetické odpovědi se po DLI objevují po delší době (za 5–6 měsíců, ale i déle než po1 roce) [7, 8]. Možnou protinádorovou
trvání), nabývá po léčbě některými inhibitory tyrozinkináz značného významu [5]. Podobná data se objevují v případě léčby protinádorovými vakcínami nebo při použití imunoterapie blokující CTLA-4 (cytotoxic T-lymphocyte antigen 4). Účinky imunoterapie mohou být na rozdíl od chemoterapie časově opožděné, a proto je třeba pečlivě zvážit čas, kdy se má efekt imunoterapie hodnotit [6]. To je dáno jiným mechanismem působení, kdy musí dojít nejprve k aktivaci buněk imunitního systému, k jejich vycestování do lokální spádové uzliny, k jejich pomnožení, návratu do místa protinádorového účinku a v ideálním případě k napadení a destrukci nádorové tkáně. K tomuto účinku nedojde logicky v řádu dnů či týdnů, ale spíše měsíců, podobně jako je tomu při aplikaci dárcovských lymfocytů (DLI) u relabující chronické myeloidní leukemie. Ukazuje se, že cytogenetické odpovědi se po DLI objevují po delší době (za 5–6 měsíců, ale i déle než po1 roce) [7, 8]. Možnou protinádorovou ![Obr. 1 Zjednodušené schéma odpovědi na imunoterapii – objektivní odpověď, progrese a tzv. pseudoprogrese podle kritérií irRC; upraveno podle [19] – Ribas, et al., 2007.](https://www.remedia.cz/photo-a-28153---.jpg) odpověď u solidních nádorů po aplikaci imunoterapie v porovnání s chemoterapií schematicky znázorňuje graf 1. Po imunoterapii se může objektivní odpověď projevit později a může se objevit i atypická odpověď na léčbu. Nádor se po aplikaci imunoterapeutické léčby může zvětšit v důsledku jeho infiltrace proliferujícími T-lymfocyty, které napadají nádorovou tkáň (pseudoprogrese). Mohou se též objevit nová nádorová ložiska, neboť původně neznatelná léze se po infiltraci buňkami imunitního systému zvětší a je chybně vyhodnocena jako progrese choroby (obr. 1). Tyto změny nelze postihnout v klasifikaci WHO ani RECIST. Příkladem mohou být výsledky klinických studií s výše uvedenými formami protinádorové léčby, jak rozvedeme v následujícím textu.
odpověď u solidních nádorů po aplikaci imunoterapie v porovnání s chemoterapií schematicky znázorňuje graf 1. Po imunoterapii se může objektivní odpověď projevit později a může se objevit i atypická odpověď na léčbu. Nádor se po aplikaci imunoterapeutické léčby může zvětšit v důsledku jeho infiltrace proliferujícími T-lymfocyty, které napadají nádorovou tkáň (pseudoprogrese). Mohou se též objevit nová nádorová ložiska, neboť původně neznatelná léze se po infiltraci buňkami imunitního systému zvětší a je chybně vyhodnocena jako progrese choroby (obr. 1). Tyto změny nelze postihnout v klasifikaci WHO ani RECIST. Příkladem mohou být výsledky klinických studií s výše uvedenými formami protinádorové léčby, jak rozvedeme v následujícím textu.
Klinické zkušenosti s hodnocením léčby některými inhibitory tyrozinkináz
Použití kritérií WHO či RECIST se ukázalo jako problematické např. při hodnocení léčebného účinku některých inhibitorů tyrozinkináz (TKI). Při léčbě gastrointestinálního stromálního tumoru imatinibem ukázali Benjamin a kol. [9], že tato terapie neprodlužuje dobu do progrese, ale významně prodlužuje celkovou dobu přežití. Předčasné ukončení léčby pro její zdánlivou neúčinnost by nemocného mohlo poškodit. Podobné rozpory v hodnocení byly popsány po léčbě sorafenibem u karcinomu ledviny. Významná část nemocných považovaných za „neodpovídající na léčbu“ podle kritérií RECIST (menší než 25% zmenšení nádoru) měla z pokračující léčby prospěch vyjádřený prodloužením doby do progrese i prodloužením doby přežití [10]. Podobná pozorování byla učiněna i po léčbě sunitinibem [11].
Klinické zkušenosti s imunoterapií vakcínami na bázi dendritických buněk
Vývoj nových technik kultivace buněk umožnil in vitro produkovat velká množství dendritických buněk jako předpoklad jejich terapeutického využití k vakcinaci. Vznikla tak nová metoda protinádorové imunoterapie. Příkladem může být vakcína sipuleucel-T proti karcinomu prostaty rezistentnímu na hormonální léčbu. Byla připravena in vitro kultivací dendritických buněk s chimérickým proteinem obsahujícím GM-CSF (růstový faktor stimulující kolonie granulocytů a makrofágů) a s prostatickou kyselou fosfatázou, která je silně exprimována u více než 90 % buněk karcinomu prostaty. Výsledky první velké studie III. fáze klinického zkoušení nesplnily předpoklad účinku vakcíny na prodloužení doby do progrese [12]. Ukázalo se však, že pacienti léčení sipuleucelem-T měli delší medián přežití než pacienti, kteří dostávali placebo [13]. Tyto příznivé účinky potvrdila i další klinická studie. Doba do progrese se neprodloužila, ale celková doba přežití byla významně delší [14]. Tato data ukazují, že na rozdíl od cytotoxických látek potřebují vakcíny určitý čas k nastartování imunitní odpovědi. Je pravděpodobné, že podobná hlediska hodnocení bude nutno uplatnit i pro posouzení účinnosti další vakcíny z dendritických buněk (lapuleucel-T), určené k léčbě karcinomu prsu [15].
Klinické zkušenosti s imunoterapií využívající anti-CTLA-4 protilátek
CTLA-4 se vyskytuje na povrchu T-lymfocytů a patří spolu s antigenem CD28 k hlavním regulátorům imunologické odpovědi. CD28 je přítomen konstitutivně na povrchu T-lymfocytů, je pozitivním kostimulátorem T-buněk a zvyšuje jejich proliferaci a produkci IL-2. CTLA-4 naopak „vypíná“ či tlumí i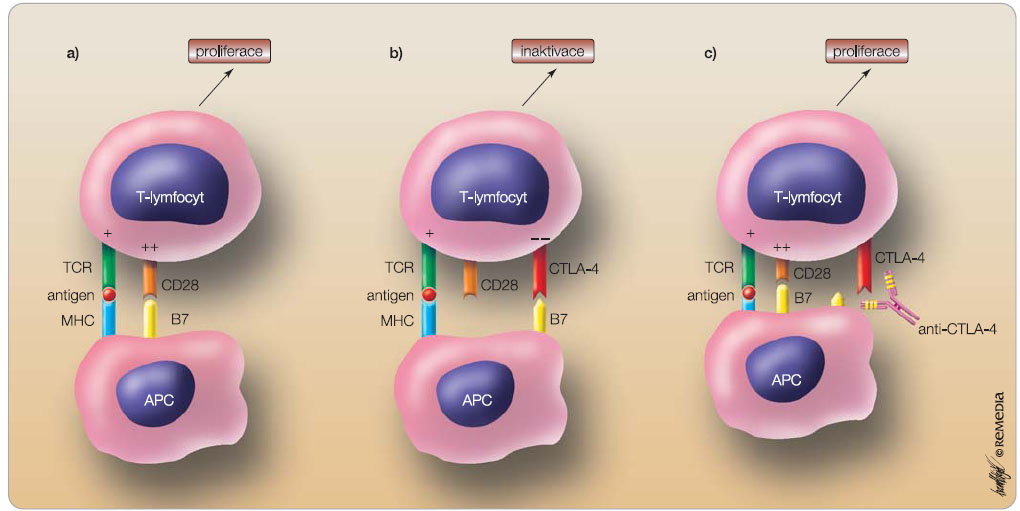 munitní odpověď. Jeho hlavní funkcí je ustavení a udržení tzv. periferní tolerance. Převaha účinku CTLA-4 je dána jeho vyšší afinitou k ligandům B7 – povrchovým molekulám buněk APC (buněk prezentujících antigen). Blokáda CTLA-4 tedy ruší jeho inhibiční signál a následně (v kooperaci s CD28) umožňuje dlouhodobou aktivaci a proliferaci T-lymfocytů a v ideálním případě napadení a destrukci nádorových buněk, viz obr. 2 [16, 17].
munitní odpověď. Jeho hlavní funkcí je ustavení a udržení tzv. periferní tolerance. Převaha účinku CTLA-4 je dána jeho vyšší afinitou k ligandům B7 – povrchovým molekulám buněk APC (buněk prezentujících antigen). Blokáda CTLA-4 tedy ruší jeho inhibiční signál a následně (v kooperaci s CD28) umožňuje dlouhodobou aktivaci a proliferaci T-lymfocytů a v ideálním případě napadení a destrukci nádorových buněk, viz obr. 2 [16, 17].
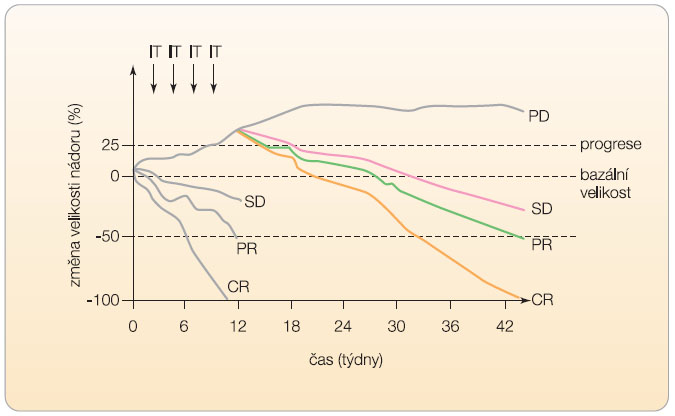 Ve vývoji jsou v současné době dvě lidské monoklonální protilátky blokující CTLA-4, a to ipilimumab (IgG1 protilátka) a tremelimumab (dříve ticilimumab, homologní IgG2 protilátka). Obě protilátky byly klinicky testovány v multicentrických randomizovaných studiích zejména u karcinomu prostaty a u maligního melanomu [18–20], ale též u nemalobuněčného karcinomu plic nebo karcinomu pankreatu [21, 22]. Při analýze výsledků těchto studií, především s metastazujícím melanomem, se ukázalo, že podle kritérií WHO byla odpověď (CR + PR + SD) zaznamenána přibližně u 30 % nemocných [23]. U části pacientů se však objevily nové typy odpovědi, které se nevyskytují u klasické chemoterapie, jak znázorňuje graf 2. Přibližně u 10 % nemocných byla zjištěna odpověď po původním zvětšení celkové nádorové masy nebo navzdory přítomnosti nových ložisek (podle WHO by se hodnotilo jako PD). Všechny tyto odpovědi byly spojeny s lepším přežíváním nemocných s pokročilým onemocněním. Právě na základě těchto studií se ukázalo, že odpověď na podávání protilátek blokujících CTLA-4 a jejich terapeutický přínos nelze objektivně zhodnotit ani podle škály WHO, ani podle škály RECIST [24, 25].
Ve vývoji jsou v současné době dvě lidské monoklonální protilátky blokující CTLA-4, a to ipilimumab (IgG1 protilátka) a tremelimumab (dříve ticilimumab, homologní IgG2 protilátka). Obě protilátky byly klinicky testovány v multicentrických randomizovaných studiích zejména u karcinomu prostaty a u maligního melanomu [18–20], ale též u nemalobuněčného karcinomu plic nebo karcinomu pankreatu [21, 22]. Při analýze výsledků těchto studií, především s metastazujícím melanomem, se ukázalo, že podle kritérií WHO byla odpověď (CR + PR + SD) zaznamenána přibližně u 30 % nemocných [23]. U části pacientů se však objevily nové typy odpovědi, které se nevyskytují u klasické chemoterapie, jak znázorňuje graf 2. Přibližně u 10 % nemocných byla zjištěna odpověď po původním zvětšení celkové nádorové masy nebo navzdory přítomnosti nových ložisek (podle WHO by se hodnotilo jako PD). Všechny tyto odpovědi byly spojeny s lepším přežíváním nemocných s pokročilým onemocněním. Právě na základě těchto studií se ukázalo, že odpověď na podávání protilátek blokujících CTLA-4 a jejich terapeutický přínos nelze objektivně zhodnotit ani podle škály WHO, ani podle škály RECIST [24, 25].
Návrh nových kritérií pro hodnocení imunoterapie irRC
-
Úplná odpověď (irCR) – úplné vymizení všech lézí (ať měřitelných či neměřitelných) a potvrzení nejméně 4 týdny po prvním zjištění kompletní odpovědi.
-
Částečná odpověď (irPR) – zmenšení nádorové masy o více než 50 % v porovnání s bazální hodnotou. Nové léze jsou možné. Potvrzení nejméně 4 týdny po zjištění irPR.
-
Stabilizace choroby (irSD) – nesplnění kritérií pro irCR a irPR při absenci progrese choroby. Zmenšení nádorové masy o méně než 50 % či zvětšení nádorové masy o méně než 25 % v porovnání s bazální hodnotou. Nové léze jsou možné.
-
Progrese choroby (irPD) – zvětšení nádorové masy o 25 % v porovnání s bazální hodnotou. Potvrzení progrese při následném měření alespoň 4 týdny po prvně dokumentované progresi.
Seznam použité literatury
- [1] Miller AB, Hoogstraten B, Staquet M, et al. Reporting results of cancer treatment. Cancer 1981; 47: 207–214.
- [2] Therasse P, Arbuck G, Eisenhauer EA, et al. New guidelines to evaluate the response to treatment in solid tumors (RECIST guidelines). J Nat Cancer Inst 2000; 92: 205–216.
- [3] Demlová R. Hodnocení odpovědi nádoru na léčbu – Recist. Klin Onkol 2005; 18 Suppl: 248–249.
- [4] Eisenhauer EA, Therasse P, Bogaerts J, et al. New response criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer 2009; 45: 226–247.
- [5] Tsujino K, Kawaguchi T, Kubo A, et al. Is response rate of stable disease rate a surrogate endpoint for survival in the treatment of advanced non-small cell lung cancer using epidermal growth factor receptor tyrosine kinase inhibitor? J Clin Oncol 2008; 26 abstr. 14600.
- [6] Hoos A, Eggermont AM, Janetzki S, et al. Improved endpoints for cancer immunotherapy trials. J Nat Cancer Inst 2010; 102: 1388–1397.
- [7] Dazzi E, Szydlo RM, Craddock C, et al. Comparison of single-dose and escalating-dose regimen of donor lymphocyte infusion for relapse after allografting for chronic myeloid leukemia. Blood 2000; 95: 67–71.
- [8] Shah NP, Kim FW, Kantarjian H, et al. Potent, transient inhibition of BCR-ABL with dasatinib 100 mg daily achieves rapid and durable cytogenetic responses and high transformation-free survival rates in chronic phase chronic myeloid leukemia patients with resistance, suboptimal response or tolerance to imatinib. Haematologica 2010; 95: 232–240.
- [9] Benjamin RS, Choi H, Macapinlax HA, et al. We should desist using RECIST, at least in GIST. J Clin Oncol 2007; 25: 1760–1764.
- [10] Faivre S, Delbado C, Vera K, et al. Safety, pharmacokinetic, and antitumor activity of SU11248, a novel oral multitarget tyrosine kinase inhibitor, in patients with cancer. J Clin Oncol 2006; 24: 25–35.
- [11] Ratain MJ, Eisen T, Stadler WM, et al. Phase II placebo-controlled randomized discontinuation trial of sorafenib in patients with metastatic renal cell carcinoma. J Clin Oncol 2006; 24: 2505–2512.
- [12] Maddan RA, Gulley JL, Fojo T, et al. Therapeutic cancer vaccines in prostate cancer: The paradox of improved survival without changes in time to progression. Oncologist 2010; 15: 969–975.
- [13] Small EJ, Schellhamer PF, Higano CS, et al. Placebo-controlled phase III trial of immunologic therapy with sipuleucel-T (APC8015) in patients with metastatic, asymptomatic hormone refractory prostate cancer. J Clin Oncol 2006; 24: 3089–3094.
- [14] Kantoff PW, Higano CS, Shore ND, et al. Sipuleucel-T immunotherapy for castration-resistant prostate cancer. N Engl J Med 2010; 363: 411–422.
- [15] Peethambaram PP, Melisko ME, Rinn KJ, et al. A phase I trial of immunotherapy with lapuleucel-T (APC8024) in patients with refractory metastatic tumors that express HER-2/neu. Clin Cancer Res 2009; 15: 5937–5944.
- [16] Chambers CA, Kuhns MS, Egen JF, et al. CTLA-4-mediated inhibition in regulation of T-cell response: mechanisms and manipulation in tumor immunotherapy. Ann Rev Immunol 2001; 19: 565–594.
- [17] Wolchok JD, Saenger Y. The mechanism of anti-CTLA-4 activity and the negative regulation of T cell activation. Oncologist 2008; 13: 2–9.
- [18] Reuben JM, Lee BN, Li C, et al. Biologic and immunomodulatory events after CTLA-4 blockade with ticilimumab in patients with advanced malignant melanoma. Cancer 2006; 106: 2437–2444.
- [19] Ribas A, Hanson DC, Noe DA, et al. Tremelimumab (CP-675,206), a cytotoxic T lymphocyte-associated antigen 4 blocking monoclonal antibody in clinical development for patients with cancer. Oncologist 2007; 12: 873–883.
- [20] Small EJ, Tchemkedylan NS, Rini BI, et al. A pilot trial of CTLA-4 blockade with human anti-CTLA-4 in patients with hormone-refractory prostate cancer. Clin Cancer Res 2007; 13: 1810–1815.
- [21] Movva S, Verschraegen C. The monoclonal antibody to cytotoxic T lymphocyte antigen 4, ipilimumab (MDX-010), a novel treatment strategy in cancer management. Expert Opin Biol Ther 2009; 2: 231–241.
- [22] Royal RE, Levy C, Turmer K, et al. Phase 2 trial of single agent ipilimumab (anti-CTLA-4) for locally advanced or metastatic pancreatic adenocarcinoma. J Immunother 2010; 8: 828–833.
- [23] O’Day SJ, Maio M, Charion-Sileni V, et al. Efficacy and safety of ipilimumab monotherapy in patients with pretreated advanced melanoma: a multicenter single-arm phase II study. Ann Oncol 2010; 8: 1721–1727.
- [24] Hodi FS, Hoos A, Ibrahim R, et al. Novel efficacy criteria for antitumor activity to immunotherapy using the example of ipilimumab, an anti-CTLA-4 monoclonal antibody. J Clin Oncol 2008; 26 (Suppl.): 3008.
- [25] Ribas A, Chmielowski B, Glaspy JA. Do we need a different set of response assessment criteria for tumor immunotherapy? Clin Cancer Res 2009; 15: 7116–7118.
- [26] Wolchok JD, Hoos A, O’Day S, et al. Guidelines for the evaluation of immune therapy activity in solid tumors: Immune-related response criteria. Clin Cancer Res 2009; 15: 7412–7420.
- [27] Weber J. Ipilimumab: controversies in its development, utility and autoimmune adverse events. Cancer Immunol Immunother 2009; 58: 823–830.