Precizní imunoterapie solidních nádorů ‒ současný stav a pohled do budoucnosti
Souhrn:
Petruželka L. Precizní imunoterapie solidních nádorů ‒ současný stav a pohled do budoucnosti. Remedia 2020; 30: 396–401.
Onkologická onemocnění představují jedny z nejběžnějších a zároveň nejzávažnějších chorob známých v klinické medicíně. Ke klíčovému pokroku v onkologii poslední doby patří klinická implementace personalizované a precizní onkologie a znovuobrození imunoterapie. Precizní onkologie spočívá v individualizaci léčby pro každého pacienta a pro každý nádor na základě molekulární charakteristiky nádorové choroby a genové výbavy konkrétního nemocného. Personalizovaná onkologie znamená léčbu přizpůsobenou charakteristice a jedinečnosti každého pacienta. Adresný přístup ke každému nemocnému a individualizace léčby s respektováním jedinečných znaků nádorového onemocnění i hostitele nemoci představuje budoucnost onkologie.
Summary:
Petruzelka L. Precise immunotherapy of solid tumors – current status and future perspective. Remedia 2020; 30: 396–401.
Oncological diseases represent one of the most common and at the same time the most serious diseases known to clinical medicine. Clinical implementation of personalized and precise oncology and re‑discovery of immunotherapy comprises a key advance in oncology in recent years. Precise oncology is grounded in individualization of therapy for each patient and each tumor based on molecular characteristics of oncological disease and genetic make‑up of a specific patient. Personalized medicine means a therapy adjusted to the characteristics and uniqueness of each patient. Directed approach to each patient and individualization of therapy with respect to both unique markers of oncological disease and disease host represents the future of oncology.
Key words: precise oncology – personalized oncology – immunotherapy – checkpoint inhibitors.
Úvod
Onkologická onemocnění jsou jedněmi
z nejběžnějších a zároveň nejzávažnějších
chorob známých v klinické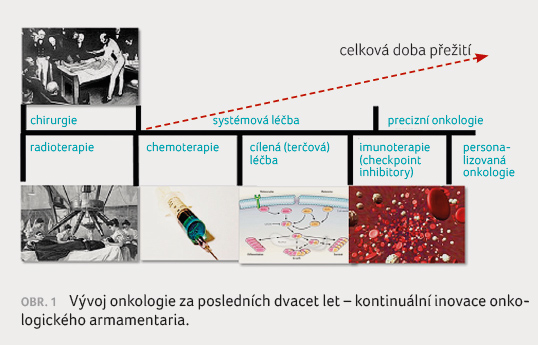 medicíně. Statistika ukazuje, že
nějaká forma nádorového onemocnění postihne více než třetinu
populace a způsobí více než 20 % všech úmrtí.
Ve vyspělých zemích představuje léčba nádorových chorob
více než 20 % výdajů za lékařskou péči. Jedině
individualizace léčby může vést k redukci nákladů
na léčbu eliminací neúčinných a „toxických“
terapeutických postupů. Vývoj onkologie za posledních 20 let
spočívá v kontinuální inovaci terapeutického armamentaria
a ukončení zastaralého konceptu stejné léčby pro všechny
ve stejném klinickém stadiu ve stejné primární
lokalizaci (tzv. one size fits all), obrázek 1.
Ke klíčovému pokroku v onkologii poslední doby patří
klinická implementace personalizované a precizní onkologie
a znovuobrození imunoterapie
(obr. 2).
Precizní onkologie se opírá o individualizaci
léčby pro každého nemocného a pro každý nádor (tzv.
léčba na míru) na základě molekulární (genové)
charakteristiky nádorové choroby a genové výbavy každého
pacienta. Personalizovaná onkologie znamená léčbu přizpůsobenou
charakteristice nemocného (tzv. adresná léčba) vycházející
z filozofie jedinečnosti každého pacienta. Adresný přístup
ke každému nemocnému a individualizace léčby
s respektováním jedinečných znaků nádorového onemocnění
i hostitele nemoci představuje budoucnost onkologie.
Personalizovaná a precizní onkologie je jedinou zárukou
ukončení necíleného podávání cílené léčby. Precizní
imunoterapie solidních nádorů kopíruje obecný koncept precizní
onkologie a je budoucností správného použití imunoterapie
využívané napříč solidními nádory.
medicíně. Statistika ukazuje, že
nějaká forma nádorového onemocnění postihne více než třetinu
populace a způsobí více než 20 % všech úmrtí.
Ve vyspělých zemích představuje léčba nádorových chorob
více než 20 % výdajů za lékařskou péči. Jedině
individualizace léčby může vést k redukci nákladů
na léčbu eliminací neúčinných a „toxických“
terapeutických postupů. Vývoj onkologie za posledních 20 let
spočívá v kontinuální inovaci terapeutického armamentaria
a ukončení zastaralého konceptu stejné léčby pro všechny
ve stejném klinickém stadiu ve stejné primární
lokalizaci (tzv. one size fits all), obrázek 1.
Ke klíčovému pokroku v onkologii poslední doby patří
klinická implementace personalizované a precizní onkologie
a znovuobrození imunoterapie
(obr. 2).
Precizní onkologie se opírá o individualizaci
léčby pro každého nemocného a pro každý nádor (tzv.
léčba na míru) na základě molekulární (genové)
charakteristiky nádorové choroby a genové výbavy každého
pacienta. Personalizovaná onkologie znamená léčbu přizpůsobenou
charakteristice nemocného (tzv. adresná léčba) vycházející
z filozofie jedinečnosti každého pacienta. Adresný přístup
ke každému nemocnému a individualizace léčby
s respektováním jedinečných znaků nádorového onemocnění
i hostitele nemoci představuje budoucnost onkologie.
Personalizovaná a precizní onkologie je jedinou zárukou
ukončení necíleného podávání cílené léčby. Precizní
imunoterapie solidních nádorů kopíruje obecný koncept precizní
onkologie a je budoucností správného použití imunoterapie
využívané napříč solidními nádory.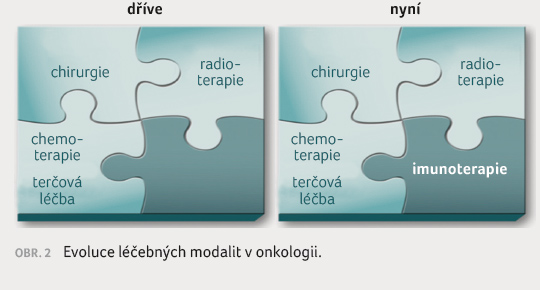
Imunoterapie
jako znovuobrozená modalita
Imunoterapie je po období skepse
onkology vnímána jako znovunalezená a perspektivní léčebná
možnost.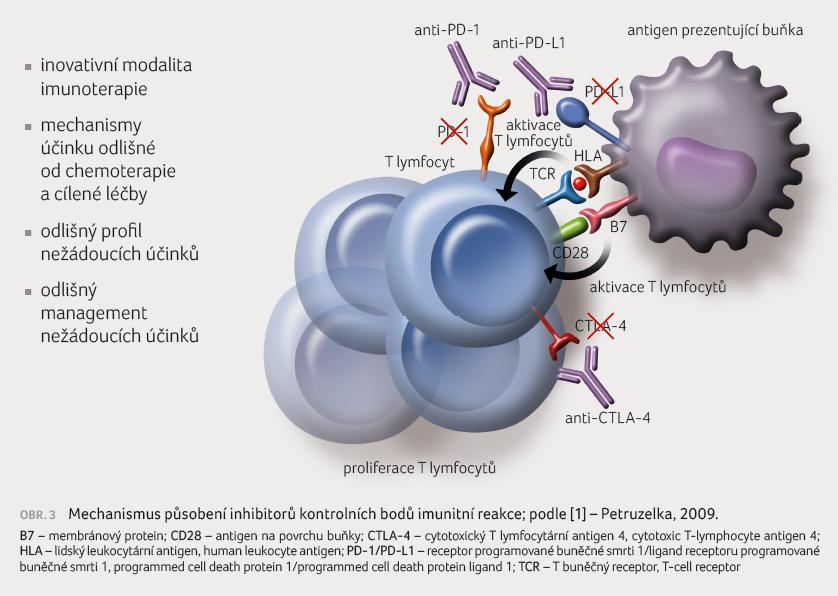 Imunoterapie
představuje „revitalizovanou“ léčebnou modalitu. Průlomem
v protinádorové imunoterapii je klinické využití blokády
imunitních kontrolních bodů (immune checkpoint blockade), která
odstartovala éru cílené protinádorové imunoterapie. Toto
znovuobrození imunoterapie patří mezi zásadní události poslední
doby. Inhibitory kontrolních bodů imunitní reakce (checkpoint
inhibitory) se staly nepostradatelnou součástí onkologické léčby.
Jedná se o inovativní terapeutický modus s odlišnými
mechanismy účinku (obr. 3)
oproti chemoterapii a cílené (terčové) léčbě s jiným
profilem nežádoucích účinků vyžadujících rozdílný
management [1]. Při cílené léčbě nejde o úplnou
eliminaci, ale o chronickou blokádu maligního signálu, vždy
s rozvojem rezistence v čase. Imunoterapie checkpoint
inhibitory představuje inovativní modalitu s plateau křivky
přežití (graf 1)
[2‒5]. Na začátku křivek přežití je výsledek
imunoterapie ve srovnání s chemoterapií horší.
Po překřížení je jednoznačně lepší
imunoterapie. První skupina nemocných s horším průběhem
onemocnění je označována jako hyperprogresoři nebo
non respondéři. Většinovou skupinu po eliminaci
hyperprogresorů nebo non respondérů tvoří imunorespondéři
s pravděpodobným delším trváním léčebné odpovědi.
Imunoterapie
představuje „revitalizovanou“ léčebnou modalitu. Průlomem
v protinádorové imunoterapii je klinické využití blokády
imunitních kontrolních bodů (immune checkpoint blockade), která
odstartovala éru cílené protinádorové imunoterapie. Toto
znovuobrození imunoterapie patří mezi zásadní události poslední
doby. Inhibitory kontrolních bodů imunitní reakce (checkpoint
inhibitory) se staly nepostradatelnou součástí onkologické léčby.
Jedná se o inovativní terapeutický modus s odlišnými
mechanismy účinku (obr. 3)
oproti chemoterapii a cílené (terčové) léčbě s jiným
profilem nežádoucích účinků vyžadujících rozdílný
management [1]. Při cílené léčbě nejde o úplnou
eliminaci, ale o chronickou blokádu maligního signálu, vždy
s rozvojem rezistence v čase. Imunoterapie checkpoint
inhibitory představuje inovativní modalitu s plateau křivky
přežití (graf 1)
[2‒5]. Na začátku křivek přežití je výsledek
imunoterapie ve srovnání s chemoterapií horší.
Po překřížení je jednoznačně lepší
imunoterapie. První skupina nemocných s horším průběhem
onemocnění je označována jako hyperprogresoři nebo
non respondéři. Většinovou skupinu po eliminaci
hyperprogresorů nebo non respondérů tvoří imunorespondéři
s pravděpodobným delším trváním léčebné odpovědi.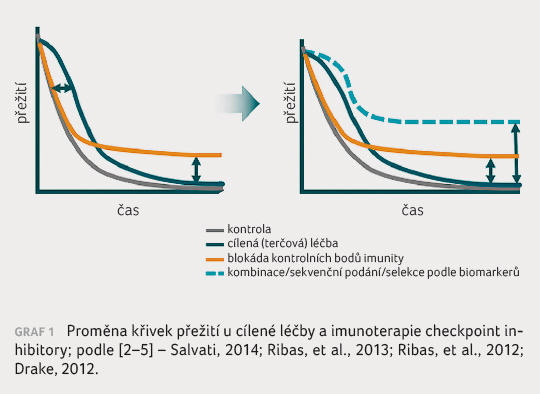
Imunoterapie checkpoint inhibitory a terčová terapie jsou rozdílné, v řadě indikací se vylučující systémové modality z důvodu odlišných mechanismů účinku. Typickým příkladem je léčba nemalobuněčných karcinomů plic, kde přítomnost určitých aberací (EGFR mutace, ALK a ROS pozitivita) vylučuje imunoterapii jako léčebný postup první volby a zahájení imunoterapie může být spojeno s nárůstem rizika vyššího výskytu nežádoucích účinků.
Dosavadní data z oblasti imunoterapie checkpoint inhibitory v léčbě většiny solidních nádorů prokázala:
- účinnost v první linii léčby
- účinnost u silně předléčených pacientů
- trvání léčebné odpovědi po ukončení léčby
- časté dlouhodobé trvání léčebné odpovědi
- účinnost při kombinaci s chemoterapií
První zmínky o „imunoterapii“ v onkologii lze datovat na konec 19. století, kdy chirurg William Coley jako první popsal, že inokulace bakteriálního substrátu získaného z míst zánětu přímo do nádoru (sarkom) vede ke zmenšení nádorové masy [6]. Účinnost tohoto postupu byla klinicky marginální a ve své době postrádala vysvětlení mechanismu účinku [7]. Receptor programované buněčné smrti (programmed cell death protein 1, PD 1) byl poprvé zmíněn v časných devadesátých letech minulého století v rámci studia jeho exprese při indukci apoptózy u T buněčných hybridomů. Revoluční klinický význam imunoterapie checkpoint inhibitory potvrdilo udělení Nobelovy ceny za medicínu a fyziologii v roce 2018 Jamesi P. Allisonovi za rozluštění úlohy cytotoxického T lymfocytárního antigenu 4 (cytotoxic T lymphocyte antigen 4, CTLA 4) a Tasuku Hondžóovi za popis receptoru a ligandu receptoru programované buněčné smrti (programmed cell death protein ligand 1, PD L1) [8]. Na rozdíl od chemoterapie a terčové léčby checkpoint inhibitory nepůsobí přímo cytotoxicky na nádorové buňky, ale léčba vede k obnovení nádorem paralyzované imunity hostitele nemoci.
Imunoterapie
v současné klinické praxi
Imunoterapie checkpoint inhibitory je
v současné klinické praxi využívána především v léčbě
metastazujících solidních nádorů (tab. 1).
Shrnutí současné dostupnosti imunoterapie v léčbě metastazujících solidních nádorů uvádí tabulka 2.
Přesná
(precizní) imunoterapie
Přesná (precizní) imunoterapie je
zatím iluzorní. Imunoterapie je sice účinná napříč solidními
nádory, ale hrdlo účinnosti je poměrně úzké a léčebné
odpovědi lze dosáhnout jen u 15‒30 % léčených pacientů.
Širší hrdlo účinnosti je u nejvíce imunogenních nádorů,
jako jsou maligní melanomy, renální a plicní karcinomy.
Limitací tohoto inovovaného terapeutického přístupu je chybění
prediktivních biomarkerů a imunomarkerů, které jsou nezbytné
pro zúžení terapeutického hrdla při výběru nemocných [9].
Klinicky aplikovaná imunoterapie předbíhá prediktivní
imunodiagnostiku. Nutnost identifikace a validace dalších
imunoprediktorů je
proto trvající klinickou urgencí. Precizní imunoterapie
s využitím širokého spektra imunobiomarkerů je cestou
k navýšení počtu léčebných odpovědí. Je otázkou času,
kdy skončí éra necílené „paliativní“ imunoterapie
checkpoint inhibitory ve prospěch precizní cílené
„kurativní“ imunoterapie. Kromě molekulárních biomarkerů
nelze při indikaci imunoterapie nikdy opominout klíčové klinické
faktory, jako jsou biologický věk, výkonnostní stav, komorbidity
včetně posouzení preferencí pacienta. Stále existuje řada
nezodpovězených otázek a nevyřešených kontroverzí.
Roztříštěná metodika stanovení exprese PD L1 je příkladem
nevhodným k následování. Pravděpodobnost léčebné
odpovědi se zvyšuje s narůstající expresí PD L1, ale
u některých PD L1 negativních nádorů lze navodit
léčebnou odpověď [10]. Řešením není prohlásit expresi PD L1
za zbytečný a nepotřebný biomarker. Budoucnost
imunopredikce není v izolovaném, ale v kombinovaném
využití prediktorů při utilizaci informací jak z nádoru,
tak z nádorového mikroprostředí. Opomíjeným prediktivním
imunobiomarkerem je mikrosatelitová nestabilita související
s mutací genů zodpovědných za opravy replikačních
chyb v DNA označovaných jako mismatch repair genes (MMR geny).
Vodítkem k nalezení mutovaného genu je imunohistochemické
vyšetření exprese MMR proteinů hMLH1, hMSH2, hMSH6 a hPMS2.
Přítomnost mutovaných genů má za následek vznik nádorů
charakteristických vysokým stupněm nestability v krátkých
tandemových repeticích molekuly DNA (mikrosatelitech). Tyto tumory
jsou proto označovány jako MSI H (microsatellite
instability high). Imunopredikce zahrnuje též vyšetření
periferního imunomu a imunologické charakteristiky hostitele
nemoci, včetně jeho mikrobiomu. Identifikaci
mikrobiomu jako silného faktoru pro
imunopredikce je možno označit za průlomovou událost pro
budoucnost imunoterapie. Výsledky humánních epidemiologických
studií a experimentu
na myších modelech prokazují, že střevní mikrobiota
může determinovat účinnost protinádorové imunoterapie
a může být využita jako prognosticko prediktivní
biomarker a současně jako terčová struktura pro léčbu.
Rozdílné složení mikrobiomu může vést k rozdílné
odpovědi na imunoterapii. Narušení mikrobiomu (dysbióza)
může snížit účinnost imunoterapie. Modulace mikrobiomu
představuje zcela novou možnost ovlivnění účinnosti
imunoterapie checkpoint inhibitory. Pro účinné fungování
protinádorové imunitní odpovědi je nutná správná funkce
imunitního systému, včetně tří klíčových funkcí T lymfocytů
‒ generace a aktivace cytotoxických T lymfocytů, jejich
infiltrace do nádorové tkáně a rozpoznání a cílená
destrukce nádorových buněk. Na základě analýzy průběhu
protinádorové imunitní odpovědi byly popsány tři základní
imunitní fenotypy, které vycházejí ze zastoupení T
lymfocytů v nádoru a jejich aktivity v nádorovém
mikroprostředí [11‒16].
inovovaného terapeutického přístupu je chybění
prediktivních biomarkerů a imunomarkerů, které jsou nezbytné
pro zúžení terapeutického hrdla při výběru nemocných [9].
Klinicky aplikovaná imunoterapie předbíhá prediktivní
imunodiagnostiku. Nutnost identifikace a validace dalších
imunoprediktorů je
proto trvající klinickou urgencí. Precizní imunoterapie
s využitím širokého spektra imunobiomarkerů je cestou
k navýšení počtu léčebných odpovědí. Je otázkou času,
kdy skončí éra necílené „paliativní“ imunoterapie
checkpoint inhibitory ve prospěch precizní cílené
„kurativní“ imunoterapie. Kromě molekulárních biomarkerů
nelze při indikaci imunoterapie nikdy opominout klíčové klinické
faktory, jako jsou biologický věk, výkonnostní stav, komorbidity
včetně posouzení preferencí pacienta. Stále existuje řada
nezodpovězených otázek a nevyřešených kontroverzí.
Roztříštěná metodika stanovení exprese PD L1 je příkladem
nevhodným k následování. Pravděpodobnost léčebné
odpovědi se zvyšuje s narůstající expresí PD L1, ale
u některých PD L1 negativních nádorů lze navodit
léčebnou odpověď [10]. Řešením není prohlásit expresi PD L1
za zbytečný a nepotřebný biomarker. Budoucnost
imunopredikce není v izolovaném, ale v kombinovaném
využití prediktorů při utilizaci informací jak z nádoru,
tak z nádorového mikroprostředí. Opomíjeným prediktivním
imunobiomarkerem je mikrosatelitová nestabilita související
s mutací genů zodpovědných za opravy replikačních
chyb v DNA označovaných jako mismatch repair genes (MMR geny).
Vodítkem k nalezení mutovaného genu je imunohistochemické
vyšetření exprese MMR proteinů hMLH1, hMSH2, hMSH6 a hPMS2.
Přítomnost mutovaných genů má za následek vznik nádorů
charakteristických vysokým stupněm nestability v krátkých
tandemových repeticích molekuly DNA (mikrosatelitech). Tyto tumory
jsou proto označovány jako MSI H (microsatellite
instability high). Imunopredikce zahrnuje též vyšetření
periferního imunomu a imunologické charakteristiky hostitele
nemoci, včetně jeho mikrobiomu. Identifikaci
mikrobiomu jako silného faktoru pro
imunopredikce je možno označit za průlomovou událost pro
budoucnost imunoterapie. Výsledky humánních epidemiologických
studií a experimentu
na myších modelech prokazují, že střevní mikrobiota
může determinovat účinnost protinádorové imunoterapie
a může být využita jako prognosticko prediktivní
biomarker a současně jako terčová struktura pro léčbu.
Rozdílné složení mikrobiomu může vést k rozdílné
odpovědi na imunoterapii. Narušení mikrobiomu (dysbióza)
může snížit účinnost imunoterapie. Modulace mikrobiomu
představuje zcela novou možnost ovlivnění účinnosti
imunoterapie checkpoint inhibitory. Pro účinné fungování
protinádorové imunitní odpovědi je nutná správná funkce
imunitního systému, včetně tří klíčových funkcí T lymfocytů
‒ generace a aktivace cytotoxických T lymfocytů, jejich
infiltrace do nádorové tkáně a rozpoznání a cílená
destrukce nádorových buněk. Na základě analýzy průběhu
protinádorové imunitní odpovědi byly popsány tři základní
imunitní fenotypy, které vycházejí ze zastoupení T
lymfocytů v nádoru a jejich aktivity v nádorovém
mikroprostředí [11‒16].
Základní imunitní fenotypy zahrnují fenotyp bez zánětlivé infiltrace (immune desert), fenotyp s infiltrací nádorové periferie (immune excluded) a fenotyp se zánětlivou infiltrací (immune inflamed). Nádory bez zánětlivé infiltrace jsou charakterizovány nedostatečně rozvinutou imunitní reakcí, jsou nedostatečně infiltrovány lymfocyty, zřídka exprimují PD L1 a jsou na opačném konci v míře imunitní reakce nádoru. Zhoubné nádory se zánětlivou infiltrací jsou charakterizovány přítomností tumor infiltrujících lymfocytů, vysokou hustotou CD8+ T lymfocytů produkujících interferon gama, expresí PD L1 na tumor infiltrujících imunitních buňkách, možnou genomickou nestabilitou a přítomností preexistující protinádorové imunitní odpovědi. Rozpoznání imunitního fenotypu může významně přispět v rozhodovacím procesu a při volbě terapeutické strategie. U tzv. studených, nedostatečně imunogenních nádorů je jednou z možností ke zvýšení účinnosti kombinovaná imunoterapie nebo kombinace s jinými terapeutickými modalitami. Kombinace blokátorů kontrolních bodů imunitní reakce s protinádorovými vakcínami je cestou, jak indukovat protinádorovou imunitu u primárně imunorezistentních nádorů [17]. Pomocí negativní imunopredikce je možné nemocné uchránit od potenciálních rizik imunoterapie, včetně fenoménu hyperprogrese [18]. U limitované frakce (~5 %) léčených nemocných může imunoterapie způsobit rychlou progresi nádorového onemocnění označovanou jako hyperprogrese (hyperprogressive disease, HPD). Pro zvýšení bezpečnosti a účinnosti imunoterapie je nutno HPD detailně rozpoznat. Problematika uvedeného fenoménu přesahuje rámec tohoto sdělení.
Signálem k zahájení cílené (terčové) léčby při výběru léčebné modality první volby nezávisle na expresi PD L1 může být přítomnost řídicí aberace. To platí pro nemalobuněčné plicní karcinomy s prokázanou mutací receptoru epidermálního růstového faktoru (EGFR), kde byla zaznamenána nižší účinnost a vyšší riziko toxicity při zahájení léčby checkpoint inhibitory. Stav EGFR (plus ALK a ROS aberace) by měl být znám před zahájením léčby a při opož

dění je nutné rychlé přesmyknutí na anti EGFR cílenou léčbu při potvrzení řídicí aberace [19].
Mezi absolutní kontraindikace imunoterapie checkpoint inhibitory patří aktivní klinicky agresivní nebo symptomatické autoimunitní onemocnění. U ostatních solidních nádorů nemá stanovení molekulárních aberací vliv na rozhodovací proces. U neaktivních autoimunitních onemocnění bez klinické symptomatologie je namístě klinická opatrnost. Imunoterapii nelze doporučit u nemocných po orgánové transplantaci, stejně jako podávání imunoterapie v graviditě. Zpočátku byla obava z podávání imunoterapie u nemocných s chronickou virovou infekcí, jako je hepatitida B a C. Při hodnocení účinku imunoterapie v léčbě hepatocelulárních karcinomů se tato terapie ukázala být poměrně bezpečnou modalitou.
Klinická realita precizní
imunoterapie je odrazem zaostalosti imunopredikce (tab. 3). Cestou k precizní imunoterapii je
tzv. imuno omika založená
na výběru respondérů na imunoterapii s využitím
všech omických metod (tab. 4).
Kombinace
imunoterapie checkpoint inhibitory a kombinace imunoterapie
s chemoterapií
Monoimunoterapie nebo kombinovaná imunoterapie je preferována u fenotypu se zánětlivou infiltrací. Jsou to nádory s vysokou expresí PD L1 na tumor infiltrujících imunitních buňkách, s genomickou nestabilitou a s vyšší mutační náloží. Významnou klinickou výhodou monoimunoterapie je profil nežádoucí účinků (bez toxických projevů chemoterapie). Kombinovaná imunoterapie by byla u tohoto fenotypu patrně optimálním řešením ve vztahu k účinnosti, ale je limitována relativně strmým nárůstem nežádoucích projevů. Příkladem je monoimunoterapie pembrolizumabem v první linii u pokročilých nemalobuněčných plicních karcinomů s expresí PD L1 ≥ 50 % Příkladem vyšší účinnosti kombinované imunoterapie využívající checkpoint inhibitory odlišného typu účinku je kombinace ipilimumabu a nivolumabu v léčbě renálních karcinomů a maligních melanomů. Historicky byla chemoterapie spojována s imunosupresí, a proto byla považována za inkompatibilní s imunoterapií. Současný pohled se změnil. Účinek kombinace imunoterapie checkpoint inhibitorů s chemoterapií vychází z imunomodulačního účinku chemoterapie, který zahrnuje jak nádorové, tak imunokompetentní buňky. Klasický genotoxický účinek chemoterapie ovlivňuje novotvorbu neoantigenů exprimovaných na nádorových buňkách a dochází tak ke stimulaci antigenicity. Toto působení je dále umocněno zvýšenou regulací molekul hlavního histokompatibilního komplexu I a aktivací antigen prezentujících buněk. Chemoterapie způsobuje destrukci nádorových buněk, což vede k uvolnění nádorových antigenů, které mohou spustit přípravu a aktivaci T lymfocytů. Klinickou nevýhodou kombinace imunoterapie a chemoterapie je nárůst počtu nežádoucích účinků plynoucích z toxického profilu chemoterapie.
Kombinace imunoterapie a radioterapie
Radioterapie je historicky vnímána jako striktně lokoregionálně působící léčebná možnost. V poslední době bylo rozpoznáno, že radioterapie může významně příznivě ovlivnit léčebnou odpověď cestou působení na imunitní komponenty nádoru. Příkladem je extrémně vzácný abskopální efekt, spočívající v regresi vzdálených metastatických ložisek po lokálním ozáření primárního nádoru. Synergistický účinek imunoterapie a radioterapie je předmětem klinického výzkumu a první klinické výsledky dokládají správnost tohoto konceptu. Vysvětlení synergistického působení přesahuje rámec tohoto sdělení. Systémový synergismus neplatí pouze pro checkpoint inhibitory, ale byl prokázán i v imunoterapii s jiným mechanismem účinku (dendritické buňky, vakcinační strategie, toll like receptory 7/8, agonisté antigenu OX 40 a další).
Kontroverze precizní imunoterapie
Hodnocení léčebné odpovědi
Kritéria hodnocení léčebné odpovědi v rámci imunoterapie (iRECIST, Response Evaluation Criteria in Solid Tumours) jsou odlišná od pravidel hodnocení léčebné odpovědi při chemoterapii nebo cílené léčbě. Při imunoterapii checkpoint inhibitory se objevuje unikátní zobrazovací i klinický fenomén, tzv. pseudoprogrese. Pseudoprogrese (nepotvrzená progrese) znamená přechodné zvětšení velikosti léze (lézí) nebo vznik nových lézí s následnou regresí, která je známkou léčebné odpovědi a která může být i při zaznamenané pseudoprogresi déletrvající. Rozdíl oproti progresi při konvenční chemoterapii a cílené léčbě souvisí s infiltrací jak klinických, tak subklinických lézí imunokompetentními buňkami. Pseudoprogrese byla popsána napříč solidními nádory nejčastěji při léčbě maligních melanomů v 5‒10 % případů. U nemalobuněčných karcinomů plic je pseudoprogrese vzácná, v rozmezí 1‒3 %. Pseudoprogrese může vést k mylné interpretaci zobrazovacího nálezu (pseudoprogrese vs. progrese). Konfirmačním zobrazovacím vyšetřením je nutné odlišit pseudoprogresi od pravé progrese. Ke správnému odlišení je nutná současně i klinická interpretace. Klinické projevy pseudoprogrese nejsou většinou spojeny se zhoršením klinického stavu, naopak může být zaznamenáno symptomatické zlepšení (např. zvýšení chuti k jídlu, zmírnění projevů bolesti). Klinické projevy pravé progrese jsou spojeny se zhoršením klinického stavu (např. úbytek hmotnosti, zvýšená únavnost, zhoršení projevů bolesti). Při diferenciální diagnóze je třeba upozornit na imunitně podmíněnou sarkoidní reakci. Byly popsány zvětšující se uzlinové, plicní nebo jiné viscerální léze, které biopticky odpovídaly granulomům bez známek maligního bujení. Většinou se objevují časně po prvních dávkách imunoterapie. Proporcionální výskyt pseudoprogresí nikdy nepřekročil 10 % nezávisle na typu nádoru. Většina radiologicky vyhodnocených progresí odpovídá objektivní progresi, ale fenomén pseudoprogrese nelze nikdy při imunoterapii vyloučit a klinická ostražitost je namístě, aby nedošlo k předčasnému ukončení imunoterapie.
Jak dlouho podávat léčbu
Optimální trvání imunoterapie checkpoint inhibitory je otevřenou otázkou. Předčasné ukončení nebo příliš dlouhá doba podávání mohou nepříznivě ovlivnit léčebný výsledek. Rizikovým scénářem je záměna pseudoprogrese za progresi onemocnění. Pokud trvá léčebná odpověď a pacient je v dobrém klinickém stavu, nelze zatím na otázku doby trvání léčby spolehlivě odpovědět. Povelem k ukončení léčby je nepřijatelná toxicita nebo klinicky jednoznačná progrese. Byly popsány déletrvající léčebné odpovědi po předčasném ukončení léčby, ale jedná se zatím o jednotlivá pozorování, z nichž není možno vyvozovat klinické závěry.
Závěr
Začlenění checkpoint inhibitorů do klinické praxe přineslo průlomové zlepšení výsledků léčby do té doby obtížně léčitelných nádorů, jako jsou především nemalobuněčné plicní karcinomy. Imunoterapie checkpoint inhibitory je v současnosti pevně ukotvena do léčebných standardů u maligních melanomů, renálních karcinomů, nemalobuněčných plicních karcinomů a je otázkou času u dalších indikací (uroteliální karcinomy, hepatocelulární karcinomy, karcinomy hlavy a krku, MSI H kolorektální karcinomy, spinocelulární karcinomy kůže a další). Výzvou pro blízkou budoucnost je identifikace nových biomarkerů a imunomarkerů, které umožní bezpečné podání imunoterapie a efektivní výběr správné cílové populace nemocných. Receptory CTLA 4 a PD 1/PD L1 reprezentují pouze dvě z množiny potenciálních terčových struktur pro léčbu checkpoint inhibitory. Množství nových agens pro imunoterapii se nachází ve fázi preklinického vývoje a v časných fázích klinického zkoušení. Mimořádné pozornosti se dostává odhalování možností racionální kombinace checkpoint inhibitorů s jinou protinádorovou léčbou včetně radioterapie. V dohledné době lze očekávat posun k léčbě méně pokročilých stadií v neoadjuvantní a adjuvantní indikaci. Imunoterapie není léčbou pro všechny (fenomén hyperprogrese nelze podcenit). Imunoterapie není paliativní léčba. Cílem je prodloužení přežití, ne pouze symptomatická úleva. Imunoterapie není léčbou bez nežádoucích účinků. Predikce a včasné řešení nežádoucích účinků je prioritou roku 2020. Budoucnost leží v sofistikované imunopredikci, jejíž jádro spočívá v kombinovaném využití prediktorů při utilizaci informací z nádoru a nádorového mikroprostředí. Vytvoření multidisciplinárního centra pro precizní a personalizovanou medicínu a imunoterapii představuje jedno z možných řešení. Nezbytnou součástí je aktivní molekulární tzv. tumor board, bez kterého není možné plně implementovat principy precizní medicíny včetně precizní imunoterapie do klinické praxe.
Na závěr uveďme predikci budoucího využití imunoterapie po roce 2025 ‒ více než 50 % nemocných se solidními nádory bude léčeno imunoterapií a o více než 50 % poklesne využití chemoterapie.
Seznam použité literatury
- [1] Petruzelka L, Votruba J. Imunoterapie nemalobuněčných karcinomů plic. In Karcinom plic. Farmakoterapie. Praha: Farmakon Press, 2019, s. 108‒136.
- [2] Salvati M. 3rd International Symposium in Lung Cancer, 2014.
- [3] Ribas A, Kefford R, Marshall MA, et al. Phase III Randomized Clinical Trial Comparing Tremelimumab With Standard‑of‑Care Chemotherapy in Patients With Advanced Melanoma. J Clin Oncol 2013; 31: 616‒622.
- [4] Ribas A, Hersey P, Middleton MR, et al. New challenges in endpoints for drug development in advanced melanoma. Clin Cancer Res 2012; 18: 336‒341.
- [5] Drake CG. Combination immunotherapy approaches. Ann Oncol 2012; 23(Suppl 8): viii41‒viii46.
- [6] Coley WB. The treatment of malignant tumors by repeated inoculations of erysipelas: with a report of ten original cases. Am J Med Sci 1993; 105: 487.
- [7] Canavan N. A Cure Within: Scientists Unleashing the Immune System to Kill Cancer. Cold Spring Harbor Laboratory Press, U.S. 2017.
- [8] Altmann DM. A Nobel prize‑worthy pursuit: cancer immunology and harnessing immunity to tumour neoantigens. Immunology 2018; 155: 283‒284.
- [9] Pillai R, Steuer C. Debate: What do you recommend for stage IV patients with high PD‑L1 expression? 2019 Debates and Didactics in Hematology and Oncology. Presented July 26, 2019; winshipcancerddho.com
- [10] Ancevski HK, Socinski MA, Villaruz LC, et al. PD‑L1 Testing in Guiding Patient Selection for PD‑1/PD‑L1 Inhibitor Therapy in Lung Cancer. Mol Diagn Ther 2018; 22: 1–10.
- [11] Petruželka L. Imunoterapie solidních nádorů – současný stav, nové možnosti a limitace. Postgraduální medicína 2020: 143–151.
- [12] Chen DS, Mellman I. Elements of cancer immunity and the cancer‑immune set point. Nature 2017; 541: 321–330.
- [13] Chen DS, Mellman I. Oncology meets immunology: the cancer‑immunity cycle. Immunity 2013; 39: 1–10.
- [14] Rapoport H Westman. Managing immunne‑related Adverse Events in Oncology. Karger Publishers Limited, Oxford UK, 2019.
- [15] Gajewski TF, Schreiber H, Fu YX. Innate and adaptive immune cells in the tumor microenvironment. Nat Immunol 2013; 14: 1014–1022.
- [16] Gong J, Chehrazi‑Raffle A, Reddi S, Salgia R. Development of PD‑1 and PD‑L1 inhibitors as a form of cancer immunotherapy: a comprehensive review of registration trials and future considerations. J Immunother Cancer 2018; 6: 8.
- [17] Andersen MH. Anti‑cancer immunotherapy: breakthroughs and future strategies. Seminars in Immunopathology 2019; 41: 1–3.
- [18] Champiat S, Dercle L, Ammari S, et al. Hyperprogressive disease is a new pattern of progression in cancer patients treated by anti‑PD‑1/PD‑L1. Clin Cancer Res 2017; 23: 1920‒1928.
- [19] Petruželka L. Jak, kdy a proč hodnotit léčebnou odpověď na léčbu imunoterapií „check point inhibitory“ při léčbě pokročilých nemalobuněčných plicních karcinomů (NSCLC). Onkologie 2019; 213: 278–281.