Řešení urgentních stavů spojených s rizikem krvácení u nemocných užívajících nová perorální antikoagulancia – možnosti ukončení účinku
Souhrn:
Nová perorální antikoagulancia užívaná v ČR (dabigatran, apixaban, rivaroxaban), která jsou indikována v prevenci systémové embolizace u nevalvulární fibrilace síní a v léčbě tromboembolické nemoci, měla dosud nevýhodu nedostupnosti specifického antidota pro případ vzniku významného krvácení nebo nutnosti urgentního chirurgického výkonu. Od podzimu 2015 již bylo schváleno k použití antidotum pro dabigatran etexilát – idarucizumab, monoklonální protilátka k vyvázání a k inaktivaci léčiva. Přípravek je registrován a dostupný na farmaceutickém trhu. K reverzi účinku xabanů jsou na obzoru dvě antidota – 3. fází klinického hodnocení prochází andexanet alfa, určený jako antidotum xabanů, i ciraparantag (PER977), který působí jako univerzální antagonista antikoagulačního účinku xabanů i heparinů.
Key words:
dabigatran – idarucizumab – apixaban – rivaroxaban – andexanet alpha – ciraparantag.
Summary:
New oral anticoagulants prescribed in the Czech Republic (dabigatran, apixaban, rivaroxaban), indicated for prevention of systemic embolization in non valvular atrial fibrillation and for treatment of thromboembolic disease, had a major disadvantage until recently: there was no specific antidote available for their users in cases of significant bleeding or in cases when urgent surgery was needed. During autumn of 2015, antidote for dabigatran exetilate – idarucizumab, a monoclonal antibody capable of binding and inactivation of this drug – was approved for clinical use. It has been registered and became available on the pharmaceutical market. As for the xabans, two antidotes are approaching their approval – andexanet alpha, making its way through phase 3 clinical trials (xaban antidote), and ciraparantag (PER77), acting as a universal antidote of both xabans and heparins.
Úvod
Dlouhodobě působící perorální antikoagulační léčba je primárně indikována v prevenci iktu a systémové embolizace u nemocných s fibrilací síní, dále pro léčbu hluboké žilní trombózy a plicní embolie, a také u řady dalších stavů kardiovaskulárních onemocnění – jako v případě významných chlopenních vad, stavů po jejich náhradách, u nemocných s tromby v srdečních oddílech nebo u nemocných s nemocí periferních tepen (při aneurysmatech, po úspěšné rekanalizaci periferních bypassů k zachování jejich průchodnosti, u disekcí tepen apod.). Počet nemocných dlouhodobě léčených perorální antikoagulační terapií v průběhu posledních let narůstá. Důvodem je nejen stárnutí populace a stoupající prevalence výše uvedených stavů, ale i lepší povědomí o rizicích neléčených pacientů. Zejména v případě fibrilace síní se s nástupem nových perorálních antikoagulancií zřetelně zvýšil záchyt těchto nemocných, a tím i počet léčených – ať již warfarinem, nebo přímými perorálními antikoagulancii. Zásah do tak významného regulačního systému, jakým je hemostáza, je však provázen rizikem krvácení. Například ve Spojených státech amerických je antikoagulační a protidestičková léčba jednou z vedoucích příčin emergentních hospitalizací, hned po nežádoucích příhodách spojených s antidiabetickou léčbou.
Nová perorální antikoagulancia – NOAC (resp. jinak interpretovaným názvem non‑vitamin K antikoagulancia), případně DOAC (direct – přímá perorální antikoagulancia) – bezpochyby představují revoluci v léčbě tromboembolických stavů. Z přímých inhibitorů koagulačního faktoru Xa máme již několik let pro léčbu nevalvulární fibrilace síní registrovány tři xabany (apixaban, rivaroxaban a edoxaban), úhradu však mají stanovenu jen prvé dva. Ve fázi klinického hodnocení se nachází řada dalších přímých inhibitorů faktoru Xa, nejdále v klinických zkouškách postoupil betrixaban – xaban s nejnižší mírou renální exkrece a s nejdelší dobou účinku. Z přímých trombinových inhibitorů je již řadu let k užití ve výše uvedených indikacích dabigatran. Ve všech registračních studiích tato léčiva prokázala minimálně stejnou účinnost jako konvenční, dosud užívané postupy (enoxaparin či warfarin), při velmi dobrém bezpečnostním profilu [1–4]. Riziko obávaného intrakraniálního krvácení se impresivně snižuje u všech NOAC přibližně na polovinu. Jedinou výjimkou je krvácení do gastrointestinálního traktu, to je vyšší při podávání rivaroxabanu, edoxabanu i dabigatranu, výjimkou je pouze apixaban, který tento typ krvácení nezvyšuje [5,6]. Výhodou těchto nových přípravků je kromě perorálního podání i používání fixních dávek, při nichž navíc nemusí být účinek pravidelně monitorován. Dále je podávání NOAC v porovnání s warfarinem spojeno s nižším rizikem lékových a potravinových interakcí.
Podáváme‑li antikoagulační léčbu, stále musíme mít na zřeteli riziko krvácení, a to jak spontánního, tak traumatického, či krvácení spojeného s intervenčními výkony. Toto se zvyšuje při současné léčbě protidestičkovými léky či u osob s vyšším rizikem hemoragie, tj. u pacientů tzv. křehkých. Proto s rozšiřováním počtu léčených přibývá doporučených postupů, jak řešit vzniklá krvácení a jak postupovat v případě traumat nebo nutnosti urgentních operací [7].
Ještě nedávno platila výhrada, že NOAC nemají antidotum, tedy nelze jejich působení účinně zrušit. Je nutno si ale uvědomit, že ukončení působení warfarinu vitaminem K nepředstavuje podání antidota v pravém slova smyslu, neboť obnovení syntézy koagulačních faktorů je děj provleklý, tudíž ani hodnota protrombinového času (INR, international normalized ratio) není normalizována ihned. Proto v urgentních stavech krvácení nebo při hrozící neodkladné operaci u nemocných léčených warfarinem je nutné podání čerstvé plazmy nebo koncentrátu koagulačních faktorů.
Na následujících řádcích podáváme stručný přehled optimálního postupu při významném krvácení nebo při nutnosti chirurgické léčby u urgentních stavů [8,9]. Probereme i stav vývoje jednotlivých antidot pro NOAC s důrazem na monoklonální protilátku k reverzi účinku dabigatranu idarucizumab, který je v České republice již registrován.
Možnosti monitorování hemokoagulační aktivity při léčbě NOAC
Situace nemocného, který dlouhodobě užívá antikoagulancia, se komplikuje v zásadě zejména perioperačně (nejvíce u urgentních zásahů) a při vzniku spontánního nebo traumatem navozeného krvácení. S tím je spojen i problém monitorace – typu testů a jejich dostupnosti na jednotlivých pracovištích.
U nemocných léčených antikoagulancii a indikovaných k elektivní chirurgické léčbě je důležité načasování přerušení léčby NOAC. Tato doba závisí na biologickém poločasu léčiva, na výši rizika krvácení u plánovaného výkonu a také na renálních funkcích nemocného (které klesají nejen při specifickém onemocnění ledvin, ale s věkem u všech nemocných). Některé výkony, jako operace katarakty nebo malé kožní zákroky, mohou být prováděny i bez přerušení léčby antikoagulanciem. Obecně platí, že v případě výkonu s malým rizikem krvácení má být podávání xabanů přerušeno alespoň 24 hodin před zákrokem, u výkonů se středním rizikem krvácení 24–48 hodin před jejich zahájením a u chirurgické léčby s vysokým rizikem krvácení 48–72 hodin před operací. U dabigat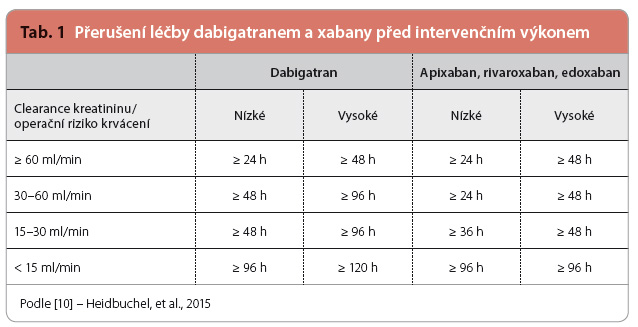 ranu je o něco složitější postup vysazování, který závisí na hodnotě glomerulární filtrace, přičemž nejobvykleji se dabigatran vysazuje 48–72 hodin před výkonem – dle rizika krvácení a hodnoty renálních funkcí (požadovaná doba vysazení jednotlivých NOAC je uvedena v tab. 1). Znovuzahájení léčby NOAC po operaci se uvádí s minimálním odstupem 24 hodin, eventuálně podle rizika provedeného výkonu či výskytu komplikací i později [11].
ranu je o něco složitější postup vysazování, který závisí na hodnotě glomerulární filtrace, přičemž nejobvykleji se dabigatran vysazuje 48–72 hodin před výkonem – dle rizika krvácení a hodnoty renálních funkcí (požadovaná doba vysazení jednotlivých NOAC je uvedena v tab. 1). Znovuzahájení léčby NOAC po operaci se uvádí s minimálním odstupem 24 hodin, eventuálně podle rizika provedeného výkonu či výskytu komplikací i později [11].
U nemocného s akutním, život ohrožujícím krvácením nebo s nutností neodkladné operace se orientujeme 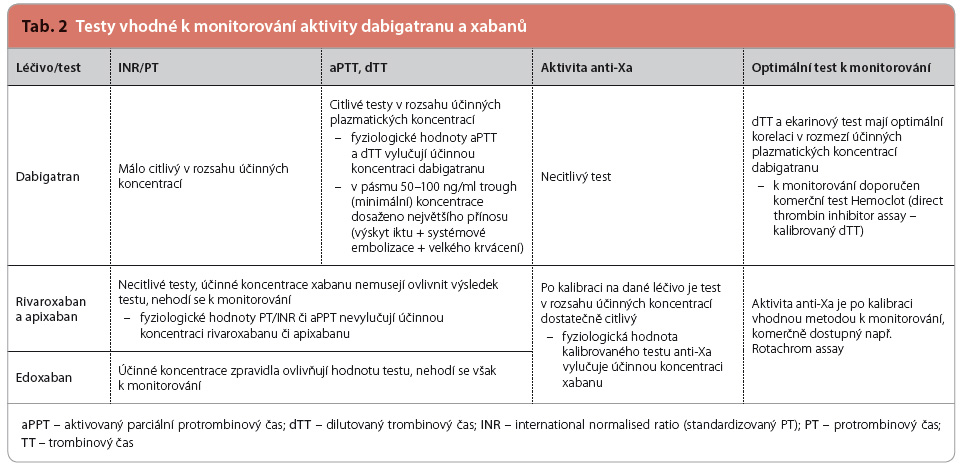 o antikoagulační aktivitě některým z antikoagulačních testů. Nutno zdůraznit, že v případě léčby NOAC „rutinně užívané testy“ – INR a aPTT (activated partial tromboplastine time, aktivovaný parciální tromboplastinový čas) – neodrážejí přesně míru reziduální antikoagulační aktivity. Zejména INR se nehodí k monitoraci účinku kteréhokoliv z NOAC. Test aPTT je prodloužen v případě léčby dabigatranem, nicméně ani tato hodnota neodráží přesně stav koagulace. Pro monitoraci míry ovlivnění organismu dabigatranem je určující buď trombinový čas (TT), nebo dilutovaný trombinový čas (dTT – nejběžněji užívaný test Hemoclot), případně ekarinový srážecí čas (ECT). U apixabanu, rivaroxabanu a edoxabanu je optimální užití anti‑Xa chromogenní assay (viz tab. 2).
o antikoagulační aktivitě některým z antikoagulačních testů. Nutno zdůraznit, že v případě léčby NOAC „rutinně užívané testy“ – INR a aPTT (activated partial tromboplastine time, aktivovaný parciální tromboplastinový čas) – neodrážejí přesně míru reziduální antikoagulační aktivity. Zejména INR se nehodí k monitoraci účinku kteréhokoliv z NOAC. Test aPTT je prodloužen v případě léčby dabigatranem, nicméně ani tato hodnota neodráží přesně stav koagulace. Pro monitoraci míry ovlivnění organismu dabigatranem je určující buď trombinový čas (TT), nebo dilutovaný trombinový čas (dTT – nejběžněji užívaný test Hemoclot), případně ekarinový srážecí čas (ECT). U apixabanu, rivaroxabanu a edoxabanu je optimální užití anti‑Xa chromogenní assay (viz tab. 2).
Bližší informace o testování antikoagulační aktivity NOAC lze najít v materiálu České společnosti pro trombózu a hemostázu ČLS JEP – Doporučení pro bezpečnou léčbu novými perorálními antikoagulancii [10].
Řešení krvácení u nemocného léčeného xabany a gatrany
Riziko krvácení při antikoagulační léčbě je významné a jde o nejběžnější nežádoucí účinek. Kromě základních opatření, kterými je přerušení či ukončení léčby a provedení obecných postupů k ukončení krvácení (zejména mechanického či endoskopického ošetření místa krvácení), je nutno udržet vlastní cirkulaci a perfuzi životně důležitými orgány. Konkrétní postupy se liší podle charakteru krvácení a stavu nemocného. Paralelně je namístě monitorovat tíži krvácení, tj. sledovat krevní obraz a hemodynamiku nemocného. V případě většího krvácení je pak nutná volumová expanze a substituční léčba erytrocyty. V dalším kroku je namístě rozvaha, zda stav nevznikl následkem předávkování nebo zásadní změnou renální či hepatální funkce, případně zda se na stavu nepodílí trombocytopenie, nebo dokonce diseminovaná intravaskulární koagulace.
U nemocného, který užil NOAC 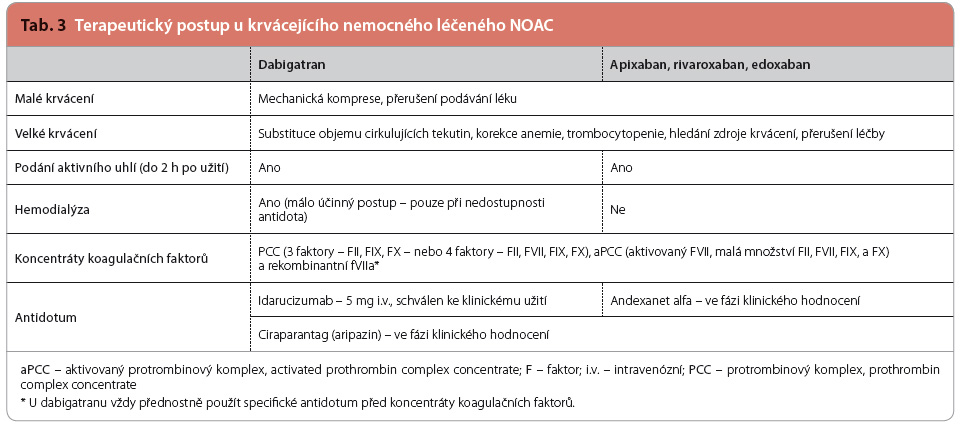 před méně než dvěma hodinami, je potřeba zvážit podání aktivního uhlí ke snížení absorpce léčiva. Tento postup je vhodný zejména v případě akutního předávkování. Jako další možnost, zejména v nepřítomnosti antidota u daného NOAC, se uvádí aplikace koncentrátů koagulačních faktorů (prothrombin complex concentrate, PCC) – viz tab. 3. Optimálním postupem v řešení krvácení nebo provedení emergentního výkonu je podání specifického antidota.
před méně než dvěma hodinami, je potřeba zvážit podání aktivního uhlí ke snížení absorpce léčiva. Tento postup je vhodný zejména v případě akutního předávkování. Jako další možnost, zejména v nepřítomnosti antidota u daného NOAC, se uvádí aplikace koncentrátů koagulačních faktorů (prothrombin complex concentrate, PCC) – viz tab. 3. Optimálním postupem v řešení krvácení nebo provedení emergentního výkonu je podání specifického antidota.
Specifické postupy k ukončení antikoagulační aktivity při léčbě xabany či gatrany
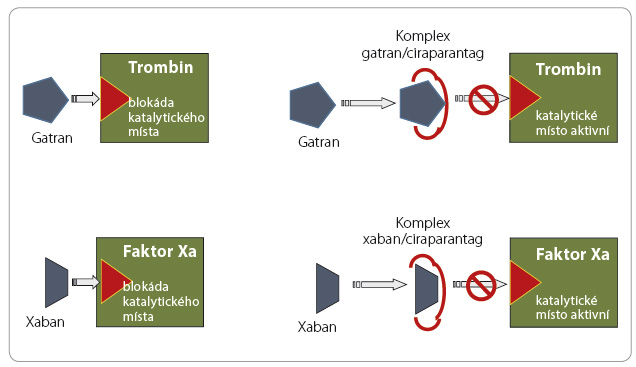
Vzh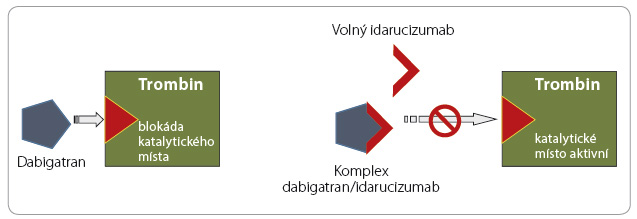 ledem k relativní častosti krvácení a k jeho potenciální závažnosti byla v posledních letech vyvíjena antidota k ukončení antikoagulační aktivity. Strategie ukončení působení warfarinu je založena na obnovení syntézy antikoagulačních faktorů podáním vitaminu K či přímo podáním koagulačních faktorů, strategie ukončení účinku heparinu a jeho derivátů vychází z inaktivace antikoagulancia v cirkulaci protaminem. Přístupů k ukončení účinku xabanů a gatranů je více. Působení dabigatranu můžeme inhibovat idarucizumabem, monoklonální protilátkou vázající molekulu léčiva (obr. 1). Účinek xabanů lze ukončit vyvázáním léčiva na „falešný substrát“ (analog faktoru Xa), který nemá koagulační aktivitu, či obsazením vazného místa antikoagulancia, kterým se váže na ka
ledem k relativní častosti krvácení a k jeho potenciální závažnosti byla v posledních letech vyvíjena antidota k ukončení antikoagulační aktivity. Strategie ukončení působení warfarinu je založena na obnovení syntézy antikoagulačních faktorů podáním vitaminu K či přímo podáním koagulačních faktorů, strategie ukončení účinku heparinu a jeho derivátů vychází z inaktivace antikoagulancia v cirkulaci protaminem. Přístupů k ukončení účinku xabanů a gatranů je více. Působení dabigatranu můžeme inhibovat idarucizumabem, monoklonální protilátkou vázající molekulu léčiva (obr. 1). Účinek xabanů lze ukončit vyvázáním léčiva na „falešný substrát“ (analog faktoru Xa), který nemá koagulační aktivitu, či obsazením vazného místa antikoagulancia, kterým se váže na ka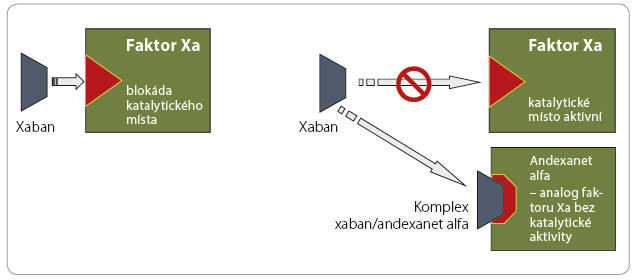 talytické centrum faktoru Xa či trombinu (obr. 2, 3). Účinnost a bezpečnost již byla prověřena u inhibitoru dabigatranu – idarucizumabu, který byl na základě příznivých výsledků klinických zkoušek uvolněn ke klinickému užití. Naopak ostatní antidota (andexanet alfa a ciraparantag) se stále nacházejí ve fázi klinického hodnocení.
talytické centrum faktoru Xa či trombinu (obr. 2, 3). Účinnost a bezpečnost již byla prověřena u inhibitoru dabigatranu – idarucizumabu, který byl na základě příznivých výsledků klinických zkoušek uvolněn ke klinickému užití. Naopak ostatní antidota (andexanet alfa a ciraparantag) se stále nacházejí ve fázi klinického hodnocení.
Idarucizumab – specifické antidotum dabigatranu
Idarucizumab je fragment humanizované myší monoklonální protilátky, který se váže v poměru 1 : 1 k dabigatranu a antagonizuje jeho působení (tab. 4). Afinita dabigatranu k idarucizumabu je vysoká (~ 350krát silnější než afinita dabigatranu k trombinu). Způsob podání idarucizumabu je výlučně intravenózní, neproniká extravaskulárně a váže jak dabigatran volný, tak navázaný na trombin. Poločas plazmatické eliminace komplexu antigen/protilátka je přibližně 45 minut, vylučuje se především renálně. A čkoliv idarucizumab jeví strukturální podobnost s trombinem, nemá protrombotickou aktivitu [12].
čkoliv idarucizumab jeví strukturální podobnost s trombinem, nemá protrombotickou aktivitu [12].
Již studie fáze II se zdravými mladými dobrovolníky prokázaly, že po podání 220 mg dabigatranu 2× denně aplikace idarucizumabu kompletně ukončí antikoagulační působení, což bylo zjištěno opakovaným stanovením dTT, ECT a aPTT. Stejné výsledky přinesly studie u dobrovolníků středního věku a u dobrovolníků s omezenou funkcí ledvin (těm byla podávána redukovaná dávka 150 mg dvakrát denně). Po obnovení medikace dabigatranem 24 hodin po aplikaci idarucizumabu bylo opět dosaženo antikoagulačního působení. I druhá aplikace idarucizumabu v odstupu dvou měsíců ukončila antikoagulační účinek dabigatranu, přičemž nebyla zjištěna hypersenzitivita, pouze u jednoho ze šesti dobrovolníků se prokázaly protilátky proti antidotu [13,14].
Registrační, prospektivní studie 3. fáze klinického zkoušení RE‑VERSE AD stanovila účinnost a bezpečnost idarucizumabu u dvou skupin nemocných léčených dabigatranem, dominantní indikací pro léčbu dabigatranem byla fibrilace síní. Do studie byli zařazováni jak nemocní s život ohrožujícím krvácením (skupina A, n = 51), tak pacienti s nutností emergentní chirurgické léčby, tj. bez možnosti odložení operace do doby odeznění účinku (skupina B, n = 39). Z čistě etického důvodu se nemohlo jednat o randomizovanou studii. Primárním ukazatelem účinku byl průkaz poklesu antikoagulačního účinku dabigatranu, stanovený sérií laboratorních dabigatran‑specifických hemokoagulačních testů (dTT a ECT). Tyto testy byly prováděny centrálně a klinici neměli přístup k jejich výsledkům, opírali se pouze o výsledek testu aPTT prováděného lokálně. Při iniciálním stanovení mělo 68 nemocných zvýšenou hodnotu dTT a 81 nemocných mělo zvýšenou hodnotu ECT. Idarucizumab byl podáván v dávce 5 mg intravenózně.
Prvotní analýza (51 pacientů ve skupině A a 39 pacientů ve skupině B) ukázala, že idarucizumab normalizoval výsledky testů u 88 % až 98 % pacientů, přičemž účinek byl patrný v několika minutách. Ve skupině A idarucizumab normalizoval dTT u 98 % pacientů, ve skupině B u 93 % pacientů. Ekarinový čas byl normalizován u 89 % pacientů ve skupině A a u 88 % ve skupině B. Plazmatické koncentrace dabigatranu byly minimální (< 20 ng/ml) i při stanovení po 24 hodinách u všech, s výjimkou jednoho pacienta. Nicméně případný vzestup plazmatické koncentrace nevázaného dabigatranu po 24 hodinách lze vysvětlit jeho přestupem z extravaskulárních do intravaskulárních prostor a současně krátkým biologickým poločasem idarucizumabu (45 minut). Dle klinického stavu je tedy možno v danou chvíli zvážit opakované podání antidota.
Co se týká klinického průběhu, bylo dosaženo téměř okamžitého obnovení hemostázy zhruba po 12 hodinách od podání dabigatranu u nemocných s významným krvácením. Vlastní resoluce krvácení byla obtížně stanovitelná, v řadě případů šlo o krvácení intrakraniální nebo retroperitoneální. U nemocných léčených pro nutnost urgentní operace byla hodnocena hemostáza během chirurgického výkonu jako normální a pouze výjimečně jako mírně abnormální. Trombotické příhody, a to jak časné (tj. do 72 hodin po podání antidota), tak pozdní (tj. po více než 72 hodinách), se objevily celkem asi u 5 % nemocných v době, kdy ještě nebyli léčeni žádným antikoagulanciem [15].
V dané studii nebyly pozorovány jakékoliv varovné bezpečnostní problémy spojené s aplikací idarucizumabu, stejně jako se nevyskytly u 200 dobrovolníků v předchozích studiích 2. fáze hodnocení.
Andexanet alfa: antidotum inhibitorů faktoru Xa
Andexanet alfa (PRT06444 5) je rekombinantní a inaktivovaná forma faktoru X, který má sloužit jako univerzální antidotum pro všechny inhibitory faktoru Xa (tab. 5, obr. 2). Neutralizuje tedy působení nejen xabanů, ale i nízkomolekulárních heparinů a fondaparinuxu (u frakcionovaných heparinů jde pouze o parciální inhibici působení, protože není ovlivněno působení na trombin). Andexanet alfa nemá vlastní prokoagulační aktivitu díky mutaci v jedné z aminokyselin v katalytické části molekuly. Tato modifikace dovoluje vázat se k přímým inhibitorům faktoru Xa a ke komplexu heparin/antitrombin, i když chybí původní enzymatická aktivita. Neinteraguje s jakýmkoliv koagulačním plazmatickým proteinem, s výjimkou TFPI (tissue factor pathway inhibitor).
5) je rekombinantní a inaktivovaná forma faktoru X, který má sloužit jako univerzální antidotum pro všechny inhibitory faktoru Xa (tab. 5, obr. 2). Neutralizuje tedy působení nejen xabanů, ale i nízkomolekulárních heparinů a fondaparinuxu (u frakcionovaných heparinů jde pouze o parciální inhibici působení, protože není ovlivněno působení na trombin). Andexanet alfa nemá vlastní prokoagulační aktivitu díky mutaci v jedné z aminokyselin v katalytické části molekuly. Tato modifikace dovoluje vázat se k přímým inhibitorům faktoru Xa a ke komplexu heparin/antitrombin, i když chybí původní enzymatická aktivita. Neinteraguje s jakýmkoliv koagulačním plazmatickým proteinem, s výjimkou TFPI (tissue factor pathway inhibitor).
Studie 2. fáze klinického hodnocení ukázaly účinnost andexanetu alfa v reverzi účinku apixabanu, rivaroxabanu, edoxabanu a enoxaparinu.
V současné době probíhá série studií ANNEXA (Andexanet Alfa a Novel Antidote to the Anticoagulant Effects of fXA Inhibitors) zaměřených na zjištění účinnosti a bezpečnosti u zdravých dobrovolníků antikoagulovaných buď apixabanem (ANNEXA‑A) nebo rivaroxabanem (ANNEXA‑R). Předběžná data z první studie s 33 jedinci ukázala, že bolus 400 mg andexanetu alfa bezprostředně zrušil antikoagulační působení apixabanu a normalizace koagulace trvala 1–2 hodiny. V reverzi účinku rivaroxabanu je používána dávka 800 mg u starších zdravých dobrovolníků. Je tedy zajímavé, že k reverzi účinku apixabanu a rivaroxabanu jsou užity různé dávky, pravděpodobně jiné budou užívány u frakcionovaných heparinů [16–18].
Byla zahájena i otevřená studie k průkazu účinku andexanetu alfa u pacientů s akutním krvácením v průběhu léčby různými xabany nebo enoxaparinem (ANNEXA‑4).
Ciraparantag – univerzální antidotum (derivátů heparinu a NOAC)
Ciraparantag (aripazin, PER977) je malá synteticky vyrobená molekula, která váže a inaktivuje přímé inhibitory faktoru Xa (xabany), přímé trombinové inhibitory (gatrany) a hepariny (nefrakcionované i nízkomolekulární) i pentasacharidy (tab. 6, obr. 3). Přesný mechanismu účinku nebyl zveřejněn, ni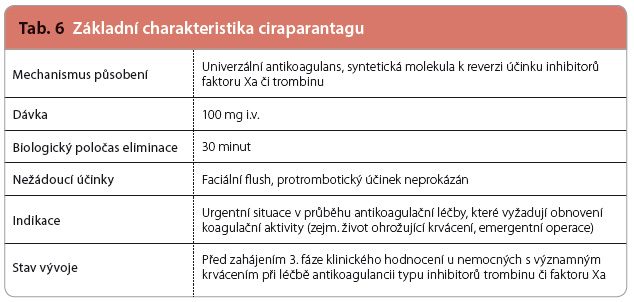 cméně v materiálech uvolněných výrobcem je zřejmé, že ciraparatang má celkem šest vazných míst, která se v různé míře účastní na inaktivaci jednotlivých antikoagulancií. Vazba léčiv běžně užívaných v kardiologii je přitom zanedbatelná.
cméně v materiálech uvolněných výrobcem je zřejmé, že ciraparatang má celkem šest vazných míst, která se v různé míře účastní na inaktivaci jednotlivých antikoagulancií. Vazba léčiv běžně užívaných v kardiologii je přitom zanedbatelná.
Doklady o účinku se opírají o reverzi působení edoxabanu, apixabanu i rivaroxabanu v testech in vitro – kvantifikace stanovením aktivity anti‑Xa. V preklinických studiích snížil ciraparantag krvácení o více než 90 % v modelu předávkování antikoagulanciem při užití stonásobné dávky dabigatranu, rivaroxabanu, apixabanu nebo edoxabanu [19,20].
Ve studii 2. fáze klinického hodnocení byl testován vliv na odeznění účinku edoxabanu. Aplikace ciraparantagu vedla k obnovení hemostázy během 10–30 minut a tento účinek trval 24 hodin. Nebyl zjištěn nežádoucí účinek podání ani laboratorní signály prokoagulačního působení [21]. V současné době jsou iniciovány registrační studie 3. fáze hodnocení.
Závěr
Léčba novými perorálními antikoagulancii se v průběhu posledních let rozšiřuje a díky tomu se řada lékařských odborností musí seznamovat nejen se základními farmakologickými daty těchto přípravků, ale je nutné znát i možnosti posouzení jejich antikoagulačního účinku v kritických stavech a vědět, jak optimálně zrušit účinek v případě nutnosti. Zásadním přínosem v jejich bezpečném podávání a při řešení kritické situace je existence antidota. Prvním antidotem, které je již registrované a dostupné, je idarucizumab – určený k reverzi účinku dabigatranu.
Obrázky v článku: archiv autorky.
Podpořeno projektem PRVOUK – P35.
Seznam použité literatury
- [1] Connolly SJ, Ezekowitz MD, Yusuf S, et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361: 1139–1151.
- [2] Granger CB, Alexander JH, McMurray JJ, et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2011; 365: 981–992.
- [3] Patel MR, Mahaffey KW, Garg J, et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011; 365: 883–891.
- [4] Giugliano RP, Ruff CT, Braunwald E, et al. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2013; 369: 2093–2104.
- [5] Ruff CT, Giugliano RP, Braunwald E, et al. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: a meta analysis of randomised trials. Lancet 2014; 383: 955–962.
- [6] Chai Adisaksopha C, Crowther M, Isayama T, Lim W. The impact of bleeding complications in patients receiving target specific oral anticoagulants: a systematic review and meta analysis. Blood 2014; 124: 2450–2458.
- [7] Weitz JI, Pollack CV, Jr. Practical management of bleeding in patients receiving non vitamin K antagonist oral anticoagulants. Thromb Haemost 2015; 114: 1113–1126.
- [8] Crowther M, Crowther MA. Antidotes for novel oral anticoagulants: current status and future potential. Arterioscler Thromb Vasc Biol 2015; 35: 1736–1745.
- [9] Ebright J, Mousa SA. Oral anticoagulants and status of antidotes for the reversal of bleeding risk. Clin Appl Thromb Hemost 2015; 21: 105–114.
- [10] Heidbuchel H, Verhamme P, Alings M, et al. Updated European Heart Rhythm Association Practical Guide on the use of non vitamin K antagonist anticoagulants in patients with non valvular atrial fibrillation. Europace 2015; 17: 1467–1507.
- [11] Paikin JS, Hirsh J, Chan NC, et al. Timing the first post operative dose of anticoagulants: lessons learned from clinical trials. Chest 2015; 148: 587–595.
- [12] Schiele F, van Ryn J, Canada K, et al. A specific antidote for dabigatran: functional and structural characterization. Blood 2013; 121: 3554–3562.
- [13] Glund S, Stangier J, Schmohl M, et al. Safety, tolerability, and efficacy of idarucizumab for the reversal of the anticoagulant effect of dabigatran in healthy male volunteers: a randomised, placebo controlled, double blind phase 1 trial. Lancet 2015; 386: 680–690.
- [14] Glund S, Moschetti V, Norris S, et al. A randomised study in healthy volunteers to investigate the safety, tolerability and pharmacokinetics of idarucizumab, a specific antidote to dabigatran. Thromb Haemost 2015; 113: 943–951.
- [15] Pollack CV, Jr, Reilly PA, Eikelboom J, et al. Idarucizumab for dabigatran reversal. N Engl J Med 2015; 373: 511–520.
- [16] Crowther M, Vandana M, Michael K, et al. A phase 2 randomized, double blind, placebo controlled trial demonstrating reversal of rivaroxaban induced anticoagulation in healthy subjects by andexanet alfa (PRT064445), an antidote for fxa inhibitors (abstract) Blood 2013; 122: 3636.
- [17] Crowther M, Levy G, Lu G, et al. ANNEXA A: a phase 3 randomized, double blind, placebo controlled trial, demonstrating reversal of apixaban induced anticoagulation in older subjects by andexanet alfa (PRT064445), a universal antidote for factor Xa (fXa) inhibitors. Circulation 2014; 130: 2105–2126.
- [18] Crowther M, Gold A, Lu G, et al. ANNEXA (TM) A PART 2: a phase 3 randomized, double blind, placebo controlled trial demonstrating sustained reversal of apixaban induced anticoagulation in older subjects by andexanet ALFA (PRT064445), a universal antidote for factor XA (FXA) inhibitors. J Thromb Haemost 2015; 13: 84–85.
- [19] Laulicht B, Bakhru S, Lee C, et al. Small molecule antidote for anticoagulants. Circulation 2012; 126: A11395.
- [20] Laulicht B, Bakhru S, Steiner S, et al. PER977 (ciraparantag) reverses edoxaban anticoagulation at steady state and has no effect on reanticoagulation at the next scheduled dose. Eur Heart J 2015; 36 Abstract Supplement.
- [21] Ansell JE, Bakhru SH, Laulicht BE, et al. Use of PER977 to Reverse the Anticoagulant Effect of Edoxaban. N Engl J Med 2014; 371: 2141–2142.