Současné možnosti léčby sirolimem
Sirolimus je antibiotické imunosupresivum, které patří do skupiny inhibitorů proteinkinázy mTOR (mammalian target of rapamycin). Své místo má zejména v transplantologii. Nejprve našel využití pouze v kombinaci s cyklosporinem v rámci klinických studií anebo jako záchranná léčba v případě pokročilé dysfunkce štěpu. Později se prokázaly také protinádorové účinky sirolimu, a proto je stále častěji používán u transplantovaných pacientů s malignitami. Tento článek shrnuje nejnovější poznatky z různých klinických situací, kdy je vhodné použití sirolimu po transplantaci ledviny.
Úvod
Sirolimus je novější makrolidové imunosupresivum, které se řadí do skupiny inhibitorů mTOR (mammalian target of rapamycin), tato skupina se nověji označuje jako inhibitory proliferačního signálu. Kromě sirolimu jsou k dispozici jeho deriváty everolimus, temsirolimus a zotarolimus. Everolimus je používán ve stejných indikacích jako sirolimus, temsirolimus je určen pro léčbu některých solidních nádorů (například ledvin) a zotarolimus je používán pro své antiproliferativní účinky v potažených koronárních stentech.
Sirolimus byl izolován z aktinomycety Streptomyces hygroscopicus nalezené v polovině 70. let ve vzorcích půdy na Velikonočním ostrově. Jeho makrolidová struktura a místo objevu (Rapa Nui) určily původní název nového léku jako rapamycin [1]. Sirolimus se používá v různých imunosupresivních kombinacích, zpočátku byl doporučován spolu s kalcineurinovými inhibitory (CNI). Již v prvních studiích ale byla pozorována potenciace nefrotoxicity cyklosporinu A. Jeho četné vedlejší účinky bohužel omezily výraznější rozšíření, v současnosti se používá u 8–10 % nemocných po transplantaci ledviny a jeho preskripce se dále nezvyšuje. Přesto se ukazuje, že má v imunosupresivních režimech své místo. Cílem tohoto přehledného článku je informovat čtenáře o možném současném využití tohoto preparátu.
Klinické situace, kdy je možno použít sirolimus po transplantaci ledviny
1. Časné ukončení terapie CNI a léčba samotným sirolimem
Dosud největší prospektivní randomizovanou studií sledující dlouhodobou léčbu sirolimem je tzv. studie 310, kterou provádí Rapamune Maintenance Regimen Study Group. Jedná se o multicentrickou studii, jíž se účastnilo 57 center z Evropy, Kanady a Austrálie. 525 nemocných po transplantaci ledviny bylo léčeno kombinací cyklosporinu A (údolní hladiny 200–400 ng/ml v prvním měsíci, 150–300 ng/ml do 3. měsíce), sirolimu (užíván 4 hodiny po podání dávky cyklosporinu, úvodní dávka byla 6 mg a dále nemocní dostávali 2 mg/den s cílovou hladinou > 5 ng/ml) a steroidů (dle zvyklostí každého centra, 5–10 mg/den v 6. měsíci). Po třech měsících byli nemocní randomizováni do dvou skupin: cyklosporin A (CsA) + sirolimus (SIR) + steroidy (ST) (n = 215) anebo sirolimus + steroidy (n = 215). Nerandomizováno bylo 95 nemocných, kteří měli špatnou renální funkci nebo prodělali závažné vaskulární rejekce. Nemocní léčení kombinací s cyklosporinem dostávali fixní dávku sirolimu 2 mg (hladiny > 5 ng/ml), hladiny cyklosporinu se pohybovaly v rozmezí 75–200 ng/ml. Nemocní ve druhé skupině měli dávku sirolimu zvýšenu tak, aby dosáhli cílové hladiny 20–30 ng/ml, a podávání cyklosporinu bylo postupně ukončováno během 4–6 týdnů. První výsledky této studie, která byla již poměrně rozsáhlá, ukázaly po prvním roce léčby podobné přežití štěpů (SIR-CsA-ST vs. SIR-ST: 95,8 % vs. 97,2 %) i nemocných (97,2 % vs. 98,1 %). Po randomizaci byl od 3. do 12. měsíce výskyt akutních rejekcí vyšší ve skupině bez cyklosporinu (4,2 % vs. 9,8 %). Ve 12. měsíci byla však renální funkce významně lepší ve skupině léčených sirolimem (sérový kreatinin 158 µmol/l vs. 142 µmol/l) a rovněž krevní tlak významně poklesl (139,8/81,3 vs. 133,5/78,6 mm Hg). Obě skupiny se lišily v zastoupení vedlejších účinků. Ve skupině s cyklosporinem byl popsán vyšší výskyt hypertenze, hyperurikémie a herpetických infekcí, kdežto ve skupině se sirolimem byl vyšší výskyt trombocytopenie, abnormálních jaterních testů a hypokalémie [2]. Po 4 letech se rozdíly mezi skupinami dále zvýraznily, přesvědčivě měli nemocní léčení jen sirolimem a steroidy významně lepší renální funkci v porovnání s těmi, kteří byli léčeni cyklosporinem, sirolimem a steroidy [3]. Protože někteří nemocní podstoupili opakované protokolární biopsie, jsou nyní k dispozici zajímavé údaje o vývoji histologických změn. I když v prvním roce žádné velké rozdíly mezi oběma skupinami nebyly pozorovány, ve třetím roce již měli nemocní léčení kombinací cyklosporin a sirolimus významně závažnější strukturální postižení měřené tzv. CADI skóre (chronic allograft damage index) [4]. K dispozici jsou již údaje o podobné práci, která místo cyklosporinu A použila v imunosupresivním schématu takrolimus. V tomto případě nebyly po dvou letech pozorovány velké rozdíly mezi skupinami v hodnotách kreatininu a proteinurie [5]. Je tedy zatím třeba mírnit nadměrný optimismus vycházející z výše uvedených dat do doby, než budou publikovány další dlouhodobé výsledky z jiných studií včetně popisu vedlejších účinků. Každopádně platí, že je možné časně ukončovat léčbu CNI pouze u pacientů bez rizika rejekce.
2. Režim se sirolimem de novo bez inhibitorů kalcineurinu
Použití sirolimu v kombinaci s mykofenolát mofetilem de novo po transplantaci ledviny je možné pouze v případě současně podané indukční imunosuprese. Největší dosud publikovanou studií byla práce Ekberga a kol., která recentně prokázala, že v porovnání s ostatními režimy je po indukci s monoklonální protilátkou proti receptoru pro interleukin-2 léčba sirolimem a mykofenolát mofetilem spojena s vyšším výskytem akutních rejekcí a s kratším jednoročním přežitím štěpů [6]. Tato práce má hodně kritiků především pro určení kontrolní skupiny. Dlouhodobá léčba oběma zmíněnými preparáty je také spojena se závažnou anémií, často vyžadující léčbu epoetiny. Menší pilotní studie, publikované především americkými autory, ukázaly uspokojivé dlouhodobé výsledky, byla-li jako indukce použita monoklonální protilátka alemtuzumab [7]. Opět ale byla zaznamenána řada vedlejších účinků, z nichž nejčastěji se vyskytovala myelotoxicita, ale také protilátkami zprostředkované rejekce. V současnosti není možné doporučit léčbu sirolimem de novo po transplantaci ledviny bez inhibitorů kalcineurinu, i když výjimky samozřejmě mohou existovat.
3. Sirolimus jako alternativa k inhibitorům kalcineurinu při dysfunkci štěpu
Sirolimus byl v minulosti často používán jako alternativa k inhibitorům kalcineurinu v léčbě nemocných s dysfunkcí štěpu. Výsledky monocentrických studií nebyly příliš konkluzivní. U některých nemocných se funkce štěpu zlepšila, u stejně velké skupiny nemocných se pak zase zhoršila a většinou se nepříznivému průběhu nepodařilo zabránit. U většiny nemocných s dysfunkcí transplantované ledviny, dříve označovanou jako chronická nefropatie štěpu (CAN), se za několik měsíců po změně terapie z cyklosporinu na sirolimus vyvinula klinicky významná proteinurie [8]. Tato komplikace prakticky znemožnila další pokračování léčby a byla obtížně kontrolovatelná renoprotektivní terapií inhibitory ACE anebo sartany. Je zajímavé, že pokud byli nemocní léčeni původně takrolimem, konverze na léčbu sirolimem nebyla spojena s takovými vedlejšími účinky a výsledky byly uspokojivější [9]. To svědčí pro menší poškození štěpů při léčbě takrolimem než při léčbě cyklosporinem A. V současnosti se monoterapie sirolimem v případě dysfunkce transplantované ledviny s proteinurií používá zřídka. Zahájení léčby sirolimem by mělo vždy předcházet histologické vyšetření vylučující aktivní rejekční změny. U pacientů s proteinurií (>1 g/24 h) je tato verze nevhodná.
4. Sirolimus u nemocných s anamnézou anebo s výskytem malignit de novo
V poslední době jsme svědky vyššího výskytu nádorů po transplantaci orgánů [10]. Jedním z hlavních důvodů je vyšší věk nemocných [11] a také delší expozice imunosupresivům, která souvisí s prodloužením funkce štěpů v porovnání s obdobím před 20 lety. Jinými riziky jsou mužské pohlaví, trvání dialýzy, předchozí anamnéza tumorů [12] a vyšší frekvence preformovaných protilátek před transplantací (PRA) [13]. Data z registrů ukazují, že mezi imunosupresivy existují rozdíly co do výskytu malignit po transplantaci ledviny. Indukční preparáty, antithymocytární globuliny a monoklonální protilátka OKT3 spolu s kalcineurinovými inhibitory cyklosporinem A a takrolimem jsou častěji spojovány s výskytem potransplantačních lymfoproliferací. V případě azathioprinu a mykofenolát mofetilu ovšem tyto asociace popsány nebyly [14].
Desetileté přežití transplantovaných nemocných s výskytem maligního onemocnění je poloviční oproti nemocným bez výskytu těchto onemocnění. Některá centra proto mění imusupresivní schéma u nemocných, kteří mají vyšší riziko potransplantačních malignit. I když nejsou k dispozici kvalitní data z prospektivních randomizovaných studií, pro svoje protinádorové účinky je sirolimus recentně používán u nemocných s anamnézou malignity před transplantací, kteří se nacházejí v nejvyšším riziku rekurence nebo duplicity. Často jsou na tuto léčbu převáděni také ti nemocní, u kterých se nádor po transplantaci vyskytne.
Z retrospektivní analýzy databáze OPTN/UNOS (Organ Procurement and Transplantation Network/United Network for Organ Sparing) čítající 33 249 transplantací od zemřelých dárců vyplývá, že 504 nemocných bylo léčeno sirolimem nebo everolimem bez inhibitorů kalcineurinu, 2321 bylo léčeno těmito preparáty spolu s inhibitory kalcineurinu a 30 424 nemocných pak CNI bez inhibitorů mTOR. Výskyt malignit byl 0,60 % během sledování po 963 dní v případě léčby s inhibitory mTOR a 1,81 % u nemocných léčených bez CNI (p < 0,0001). Multivariační analýza odhalila, že udržovací léčba s inhibitory mTOR snížila výskyt solidních nádorů o 55 % [12]. V prospektivní RMR (Rapamune Maintenance Regimen) studii byl výskyt nádorů ve skupině léčené dlouhodobě pouze sirolimem nižší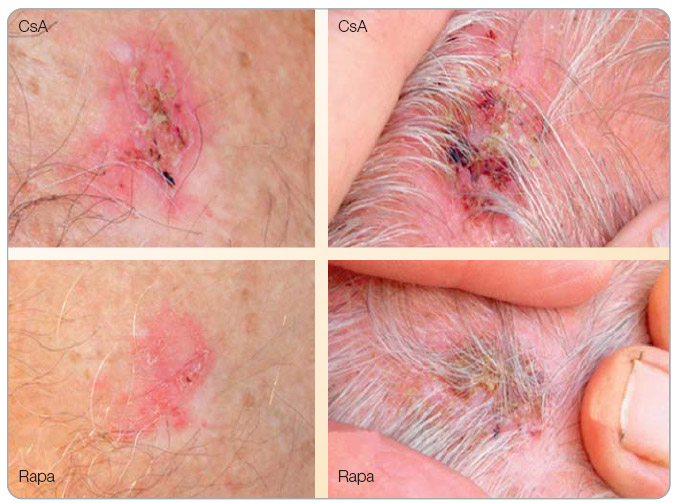 než ve skupině léčené kombinací cyklosporinu a sirolimu [15]. V případě Kaposiho sarkomů je v současnosti doporučován převod na léčbu sirolimem, protože se zdá, že je tento typ kožní malignity kurabilní samotným sirolimem. V práci Stalloneho a kol. bylo demonstrováno, že kožní projevy u nemocných s biopticky potvrzenými Kaposiho sarkomy vymizely do 3 měsíců poté, co byli nemocní převedeni na léčbu sirolimem. Remise onemocnění byla prokázána histologicky za dalších 6 měsíců. Po převodu se nevyskytly rejekce ani změny ve funkci štěpů [16]. Osobní zkušenosti (obr. 1) i zkušenosti z ostatních center svědčí o účinnosti sirolimu při zmenšení rozsahu bazaliomů a spinaliomů; v současnosti probíhá několik prospektivních studií o vlivu sirolimu na rozsah kožních malignit.
než ve skupině léčené kombinací cyklosporinu a sirolimu [15]. V případě Kaposiho sarkomů je v současnosti doporučován převod na léčbu sirolimem, protože se zdá, že je tento typ kožní malignity kurabilní samotným sirolimem. V práci Stalloneho a kol. bylo demonstrováno, že kožní projevy u nemocných s biopticky potvrzenými Kaposiho sarkomy vymizely do 3 měsíců poté, co byli nemocní převedeni na léčbu sirolimem. Remise onemocnění byla prokázána histologicky za dalších 6 měsíců. Po převodu se nevyskytly rejekce ani změny ve funkci štěpů [16]. Osobní zkušenosti (obr. 1) i zkušenosti z ostatních center svědčí o účinnosti sirolimu při zmenšení rozsahu bazaliomů a spinaliomů; v současnosti probíhá několik prospektivních studií o vlivu sirolimu na rozsah kožních malignit.
Podávání sirolimu není vhodné zahájit bezprostředně po transplantaci ledviny, protože je tato léčba spojována s opožděním rozvoje funkce štěpu, s problematickým hojením operační rány a s četnějším výskytem lymfokél. Rovněž se ukazuje, že léčba sirolimem a mykofenolát mofetilem bez inhibitorů kalcineurinu bezprostředně po transplantaci ledviny je spojena s vyšším výskytem rejekcí. Proto je vhodné po 3–6 měsíců tyto nemocné léčit standardní imunosupresí. Není-li nemocný ve vysokém imunologickém riziku (vyšší frekvence PRA, opakované rejekce) a nejsou-li jiné kontraindikace zahájení léčby sirolimem (vyšší proteinurie, excesivní hyperlipidémie a leukopenie/trombocytopenie), mohou mít tito nemocní prospěch z takovéto změny imunosuprese. Vyskytne-li se maligní onemocnění po transplantaci ledviny, je nezbytné redukovat imunosupresi a po dobu onkologické léčby je možno imunosupresi ukončit, protože chemoterapie sama o sobě je dostatečně imunosupresivní. Po ukončení takovéto léčby je pak možno nemocného převést na léčbu sirolimem. Je ale třeba zdůraznit, že neexistují žádné prospektivní randomizované studie, které by tento postup verifikovaly jako bezpečný a účinný.
5. Kombinovaná léčba inhibitory kalcineurinu a sirolimem
Sirolimus zvyšuje hladiny cyklosporinu A a potencuje tak jeho nefrotoxicitu a hypertenzi nemocných. Cyklosporin A zase obráceně zvyšuje hladiny sirolimu. Podobně sirolimus zvyšuje i toxicitu takrolimu. Vedle potenciace vedlejších účinků však kombinace sirolimu a inhibitorů kalcineurinu zvyšuje jejich imunosupresivní účinnost; toho lze využít při léčbě rezistentních rejekcí nebo u nemocných ve vysokém imunologickém riziku. Takováto dlouhodobá léčba může být problematická vzhledem k četným vedlejším účinkům. Asi nejsilnější základní imunosupresi představuje léčba založená na kombinaci takrolimu a sirolimu spolu s kortikoidy. Jakkoliv se zpočátku zdálo, že tato kombinace není možná (oba preparáty se váží na stejný vazebný protein FKBP), jsou již dnes k dispozici data nejen z retrospektivních monocentrických pozorování, ale také z klinických studií, jež potvrzují vysokou imunosupresivní účinnost této kombinace. Pilotní projekty ukázaly u nemocných v riziku rejekce významně nižší výskyt akutních rejekcí při podávání kombinace takrolimus + sirolimus + steroidy i bez indukční léčby. Pokud u těchto nemocných byly následně z léčby odebrány steroidy, vyvinula se v průběhu let u některých nemocných závažná dysfunkce štěpu a biopsie prokázala chronické změny, i když akutní rejekce nebyla přítomna [17]. Ve větší prospektivní randomizované studii se vyskytlo během prvního roku nejméně rejekcí právě při léčbě takrolimem a fixní dávkou 2 mg sirolimu proti ostatním skupinám léčeným takrolimem + mykofenolát mofetilem a nebo takrolimem s fixní dávkou sirolimu 0,5 mg [18]. Autoři ovšem zaznamenali nejvíce vedlejších účinků právě ve skupině léčené takrolimem a 2 mg sirolimu. Vzhledem k individuální variabilitě biologické dostupnosti sirolimu mohli být tito nemocní vystaveni vyšším hladinám sirolimu. Na druhou stranu, údaje z databází svědčí o vyšším riziku ztráty štěpu při léčbě kombinací takrolimu a sirolimu oproti léčbě kombinací takrolimu a mykofenolát mofetilu [19]. Ukazuje se tak, že kombinaci sirolimu a takrolimu je asi možné použít po přechodnou dobu u nemocných s vysokým rizikem vzniku rejekcí anebo při záchranné léčbě rejekcí refrakterních na léčbu. Vedlejší účinky mohou být ale limitující pro dlouhodobé podávání této kombinace.
Terapie sirolimem
Sirolimus je dostupný v lékové formě tablet (1 mg nebo 2 mg). Léčba se řídí údolními hladinami. V současnosti se dříve doporučovaná nasycovací dávka ve většině center nepoužívá. V úvodu léčby jsou podávány 4 mg sirolimu v jedné ranní dávce denně po dobu 5–7 dní, posléze se dávky přizpůsobují údolním hladinám. První údolní hladiny má cenu měřit až po 5–7 dnech, kdy je dosaženo ustáleného stavu. Cílové hladiny sirolimu by měly být udržovány mezi 4–8 ng/ml. V prvních studiích byly používány hladiny vyšší (nejdříve 12–20 ng/ml, později 8–12 ng/ml), ale ty byly spojeny s četnými vedlejšími účinky. Inhibitory mTOR mají rozličné vedlejší účinky. Četné jsou hematologické komplikace, leukopenie a trombocytopenie. Opožděné hojení ran a lymfokély jsou typickou komplikací vyplývající z antiproliferačního účinku inhibitorů mTOR. Obvyklá je rovněž hyperlipidémie, zvláště hypertriglyceridémie. Aftózní změny v ústech byly popisovány při užívání sirolimu v roztoku. Časté jsou rovněž kožní změny připomínající akné. Sirolimus může opozdit rozvoj funkce štěpu po transplantaci kvůli prodloužení regenerace tubulů [20], potencuje nefrotoxicitu cyklosporinu a takrolimu. Z nefrologického hlediska je nejdůležitějším vedlejším účinkem proteinurie. Ukazuje se, že podávání sirolimu u štěpů, které již mají vyvinuté morfologické změny, vede ke vzniku závažné proteinurie. I když je proteinurie nefrotického rázu, zřídka vznikne nefrotický syndrom. Vysvětlení proteinurie při léčbě sirolimem není snadné. Čistě hemodynamické změny po ukončení léčby cyklosporinem nemohou být příliš významné, protože proteinurie při léčbě sirolimem vznikne i po transplantaci ostrůvků nebo při léčbě de novo. Bylo prokázáno, že sirolimus inhibuje tvorbu růstového faktoru pro endotel cév (VEGF), podílí se na poškození podocytů [21, 22]. Renální biopsie často odhalí obraz podobný fokálně-segmentální glomeruloskleróze. Je nutno poznamenat, že proteinurie nevzniká u všech pacientů léčených sirolimem. Jak ale bylo uvedeno dříve, v případě již vytvořených strukturálních změn s proteinurií nebo dokonce s významnou renální dysfunkcí ještě před převodem na léčbu sirolimem je zhoršení proteinurie pravidlem.
Závěr
Sirolimus je na českém trhu k dispozici nyní devátým rokem a názory na jeho  použití se změnily (tab. 1). Zpočátku byl používán pouze v kombinaci s cyklosporinem v rámci klinických studií anebo jako záchranná léčba v případě pokročilé dysfunkce štěpu. Nové poznatky o jeho protinádorovém účinku pak vedly k jeho častějšímu použití u nemocných s malignitami. Kombinace sirolimu s takrolimem je i přes vedlejší účinky používána jako záchranná léčba u nemocných s rejekcemi. Kromě transplantací ledvin se sirolimus začal daleko více používat u nemocných po transplantacích srdce a také po transplantaci Langerhansových ostrůvků.
použití se změnily (tab. 1). Zpočátku byl používán pouze v kombinaci s cyklosporinem v rámci klinických studií anebo jako záchranná léčba v případě pokročilé dysfunkce štěpu. Nové poznatky o jeho protinádorovém účinku pak vedly k jeho častějšímu použití u nemocných s malignitami. Kombinace sirolimu s takrolimem je i přes vedlejší účinky používána jako záchranná léčba u nemocných s rejekcemi. Kromě transplantací ledvin se sirolimus začal daleko více používat u nemocných po transplantacích srdce a také po transplantaci Langerhansových ostrůvků.
Seznam použité literatury
- [1] Vezina C, Kudelski A, Seghal SN. Rapamycin (AY-22,989), a new antifungal antibiotic. I. taxonomy of the producing streptomycete and isoloation of the active principle. J Antibiot 1975; 28: 721–726.
- [2] Johnson RWG, Kreis H, Oberbauer R, et al. Sirolimus allows early cyclosporine withdrawal in renal transplantation resulting in improved renal function and lower blood pressure. Transplantation 2001; 72: 777–786.
- [3] Oberbauer R, Segoloni G, Campistol JM, et al. Rapamune Maintenance Regimen Study Group. Early cyclosporine withdrawal from a sirolimus-based regimen results in better renal allograft survival and renal function at 48 months after transplantation. Transpl Int 2005; 18: 22–28.
- [4] Mota A, Arias M, Taskinen EI, et al. Rapamune Maintenance Regimen Trial. Sirolimus-based therapy following early cyclosporine withdrawal provides significantly improved renal histology and function at 3 years. Am J Transplant 2004; 4: 953–961.
- [5] Morales JM, Grinyó JM, Campistol JM, et al. Improved renal function, with similar proteinuria, after two years of early tacrolimus withdrawal from a regimen of sirolimus plus tacrolimus. Transplantation 2008; 86: 620–622.
- [6] Ekberg H, Tedesco-Silva H, Demirbas A, et al. ELITE-Symphony Study. Reduced exposure to calcineurin inhibitors in renal transplantation. N Engl J Med 2007; 357: 2562–2575.
- [7] Flechner SM, Friend PJ, Brockmann J, et al. Alemtuzumab induction and sirolimus plus mycophenolate mofetil maintenance for CNI and steroid-free kidney transplant immunosuppression. Am J Transplant 2005; 5: 3009–3014.
- [8] Ruiz JC, Campistol JM, Sánchez-Fructuoso A, et al. Increase of proteinuria after conversion from calcineurin inhibitor to sirolimus-based treatment in kidney transplant patients with chronic allograft dysfunction. Nephrol Dial Transplant 2006; 21: 3252–3257.
- [9] Witzke O, Viklicky O, Türk TR, et al. Conversion to sirolimus of patients with chronic allograft nephropathy – a retrospective analysis of outcome and influencing factors. Langenbecks Arch Surg 2009. In press.
- [10] Kessler M, Jay N, Molle R, Guillemin F. Excess risk of cancer in renal transplant patients. Transpl Int 2006; 19: 908–914.
- [11] Kauffman HM, Cherikh WS, McBride MA, et al. Post-transplant de novo malignancies in renal transplant recipients: the past and present. Transplant Int 2006; 19: 607–620.
- [12] Kauffman HM, Cherikh WS, Cheng Y, et al. Maintenance immunosuppression with target-of-rapamycin inhibitors is associated with a reduced incidence of de novo malignancies. Transplantation 2005; 80: 883–889.
- [13] Wimmer CD, Rentsch M, Crispin A, et al. The janus face of immunosuppression – de novo malignancy after renal transplantation: the experience of the Transplantation Center Munich. Kidney Int 2007; 71: 1271–1278.
- [14] Caillard S, Dharnidharka V, Agodoa L, et al. Post-transplant lymfoproliferative disorders after renal transplantation in the United States in era of modern immunosuppression. Transplantation 2005; 80: 1233–1243.
- [15] Campistol JM, Eris J, Oberbauer R, et al. Sirolimus therapy after early cyclosporine withdrawal reduces the risk for cancer in adult renal transplantation. J Am Soc Nephrol 2006; 17: 581–589.
- [16] Stallone G, Antonio Schena A, et al. Sirolimus for Kaposi's Sarcoma in Renal-Transplant Recipients. N Engl J Med 2005; 352: 1317–1323.
- [17] Hricik DE, Augustine JJ, Knauss TC, et al. Long-term graft outcomes after steroid withdrawal in African American kidney transplant recipients receiving sirolimus and tacrolimus. Transplantation 2007, 83: 277–281.
- [18] Vitko S, Wlodarczyk Z, Kyllönen L, et al. Tacrolimus combined with two different dosages of sirolimus in kidney transplantation: results of a multicenter study. Am J Transplant 2006; 6: 531–538.
- [19] Meier-Kriesche HU, Schold JD, Srinivas TR, et al. Sirolimus in combination with tacrolimus is associated with worse renal allograft survival compared to mycophenolate mofetil combined with tacrolimus. Am J Transplant 2005; 5: 2273–2280.
- [20] Lieberthal W, Fuhro R, Andry CC, et al. Rapamycin impairs recovery from acute renal failure: role of cell-cycle arrest and apoptosis of tubular cells. Am J Physiol Renal Physiol 2001; 281: F 693–706.
- [21] Letavernier E, Bruneval P, Vandermeersch S, et al. Sirolimus interacts with pathways essential for podocyte integrity. Nephrol Dial Transplant 2009; 24: 630–638.
- [22] Letavernier E, Legendre C. mToR inhibitors-induced proteinuria: mechanisms, significance, and management. Transplant Rev (Orlando) 2008; 22: 125–130.