Význam farmakogenetiky a lékových interakcí v léčbě přímými perorálními antikoagulancii
Souhrn:
Bultas J. Význam farmakogenetiky a lékových interakcí v léčbě přímými perorálními antikoagulancii. Remedia 2019; 29: 110–119.
Nežádoucí účinky léčiv jsou nejčastější iatrogenní příčinou poškození pacienta. Lékové a potravinové interakce se pak podílejí na tomto fenoménu největší měrou. S největším rizikem závažných interakcí se setkáváme u léčiv ovlivňujících životně důležité pochody a současně majících úzké terapeutické okno. Právě takovéto vlastnosti charakterizují antikoagulancia. Při jejich nízké aktivitě hrozí trombotická komplikace, při vysoké naopak krvácení. Tento přehled se věnuje farmakogenetickým vlivům a lékovým interakcím přímých perorálních antikoagulancií (direct oral anticoagulants, DOAC).
Z lékových interakcí na podkladě farmakodynamického účinku jsou nejvýznamnější interakce s léky zvyšujícími antitrombotický účinek (tj. s ostatními antitrombotiky) či s léky poškozujícími sliznici trávicího traktu či jiných orgánů (tj. zejména s nesteroidními antiflogistiky). Tento typ interakcí je všeobecně znám. Naopak neočekávanými a často podceňovanými jsou interakce ovlivňující osud DOAC v organismu, tedy interakce farmakokinetické. Z velkých registračních studií přímých antikoagulancií (RELY a ENGAGE), kdy byly užity dvě dávky a sledována populační farmakokinetika, vyplývá, že zvýšení koncentrace či expozice o několik málo desítek procent se projeví ve zhruba stejném zvýšení rizika krvácení.
Obdobně snížení koncentrace, resp. expozice sníží antitrombotický účinek. Platí vztah mezi dávkou a účinností, resp. bezpečností. Absorpce dabigatran etexilátu je aktivně omezena eliminační pumpou glykoproteinem P (P‑gp). Navíc ke vstřebávání dochází jen v kyselém prostředí. Aplikace v kardiologii nejčastěji užívaných inhibitorů P‑gp – verapamilu či amiodaronu – zvýší expozici dabigatranu o 60‒70 %. Naopak komedikace s inhibitory protonové pumpy (IPP) sníží koncentraci dabigatranu na polovinu. S lékovými interakcemi na úrovni P‑gp (či izoenzymu CYP3A4) se setkáváme u všech xabanů, jejich význam je srovnatelný s efektem u dabigatranu. Na druhé straně absorpce xabanů není omezena IPP. Obdobně induktory P‑gp snižují expozici všem DOAC, dabigatranu i xabanům. Lékové interakce na úrovni středně silných inhibitorů P‑gp (ev. CYP3A4) mohou dosáhnout významu při spolupůsobení dalšího faktoru měnícího expozici, zejména při snížení renálních funkcí, při nízké hmotnosti, při působení více inhibitorů současně nebo vlivem farmakogenetických rozdílů.
Summary:
Bultas J. The role of pharmacogenetics and drug interactions in the treatment with direct oral anticoagulants. Remedia 2019; 29: 110–119.
Side effects are the most common iatrogenic cause of damage to the patient. Drug and food interactions are the most prominent part of this phenomenon. The greatest risk of severe interactions can be encountered with drugs influencing essential processes that also have narrow therapeutic window. Those are the characteristics of anticoagulants. Thrombotic complications are present with their low action, bleeding when their action is high. This article reviews pharmacogenetic influences and drug interactions of direct oral anticoagulants (DOAC).
Regarding drug interactions based on pharmacogenetic effect, drugs increasing antithrombotic effect (i.e., with other antithrombotics) and drugs damaging the gastrointestinal mucosa (i.e., especially non‑steroidal anti‑inflammatory drugs) play the most important role. Generally, these types of interactions are known. However, interactions influencing the fate of DOAC in the organism, i.e., pharmacokinetic interactions, are unexpected and often underrated. Increasing the concentration or exposition by a few tens of percents translates into an approximately the same increase in the risk of bleeding, as evidenced by large registration studies (RELY and ENGAGE) where two doses were used and population pharmacokinetics was observed. Similarly, lowering the concentration or exposition decreases the antithrombotic effect. A relationship between the dose and the effect and safety exists.
The absorption of dabigatran etexilate is actively limited by the elimination P glycoprotein pump (P‑gp). Moreover, absorption is possible only in an acidic environment. In cardiology, the application of most widely used P‑gp inhibitors – verapamil or amiodarone – increases the exposition to dabigatran by 60‒70%. By contrast, co‑medication with proton pump inhibitors (PPI) lowers the concentration of dabigatran by half. Drug interactions with P‑gp (or CYP3A4) can be encountered in all xabans; their importance is comparable to those of dabigatran. On the other hand, the absorption of xabans is not limited by PPI. Similarly, P‑gp inductors lower the exposition to all DOAC, dabigatran and xabans. Drug interaction with respect to moderate P‑gp inhibitors (or CYP3A4) may reach significance when co‑interacting with another factor modifying the exposition, especially with the decrease in renal function, body mass decrease, when more inhibitors are in action at once or with the influence of pharmacogenetic differences.
Key words: drug interaction, direct oral anticoagulants, dabigatran, apixaban, rivaroxaban, edoxaban, P glycoprotein, proton pump inhibitors.
Jen málo lékových skupin má tak úzké terapeutické okno jako antikoagulancia. Již malý pokles koncentrace, resp. účinnosti (měřeno např. poklesem hodnoty mezinárodního normalizovaného poměru [INR] pod 2) vede k selhání efektu a k riziku trombózy, naopak zvýšení účinku (např. vzestup INR nad 4) může vést ke krvácení. U většiny jiných léčiv, např. u antihypertenziv, u hypolipidemik či u inhibitorů protonové pumpy (IPP), se s tak úzkým oknem nesetkáme. Význam optimální koncentrace a účinku antikoagulancií je podtržen tím, že oba extrémy – trombóza i krvácení ‒ mohou ohrožovat život nemocného.
Za více než 60 let klinického užívání warfarinu jsme si osvojili zásady vedení léčby ‒ kontroly protrombinového času, resp. INR, jsou samozřejmostí. Právě díky monitorování efektu antivitaminů K se s interakcemi ad oculos setkáváme a reagujeme na ně dietními doporučeními, úpravou souběžné léčby či adjustací dávky antikoagulancia. Povědomí o lékových, a zejména potravinových interakcích warfarinu je zakořeněno nejen mezi zdravotníky, ale i mezi nemocnými. Právě tento faktor, tj. riziko interakcí při léčbě antivitaminy K, byl nejvýznamnějším důvodem preference přímých perorálních antikoagulancií (direct oral anticoagulants, DOAC). Jako velmi důležitý faktor přechodu na nová antikoagulancia jej uvádělo 98 % lékařů, teprve na dalších místech se objevila účinnost a bezpečnost [1]. Tedy vysoké riziko interakcí při léčbě antivitaminy K a nízké při léčbě DOAC je v povědomí preskribujících lékařů na prvním místě při volbě antikoagulancia. Tento mýtus je v nás petrifikován marketingovou politikou řady farmaceutických společností. Tvrzení reprezentantů nejmenované firmy, že jejich DOAC má výjimečně nízké riziko lékových interakcí, bylo posledním momentem k sepsání tohoto přehledu.
Zaměřil jsem se zejména na otázky:
- Jak časté jsou lékové interakce DOAC?
- Jak velké rozdíly v expozici léčivu a v koncentraci léčiva jsou při léčbě DOAC významné?
- Které lékové interakce, s nimiž se běžně v praxi setkáváme, jsou již klinicky relevantní?
- Jsou mezi jednotlivými DOAC významné rozdíly v riziku vzniku interakcí?
- Jak ovlivňují další faktory (tj. renální funkce, věk, farmakogenetická výbava či hmotnost) expozici DOAC a jejich koncentraci?
Významným důvodem pro preferenci
DOAC je jejich nižší potenciál pro interakci s jinými léky.
Tato skutečnost vedla k tomu, že jsme zapomněli
na ostražitost, která je při antikoagulační léčbě
namístě. Absence rutinní kontroly efektu DOAC, jež by nás
upozornila na vybočení z optimální koncentrace, může
vést ke snížení účinnosti či bezpečnosti léčby. A je
nepochybné, že v praxi jistě vede. U warfarinu naopak
s interakcemi počítáme a efekt léčby pravidelně
monitorujeme. Přitom jistě platí u dabigatranu stejně jako
u xabanů, že existuje zcela obdobná závislost mezi
antikoagulační aktivitou a účinností (určenou snížením
počtu trombotických příhod) a bezpečností (danou
hemoragickými komplikacemi). Bylo by scestné se domnívat, že
u přímých antikoagulancií tento vztah neplatí. Faktorům
ovlivňujícím expozici antikoagulanciím bychom tedy měli věnovat
pozornost; přehled a význam základních faktorů
shrnuje tabulka 1.
Věk zde uveden není, neboť jeho působení je zprostředkováno
zejména poklesem glomerulární filtrace.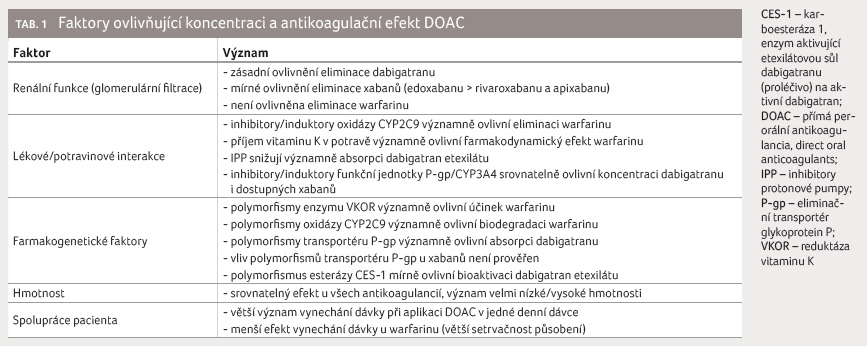
Úvodem je nutno zdůraznit, že dosud dostupná DOAC se v základním efektu – antikoagulaci – od sebe příliš neliší, všechna účinně inhibují koagulační kaskádu v místě spojení vnitřní a vnější cesty aktivace. Mezi účinkem inhibitorů trombinu (gatranů) a inhibitorů faktoru Xa (xabanů) však určité rozdíly existují. V případě gatranů inhibujeme efekt trombinu jako proteázy aktivující polymerizaci fibrinu, naopak xabany snižují koncentraci trombinu a ovlivňují obě funkce – katalytickou i regulační. U gatranů nemáme doklady o inhibici regulační funkce trombinu v komplexu trombin/trombomodulin. Komplex trombin/trombomodulin totiž mimo jiné inhibuje přirozenou fibrinolýzu. Lze si tak představit, že se obě skupiny mohou lišit, příkladem je zmíněný účinek na inhibici fibrinolýzy. Lékové interakce ovlivňující farmakodynamický účinek se tak mohou u gatranů a xabanů mírně lišit.
Jak časté a jak významné jsou lékové interakce DOAC?
O významu interakcí warfarinu s potravou či s léčivy nikdo nepochybuje, s výkyvy INR při kolísání příjmu vitaminu K v potravě se při léčbě antivitaminy K pravidelně setkáváme. Stejný názorný doklad však u DOAC nemáme, antikoagulační aktivitu či koncentraci nemonitorujeme. To však neznamená, že k interakcím nedochází, dochází k nim, ale sporadičtěji. V recentní publikaci sledující výskyt lékových interakcí jednotlivých antitrombotik byl pozorován výskyt potenciálně významných interakcí u 85 % německých seniorů léčených více léčivy současně [2]. Největší podíl interakcí byl dán současným podáváním nesteroidních antiflogistik (NSA). Lékové interakce při léčbě warfarinem se vyskytovaly u 68 % seniorů, při léčbě DOAC pak u 48 %. Tedy i léčba přímými antikoagulancii je zatížena lékovými interakcemi, musíme je očekávat asi u poloviny seniorů. Podobné údaje o interakcích DOAC u seniorů jsou publikovány i z jiných oblastí, např. v USA se výskyt potenciálních interakcí s DOAC pohyboval kolem 40 %, opět byla nejčastější skupinou léčiv s interakčním potenciálem NSA [3]. Nutno konstatovat, že lékové interakce DOAC jsou u seniorů relativně časté, právě tito pacienti jsou antikoagulancii léčeni nejčastěji.
Druhou otázkou je význam lékových interakcí, na prvním místě jejich vztah k výskytu krvácení. I zde máme data v prospektivní studii sledující výskyt krvácení vyžadujících hospitalizaci při léčbě rivaroxabanem [4]. Pouze u 20 % nemocných s významným krvácením nebyla zjištěna interakce. Naopak velká většina nemocných s krvácením při léčbě xabanem byla léčena buď léky zvyšujícími výskyt krvácení (zpravidla NSA), či zvyšujícími expozici DOAC. Tito nemocní měli koncentrace xabanu vyšší, než byly očekávány. Záměrně je nutno užít termín „očekávány“, neboť terapeutická koncentrace žádného z DOAC není oficiálně uváděna. Termín „očekávaná koncentrace“ razí doporučené postupy, konkrétně guidelines EHRA (European Heart Rhythm Association). Shrneme li, pak je doloženo, že interakce zvyšující expozici DOAC či postihující sliznici trávicího traktu mají na výskyt krvácení zásadní dopad. Naopak doklad o tom, zda léčiva snižující expozici DOAC zvyšují výskyt trombózy, nemáme. Vzhledem ke vztahu koncentrace a efektu nelze o riziku sníženého efektu či až selhání účinku DOAC při nízké koncentraci pochybovat.
Jaký je podklad lékových interakcí?
Lékové a potravinové interakce mohou vznikat na farmakodynamické bázi, potencován je antitrombotický účinek či je zvýšeno riziko krvácení poškozením cévní stěny (např. při kombinaci antikoagulancií s protidestičkovými léčivy či s NSA). Tento typ je zpravidla dobře předvídatelný.
Druhým typem jsou interakce
na farmakokinetické bázi,
kdy je ovlivněna absorpce, transformace či eliminace
antikoagulancia působením na úrovni transportních
a metabolických systémů. Tyto interakce jsou stejně časté,
ale na rozdíl od prvního typu jsou špatně předvídatelné
a v praxi je neočekáváme.
Mechanismem tohoto typu interakcí je inhibice či indukce
metabolických enzymů a influxních či efluxních
transportérů. Nejvýznamnějším systémem je tandem izoenzymu
CYP3A4 (cytochrom P450 3A4) a efluxního transportéru
glykoproteinu P (P gp). Tato eliminační jednotka (CYP3A4/P gp)
na úrovni enterocytu omezuje přístup cizorodých látek –
xenobiotik – do organismu, snižuje dostupnost asi
poloviny léčiv, která užíváme. Na úrovni renálního
tubulárního epitelu či hepatocytu zprostředkuje eliminaci
xenobiotik do moče a žluče. Při vysoké afinitě
substrátu k transportéru P gp je transmembránový přenos
realizován přímo P gp, jindy oxidáza CYP3A4 modifikací
molekuly afinitu k transportéru zvýší. Dvě DOAC –
dabigatran etexilát či edoxaban – jsou substráty pouze
P gp, druhá dvě DOAC – apixaban a rivaroxaban –
substráty izoenzymu CYP3A4 i P gp. Aktivace izoenzymu
a transportéru pak omezí dostupnost a zvýší eliminaci,
naopak inhibice dostupnost zvýší a zpomalí eliminaci. Je
nutno uvést, že většina inhibitorů a induktorů působí
současně jak na úrovni CYP3A4, tak eliminační pumpy P gp.
V praxi pak není významný rozdíl, je li DOAC substrátem
pouze P gp, či též oxidázy CYP3A4, riziko lékových
interakcí je obdobné. Přehled středně silných inhibitorů
a induktorů CYP3A4/P gp, které v praxi velmi často
s DOAC kombinujeme, je uveden v tabulce 2. Kombinace těchto inhibitorů s DOAC je velmi
častá: telmisartanem či kandesartanem je léčeno více než půl
milionu lidí v ČR, stejně tak antidepresivy typu SSRI
(selektivní inhibitory zpětného vychytávání serotoninu),
verapamilem a diltiazemem kolem 100 000 osob, stejně tak
uvedenými antiarytmiky. Dá se odhadnout, že nejméně čtvrtina
seniorů léčených DOAC užívá též některý lék patřící
do skupiny významných inhibitorů či induktorů CYP3A4/P gp.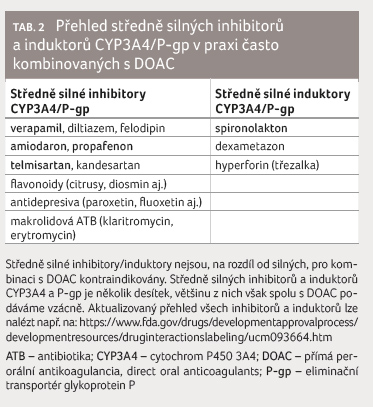
Jaké rozdíly v koncentraci a expozici DOAC jsou klinicky významné?
Jaké rozdíly v koncentraci DOAC jsou již klinicky významné ‒ pohybují se v řádu desítek procent, či se musí jednat o násobky? Odpověď nalezneme v datech z registračních megastudií fáze III klinického hodnocení (RELY a ENGAGE). Účinnost a bezpečnost dabigatranu a edoxabanu v nich byla testována při užití dvou odlišných dávek, nabízí se proto použít tyto údaje.
Ve studii RELY byl podáván
dabigatran jak v dávce 2× 110 mg, tak 2× 150 mg.
Toto zvýšení dávkování o 36 % vedlo ke vzestupu
koncentrace o 41 % (měřeno na konci dávkovacího
intervalu – trough levels). Vyšší koncentrace při režimu
2× 150 mg vedla ke snížení výskytu cévní mozkové
příhody (CMP) o 40 % oproti dávkování nižšímu [5].
Výskyt velkých hemoragických příhod při dávkování 2× 150 mg
proti 2× 110 mg vzrostl o 16 % (pod hranicí
významnosti), incidence krvácení do trávicího traktu však
stoupla významně – o 36 % (graf 1).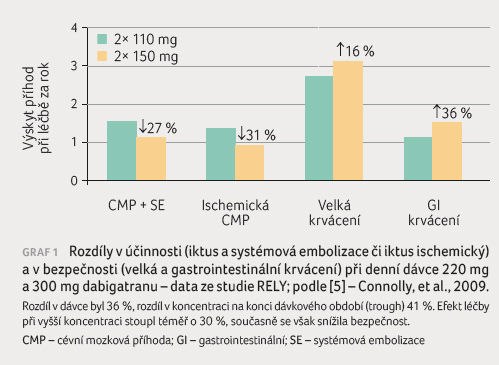
Podobná závislost mezi koncentrací antikoagulancia a účinností, resp. bezpečností léčby platí též pro edoxaban (data ze studie ENGAGE, graf 2). Podávání v nižší dávce (30 mg vs. 60 mg denně) vedlo ke snížení průměrné koncentrace o 51 %, což zvýšilo výskyt ischemických CMP o 53 % a snížilo výskyt velkých krvácení o 61 % [6]. Také pro apixaban a rivaroxaban platí těsný vztah mezi antikoagulační aktivitou a koncentrací léčiva [7]. Lze tak očekávat, že změny v koncentraci a v expozici se odrazí v účinnosti a bezpečnosti.
Shrneme li, pak změny
v koncentraci DOAC již v rozmezí 40‒60 % významně
ovlivňují účinnost (výskyt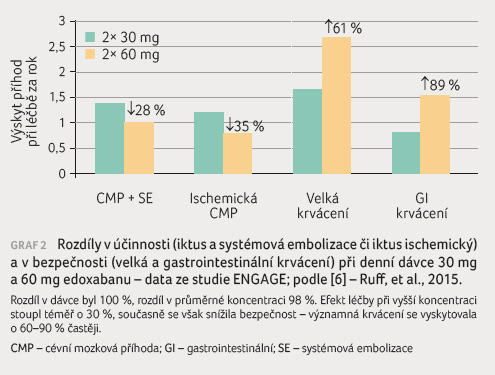 tromboembolických příhod)
i bezpečnost léčby (výskyt příhod hemoragických). Je
přímá korelace mezi koncentrací léčiva a výskytem
krvácení, resp. mezi koncentrací a poklesem výskytu
ischemických iktů a systémové embolizace. Tato data
vyvracejí mýtus, že změny koncentrace v rozmezí desítek
procent jsou klinicky nepodstatné. Naopak tyto „malé“ změny
jsou nejvýznamnější, neboť jsou v praxi nejčastější.
Takovéto změny navodí středně silné inhibitory či induktory
CYP3A4 nebo P gp, které na rozdíl od silných
inhibitorů/induktorů nejsou při léčbě DOAC kontraindikovány.
tromboembolických příhod)
i bezpečnost léčby (výskyt příhod hemoragických). Je
přímá korelace mezi koncentrací léčiva a výskytem
krvácení, resp. mezi koncentrací a poklesem výskytu
ischemických iktů a systémové embolizace. Tato data
vyvracejí mýtus, že změny koncentrace v rozmezí desítek
procent jsou klinicky nepodstatné. Naopak tyto „malé“ změny
jsou nejvýznamnější, neboť jsou v praxi nejčastější.
Takovéto změny navodí středně silné inhibitory či induktory
CYP3A4 nebo P gp, které na rozdíl od silných
inhibitorů/induktorů nejsou při léčbě DOAC kontraindikovány.
Význam interakcí DOAC na farmakodynamickém podkladě, tj. na úrovni ovlivnění účinku léčiva
Z klinického pohledu mají největší význam lékové interakce s ostatními antitrombotiky, zejména s protidestičkovými léky. Spíše však tento vztah vnímáme jako synergický účinek cíleně indikovaný než jako lékovou interakci. V praxi často kombinujeme DOAC s protidestičkovou léčbou, někdy dokonce i s protidestičkovou léčbou duální. Příkladem jsou recentní výsledky studie AUGUSTUS, kde duální antitrombotická léčba apixabanem a blokátorem receptorů pro adenosindifosfát (zpravidla klopidogrelem) byla zatížena téměř polovičním rizikem významného krvácení (velkého a klinicky významného) oproti triální léčbě s přidáním kyseliny acetylsalicylové (7,3 % vs. 13,8 %) [8]. Riziko krvácení se při kombinaci všech DOAC s protidestičkovou léčbou významně zvyšuje [9]. Obecně však lze říci, že při kombinaci protidestičkové léčby s antikoagulanciem je menší riziko krvácení při kombinaci s DOAC než s warfarinem. V rámci duální, či dokonce triální antitrombotické léčby preferujeme do kombinace DOAC oproti warfarinu. Příkladem nižšího rizika kombinace DOAC s protidestičkovou léčbou než kombinace warfarinu s touto terapií jsou např. data ze studie ARISTOTLE [10].
Druhou nejvýznamnější lékovou interakcí je zvýšení rizika krvácení při kombinaci DOAC s NSA. Příkladem významu interakcí DOAC s NSA jsou data ze studie RELY s dabigatranem/warfarinem. Velká krvácení se objevila při současné léčbě o 68 % častěji, resp. výskyt gastrointestinálních krvácení stoupl o 81 %. Nebyl zjištěn rozdíl ve zvýšení rizika kombinace s NSA mezi dabigatranem a warfarinem [11].
Jako třetí významná léková interakce s DOAC se uvádí zvýšení rizika krvácení při současném podávání antidepresiv ze skupiny SSRI. Mechanismem by mohla být aktivace trombocytů při zvýšené nabídce serotoninu. Všechny souhrny údajů o přípravku (SPC) obecně zmiňují riziko této interakce. Zcela však chybějí podklady o skutečném významu této kombinace, naopak jsou k dispozici cílené práce, které dosti dokladů nenalezly [3].
Shrneme li, pak je nutno zdůraznit riziko zvýšeného krvácení, zejména do trávicího traktu, při kombinaci DOAC s NSA. Toto je ostatně přítomno též u všech ostatních antitrombotik, jak antikoagulancií, tak protidestičkových léků. Zvýšení rizika velkých krvácení či krvácení do trávicího traktu o více než dvě třetiny při podávání kombinace těchto léků mluví samo za sebe. Zvýšení rizika krvácení při kombinaci DOAC s protidestičkovou léčbou je známou a respektovanou skutečností. Zde však jde spíše o cílený aditivní efekt než o interakci.
Význam interakcí DOAC na farmakokinetickém podkladě, tj. na úrovni ovlivnění koncentrace léčiva a expozice léčivu
Interakce léčiv na farmakokinetickém podkladě ovlivňují expozici léku. Expozice léčivu (AUC – součin koncentrace a času, plocha pod křivkou plazmatické koncentrace) je závislá na řadě faktorů. Zásadní význam v lékových a potravinových interakcích ovlivňujících osud léčiva v organismu má interakce na úrovni metabolických enzymů a transmembránových transportérů. Oba systémy působí na úrovni enterocytu, hepatocytu, tubulární epitelie nefronu. Jejich aktivita rozhoduje o biologické dostupnosti, transformaci (aktivaci či inaktivaci) a eliminaci naprosté většiny cizorodých molekul (xenobiotik), tedy i velké většiny léků.
Transportní eliminační pumpy a enzymatické systémy (zpravidla oxidázy CYP či transferázy) tvoří často funkční jednotku, jejímž cílem je omezení expozice organismu xenobiotikům (léčivům, toxinům atp.). Nejvýznamnější je tandem CYP3A4 a P gp – úlohou oxidázy je oxidace substrátu a zvýšení jeho afinity k eliminační pumpě. Tak je docíleno omezení dostupnosti a zvýšení eliminace asi poloviny běžně užívaných léčiv. Izoenzym CYP3A4 i P gp mají zpravidla stejné substráty, a vzhledem k tomu, že mají stejný regulační gen, mají až na výjimky i stejné inhibitory a induktory. Nepřekvapí proto ani podobnost lékových a potravinových interakcí DOAC. Všechna jsou totiž substráty P gp a apixaban a rivaroxaban též oxidázy CYP3A4.
Vedle transportních a metabolických jednotek je absorpce i renální eliminace některých léčiv ovlivněna jejich disociačním stavem. Zpravidla je absorpce významně vyšší, nejsou li molekuly disociovány. Léčiva charakteru slabých kyselin se vstřebávají lépe v kyselém prostředí, naopak slabé zásady v prostředí alkalickém. Tato skutečnost vysvětluje, že dabigatran etexilát se vstřebává převážně v distálním žaludku či v proximálním duodenu, ostatní DOAC se naopak absorbují v tenkém střevě. Změna pH v žaludku pak ovlivní dostupnost dabigatranu, ale nikoliv xabanů.
Vliv polymorfismů P gp a lékové interakce ovlivňující absorpci dabigatranu
Dominantním transportérem dabigatran
etexilátu (nikoliv však jeho aktivního metabolitu –
dabigatranu) je P gp. Vzhledem k vysoké afinitě k této
eliminační pumpě má dabigatran nízkou biologickou dostupnost,
která se pohybuje mezi 5‒8 %. Vyšší absorpce etexilátové
soli dabigatranu je dosaženo v kyselém prostředí žaludku
a proximálního duodena, naopak vzestup pH dostupnost léčiva
snižuje. Ještě na úrovni parenchymatózních buněk žaludku
či enterocytu dochází k hydrolýze na vlastní léčivo –
dabigatran. Tento aktivní metabolit již není substrátem žádného
metabolicko transportního systému a je z 80‒90 %
eliminován z organismu prostou glomerulární filtrací do moče
či z malé části do žluče (obr. 1). Z důvodu nízké dostupnosti dabigatranu je
nutno počítat s vyšším rizikem klinicky významného
zvýšení či snížení expozice při inhibici, resp. indukci P gp.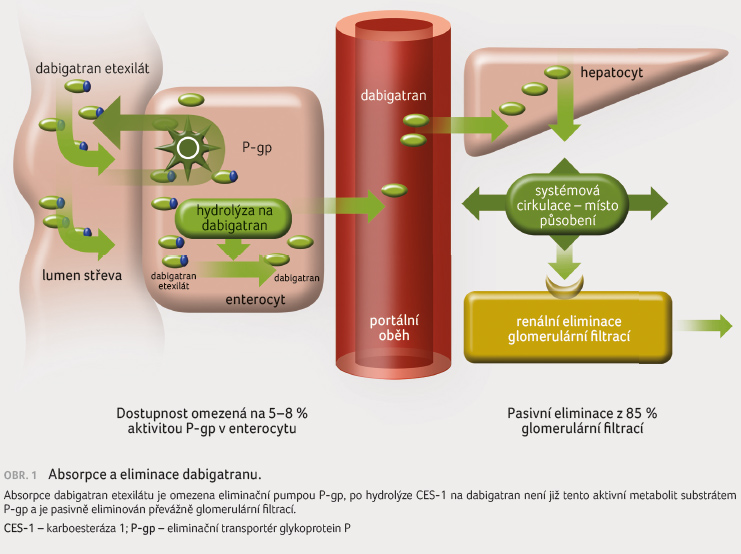
Obdobně je dostupnost ovlivněna farmakogenetickou výbavou. Polymorfismy této pumpy s vyšší aktivitou P gp (asi čtvrtina české populace) absorbují dabigatran etexilát významně méně, naopak genotyp s nízkou aktivitou (opět asi čtvrtina populace) se vyznačuje vyšší dostupností [12,13]. Rozdíly v koncentraci dabigatranu jsou více než dvojnásobné. Naproti tomu genotyp s nízkou aktivitou karboesterázy 1 (CES 1), enzymu aktivujícího dabigatran etexilát na aktivní dabigatran, ovlivní koncentraci méně významně, snížení činilo pouze 40 %. Význam polymorfismu P gp u absorpce dabigatran etexilátu je dán velkou afinitou substrátu k této pumpě. Dostupnost xabanů, jejichž afinita k P gp je výrazně menší, je ovlivněna nevýznamně [14].
Interakce dabigatran etexilátu
ovlivňující farmakokinetiku
jsou rovněž časté. Klinicky důležitá je léková
interakce dabigatranu s IPP.
Léky z této skupiny je léčeno více než 20 % seniorů,
těch, kteří užívají antitrombotika, ještě více. Uvedená
interakce je málo známá, a je přitom významná. Jak bylo
vysvětleno, dabigatran etexilát se lépe absorbuje v kyselém
prostředí. Vzestup hodnoty pH při léčbě IPP dostupnost snižuje.
V kontrolovaných cílených studiích, kdy byli pacienti léčeni
dlouhodobě IPP, byly snížení koncentrace i expozice
dabigatranu podstatné (graf 3).
V japonské studii vedla léčba IPP ke snížení
vrcholové i minimální koncentrace dabigatranu o třetinu,
nebyl doložen rozdíl mezi jednotlivými IPP [15]. Pro evropskou
populaci máme data ze slovenské studie [16]. V této
studii byly rozdíly ještě výraznější, minimální koncentrace
dabigatranu klesla při léčbě IPP o 47 % (ze 111 ng/ml
na 59 ng/ml), resp. vrcholová koncentrace klesla o 49 %
(ze 174 ng/ml na 88 ng/ml). Všechny rozdíly byly
vysoce statisticky signifikantní, klinická relevance poklesu
koncentrací téměř na polovinu byla rovněž významná.
Nutno zdůraznit velkou interindividuální variabilitu působení
léčby IPP. Také SPC Pradaxa konstatuje 30% snížení koncentrace
dabigatranu při nepravidelném podávání IPP, nález reflektuje
výsledky populační farmakokinetiky provedené ve studii RELY
[17].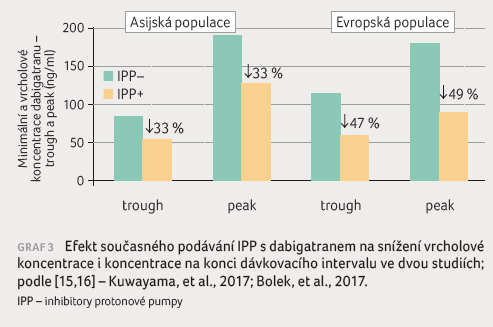
O účinku blokátorů receptoru H2 (ranitidinu a cimetidinu), které nezvyšují pH v žaludku tak výrazně jako IPP, nejsou data. Antacida snižují dostupnost asi o 20 % [18]. Podobně dostupnost dabigatranu snižují bariatrické operace redukující fundus žaludku či žaludek obcházející, tedy redukující produkci kyseliny solné. Data však existují pouze na úrovni ojedinělých pozorování [19].
Vedle závislosti na pH je absorpce dabigatran etexilátu (proléčiva) ovlivněna aktivitou eliminační pumpy P gp. Vzhledem k vysoké afinitě k této pumpě je koncentrace dabigatranu významně ovlivněna inhibitory či induktory tohoto transportéru. Efekt IPP se s účinkem inhibitorů, resp. induktorů P gp sčítá.
Jaká jsou konkrétní data pro interakci inhibitorů P pg s dabigatranem? Silné inhibitory – ketokonazol, itrakonazol, cyklosporin a dronedaron ‒ jsou kontraindikovány. Po jejich podání se expozice dabigatranu zvyšuje dvoj až trojnásobně [17]. Tato léčiva, která jsou pro podávání v kombinaci s dabigatranem kontraindikována, problém nepředstavují. V praxi je daleko běžnější kombinace dabigatranu s verapamilem a s amiodaronem, jejich společnou indikací je fibrilace síní. Platné SPC nabádá k opatrnosti. Dat pro interakci verapamilu s dabigatranem u zdravých dobrovolníků je dostatek, testováno bylo podání rychle rozpustné formy i retardované formy verapamilu [20]. Klinickou praxi nejlépe odráží model podávání verapamilu po dobu několika týdnů ve formě s prodlouženým účinkem v dávce 240 mg jedenkrát denně. Expozice dabigatranu stoupla o 71 %, resp. maximální koncentrace o 91 %. Takovéto zvýšení expozice je nepochybně klinicky významné. Je vhodné buď volit jiný blokátor kalciového kanálu, nebo zvážit redukci dávky dabigatranu. Volba jiného DOAC nic neřeší, jak bude posléze ukázáno, léková interakce tohoto typu je společná jak dabigatranu, tak všem xabanům.
Léčba dabigatranem u nemocných
s fibrilací síní bývá často kombinována též s léčbou
antiarytmickou. Vynecháme li málo užívaný dronedaron
(s dabigatranem kontraindikovaný), je při posuzování
interakčního potenciálu nutné zdůraznit interakci s amiodaronem
a propafenonem. Oba patří mezi středně silné inhibitory
P gp. Výrobce přípravku Pradaxa doporučuje opatrnost při
současném podávání. V časných studiích klinického
hodnocení u zdravých dobrovolníků bylo doloženo zvýšení
expozice dabigatranu o 58 % při jednorázovém současném
podání dabigatran etexilátu s amiodaronem [21]. V jiné
studii, opět s jednorázovým současným podáním amiodaronu
s etexilátovou solí dabigatranu, vzrostla expozice dabigatranu
o 60 % a maximální koncentrace o 50 % [22].
V téže studii byl prověřován též efekt verapamilu či
klaritromycinu v témže uspořádání, jejich dopad
na expozici a maximální koncentraci dabigatranu byl
identický s účinkem amiodaronu. Výrazně větší však bylo
zvýšení koncentrace dabigatranu po kombinaci s dronedaronem,
po tomto arytmiku stoupla expozice na více než
dvojnásobek (o 136 %), resp. maximální koncentrace o 125 %.
Dopad chronické léčby amiodaronem na expozici dabigatranu
prověřován nebyl. Přitom právě tato data by byla pro klinika
nejcennější. Nicméně dá se konstatovat, že i zvýšení
koncentrace dabigatranu o polovinu klinický význam má. Význam
interakce dabigatran etexilátu s propafenonem nebyl prověřován.
Vzhledem k tomu, že jeho inhibiční potenciál na úrovni
P gp je srovnatelný s amiodaronem a verapamilem, je
tato interakce uváděna jako významná [23]. Přehled výsledků
studií provedených s inhibitory a induktory P gp při
podávání dabigatran etexilátu je uveden v grafu 4.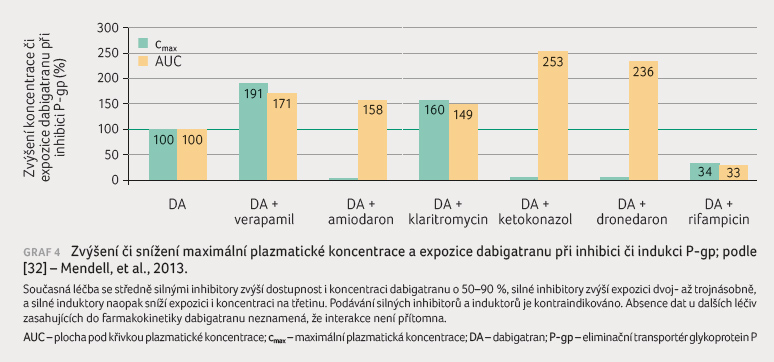
Ostatní lékové interakce dabigatranu se středně silnými inhibitory P gp (s klaritromycinem, chinidinem a tikagrelorem) jsou podstatně méně frekventní a mají menší význam. Chinidin se prakticky neužívá. Klaritromycin, který zvyšuje expozici asi o polovinu, se kombinuje s dabigatranem méně často a jedná se o léčbu krátkodobou. Určitý význam může mít kombinace s tikagrelorem, která připadá v úvahu např. u osob po akutní koronární příhodě či vaskulární intervenci a současně fibrilaci síní. Data získaná z farmakokinetické studie u zdravých dobrovolníků při podávání udržovací dávky tikagreloru ukazují zvýšení jak expozice dabigatranu, tak jeho maximální koncentrace asi o 30 %, tedy na hranici významnosti [24]. Při této kombinaci je významnější interakce na bázi farmakodynamiky, nicméně i mírné zvýšení expozice antikoagulanciu může přispět ke zvýšenému výskytu krvácení. Je ke zvážení volba nižší dávky dabigatranu, např. 110 mg 2× denně.
Potravinové interakce či interakce s fytofarmaky na bázi inhibice P gp v SPC zmiňovány nejsou, též chybějí farmakokinetické studie. Nicméně je pravděpodobné mírné zvýšení aktivity dabigatranu při expozici polyfenolickým látkám z citrusových plodů. Do inhibitorů tohoto typu patří zejména flavonoid naringin a furanokumariny, jako je bergamotin obsažený hlavně v grapefruitu. Podobný efekt mají flavonoidy z fytofarmak, konkrétně diosmin z venofarmak. U osob s vysokým rizikem krvácení je vhodné vzít i takovéto „slabé“ interakce do hry při rozhodování o volbě optimální dávky antikoagulancia. To bude platit nejen na úrovni dabigatranu, ale opět i všech xabanů.
Též induktory P gp se silným indukčním potenciálem (karbamazepin, fenytoin, rifampicin či třezalka) ovlivňují dostupnost dabigatran etexilátu. Zvýšení aktivity eliminačního transportéru významně sníží dostupnost proléčiva. Výrobce nedoporučuje tyto silné induktory s dabigatranem kombinovat. Kombinace rifampicinu (referenční induktor P gp) s dabigatran etexilátem snížila expozici dabigatranu o 67 % a maximální koncentraci o 66 % [25]. Snížená dostupnost dabigatranu přetrvávala ještě několik dnů po přerušení podávání rifampicinu. Pro ostatní induktory přímá data o dopadu kombinace s dabigatranem nemáme, analogie s referenčním rifampicinem je předpokládána. Do skupiny silných induktorů P gp patří též dexametazon či spironolakton, o jejich kombinaci s dabigatranem se sice SPC nezmiňuje, nicméně též při léčbě dexametazonem i spironolaktonem je nutno předpokládat snížení expozice dabigatranu. Například kombinace spironolaktonu s jinými substráty P gp, konkrétně s digoxinem, snížila absorpci o 40 % [26]. Kombinace dabigatranu s těmito dvěma induktory P gp je podstatně častější než prakticky neužívané kombinace s fenytoinem, karbamazepinem či rifampicinem. Ve Skandinávii, kde antikoagulační léčba probíhá na tzv. antikoagulačních klinikách, tedy pracovištích s nebývalou zkušeností s antikoagulační léčbou, jsou právě spironolakton a amiodaron vedeny jako léčiva z pohledu interakcí zvláště nebezpečná [27].
Vliv lékových interakcí na absorpci a eliminaci xabanů (apixabanu, edoxabanu a rivaroxabanu)
Apixaban
a rivaroxaban
jsou substráty oxidázy CYP3A4 a transportéru P gp,
jejich afinita k tomuto eliminačnímu systému je nízká,
biologická dostupnost se proto pohybuje mezi 50‒70 %, resp. při
užití s jídlem u rivaroxabanu mezi 190‒100 %.
Z důvodu nízké afinity k tomuto
metabolicko transportnímu systému je riziko zvýšení
dostupnosti antikoagulancia relativně malé. Přistupuje však další
složka, kterou je interakce na úrovni eliminace (obr. 2). Ta je facilitována na úrovni biliárního pólu
hepatocytu zejména prostřednictvím P gp. Význam izoenzymu
CYP3A4 je malý, metabolizováno je pouze 25 % apixabanu či 33 %
rivaroxabanu [28].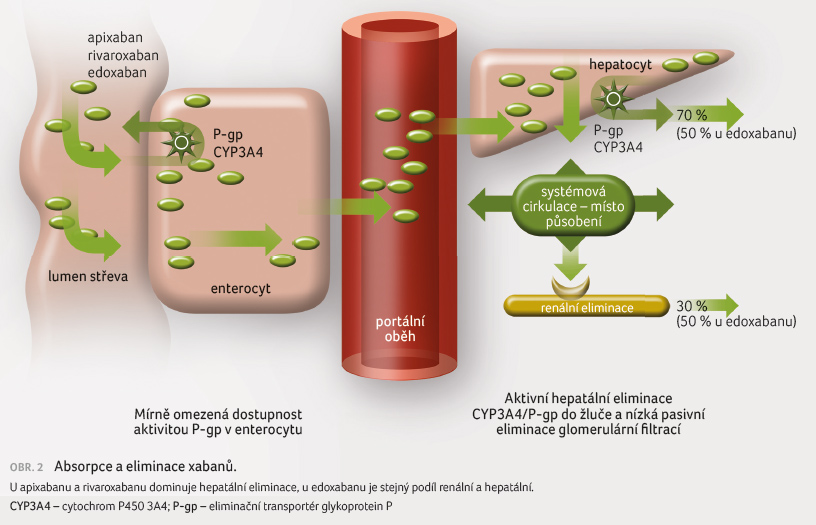
Inhibitory P gp a CYP3A4 tak mírně zvyšují biologickou dostupnost apixabanu a rivaroxabanu a současně mírně snižují jejich eliminaci, naopak induktory P gp a CYP3A4 snižují absorpci a potencují eliminaci. Ve výsledku se oba vlivy (absorpce a eliminace) sumují. Na eliminaci apixabanu i rivaroxabanu se podílí i další eliminační pumpa – breast cancer resistance protein (BCRP), riziko interakcí je proto při inhibici P gp na úrovni eliminace nižší. Lékové interakce ovlivňující eliminační pumpu BCRP jsou vzácné a jejich klinický význam je zanedbatelný [29,30]. Transportér BCRP však může zajistit eliminaci při snížené aktivitě P gp. Díky nižší afinitě apixabanu a rivaroxabanu k P gp a díky dvojí cestě eliminace není polymorfismus této pumpy, na rozdíl od dabigatranu, významný. Vedle hepatální eliminace se v menší míře uplatní též renální cesta, oba xabany jsou vylučovány z 25‒35 % též renálně, spíše tubulární sekrecí než glomerulární filtrací.
Na rozdíl od prvních dvou xabanů není edoxaban substrátem CYP3A4. Jeho absorpce i eliminace je však ovlivněna transportérem P gp. Afinita k němu je i bez předchozí oxidace obdobná jako u apixabanu a rivaroxabanu, výsledná biologická dostupnost se pohybuje kolem 60 %. Vzhledem k tomu, že CYP3A4 i P gp mají obdobné induktory a inhibitory, nemá absence oxidáz pro biotransformaci a eliminaci edoxabanu větší praktický význam. Eliminace edoxabanu je vyrovnaná – z poloviny hepatální a z poloviny renální (převážně jako mateřská látka). Požití s potravou jen nevýznamně ovlivní dostupnost edoxabanu.
Interakce apixabanu i rivaroxabanu
se silnými inhibitory a induktory CYP3A4 a P gp byly
prověřovány v rámci preregistračních i postregistračních
studií [3,31,32]. Kombinace s řadou antimykotik (např.
ketokonazolem, itrakonazolem a dalšími) či s některými
inhibitory HIV proteázy (např. ritonavirem) není doporučována,
resp. v řadě indikací je kontraindikována. Obdobně je tomu
u silných induktorů CYP3A4/P gp (např. fenytoinu,
karbamazepinu, fenobarbitalu či třezalky tečkované). Vzhledem
k tomu, že se azolová antimykotika a antiretrovirotika či
antikonvulziva užívají v kombinaci s antikoagulancii
vzácně, jsou z klinického hlediska zajímavější interakce
s daleko častěji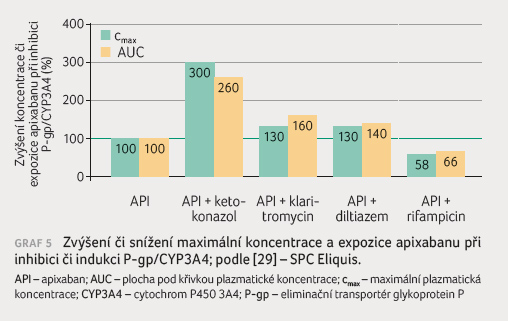 užívanými středně silnými inhibitory,
resp. induktory. Běžné jsou kombinace antikoagulancií
s antiarytmiky (zejména s amiodaronem a propafenonem)
a s non dihydropyridinovými blokátory kalciového
kanálu (s verapamilem a diltiazemem). Tyto kombinace jsou
významné nejen pro svoji frekvenci, ale i pro delší trvání.
Je rozdíl, podáváme li s antikoagulanciem antibiotikum
(např. klaritromycin či erytromycin) po dobu týdne, či
antiarytmikum (zejména amiodaron) po měsíce či léta.
Bohužel data pro interakci amiodaronu s apixabanem nebo
s rivaroxabanem nejsou k dispozici, farmakokinetické
studie nebyly provedeny. Nicméně podle analogie s obdobně
silnými inhibitory CYP3A4/P gp (např. s klaritromycinem
či diltiazemem), které zvyšují expozici apixabanu či
rivaroxabanu o 40‒50 %, je pravděpodobné, že na této
úrovni můžeme očekávat dopad interakce obou xabanů
s amiodaronem nebo verapamilem. Podobně chybějí data pro
kombinaci s verapamilem. Pouze u apixabanu byl sledován
efekt diltiazemu s podobně silnou inhibicí CYP3A4/P gp,
jako má verapamil, jeho maximální koncentrace stoupla o 30 %,
resp. expozice apixabanu se zvýšila o 40 %. Dá se tedy
konstatovat, že léková interakce apixabanu či rivaroxabanu
s často kombinovanými amiodaronem či
užívanými středně silnými inhibitory,
resp. induktory. Běžné jsou kombinace antikoagulancií
s antiarytmiky (zejména s amiodaronem a propafenonem)
a s non dihydropyridinovými blokátory kalciového
kanálu (s verapamilem a diltiazemem). Tyto kombinace jsou
významné nejen pro svoji frekvenci, ale i pro delší trvání.
Je rozdíl, podáváme li s antikoagulanciem antibiotikum
(např. klaritromycin či erytromycin) po dobu týdne, či
antiarytmikum (zejména amiodaron) po měsíce či léta.
Bohužel data pro interakci amiodaronu s apixabanem nebo
s rivaroxabanem nejsou k dispozici, farmakokinetické
studie nebyly provedeny. Nicméně podle analogie s obdobně
silnými inhibitory CYP3A4/P gp (např. s klaritromycinem
či diltiazemem), které zvyšují expozici apixabanu či
rivaroxabanu o 40‒50 %, je pravděpodobné, že na této
úrovni můžeme očekávat dopad interakce obou xabanů
s amiodaronem nebo verapamilem. Podobně chybějí data pro
kombinaci s verapamilem. Pouze u apixabanu byl sledován
efekt diltiazemu s podobně silnou inhibicí CYP3A4/P gp,
jako má verapamil, jeho maximální koncentrace stoupla o 30 %,
resp. expozice apixabanu se zvýšila o 40 %. Dá se tedy
konstatovat, že léková interakce apixabanu či rivaroxabanu
s často kombinovanými amiodaronem či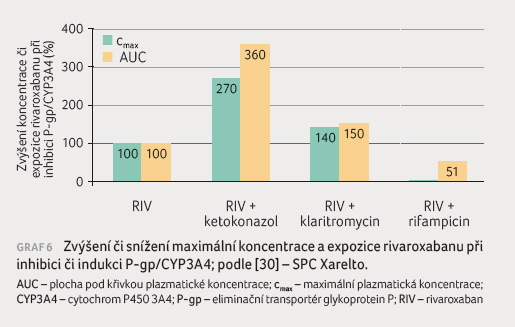 verapamilem je
pravděpodobně klinicky jen mírně významná, expozice bude zřejmě
zvýšena řádově v desítkách procent. Data ze studií
s lékovými interakcemi apixabanu a rivaroxabanu podávají
graf 5 a 6.
Je patrné, že stejně jako u dabigatranu silné inhibitory
zvyšují koncentraci a expozici dvoj až čtyřnásobně,
středně silné inhibitory pak o 30‒60 %, silný induktor
sníží expozici o třetinu až o polovinu.
verapamilem je
pravděpodobně klinicky jen mírně významná, expozice bude zřejmě
zvýšena řádově v desítkách procent. Data ze studií
s lékovými interakcemi apixabanu a rivaroxabanu podávají
graf 5 a 6.
Je patrné, že stejně jako u dabigatranu silné inhibitory
zvyšují koncentraci a expozici dvoj až čtyřnásobně,
středně silné inhibitory pak o 30‒60 %, silný induktor
sníží expozici o třetinu až o polovinu.
Edoxaban není substrátem oxidáz cytochromového systému, pouze transportéru P gp. Setkáváme se s názorem, že jeho užití je spojeno s nižším výskytem lékových interakcí. Data z farmakokinetických studií s edoxabanem však svědčí o opaku. Vlastní eliminace na úrovni enterocytu, hepatocytu či epitelie nefronu je zprostředkována efluxními pumpami, zejména P gp. Absence afinity edoxabanu k CYP3A4 nemá klinický význam a výskyt a závažnost lékových interakcí nesnižuje.
Konkrétní data z farmakokinetických
studií s edoxabanem ukazují, že středně silné inhibitory
P gp, konkrétně verapamil a amiodaron, zvyšují expozici
i maximální koncentraci asi o polovinu, silné inhibitory
pak až o 90 % [33]. Indukce P gp při použití silného
induktoru P gp měla jen malý vliv na snížení expozice
edoxabanu [34]. Snížení o 34 % bylo do jisté míry
kompenzováno lehkým vzestupem koncentrace dvou aktivních
metabolitů M4 a M6.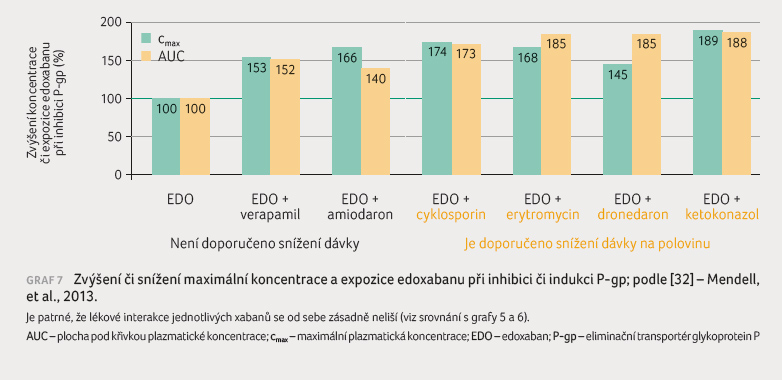 Mechanismus zvýšení koncentrace těchto
metabolitů není jasný. Porovnáme li hodnoty s interakčním
potenciálem apixabanu či rivaroxabanu, pak dopad lékových
interakcí u všech tří xabanů je zcela srovnatelný (graf 5‒7).
Mechanismus zvýšení koncentrace těchto
metabolitů není jasný. Porovnáme li hodnoty s interakčním
potenciálem apixabanu či rivaroxabanu, pak dopad lékových
interakcí u všech tří xabanů je zcela srovnatelný (graf 5‒7).
Tyto relativně jednoduché vztahy však
platí jen za ideálních podmínek. Při kombinaci s dalším
faktorem zvyšujícím expozici, např. s nižší hmotností,
vyšším věkem či s redukovanou glomerulární filtrací
a zhoršenou tubulární sekrecí při tubulointersticiálním
postižení ledviny, již další faktory působí aditivně a i méně
významné interakce ovlivní účinnost a bezpečnost.
Příkladem je efekt kombinace rivaroxabanu se středně silným
inhibitorem CYP3A4/P gp – erytromycinem – při
dobré a při snížené glomerulární filtraci (graf 8). Je patrné, že samostatné působení jednoho faktoru
(mírné snížení glomerulární filtrace či současná léčba
středně silným inhibitorem CYP3A4/P gp) zvýší expozici
o 30‒40 %, jejich kombinace však vede ke zvýšení
o 80 %, resp. na dvojnásobek.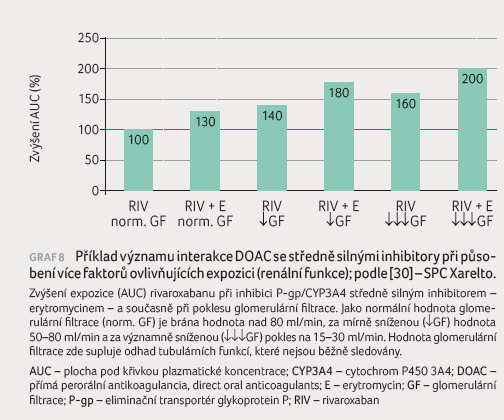
Shrneme li, pak apixaban, edoxaban i rivaroxaban mají zcela obdobné riziko lékových interakcí. Je nutno se vyhnout jak kombinaci se silnými inhibitory CYP3A4/P gp, tj. některým azolovým antimykotikům a antiretrovirotikům, tak i kombinaci se silnými induktory CYP3A4/P gp, zejména s relativně často užívanými extrakty z třezalky. Z klinického hlediska významnější jsou relativně časté interakce xabanů se středně silnými inhibitory (verapamilem, amiodaronem, propafenonem, telmisartanem či s antidepresivy typu SSRI, zejména s paroxetinem, fluoxetinem apod.) nebo s induktory (spironolaktonem, dexametazonem). Nutno však zdůraznit riziko závažného zvýšení koncentrace xabanů při současném působení dalšího faktoru zvyšujícího dostupnost či snižujícího eliminaci.
Při vzájemném porovnání dabigatranu se skupinou xabanů lze konstatovat srovnatelný dopad interakcí na úrovni funkční jednotky izoenzymu CYP3A4 a P gp. Středně silné inhibitory i induktory, tj. léky, které v praxi s DOAC běžně kombinujeme, ovlivní koncentraci srovnatelně. Rozdíl je jen ve významném snížení koncentrace dabigatranu při současném podávání IPP. Tato interakce u xabanů není. Při indikaci IPP je proto výhodnější volit mezi některým z xabanů. Dalším rozdílem je výrazně větší dopad farmakogenetické výbavy na biologickou dostupnost u dabigatranu než u ostatních přímých antikoagulancií. Genotyp s vyšší aktivitou P gp, vyskytující se asi u čtvrtiny populace, je spojen s dvoj až trojnásobnými koncentracemi dabigatranu proti stejně často se vyskytujícímu genotypu s aktivitou nízkou.
Volba optimálního antikoagulancia při riziku lékové interakce
Ačkoliv se význam lékových interakcí u jednotlivých DOAC v detailech liší, výsledné poselství je stejné: kombinaci se silnými inhibitory P gp se vyhneme. Nevhodná je kombinace všech DOAC především s klaritromycinem, cyklosporinem, dronedaronem, antimykotiky – ketokonazolem či itrakonazolem, některými antiretrovirotiky – ritonavirem či nelfinavirem. Při nutnosti podávání těchto léčiv je namístě užití warfarinu. Při kombinaci se středně silnými inhibitory P gp (zejména s amiodaronem, verapamilem či s potravinami – citrusové plody – obsahujícími flavonoidy) zvážíme další faktory ovlivňující expozici a nezřídka dávku DOAC redukujeme. Rovněž se vyhneme kombinaci se silnými induktory P gp (hlavně s rifampicinem, spironolaktonem, hyperforinem – obsaženým ve výtažcích z třezalky, dexametazonem, s některými antikonvulzivy – fenytoinem aj.). Při potřebě užít tyto látky je výhodnější zvolit warfarin. Zde se sice může vyskytnout též interakce zvyšující koncentraci warfarinu, nicméně snadnost přesného monitorování výsledného efektu pomocí rychle a běžně dostupného INR nám kombinaci umožní.
Otázkou je, zda není výhodné se
orientovat ve výsledné antikoagulační aktivitě –
u dabigatranu užitím komerčního setu Hemoclot, u xabanů
určením aktivity antiXa – a na základě získaných
hodnot modifikovat dávku. I když se s podobnou praxí
setkáváme zejména u hematologů, zatím je cesta špatně
schůdná. Problémem je, že nejsou stanoveny jasné a relativně
úzké terapeutické meze, hranice obdobné terapeutickému oknu
warfarinu, tedy hodnotě INR 2‒3. Recentní doporučené postupy
EHRA uvádějí „očekávané“ hodnoty koncentrace jednotlivých
DOAC v období maximálních plazmatických hodnot (levels at
peak) a hodnot na konci dávkovacího intervalu (levels at
trough) při standardních dávkách užívaných v indikaci
profylaxe tromboembolie při fibrilaci síní [27]. Hodnoty mají tak
veliký rozptyl, že si lze jen obtížně představit, že by bylo
podle nich možno upravovat dávku (graf 9A, B). Rozdíl mezi maximální očekávanou koncentrací
v době vrcholového efektu a minimální koncentrací
na konci dávkovacího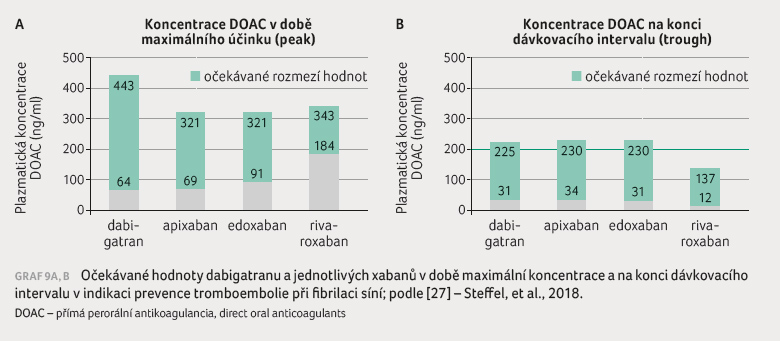 intervalu se pohybuje od 9,4
u apixabanu přes 10,4 u edoxabanu, resp. 14,3
u dabigatranu až ke 28,5 u rivaroxabanu. To znamená,
že jsou přítomny deseti až třicetinásobné rozdíly
v očekávaných koncentracích. Tento rozptyl výrazně
kontrastuje s jasným a přesně definovaným terapeutickým
rozmezím hodnot INR při sledování efektu antivitaminů K. Obdobné
rozmezí terapeutických hodnot koagulačních testů chybí, není
k dispozici jak pro léčbu dabigatranem, tak xabany. Jsem
přesvědčen, že jasné stanovení relativně úzkého optimálního
rozmezí koncentrace DOAC by výrazně přispělo ke zvýšení
účinnosti a bezpečnosti léčby. Nikoliv k pravidelnému
monitorování, ale adjustace dávky na počátku léčby by
eliminovala, či alespoň snížila vliv farmakogenetické výbavy
a souběžné medikace.
intervalu se pohybuje od 9,4
u apixabanu přes 10,4 u edoxabanu, resp. 14,3
u dabigatranu až ke 28,5 u rivaroxabanu. To znamená,
že jsou přítomny deseti až třicetinásobné rozdíly
v očekávaných koncentracích. Tento rozptyl výrazně
kontrastuje s jasným a přesně definovaným terapeutickým
rozmezím hodnot INR při sledování efektu antivitaminů K. Obdobné
rozmezí terapeutických hodnot koagulačních testů chybí, není
k dispozici jak pro léčbu dabigatranem, tak xabany. Jsem
přesvědčen, že jasné stanovení relativně úzkého optimálního
rozmezí koncentrace DOAC by výrazně přispělo ke zvýšení
účinnosti a bezpečnosti léčby. Nikoliv k pravidelnému
monitorování, ale adjustace dávky na počátku léčby by
eliminovala, či alespoň snížila vliv farmakogenetické výbavy
a souběžné medikace.
Další zvýšení účinnosti a bezpečnosti by bylo jistě vítáno. Když totiž spočteme čistý klinický přínos u jednotlivých DOAC ve velkých studiích (RELY, ROCKET AF, ARISTOTLE a ENGAGE) v indikaci prevence vzniku tromboembolických komplikací v rámci fibrilace síní, zjistíme, že v porovnání s warfarinem nepřesahuje absolutní přínos 1 % ročně (graf 10). Tento rozdíl by pravděpodobně bylo možno podstatně zvýšit. Účinnost a bezpečnost antikoagulancií je dána především optimálním setrváváním koncentrace léčiva v terapeutickém okně, tedy co nejnižší intraindividuální a interindividuální variabilitou.
Seznam použité literatury
- [1] Murphy A, Kirby A, Bradley C. Knowledge is power: general practitioners prescribing of new oral anticoagulants in Ireland. BMC Res Notes 2018; 11: 478.
- [2] Schneider KL, Kastenmüller K, Weckbecker K, et al. Potential Drug‑Drug Interactions in a Cohort of Elderly, Polymedicated Primary Care Patients on Antithrombotic Treatment. Drugs Aging 2018; 35: 559‒568.
- [3] Forbes HL, Polasek TM. Potential drug–drug interactions with direct oral anticoagulants in elderly hospitalized patients. Ther Adv Drug Saf 2017; 8: 319–328.
- [4] Sennesael AL, Larock AS, Douxfils J, et al. Rivaroxaban plasma levels in patients admitted for bleeding events: insights from a prospective study. Thromb J 2018; 16: 28.
- [5] Connolly SJ, Ezekowitz MD, Yusuf S, et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361: 1139‒1151.
- [6] Ruff CT, Giugliano RP, Braunwald E, et al. Association between edoxaban dose, concentration, anti‑Factor Xa activity, and outcomes: an analysis of data from the randomised, double‑blind ENGAGE AF‑TIMI 48 trial. Lancet 2015; 385: 2288‒2295.
- [7] Beyer J, Trujillo T, Fisher S, et al. Evaluation of a Heparin‑Calibrated Antifactor Xa Assay for Measuring the Anticoagulant Effect of Oral Direct Xa Inhibitors. Clinical and Applied Thromb/Hemost 2016; 22: 423.
- [8] Lopes RD, et Augustus investigators. Antithrombotic Therapy after Acute Coronary Syndrome or PCI in Atrial Fibrillation. N Engl j Med 2019; doi: 10.1056/NEJMoa1817083.
- [9] Hellwig T, Gulseth M. Pharmacokinetic and pharmacodynamic drug interactions with new oral anticoagulants: what do they mean for patients with atrial fibrillation? Ann Pharmacother 2013; 47: 1478‒1487.
- [10] Alexander JH, Lopes RD, Thomas J, et al. Apixaban vs. warfarin with concomitant aspirin in patients with atrial fibrillation: insights from the ARISTOTLE trial. Eur Heart J 2014; 35: 224‒232.
- [11] Kent AP, Brueckmann M, Fraessdorf M, et al. Concomitant Oral Anticoagulant and Nonsteroidal Anti‑Inflammatory Drug Therapy in Patients With Atrial Fibrillation. J Am Coll Cardiol 2018; 72: 255‒267.
- [12] Sychev DA, Levanov AN, Shelekhova TV, et al. The impact of ABCB1(rs1045642 and rs4148738) and CES1 (rs2244613) gene polymorphisms on dabigatran equilibrium peak concentration in patients after total knee arthroplasty. Pharmgenomics Pers Med 2018; 11: 127‒137.
- [13] Pechandová K, Buzková H, Slanař O, Perlík F. Polymorphisms of the MDR1 gene in the Czech population. Folia Biol 2006; 52: 184‒189.
- [14] Bolek T, Samoš M, Škorňová I, et al. Does proton pump inhibition change the on‑treatment anti‑Xa activity in xabans‑treated patients with atrial fibrillation? A pilot study. J Thromb Thrombolysis 2019; 47: 140‒145.
- [15] Kuwayama T, Osanai H, Ajioka M, et al. Influence of proton pump inhibitors on blood dabigatran concentrations in Japanese patients with non‑valvular atrial fibrillation. J Arrhythm 2017; 33: 619–623.
- [16] Bolek T, Samoš M, Stančiaková L, et al. The Impact of Proton Pump Inhibition on Dabigatran Levels in Patients With Atrial Fibrillation. Am J Ther 2017; doi: 10.1097/MJT.0000000000000599.
- [17] SPC Pradaxa; https://www.ema.europa.eu/documents/product‑information/pradaxa‑epar‑product‑information_cs.pdf
- [18] Stangier J. Clinical pharmacokinetics and pharmacodynamics of the oral direct thrombin inhibitor dabigatran etexilate. Clinical Pharmacokinetics 2008; 47: 285–295.
- [19] Martin KA, Lee CR, Farrell TM, et al. Oral Anticoagulant Use after Bariatric Surgery: A Literature Review and Clinical Guidance. Am J Med 2017; 130: 517–524.
- [20] Härtter S, Sennewald R, Nehmiz G, et al. Oral bioavailability of dabigatran etexilate (Pradaxa®) after co‑medication with verapamil in healthy subjects. Br J Clin Pharmacol 2013; 75: 1053–1062.
- [21] Zhao Y, Hu ZY. Physiologically based pharmacokinetic modelling and in vivo [I]/K(i) accurately predict P‑glycoprotein‑mediated drug‑drug interactions with dabigatran etexilate. Br J Pharmacol 2014; 171: 1043‒1053.
- [22] Vranckx P, Valgimigli M, Heidbuchel H. The Significance of Drug‑Drug and Drug‑Food Interactions of Oral Anticoagulation. Arrhythm Electrophysiol Rev 2018; 7: 55–61.
- [23] Investigation of Drug‑drug Interaction of Dabigatran and Ticagrelor; https://clinicaltrials.gov/ct2/show/results/NCT01734772
- [24] Härtter S, Koenen‑Bergmann M, Sharma A, et al. Decrease in the oral bioavailability of dabigatran etexilate after co‑medication with rifampicin. Br J Clin Pharmacol 2012; 74: 490‒500.
- [25] Ghanem CI, Gómez PC, Arana MC, et al. Induction of rat intestinal P‑glycoprotein by spironolactone and its effect on absorption of orally administered digoxin. J Pharmacol Exp Ther 2006; 318: 1146‒1152.
- [26] Barnes GD, Nallamothu BK, Sales AE, Froehlich JB. Reimagining Anticoagulation Clinics in the Era of Direct Oral Anticoagulants. Circ Cardiovasc Qual Outcomes 2016; 9: 182‒185.
- [27] Steffel J, Verhamme P, Potpara TS, et al. The 2018 European Heart Rhythm Association Practical Guide on the use of non‑vitamin K antagonist oral anticoagulants in patients with atrial fibrillation. Eur Heart J 2018; 39: 1330–1393.
- [28] Sjöstedt N, Holvikari K, Tammela P, et al. Inhibition of Breast Cancer Resistance Protein and Multidrug Resistance Associated Protein 2 by Natural Compounds and Their Derivatives. Mol Pharm 2017; 14: 135‒146.
- [29] SPC Eliquis; https://www.ema.europa.eu/en/documents/product‑information/eliquis‑epar‑product‑information_cs.pdf
- [30] SPC Xarelto; https://www.ema.europa.eu/en/documents/product‑information/xarelto‑epar‑product‑information_cs.pdf
- [31] Samer CF, Lorenzini KI, Rollason V, et al. Applications of CYP450 testing in the clinical setting. Mol Diagn Ther 2013; 17: 165–184.
- [32] Mendell J, Zahir H, Matsushima N, et al. Drug‑Drug Interaction Studies of Cardiovascular Drugs Involving P‑Glycoprotein, an Efflux Transporter, on the Pharmacokinetics of Edoxaban, an Oral Factor Xa Inhibitor. Am J Cardiovasc Drugs 2013; 13: 331‒342.
- [33] SPC Lixiana; https://www.ema.europa.eu/documents/product‑information/lixiana‑epar‑product‑information_cs.pdf
- [34] Mendell J, Chen S, He L, Desai M, et al. The effect of rifampin on the pharmacokinetics of edoxaban in healthy adults. Clin Drug Investig 2015; 35: 447‒453.