Význam signální cesty EGFR a prediktivní markery cílené léčby u karcinomů hlavy a krku
Receptor pro epidermální růstový faktor (EGFR) hraje významnou úlohu v kancerogenezi, a stal se proto cílovou strukturou nových metod léčby nádorů. Zavádění inhibitorů EGFR do praxe probíhá současně s výzkumem molekulárně-genetických prediktivních markerů. Předmětem diskusí jsou nejrůznější genetické alterace v signální cestě EGFR, jako je amplifikace genu pro EGFR, EGFRvIII, mutace tyrozinkinázové domény, k-ras, STAT3 aj.
Prediktivní a prognostické markery
Výzkumy zaměřené na hledání markerů, které by mohly správně určit prognózu onemocnění (prognostické faktory) a najít vhodný typ terapie pro konkrétního pacienta (prediktivní faktory), patří mezi jednu z nejvíce se rozvíjejících oblastí klinické i experimentální onkologie. Markery je možno v obecném smyslu rozdělit na molekulárně-genetické a klinické. Cílem hledání prediktivních markerů v onkologii je především volba nejvhodnější metody léčby u konkrétního pacienta, tedy individualizace terapie. Jedná se nejen o rozhodování mezi chirurgickou a konzervativní léčbou (chemoradioterapií), ale i o případy, kdy se zvažuje rozsah adjuvantní léčby (např. alterovaná frakcionace nebo chemoradioterapie versus radioterapie samotná). Zatím se řídíme především histologickým typem nádoru, jeho lokalizací, stupněm diferenciace (tzv. gradingem), anatomickým rozsahem nemoci (TNM klasifikací), celkovým zdravotním stavem pacienta a u případů adjuvantní léčby i rozsahem regionálních metastáz, pozitivitou resekčních okrajů, perineurálním šířením nádoru apod. Na to, aby mohl být jakýkoli prediktivní marker zaveden do běžné praxe, musí splnit určité podmínky. Samozřejmostí je dostatečná senzitivita, specificita, technická proveditelnost, cena vyšetření apod. Přestože je celosvětově předmětem výzkumu velké množství markerů, přínos pro praxi má ve výsledku jen malé procento z nich. Značným problémem je složitost vztahů mezi jednotlivými signálními dráhami, které se vzájemně ovlivňují, slibné se proto zdají multivariační analýzy více markerů současně. Význam prediktivních faktorů stoupá se zavedením inhibitorů EGFR do praxe. U cílené léčby obecně nalézáme významnější korelace s prediktivními faktory než u chemoterapie, neboť je zaměřena na blokádu specifického proteinu v signální dráze nádorové buňky.
Rodina receptorů pro růstové faktory erB/HER
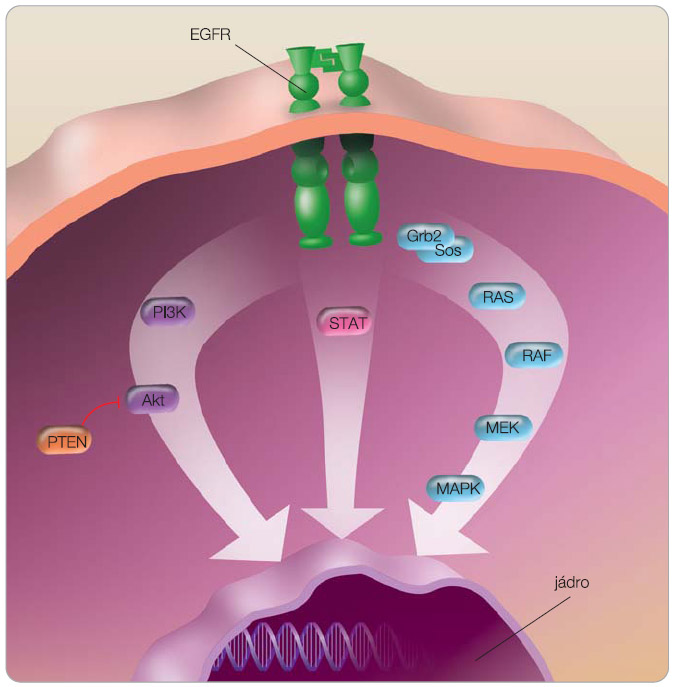 Receptor pro epidermální růstový faktor (epidermal growth factor receptor, EGFR, HER1 neboli erb-B1) patří do rodiny transmembránových receptorů pro růstové faktory erB/HER, kam dále řadíme HER2/neu (erbB2), HER3 (erbB3) a HER4 (erbB4). Tyto receptory mají extracelulární doménu, na kterou se váže ligand, transcelulární doménu a intracelulární doménu, zprostředkovávající tyrozinkinázovou aktivitou přenos signálu do buňky. Mezi hlavní kaskády přenašečů signální cesty
Receptor pro epidermální růstový faktor (epidermal growth factor receptor, EGFR, HER1 neboli erb-B1) patří do rodiny transmembránových receptorů pro růstové faktory erB/HER, kam dále řadíme HER2/neu (erbB2), HER3 (erbB3) a HER4 (erbB4). Tyto receptory mají extracelulární doménu, na kterou se váže ligand, transcelulární doménu a intracelulární doménu, zprostředkovávající tyrozinkinázovou aktivitou přenos signálu do buňky. Mezi hlavní kaskády přenašečů signální cesty 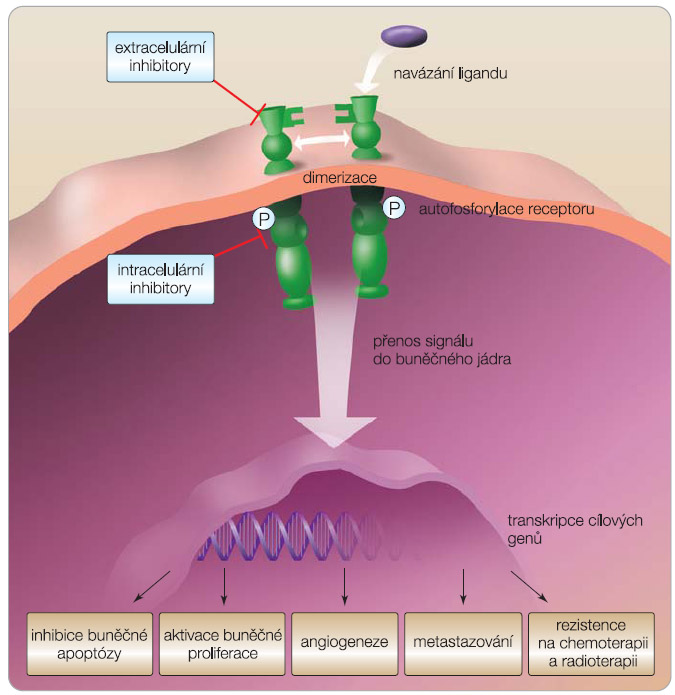 EGFR patří Ras/ Raf/MAPK (mitogen-activated protein kinase) aktivující proliferaci buněk, STAT (signal transducers and activators of transcription) a PI3K (phosphatidylinositol 3-kinase)/ Akt s vlivem na přežívání buněk (obr. 1). Kaskády v signální cestě EGFR lze aktivovat i jinými receptory (GPCR, receptor spřažený s G-proteinem, PDGFR, receptor pro růstový faktor z destiček, IGFR, receptor pro inzulinový růstový faktor nebo receptory hormonů). EGFR hraje klíčovou roli v kancerogenezi, jeho signální cesta způsobuje u nádorů aktivaci buněčného dělení, inhibici apoptózy, angiogenezi, metastazování, ale i rezistenci na radioterapii, chemoterapii a hormonální léčbu (obr. 2).
EGFR patří Ras/ Raf/MAPK (mitogen-activated protein kinase) aktivující proliferaci buněk, STAT (signal transducers and activators of transcription) a PI3K (phosphatidylinositol 3-kinase)/ Akt s vlivem na přežívání buněk (obr. 1). Kaskády v signální cestě EGFR lze aktivovat i jinými receptory (GPCR, receptor spřažený s G-proteinem, PDGFR, receptor pro růstový faktor z destiček, IGFR, receptor pro inzulinový růstový faktor nebo receptory hormonů). EGFR hraje klíčovou roli v kancerogenezi, jeho signální cesta způsobuje u nádorů aktivaci buněčného dělení, inhibici apoptózy, angiogenezi, metastazování, ale i rezistenci na radioterapii, chemoterapii a hormonální léčbu (obr. 2).
Množství receptorů na povrchu buňky podléhá za normálních okolností regulaci. Aktivovaný receptor s navázaným ligandem je signálem pro internalizaci endocytózou (down-regulace), následně proběhne jeho degradace v lysozomech anebo je recyklován zpět na buněčnou membránu. Může docházet k dysregulaci, která vede k patologické aktivaci signální cesty EGFR, a tím k negativní prognóze onemocnění a) zvýšenou expresí ligandů, b) aktivujícími mutacemi receptoru nebo přenašečů v signální cestě EGFR, c) amplifikací genu pro EGFR, d) aktivací signální cesty jinými receptory, než je EGFR, nebo nereceptorovými tyrozinkinázami [1, 2].
Exprese EGFR
Zvýšená exprese EGFR je nalézána u mnoha nádorů, jako jsou karcinomy hlavy a krku (70–100 %), jícnu (30–70 %), plic (nemalobuněčný karcinom plic, NSCLC 40–80 %), kolorekta (35–40 %), prsu (14–91 %), ledvin, mozku (maligní gliomy 40–50 %), pankreatu (30–50 %), močového měchýře (31–48 %), ovarií (35–70 %), prostaty aj. [3, 4]. Overexprese u těchto nádorů může korelovat s horší prognózou a s horším přežitím [5]. Ze všech epiteliálních nádorů exprimujících EGFR je nejvyšší zastoupení nalézáno právě u spinocelulárních karcinomů hlavy a krku (HNSCC) [1]. Nebyla však vysledována přímá úměra k odpovědi na léčbu inhibitory EGFR [6, 7].
Inhibice EGFR u HNSCC
Důvodem, proč se na EGFR zaměřila v poslední době taková pozornost, je jeho vysoká exprese a klíčový signální význam u mnoha nádorů. Stal se specifickým terčem tzv. cílené léčby (targeted therapy) založené na extracelulární nebo intracelulární blokádě receptoru. Z extracelulárních inhibitorů byly do klinické praxe zavedeny různé druhy monoklonálních protilátek a na úrovni blokády tyrozinkinázové domény se osvědčily intracelulární nízkomolekulární inhibitory. Intracelulární inhibitory procházejí buněčnou membránou a vážou se na ATP vazebné místo tyrozinkinázové domény (kompetice s ATP). Monoklonální protilátky jsou vysokomolekulární, a v organismu proto – na rozdíl od nízkomolekulárních inhibitorů – neprocházejí buněčnými membránami ani hematoencefalickou bariérou. Mají afinitu k extracelulární doméně EGFR (kompetice s přirozenými ligandy), čímž zabraňují navázání ligandu, dimerizaci a aktivaci receptoru, následně je EGFR internalizován a dochází k jeho degradaci [8]. EGFR kromě klíčového významu v kancerogenezi však hraje svoji roli i u normálních tkání, jako jsou střeva, kůže nebo ledviny; při léčebné inhibici tohoto receptoru z toho proto vyplývají nežádoucí účinky, jako je průjem, kožní vyrážka [9] 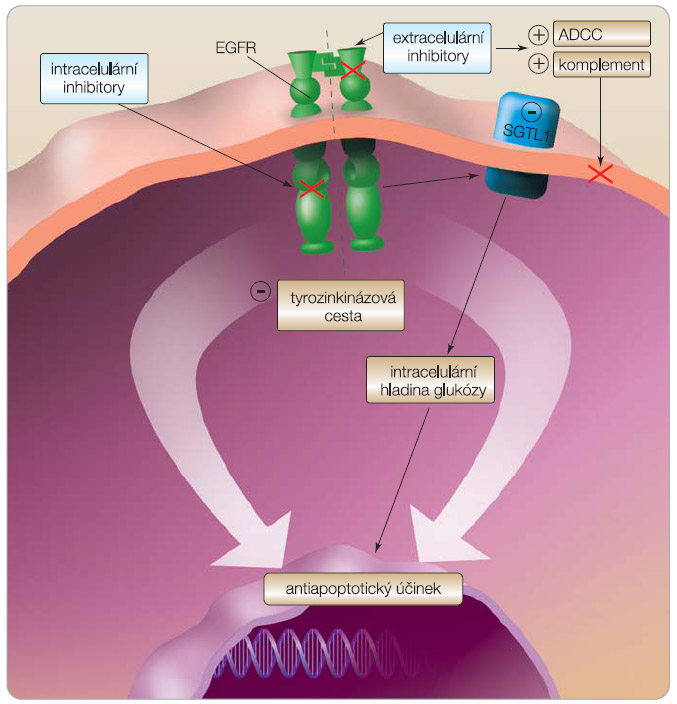 nebo hypomagnezémie (blokáda EGFR interferuje s transportním mechanismem magnesia, čímž zabraňuje zpětnému vychytávání magnesia v Henleově kličce ledvin) [10, 11]. Extracelulární inhibitory u HNSCC vykazují lepší účinnost než inhibitory intracelulární, což lze přisoudit jinému mechanismu účinku. Monoklonální protilátky vedle zablokování signální cesty receptoru aktivují na protilátkách závislou buněčnou cytotoxicitu (ADCC, antibody-dependent cellular cytotoxicity). Tato aktivace imunitního systému proti nádoru je spuštěna navázáním protilátky na nádorovou buňku, avšak je specifická pouze pro protilátky třídy IgG1, jejichž zástupcem je např. cetuximab [12]. Mezi další imunitní mechanismus patří aktivace komplementu a na komplementu závislá cytotoxicita (complement-dependent cytotoxicity) [1, 13]. V nedávné době bylo navíc prokázáno, že antiapoptotický účinek signální cesty EGFR je kromě tyrozinkinázové aktivity zprostředkován i interakcí a stabilizací transportního systému pro glukózu (SGLT1, sodium-dependent glucose cotransporter 1), který udržuje intracelulární hladinu glukózy, důležitou pro buněčné přežívání [14]. Jinými slovy, na základě tohoto zjištění lze usuzovat, že zablokování tyrozinkinázové domény receptoru způsobí pouze parciální blokádu signální cesty EGFR, což vysvětluje vedle chybění imunitní odpovědi také rozdílný terapeutický účinek (obr. 3). Dalším faktem je, že tyrozinkinázové inhibitory EGFR mohou být považovány za méně specifické než monoklonální protilátky, neboť mohou v buňce inhibovat i jiné tyrozinkinázové cesty ovlivňující i normální buněčné funkce.
nebo hypomagnezémie (blokáda EGFR interferuje s transportním mechanismem magnesia, čímž zabraňuje zpětnému vychytávání magnesia v Henleově kličce ledvin) [10, 11]. Extracelulární inhibitory u HNSCC vykazují lepší účinnost než inhibitory intracelulární, což lze přisoudit jinému mechanismu účinku. Monoklonální protilátky vedle zablokování signální cesty receptoru aktivují na protilátkách závislou buněčnou cytotoxicitu (ADCC, antibody-dependent cellular cytotoxicity). Tato aktivace imunitního systému proti nádoru je spuštěna navázáním protilátky na nádorovou buňku, avšak je specifická pouze pro protilátky třídy IgG1, jejichž zástupcem je např. cetuximab [12]. Mezi další imunitní mechanismus patří aktivace komplementu a na komplementu závislá cytotoxicita (complement-dependent cytotoxicity) [1, 13]. V nedávné době bylo navíc prokázáno, že antiapoptotický účinek signální cesty EGFR je kromě tyrozinkinázové aktivity zprostředkován i interakcí a stabilizací transportního systému pro glukózu (SGLT1, sodium-dependent glucose cotransporter 1), který udržuje intracelulární hladinu glukózy, důležitou pro buněčné přežívání [14]. Jinými slovy, na základě tohoto zjištění lze usuzovat, že zablokování tyrozinkinázové domény receptoru způsobí pouze parciální blokádu signální cesty EGFR, což vysvětluje vedle chybění imunitní odpovědi také rozdílný terapeutický účinek (obr. 3). Dalším faktem je, že tyrozinkinázové inhibitory EGFR mohou být považovány za méně specifické než monoklonální protilátky, neboť mohou v buňce inhibovat i jiné tyrozinkinázové cesty ovlivňující i normální buněčné funkce.
Do indikace karcinomů hlavy a krku byly zavedeny extracelulární inhibitory, které prokázaly supraaditivní efekt při kombinaci s radioterapií i chemoterapií. V současné době je v ČR zaregistrován pouze cetuximab, a sice v kombinaci s radioterapií v indikaci lokoregionálně pokročilých HNSCC v léčbě první linie. Svůj přínos prokázal také pro recidivující/metastatické onemocnění, v této indikaci se v současnosti jeho registrace u nás teprve chystá. S cetuximabem je spojeno výrazně nižší množství nežádoucích účinků ve srovnání s klasickou chemoterapií, nesetkáváme se s toxickým působením na játra, ledviny, krvetvorbu, srdce či nervovou soustavu. Cílená léčba je však finančně náročnější a často se u ní vyskytuje závislost účinku na specifických genetických alteracích v populaci nádorů. Proto se musí současně se zaváděním inhibitorů EGFR do praxe rozvíjet i výzkum molekulárně-genetických prediktivních markerů, které mohou významným způsobem ovlivnit nákladovou efektivitu (cost-effectiveness) této léčby.
Genetické alterace v signální cestě EGFR a jejich klinický význam
Amplifikace genu pro EGFR
Amplifikace EGFR znamená zmnožení počtu genů EGFR v buňce. V onkologii byl při její přítomnosti vysledován vztah k negativní prognóze mnoha nádorů, avšak zároveň i pozitivní prediktivní význam při léčbě inhibitory EGFR. Příkladem může být zaznamenaná lepší odpověď kolorektálních karcinomů na extracelulární inhibici EGFR [15, 16]. In vitro byla u HNSCC prokázána souvislost mezi počtem kopií EGFR genu a senzitivitou nejen na gefitinib, ale i na cetuximab [17]; nyní se čeká, až laboratorní výsledky potvrdí data z klinických studií. Jednou ze sporných otázek stále zůstává, jakým mechanismem způsobuje amplifikace genu pro EGFR lepší odpověď na cílenou léčbu. Hypoteticky si to lze vysvětlit tak, že zmnožení počtu genů v chromozomu obecně ukazuje na klíčovost exprimovaného proteinu v signální soustavě nádorové buňky, a proto blokáda této signální cesty může mít lepší léčebný efekt než u nádorových buněk bez přítomnosti genové amplifikace.
Mutace k-ras genu
K-ras je jedním z přenašečů v signální cestě EGFR a při jeho mutaci dochází ke kontinuální aktivaci signální cesty nezávisle na aktivaci nebo inhibici receptoru. Nemutovaný ras protein má schopnost inaktivace ze stavu GTP do GDP pomocí GTPázy. Aktivující bodové mutace v exonu 1 K-ras genu (v kodonech 12 a 13) snižují hydrolytickou aktivitu GTPázy, což má za následek kontinuální aktivaci K-ras proteinu. Ras mutace byla nalezena u mnoha typů nádorů, např. u nádorů plic, kolorekta, pankreatu či HNSCC. Její přítomnost je spojována s negativní prognózou onemocnění a jedná se o negativní prediktivní marker v souvislosti se standardní léčbou i s terapií inhibitory EGFR. V současné době se v mnoha zemích včetně ČR detekuje v rámci predikce účinnosti cetuximabu u kolorektálních karcinomů, u kterých se udává relativně vysoký výskyt (35–45 %) [18]. U tumorů s mutovanými formami K-ras nebyl prokázán léčebný efekt. Na posledním meetingu ASCO v roce 2008 byl potvrzen negativně prediktivní význam mutace K-ras při léčbě extracelulárními inhibitory EGFR, studie CRYSTAL a studie OPUS fáze III na kolorektálních karcinomech zaznamenaly signifikantně zlepšené přežití bez progrese onemocnění při přítomnosti nemutovaného K-ras genu. Na základě těchto výsledků bylo doporučeno rutinní testování kolorektálních karcinomů před léčbou cetuximabem či panitumumabem. Případ úspěšného zavedení tohoto genetického markeru do praxe v indikaci kolorektálních karcinomů je výzvou pro rozšíření výzkumu i na další druhy nádorů. Na meetingu AHNS (American Head and Neck Society) v roce 2008 byla prezentována studie sledující mutaci K-ras ve vztahu k lokoregionální kontrole, k přežití bez známek onemocnění a ve vztahu k přežití bez vzdálených metastáz u pacientů s lokoregionálně pokročilými karcinomy hlavy a krku, kteří byli léčeni chemoradioterapií a chirurgicky nebo bez chirurgického zákroku. Analýza DNA se podařila u 197 pacientů, z nichž 3,5 % mělo přítomnu k-ras mutaci v kodonu 12. Závěr této studie zněl, že mutace k-ras je u karcinomů hlavy a krku spojena se selháním léčby, celkovou agresivitou onemocnění, a mohla by proto ovlivnit druh volené terapie [19]. U karcinomů dutiny ústní byla k-ras mutace vysledována u 18 % (6 ze 33) pacientů na Tchajwanu, kde nádory této oblasti vznikají v souvislosti se žvýkáním betelových oříšků [20]. Jiné studie, uskutečněné v evropské populaci, zachytily pouze vzácný výskyt této ras mutace [21].
Mutace tyrozinkinázové domény EGFR
Buněčné linie s aktivujícími mutacemi tyrozinkinázové domény (nejčastěji ve formě delece v exonu 19 a bodové mutace v exonu 21) vykazují lepší odpověď na stimulaci prostřednictvím EGF s delší aktivací signální cesty než buňky s nemutovaným genem, navíc byla zjištěna i mnohonásobně účinnější inhibice intracelulárními inhibitory v případech nemalobuněčného karcinomu plic. Kontinuální aktivace EGFR v těchto případech může potlačit význam ostatních signálních cest buněčného přežívání a zvýšit tak závislost nádoru na signální cestě EGFR pro přežití. V tomto modelu pak mutovaný receptor váže intracelulární inhibitor s vyšší afinitou díky strukturálním změnám ATP vazebného místa tyrozinkinázové domény, a navíc způsobuje i vyšší senzitivitu buněk na cílenou léčbu, zapříčiněnou EGFR dependencí nádoru. Teorie tzv. „závislosti na onkogenu“ se nabízí jako vysvětlení úspěšné apoptózy nádorových buněk při inhibici signální soustavy proliferace, na níž je tumor závislý. Při genetické analýze u kolorektálních karcinomů tyto mutace nebyly zachyceny [22], u karcinomů hlavy a krku byly v mnoha studiích také neúspěšně hledány anebo zachyceny pouze ve velmi malém procentu, lišícím se dle populace (různí autoři uvádějí rozmezí od 0–4 % u bělošské populace až po 7 % u asijské populace). Na základě uskutečněných studií lze tvrdit, že v asijských zemích je nižší výskyt mutace k-ras, naopak častěji jsou tam nalézány mutace tyrozinkinázové domény. Má to i svůj důležitý výstup pro klinickou praxi, kdy se můžeme setkat s vyšší účinností intracelulárních inhibitorů EGFR u japonské populace ve srovnání s Evropou.
Mutace EGFRvIII
Bylo popsáno několik variant mutací extracelulární domény receptoru (vI–vVII), klinický význam prokázala varianta III. EGFRvIII se objevuje pouze u nádorových buněk a jedná se o mutaci s delecí v exonech 2–7, kdy receptoru chybí extracelulární doména, a nemůže se na něj proto navázat ani ligand, ani extracelulární inhibitor. EGFRvIII má schopnost dimerizace i bez navázání ligandu a kontinuální aktivace, která vede ke zvýšenému přežívání buněk a k rezistenci na protinádorovou léčbu. Tato mutace byla na základě studie u HNSCC nalezena u 42 % ze 33 pacientů a byla u ní v laboratorních podmínkách prokázána jak rezistence na cetuximab, tak i snížená odpověď na podání cisplatiny [23]. Další výzkum na buněčných liniích HNSCC prokázal, že zvýšená buněčná invazivita a migrace u EGFRvIII souvisí se zvýšenou aktivitou STAT3. Potvrzení prediktivního významu této mutace však čeká na klinické studie. Kromě rezistence na extracelulární inhibitory byla popsána také snížená odpověď na intracelulární inhibici [24], u EGFRvIII se proto mohou předpokládat strukturální změny postihující kromě extracelulární i intracelulární doménu.
STAT3
STAT3 je jedním z rodiny signálních přenašečů a aktivátorů transkripce STAT. Při aktivující mutaci STAT3 byla u HNSCC buněčných linií prokázána zvýšená exprese Bcl-X a cyklinu D1. Tumory vzniklé z buněčných linií s aktivovanou STAT3 rostou rychleji. In vitro i in vivo byla navíc prokázána rezistence na inhibici EGFR [25].
Ostatní mutace
Pozornost je zaměřena také na mutace Akt, dále na mutace tumor-supresorového genu PTEN, Src, MAPK aj. Zatím se ale jedná spíše o menší studie.
Závěr
Ukazuje se, že molekulárně-genetické prediktivní markery mají klíčový vliv na předpověď účinnosti cílené léčby. Detekce exprese EGFR neprokázala v tomto smyslu přínos, proto se pozornost zaměřila na genetické alterace v signální cestě nádorů. V rámci hledání odpovědi na podávání extracelulárních inhibitorů u pacientů s HNSCC jsou slibné především mutace genu k-ras, STAT3 a EGFRvIII jako markery negativní odpovědi a amplifikace genu pro EGFR jako marker pozitivní odpovědi. U intracelulárních inhibitorů byla navíc vysledována pozitivní odpověď při přítomnosti aktivujících mutací tyrozinkinázové domény EGFR. Při srovnávání studií je nutno brát v úvahu skutečnost, že výskyt mutací v signální cestě EGFR může být vázán nejen na různé druhy inhibitorů, ale i na různé druhy tumorů či populací.
Seznam použité literatury
- [1] Kalyankrishna S, Grandis JR. Epidermal growth factor receptor biology in head and neck cancer. J Clin Oncol 2006; 24: 2666–2672.
- [2] Oliveira S, van Bergen en Henegouwen PM, Storm G, et al. Molecular biology of epidermal growth factor receptor inhibition for cancer therapy. Expert Opin Biol Ther 2006; 6: 605–617.
- [3] Kim ES, Khuri FR, Herbst RS. Epidermal growth factor receptor biology (IMC-C225). Curr Opin Oncol 2001; 13: 506–513.
- [4] Mendelsohn J, Baselga J. Status of epidermal growth factor receptor antagonists in the biology and treatment of cancer. J Clin Oncol 2003; 21: 2787–2799.
- [5] Nicholson RI, Gee JM, Harper ME, et al. EGFR and cancer prognosis. Eur J Cancer 2001; 37: 9–15.
- [6] Burtness B, Goldwasser MA, Flood W, et al. Phase III randomized trial of cisplatin plus placebo compared with cisplatin plus cetuximab in meta-static/recurrent head and neck cancer: an Eastern Cooperative Oncology Group study. J Clin Oncol 2005; 23: 8646–8654.
- [7] Trigo J, Hitt R, Koralewski P, et al. Cetuximab monotherapy is active in patients (pts) with platinum-refractory recurrent/metastatic squamous cell carcinoma of the head and neck (SCCHN): results of a phase II study. J Clin Oncol 2004; 22: (suppl.) 5502.
- [8] Li S, Schmitz KR, Jeffrey PD, et al. Structural basis for inhibition of the epidermal growth factor receptor by cetuximab. Cancer Cell 2005; 7: 301–311.
- [9] Lacouture ME. Mechanisms of cutaneous toxicities to EGFR inhibitors. Nat Rev Cancer; 2006; 6: 803–812.
- [10] Schrag D, Chung KY, Flombaum C, et al. Cetuximab therapy and symptomatic hypomagnesemia. Journal of the National Cancer Institute 2005; 97: 1221–1224.
- [11] Tejpar S, Piessevaux H, Claes K, et al. Magnesium wasting associated with epidermal-growth-factor receptor-targeting antibodies in colorectal cancer: a prospective study. Lancet Oncol 2007; 8: 387–394.
- [12] Kawaguchi Y, Kono K, Mimura K, et al. Cetuximab induce antibody-dependent cellular cytotoxicity against EGFR-expressing esophageal squamous cell carcinoma. Int J Cancer 2007; 120: 781–787.
- [13] Imai K, Takaoka A. Comparing antibody and small-molecule therapies for cancer. Nat Rev Cancer 2006; 6: 714–727.
- [14] Weihua Z, Tsan R, Huang WCH, et al. Survival of cancer cells is maintained by EGFR independent of its kinase activity. Cancer Cell 2008; 13: 385–393.
- [15] Liévre A, Bachet JB, Le Corre D, et al. KRAS mutation status is predictive of response to cetuximab therapy in colorectal cancer. Cancer Research 2006; 66: 3992–3995.
- [16] Mornoni M, Veronese S, Benvenuti S, et al. Gene copy number for epidermal growth factor receptor and clinical response to antiEGFR treatment in colorectal cancer: a cohort study. Lancet Oncol 2005; 6: 279–286.
- [17] Erjala K, Sundwall M, Junttila TT, et al. Signaling via ErbB2 and ErbB3 associates with resistance and epidermal growth factor receptor (EGFR) amplification with sensitivity to EGFR inhibitor gefitinib in head and neck squamous cell carcinoma cells. Clinical Cancer Research 2006; 12: 4103–4111.
- [18] Bokemeyer C, Bondarenko I, Hartmann J, et al. KRAS status and efficacy in the first-line treatment of patients with mCRC treated with FOL-FOX with or without cetuximab: The OPUS experience. ASCO 2008, Abst 4000.
- [19] Bissada E, Abou Chacra Z, Guertin L, et al. Prevalence of K-RAS codon 12 mutations in head and neck squamous cell carcinoma and impact on clinical outcomes. AHNS 2008 Annual Meeting, Abst 714000.
- [20] Kuo MY, Jeng JH, Chiang CP, et al. Mutations of Ki-ras oncogene codon 12 in betel quid chewing-related human oral squamous cell carcinoma in Taiwan. J Oral Pathol Med 1994; 23: 70–74.
- [21] Chang SE, Bhatia P, Johnson NW, et al. Ras mutations in United Kingdom examples of oral malignancies are infrequent. Int J Cancer 1991; 48: 409–412.
- [22] Khambata-Ford S, Garrett CR, Meropol NJ, et al. Expression of epiregulin and amphiregulin and K-ras mutation status predict disease control in metastatic colorectal cancer patients treated with cetuximab. J Clin Oncol 2007; 25: 3230–3237.
- [23] Sok JC, Copelli FM, Thomas SM, et al. Mutant epidermal growth factor receptor (EGFRvIII) contributes to head and neck cancer growth and resistance to EGFR targeting. Clinical Cancer Research 2006; 12: 5064–5073.
- [24] Learn CA, Hartzell TL, Wikstrand CJ, et al. Resistance to tyrozine kinase inhibition by mutant epidermal growth factor receptor variant III contributes to the neoplastic phenotype of glioblastoma multiforme. Clin Cancer Res 2004; 10: 3216–3224.
- [25] Kijima T, Niwa H, Steinman RA, et al. STAT3 activation abrogates growth factor dependence and contributes to head and neck squamous cell carcinoma tumor growth in vivo. Cell Growth Differ 2002; 13: 355–362.