Kombinační léčba po transplantaci srdce
Srdeční transplantace je v posledních letech metodou volby léčby pacientů s těžkým srdečním selháním. Kombinační léčba po transplantaci srdce spočívá jednak v kombinaci imunosupresiv, jednak v kombinaci imunosupresiv s jinými léčivy, zejména statiny. Klasickou imunosupresivní terapii tvoří ciclosporin, azathioprin a kortikoidy. Novější léčebná schémata obsahují ciclosporin, mykofenolát mofetil a kortikoidy či tacrolimus, mykofenolát mofetil a kortikoidy. V posledních letech se u pacientů po ortotopické transplantaci srdce (OTS) s poruchou renálních funkcí uplatňuje léčba kombinací bez kalcineurinových inhibitorů (ciclosporinu či tacrolimu), které jsou nefrotoxické. Místo nich se užívá do kombinace s mykofenolátem sirolimus. Po prvním roce se snažíme ve všech režimech vysadit kortikoidy a výslednou doživotní léčbou je dvojkombinace. U pacientů po srdeční transplantaci je třeba pečlivě zvažovat možná rizika konkrétního farmakoterapeutického režimu. K lékovým interakcím dochází nejčastěji s ciclosporinem. Při zvýšení jeho plazmatické hladiny se může projevit nefrotoxicita. Kortikoidy zvyšují účinek ciclosporinu, s diuretiky (kličkovými nebo thiazidovými) vedou k depleci draslíku, s nesteroidními antiflogistiky potencují ulcerogenní efekt. Velmi důležité je proto pravidelné sledování pacientů kardiologem a v případě jakýchkoliv nejasností konzultace transplantačního centra.
Úvod
Ortotopická transplantace srdce (OTS) je v posledních letech metodou volby léčby pacientů s těžkým srdečním selháním. Z praktického hlediska je v potransplantačním období důležitá znalost možných komplikací a vhodné farmakoterapie včetně případných rizik – zejména lékových interakcí imunosupresiv a jejich nežádoucích účinků.
Kombinační léčba spočívá buď v kombinaci imunosupresiv navzájem, nebo v kombinaci imunosupresiv s jinými léčivy, zejména statiny.
Kombinace imunosupresiv
Charakteristika jednotlivých imunosupresiv
V této stati charakterizujeme jednotlivá léčiva, která mohou figurovat v kombinovaných imunosupresivních režimech, včetně jejich rizik.
Ciclosporin
Ciclosporin je cyklický oligopeptid izolovaný z Tolypocladium inflatum nebo Tolypocladium terricola; v buňkách se váže na cyklofiliny, s nimiž tvoří komplex, který zasahuje do procesu intracelulárních signálních cest. Jeho konečným efektem je inhibice transkripčních faktorů nutných k aktivaci některých cytokinových genů, zejména genu pro některé interleukiny (IL-2, IL-3, IL-4) a interferon g, čímž dochází k inhibici časné fáze aktivace T-lymfocytů; potlačení sekrece IL-2 zamezuje aktivaci dalších lymfocytů [1].
Mezi nežádoucí účinky léčby ciclosporinem patří hyperplazie dásní (je obvykle reverzibilní během 6 měsíců po ukončení terapie), hirsutismus, hypertenze, nefrotoxicita (projevující se jako intersticiální fibróza s tubulární atrofií), třes (jeho výskyt je závislý na dávce), riziko rozvoje infekčního onemocnění, hyperkalémie, hypomagnezémie, hyperurikémie, hyperlipidémie. Kontraindikaci představuje současná terapie tacrolimem nebo její zahájení v odstupu kratším než 12 hodin [2–4].
Lékové interakce
Ciclosporin je lipofilní a je metabolizován v játrech přes systém cytochromu P-450 (izoenzym 3A4). Jeho plazmatická koncentrace může být ovlivněna řadou léčiv, která se rovněž metabolizují přes tento systém. Ciclosporin prodlužuje biologický poločas digoxinu; zvyšuje riziko vzniku myopatie až rabdomyolýzy při terapii statiny (především lovastatinem, simvastatinem a atorvastatinem). Jeho plazmatické hladiny a toxicitu zvyšuje cimetidin, omeprazol, metoclopramid, cisaprid, diltia-zem, verapamil, amiodaron, nefazodon, některá makrolidová antibiotika (erythromycin, clarithromycin), některé flurochinolony (norfloxacin, ciprofloxacin), azolová antimykotika (ketoconazol, itraconazol, fluconazol), inhibitory retrovirových proteáz, bromocriptin, danazol, estrogeny, progestiny, flavonoidy (naringin) obsažené v grapefruitové šťávě, perorální kontraceptiva, vysoké dávky methylprednisolonu, perorální antidiabetika ze skupiny derivátů sulfonylurey, NSAID (s výjimkou koxibů), chlorochin, colchicin, allopurinol, acetazolamid a tacrolimus. Jeho plazmatické hladiny snižuje ticlopidin, některá antiepileptika (barbituráty, carbamazepin, phenytoin), extrakt z třezalky tečkované, orlistat, rifampicin, rifabutin, isoniazid, pyrazinamid, terbinafin a octreotid. Jeho nefrotoxicitu zvyšují ostatní nefrotoxická léčiva, jeho hepatotoxicitu zvyšují ostatní hepatotoxická léčiva. Současné podávání inhibitorů ACE nebo kalium šetřících diuretik vede ke zvýšení rizika hyperkalémie [5].
Azathioprin
Azathioprin je derivát cytostaticky účinného mercaptopurinu s vysokou účinností na potlačení imunity zprostředkované především T-lymfocyty.
Nežádoucí účinky zahrnují gastrointestinální obtíže (nechutenství, nauzeu, zvracení), dále megaloblastickou anémii, leukopenii (nutná kontrola krevního obrazu a diferenciálu), riziko rozvoje infekčního onemocnění; méně častá je hepatotoxi-cita, trombocytopenie a alergické kožní reakce [6].
Lékové interakce
Azathioprin snižuje účinek perorálních antikoagulancií. Jeho biotransformaci inhibuje současné podávání allopurinolu, které vyžaduje snížení dávek azathioprinu až na jednu čtvrtinu. Myelotoxicitu zvyšují ostatní myelotoxická léčiva.
Prednison
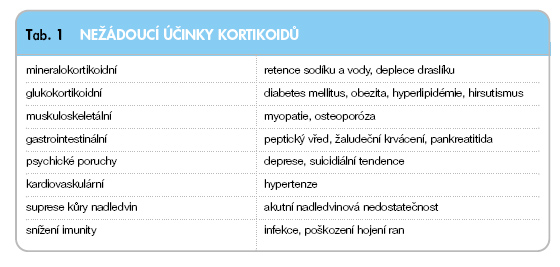
Prednison je nehalogenovaný kortiko-steroid s vystupňovanou glukokortikoidní účinností a nízkým mineralokortikoidním působením, který má nespecifické protizánětlivé účinky. Dávka 5 mg odpovídá cca 20 mg hydrocortisonu. V játrech se prednison biotransformuje na prednisolon; ve srovnání s prednisolonem má mírně nižší účinnost. Blokuje produkci cytokinů T-lymfocyty a makrofágy, inhibuje tvorbu prostaglandinů a leukotrienů (inhibicí fosfolipázy A2), tlumí tvorbu interleukinů a zasahuje do celulární imunitní odpovědi [7]. Nežádoucí účinky jsou uvedeny v tab. 1.
Lékové interakce
Kortikoidy zvyšují hladiny ciclosporinu, s diuretiky (thiazidy, furosemid) zhoršují depleci draslíku, zvyšují toxicitu digoxinu a nesteroidních antiflogistik včetně kyse-liny acetylsalicylové. Snižují účinek perorálních antidiabetik, inzulinu a antikoagulancií.
Tacrolimus
Tacrolimus je makrolidové antibiotikum produkované Streptomyces tsukubaensis s výrazným imunosupresivním účinkem. Váže se na cytoplazmatický receptor FK binding protein (FKBP-12), dochází k inhibici kalcineurin fostatázy a tím k zabránění tvorby IL-2 v T-lymfocytech.
Jeho mechanismus účinku je značně podobný mechanismu účinku ciclosporinu. Tacrolimus však brání aktivaci T-lymfocytů vyvolané mitogenní a antigenní stimulací (in vitro) přibližně 100x účinněji než ciclosporin. Je velmi účinný zejména u chronických kortikorezistentních rejekcí [8]. Jeho klinické využití je však užší. Tacrolimus se intenzivně váže na plazmatické bílkoviny a erytrocyty (více než 99 %), jeho biologický poločas je 9–11 hodin; pouze 1 % podané dávky se vylučuje močí v nezměněné formě, metabolity se vylučují převážně žlučí.
Nežádoucími účinky jsou gastrointestinální symptomy (nauzea, zvracení, bolesti břicha, průjem, nechutenství), neurotoxicita (úzkost, zmatenost, deprese, závratě, halucinace, poruchy spánku, epileptické paroxysmy, parestezie), periferní otoky, riziko rozvoje infekcí, nefrotoxicita, anémie, hyperglykémie, hyperkalémie, hypomagnezémie, svědění a alergické kožní reakce. Méně často se vyskytuje hypertenze, neuropatie, tinnitus, poruchy vidění, osteo-poróza, hyperlipidémie, vzácně lymfoproliferativní onemocnění [9].
Lékové interakce
Tacrolimus zvyšuje biologickou dostupnost ciclosporinu a riziko jeho nefrotoxicity. Jeho plazmatické hladiny a toxicitu zvyšují cimetidin, omeprazol, metoclopramid, cisaprid, diltiazem, makrolidová antibiotika (clarithromycin, erythromycin), azolová antimykotika (ketoconazol, fluconazol, itraconazol), danazol, NSA (s výjimkou koxibů) a statiny. Jeho nefrotoxicitu zvyšují aminoglykosidová a glykopeptidová antibiotika. Jeho účinek snižují některá anti-epileptika (phenobarbital, phenytoin, carbamazepin), rifampicin, rifabutin. Současné podávání kalium šetřících diuretik vede ke zvýšení rizika vzniku hyperkalémie.
Mykofenolát mofetil
Mykofenolát mofetil (MM) je účinné imunosupresivum ze skupiny antiproliferativních látek. Vlastní účinnou látkou je kyselina mykofenolová, která vzniká biotransformací proléčiva mycofenolat mofetilu. Mechanismem účinku je snížení syntézy guanosinových nukleotidů inhibicí inosinmonofosfátdehydrogenázy. MM má výraznější efekt na lymfoidní buňky než na myeloidní, což je způsobeno odlišnou závislostí těchto dvou buněčných linií na syntéze nukleotidů de novo. MM nemá vliv na časné fáze aktivace lymfocytů (neinhibuje syntézu interleukinu 2), ale zřejmě zasahuje až do pozdějších proliferativních a diferenciačních pochodů, dochází k potlačení produkce protilátek i ke snížení buněčné imunitní reakce [10].
Nežádoucí účinky zahrnují rovněž gastrointestinální obtíže (nauzea, zvracení, bolest břicha, dyspeptické obtíže, průjem nebo naopak zácpa), může se vyskytnout hypertenze, bolest hlavy, slabost, bolest na prsou, kašel, dyspnoe, periferní otoky, hematurie, anémie, leukopenie a riziko rozvoje infekčního onemocnění. Méně často se vyskytují poruchy srdečního rytmu, závratě, nespavost, bolest svalů, kostí a kloubů, třes, krvácení do trávicího ústrojí, hyperplazie dásní, gingivitida, stomatitida, pankreatitida, neutropenie, trombocytopenie, alergické kožní reakce; velmi vzácně lymfoproliferativní onemocnění.
Lékové interakce
Plazmatické hladiny snižují antacida a colestyramin.
Sirolimus
Sirolimus (rapamycin) je makrolidové antibiotikum produkované Streptomyces hydroscopicus s výrazným imunosupresivním účinkem, jehož podrobný mechanismus účinku není zcela znám, je však do značné míry odlišný od ciclosporinu nebo tacrolimu. Sirolimus brání aktivaci T-lymfocytů vyvolané mitogenní a antigenní stimulací (in vitro), přitom blokuje na vápníku závislé i nezávislé intracelulární signální transdukce. Derivátem sirolimu je everolimus. Sirolimus inhibuje progresi T-lymfocytů do S-fáze buněčného cyklu. Toto léčivo je vhodnější pro kombinaci s ciclosporinem než s tacrolimem, protože jak tacrolimus, tak sirolimus se váže na stejný intracelulární protein (FKBP-12). Experimentální data ukazují, že by sirolimus mohl zabraňovat chronické rejekci a tím i vývoji vaskulopatie štěpu. Má velmi vysokou vazbu na plazmatické bílkoviny (přibližně 92 %), biologický poločas je 57–63 hodin; pouze 2,2 % podané dávky se vylučují v nezměněné formě močí, metabolity se vylučují žlučí.
Nežádoucí účinky jsou gastrointestinální (nauzea, zvracení, bolesti břicha, zácpa nebo naopak průjem), bolesti hlavy, nespavost, hypertenze, poruchy srdečního rytmu, dyspnoe, bolesti kostí a kloubů, periferní otoky. Rizikem je rovněž rozvoj infekčního onemocnění, anémie, trombocytopenie, hypercholesterolémie, hyperlipidémie, hyperkalémie nebo naopak hypokalémie, hypofosfatémie, akneiformní erupce, alergické kožní reakce; epistaxe, otoky obličeje, hemolyticko-uremický syndrom a kožní ulcerace. Vzácně se může rozvinout capillary leak syndrom (provázený horečkou, snížením krevního tlaku, otoky končetin, poklesem tělesné hmotnosti) a velmi vzácně lymfoproliferativní onemocnění.
Lékové interakce
Sirolimus zvyšuje riziko vzniku myopatie až rabdomyolýzy při terapii statiny (především lovastatinem, simvastatinem nebo atorvastatinem). Plazmatické hladiny a toxicitu zvyšuje metoclopramid, cisaprid, diltiazem, ketoconazol a ciclosporin. Plazmatické koncentrace a toxicitu sirolimu mohou zvyšovat cimetidin, erythromycin, clarithromycin, itraconazol, fluconazol, inhibitory retrovirových proteáz a danazol. Naopak snížení plazmatické hladiny mů-žeme očekávat při současné léčbě rifampicinem nebo rifabutinem.
Převod pacientů na léčbu sirolimem
Důvodem převodu pacientů po srdeční transplantaci na léčbu sirolimem může být chronická ciclosporinová nefrotoxicita [11, 12], refrakterní rejekce [13], vasku-lopatie štěpu [14], myopatie a ciclosporinová neurotoxicita. Naopak nemocné s pokročilou renální insuficiencí (S-kreatinin > 300 mmol/l) při trombocytopenii, hypercholesterolémii (> 7,0 mmol/l) či hypertri-glyceridémii (> 4,0 mmol/l) není vhodné převádět na léčbu sirolimem [13].
Možnosti redukce nefrotoxicity kalcineurinových inhibitorů
Nefrotoxicitu kalcineurinových inhibitorů je možné snížit využitím kombinace malých dávek tacrolimu s malými dávkami sirolimu (a kortikoidy).
Při volbě imunosupresivního režimu s vyloučením kalcineurinových inhibitorů (ciclosporin či tacrolimus) a podání sirolimu s mykofenolátem dochází ke zlepšení renálních funkcí při zachování stejné účinnosti imunosuprese [15]. Tab. 2 shrnuje možné imunosupresivní režimy.
Vývoj a současné trendy v kombinační imunosupresivní terapii
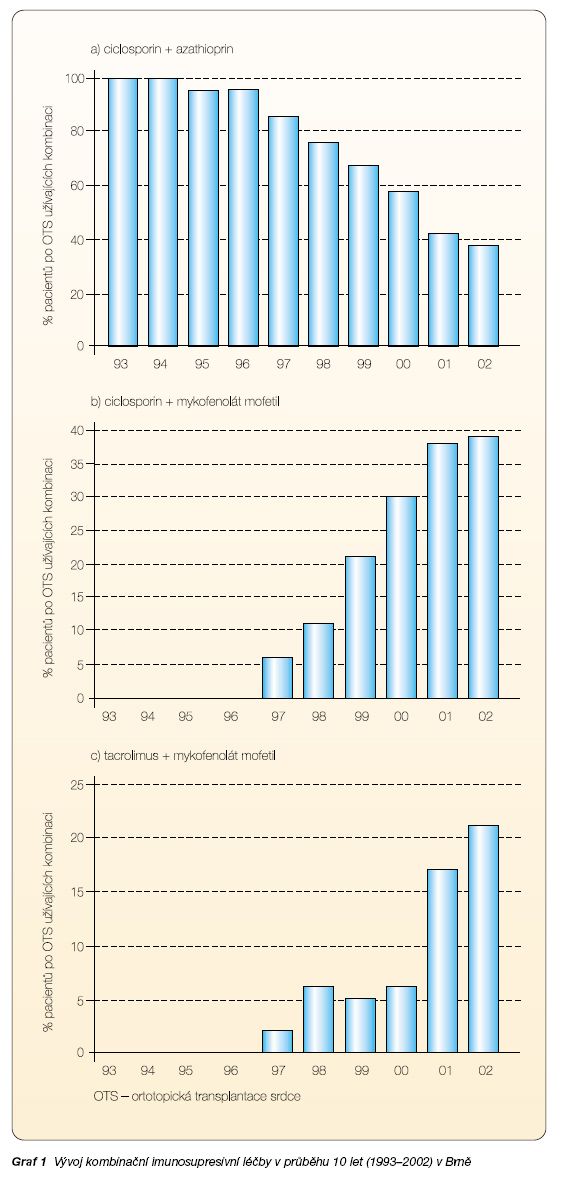
Na základě vlastních zkušeností získaných v průběhu desetiletí 1993–2002 můžeme pozorovat významné změny v imunosupresivní terapii u pacientů po OTS. Dochází k poklesu užívání ciclosporinu a azathioprinu, na rozdíl od vzestupu používání mykofenolátu a tacrolimu. V kombinační léčbě je na ústupu kombinace ciclosporin a azathioprin, naopak vzrůstá počet pacientů léčených kombinací mykofenolát + ciclosporin nebo mykofenolát + tacrolimus [16] (graf 1).
Indukční terapie
Indukční terapie zahrnuje krátký interval prvních 7 dnů od transplantace, dokud nejsou dosaženy terapeutické hladiny kalcineurinových inhibitorů. Jsou různé protokoly využívající buď monoklonální, nebo polyklonální protilátky.
Polyklonální protilátky (ATG antithymocytární nebo ALG antilymfocytární globulin) suprimují jak T-lymfocyty, tak B-lymfocyty, a tím mohou vést ke zvýšenému výskytu zejména oportunních infekcí. Muromonab (OKT3) je monoklonální protilátka namí-řená speciálně proti T-lymfocytům, a tak šetří ostatní části imunitního systému příjemce. Jako nadějné se jeví protilátky basiliximab nebo daclizumab namířené přímo proti receptoru IL-2.
Tato léčiva se podávají jako čtvrtá k základní trojkombinaci imunosupresiv [17].
Kombinace imunosupresiv s jinými léčivy
Kombinační léčba imunosupresivy s jinými léčivy u pacientů po OTS nejčastěji zahrnuje terapii hyperlipoproteinémie a hypertenze, které jsou velmi častými doprovodnými onemocněními těchto pa-cientů.
Hyperlipoproteinémie
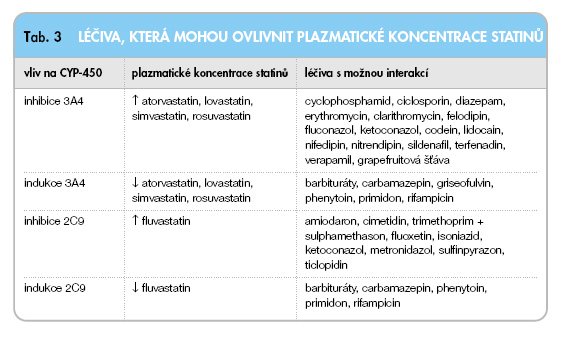
Je známo, že ciclosporin i tacrolimus jsou metabolizovány izoenzymem 3A4 cytochromu P-450. Je proto důležité znát látky, které tyto enzymy inhibují (zvýšení hladin), nebo indukují (snížení hladin) [18, 19] (tab. 3).
Atorvastatin, lovastatin, simvastatin či nový rosuvastatin jsou metabolizovány rovněž cestou CYP3A4. Na základě lékové interakce dochází ke zvýšení plazmatických koncentrací těchto statinů s následným nebezpečím vzniku myopatií či rabdomyo-lýzy [2, 3]. Naproti tomu pravastatin, který se touto cestou nemetabolizuje, anebo fluvastatin, který se metabolizuje cestou CYP2C9, se jeví jako farmakologicky vhodné u nemocných po OTS, protože nebezpečí lékových interakcí na CYP3A4 je minimální. Proto by podávání statinů metabo- lizovaných cestou CYP3A4 nemělo být z farmakologického hlediska indikované.
Přesto vznikla řada studií i s „méně vhodnými" statiny u nemocných po OTS, a to i navzdory tomu, že např. po podání 80 mg lovastatinu byla popsána závažná rabdomyolýza [20]. Ve studii Wenkeho a kol. s osmiletým podáváním simvastatinu v nízké dávce 5–20 mg denně nebyla pozorována žádná rabdomyolýza, pouze zvýšení kreatinkinázy nad 100 U/l bylo zaznamenáno u 12 aktivně léčených ve srovnání s 10 nemocnými na dietě [21]. Obdobně ve studii s atorvastatinem Patela a kol. nepozorovali autoři větší výskyt myopatií [22]. Ve srovnávací studii Keogha a kol., kdy byl po dobu jednoho roku srovnáván pravastatin se simvastatinem, však již byl rozdíl ve výskytu myopatií významný. Po léčbě simvastatinem mělo 13,3 % nemocných myositidu a 1 nemocný měl klinicky významnou rabdomyolýzu. Po léčbě pravastatinem nebyl zaznamenán žádný výskyt myopatie, ale u 2 nemocných byl pravastatin pro bolesti hlavy za-měněn za simvastatin!? [23] Obdobné závěry podává Kobashigawa a kol. jak po ročním, tak po desetiletém sledování léčby pravastatinem u pacientů po OTS, kdy pokles mortality či snížení koronární vaskulopatie nebyl provázen výskytem myopatie [24, 25].
S fluvastatinem po transplantaci srdce či ledvin bylo provedeno několik studií. Ve studii z našeho pracoviště nebyla pozorována po podání 20 mg fluvastatinu pa-cientům po transplantaci srdce myopatie ani zvýšení kreatinkinázy [26]. Vyšší dávky fluvastatinu po transplantaci srdce byly podávány v práci Hoškové. Nemocným, kteří měli po OTS nedostatečně kontrolovanou hladinu celkového a LDL cholesterolu (vyšší než 6, resp. 3,4 mmol/l), při léčbě pravastatinem v dávce 40 mg nebo fluvastatinem 40 mg podali autoři 80 mg fluvastatinu v retardované formě XL. Plazmatické koncentrace celkového i LDL cholesterolu a triglyceridů významně poklesly a koncentrace HDL cholesterolu se zvýšila. Autoři přitom nepozorovali ani u jednoho nemocného myalgii či myopatii [27].
Nedávno byla publikována největší multicentrická randomizovaná dvojitě slepá placebem kontrolovaná studie u nemocných po transplantaci ledvin (studie ALERT) [28]. Bylo sledováno 2102 nemocných, kteří dostávali buď 40 mg fluvastatinu, nebo placebo. Po průměrné době sledování 5,1 roků fluvastatin snížil koncentraci LDL cholesterolu o 32 %, snížení rizika příhody z kombinovaného cíle (srdeční smrt, nefatální infarkt myokardu nebo koronární intervence) nebylo signifikantní, ale vyskytlo se méně srdečních úmrtí a nefatálních infarktů myokardu. Rabdomyolýza byla pozorována pouze u 2 nemocných v celé studii, u jednoho ve fluvastatinové a u druhého v placebové větvi.
Částečně se ztotožníme s Christie Ballantyne, který doporučuje ve svém editorialu z roku 2000, že u nemocných je možno začít co nejdříve po OTS s podáváním nízkých dávek jakéhokoliv statinu (atorvastatin 10 mg, lovastatin 20 mg, simva-statin 10 mg, rosuvastatin 10 mg, prava-statin 20–40 mg a fluvastatin 40 mg) [29].
Jak však postupovat, je-li navzdory léčbě nízkými dávkami statinů nedostatečně kontrolovaná plazmatická koncentrace celkového cholesterolu (nad 6 mmol/l) a LDL (nad 3,5 mmol/l)? Zaměníme imunosupresivní terapii ciclosporinem za imunosupresi tacrolimem, protože imunosuprese tacrolimem vykazuje ve srovnání s ciclosporinem lepší lipidový profil [30]. Dále se snažíme o snížení dávky kortikoidů nebo o jejich úplné vysazení [4, 10]. A je-li nutno přesto kontrolovat zvýšený cholesterol, zvolíme hydrofilní fluvastatin v retardované formě, ev. pravastatin v dávkách 80 mg denně, které mají farmako-logické předpoklady k nižšímu výskytu lékových interakcí a myopatií. Tito nemocní však budou přesto vyžadovat pečlivé sledování výskytu bolestí svalů, plazmatických koncentrací kreatinkinázy, jaterních transamináz a imunosupresiv. Velmi potřebné se jeví provedení multicentrické srovnávací dvojitě slepé studie s dostatečným počtem nemocných po OTS léčených jednotlivými statiny a různými dávkami, event. kombinací statinů s ezetimibem.
Hypertenze
Hypertenze je běžnou komplikací terapie ciclosporinem. Objevuje se v 50–90 % u pacientů po srdeční transplantaci [31].
Léčba hypertenze je často velmi obtížná s potřebou kombinační terapie. Základním předpokladem úspěšné antihypertenz-ní léčby je udržování hladiny ciclosporinu na co nejnižší úrovni. Terapie zahrnuje dietu s omezením příjmu sodíku, redukci tělesné hmotnosti, zákaz kouření a podávání antihypertenziv [32].
Blokátory kalciových kanálů patří k lékům první volby. Snižují spotřebu ciclosporinu zvýšením jeho hladin v krvi. Diltiazem může mít profylaktický vliv na vznik vaskulopatie štěpu. Výhodou kalciových antagonistů je jejich metabolická neutralita [33].
Inhibitory angiotenzin konvertujícího enzymu (ACEI) patří také k lékům první volby. Jejich výhodou je rovněž metabolická neutralita. Kombinace blokátorů kalciových kanálů a inhibitorů ACE vede u dvou třetin pacientů po transplantaci srdce k uspokojivé kontrole krevního tlaku [34].
Diuretika jsou užívána časně po transplantaci. Jejich použití je účelné v případě objemové expanze a retence sodíku [35]. Jejich negativním efektem je zvýšení koncentrace LDL cholesterolu, triglyceridů a hladin kyseliny močové.
b-blokátory neovlivňují u pacientů po transplantaci srdce tepovou frekvenci. Nejsou dobře tolerovány, zvláště v časném potransplantačním období. Měly by být užívány opatrně, protože denervované srdce je závislé na katecholaminech a negativně inotropní efekt těchto léčiv by mohl být zvýšený u alograftu. Mají také nepříznivý účinek na hladiny lipidů, zvyšují koncentraci triglyceridů a snižují koncentraci HDL cholesterolu [31].
Vazodilatační léčiva jsou užívána zřídka, jejich místo je v kombinační terapii s kalciovými blokátory, inhibitory ACE nebo diuretiky. Hydralazin je užíván častěji, prazosin výjimečně v případě noční hypertenze [31].
Závěr
Problematika kombinační terapie po srdeční transplantaci je velmi složitá, neboť existuje široké spektrum léčiv, které je možné těmto pacientům podávat. Dlouhodobý prospěch této léčby pro pa-cienty závisí nejenom na práci transplantačních center a klinických pracovišť, ale také na dobré spolupráci s terénními kardiology, kteří se s těmito pacienty dnes již běžně setkávají.
Podpořeno záměrem MSM 0021622402.
Seznam použité literatury
- [1] Martínek V, Matoušovic K, Špatenka J. Objev a užití cyklosporinu v klinické praxi. Prakt Lék 2002; 82:14–20.
- [2] Špinarová L. Transplantace srdce z pohledu kardiologa. Kardiologická revue 1999; 2: 101–105.
- [3] Málek I. Transplantace srdce. Postgraduální medicína 1999; 1: 95–100.
- [4] Krejčí J, Hude P, Špinarová L, et al. Transplantace srdce – indikace, komplikace, terapie – naše zkušenosti ze sledování 100 pacientů po srdeční transplantaci. Vnitř Lék 2000; 46: 750–755.
- [5] Hošková L, Málek I, Šedivý J, et al. Lékové interakce cyklosporinu A. Cor Vasa 2002; 44: 481–488.
- [6] Lácha J. Úskalí imunosupresivní léčby. Vnitřní Lék 2003; 49: 430–433.
- [7] Gebauerová M, Jandová R, Málek I, et al. Obraz nemocného po srdeční transplantaci. Cor Vasa 1993; 35: 258–262
- [8] Rinaldi M, Pellegrini C, Martinelli L, et al. FK 506 effectiveness in reducing rejection after heart transplantation: a a prospective randomised study. J Heart Lung Transpl 1997; 16: 1001–1010.
- [9] Špinarová L, Toman J, Hude P, et al. Dlouhodobé metabolické účinky tacrolimu a cyklosporinu po transplantaci srdce. Sborník abstrakt V. konference transplantace orgánů a tkání. Brno 2002.
- [10] Špinarová L, Toman J. Pharmacotherapy after heart transplantation. Cor Vasa 2000; 42: 335–340.
- [11] Snell GI, Levvey BJ, Chin W, et al. Sirolimus allows renal recovery in lung and heart transplant recipients with chronic renal impairment. J Heart Lung Transpl 2002; 21: 540–546.
- [12] Hunt J, Lerman M, Dewey T, et al. Conversion to sirolimus lessens renal dysfunction in heart transplant patients. J Heart Lung Transpl 2004; 23 (2S): 113.
- [13] Viklický O, Matl I. Rapamycin: nové imunosupresivum schopné potlačit chronickou rejekci? Čas Lék Čes 2001; 140: 22–25.
- [14] Mancini D, Pinney S, Burkhoff D, et al. Use of rapamycin slows progression of cardiac transplantation vasculopathy. Circ 200;108: 48–53.
- [15] Groetzner J, Kaczmarek I, Muller M, et al. Calcineurin-inhibitor-free immunosuppression with mycophenolat mofetil and sirolimus after cardiac transplantation is safe and improves renal function significantly :1 year follow up. Am Transpl Congress, May 2004, Boston, USA.
- [16] Špinarová L, Hude P, Krejčí J, et al. Vývoj imunosupresivních režimů v průběhu 10 let u pacientů po transplantaci srdce. Sborník abstrakt 6. kongresu České transplantační společnosti; Praha 14.–16. 10. 2004.
- [17] Vítovec J, Špinar J. Farmakoterapie kardiovaskulárních onemocnění. Praha, Grada, 2004.
- [18] Kousalová L, Baranová J, Anzenbacher P. Lékové interakce na úrovni cytochromů P450 – část I. Klin Farmakol 2003; 17: 151–157.
- [19] Widimský J. Poškození svalů při léčbě inhibitory HMG CoA reduktázy statiny. Cor Vasa 2003; 45: 376–386.
- [20] East C, Alivizatos PA, Grundy SM, et al. Rhabdomyolysis in patients receving lovastatin after cardiac transplantation (letter). N Engl J Med 1988; 318: 47–48.
- [21] Wenke K, Meiser B, Thiery, J et al. Simvastatin Initiated Early After Heart Transplantation. 8-Year Prospective Experience. Circulation 2003; 107: 93–97.
- [22] Patel DN, Pagani FD, Koelling TM, et al. Efficacy and Safety of Atorvastatin in Heart Transplant Recipients. J Heart Lung Transplant 2002; 21: 204–210.
- [23] Keogh A, Mecdonald P, Kaan A, et al. Efficacy and Safety of Pravastatin vs Simvastatin After Cardiac Transplantation. J Heart Lung Transplant 2000; 19: 529–537.
- [24] Kobashigawa JA, Katznelson S, Laks H, et al. Effect of pravastatin on outcomes after cardiac transplantation. N Engl J Med 1995; 333: 621–627.
- [25] Kobashigawa JA, Moriguchi JD, Cogert G, et al. 10-year results of the pravastatin randomized trial in heart transplant recipients. ISHLT April 21.-24, 2004 San Francisco, USA. Abstr. 218.
- [26] Špinarová L, Toman J. Fluvastatin u pacientů po transplantaci srdce.Vnitř Lék 1998; 44: 13–16.
- [27] Hošková L, Podzimková M, Málek I. Bezpečnost a účinnost fluvastatinu po transplantaci srdce. Cor Vasa 2004; 46: 473–477.
- [28] Holdaas H, Fellström B, Jardine AG, et al. Effect of fluvastatin on cardiac outcomes in renal transplant recipients: a multicentre, randomised, placebo-controlled trial. Lancet 2003; 361 : 2024–2031.
- [29] Ballantyne CM. Statins after Cardiac Transplatation: Which Statin, What Dose, and How Low Should We Go? J Heart Lung Transplant 2000; 19: 515–517.
- [30] Fellström B. Impact and management of hyperlipidemia posttransplantation. Transplantation 2000; 70 (Suppl): S51–S57.
- [31] Wagoner LE. Management of the cardiac transplant recipient: roles of the transplant cardiologist and primary care physician. Am J Med Sci 1997; 314: 173–184.
- [32] Špinarová L. Hypertenze po transplantaci srdce. Vnitř Lek 1999; 45: 555–558.
- [33] Ventura HO, Mehra MR, Stapleton DD, et al. Cyclosporine induced hypertension in cardiac transplantation. Med Clin of North America 1997; 81: 1347–1357.
- [34] Brozena SC, Johnson MR,Ventura HO, et al. Effectiveness and safety of diltiazem or lisinopril in treatment of hypertension after heart transplantation. J Am Coll Cardiol 1996; 27: 1707–1712.
- [35] Braith RW, Mills RM, Wilcox C, et al. Breakdown of blood pressure and body fluid homeostasis in heart transplant recipients. J Am Coll Cardiol 1996; 27: 375–383.