Metodické pokyny pro farmakoterapii nádorové bolesti
Úvod
Bolest představuje jeden z nejzávažnějších projevů nádorového onemocnění. Zásadním způsobem ovlivňuje kvalitu života onkologicky nemocných. Je povinností lékaře, který o onkologicky nemocného pečuje, věnovat bolesti pozornost a účinně ji tišit. V České republice jsou v současné době k dispozici prostředky k dostatečnému zmírnění bolesti u všech onkologicky nemocných.
Cíle léčby onkologické bolesti
-
Zajištění bezbolestného spánku (dosažitelný cíl u všech nemocných).
-
Úleva od bolesti v klidu (dosažitelný cíl u naprosté většiny nemocných).
-
Úleva od bolesti při pohybu (dosažitelný cíl u většiny nemocných).
Předpoklady úspěšné léčby onkologické bolesti
-
Systematické zhodnocení bolestivého stavu (podle charakteru, časového průběhu, vztahu k nádorovému onemocnění a jeho léčbě, účinnosti dosavadní analgetické léčby).
-
Zasazení léčby bolesti do komplexního plánu onkologické léčby s optimálním využitím postupů protinádorové léčby.
-
Podpůrná komunikace a psychologická a sociální podpora, která zohledňuje, v jaké fázi nemoci se pacient nachází a jak se na svou situaci adaptoval.
-
Využití farmakologických a nefarmakologických postupů v léčbě bolesti.
-
Pravidelné sledování analgetického účinku, nežádoucích účinků a řešení těchto nežádoucích účinků.
-
Včasné odeslání nemocného na specia-lizované pracoviště léčby bolesti v případě nedostatečné odpovědi na analgetickou léčbu.
Hodnocení bolesti
Má-li být léčba bolesti racionální, je nezbytné provést podrobnou charakteristiku bolestivého stavu:
-
Příčina bolesti (Je bolest vyvolána nádorem? Je vyvolána protinádorovou léčbou? Nemá souvislost s nádorem?)
-
Typ bolesti: somatická, viscerální, neuropatická, smíšená
-
Časový průběh bolesti: trvalá stabilní, trvalá s kolísavou intenzitou, intermitentní
-
Intenzita bolestiStandardem je hodnocení intenzity bolesti dle numerické analogové škály (VAS 0–10), kde 0 je stav bez bolesti, 10 je nejsilnější bolest, jakou si pacient dokáže představit. Vyjadřování intenzity bolesti pomocí těchto nástrojů je pro některé pacienty obtížné. V těchto případech lze využít slovní hodnocení intenzity bolesti pomocí kategorií „ žádná – mírná – středně silná – silná – nesnesitelná“.
-
Intenzita bolesti se může během dne měnit, např. v návaznosti na pohyb a denní aktivity. Specifický problém představuje tzv. průlomová bolest. Jedná se o epizody silné bolesti, které trvají obvyk-le 10–60 minut a objevují se u pacienta s jinak dobře zmírněnou chronickou bolestí. Epizody průlomové bolesti se mohou vyskytnout ve vazbě na specifický pohyb (např. kašel, polykání, postavení) nebo zcela nečekaně bez vyvolávajícího podnětu.
-
Pro hodnocení intenzity bolesti je někdy vhodné, aby si pacient zaznamenával aktuální stav bolesti do deníku bolesti.
Základní typy nádorové bolesti
Z hlediska volby léčebného postupu je nejvýznamnější dělení bolesti podle převažujícího patofyziologického mechanismu.
-
Bolest nocicepční somatická: bolest vyvolaná drážděním nervových zakončení (nociceptorů) v místě tkáňového poškození. Je obvykle dobře lokalizovaná v místě poškození (např. kostní bolest, nádory prorůstající do měkkých tkání, exulcerované kožní nádory).
-
Bolest nocicepční viscerální: bolest vyvolaná infiltrací, útlakem, zúžením či distenzí v orgánech dutiny břišní a malé pánve. Bolest je obvykle neostře lokalizovaná, někdy pacientem udávaná na jiném místě na povrchu těla jako tzv. přenesená bolest. Příklady: nádorové postižení slinivky břišní, střev, jater, močovodů a močového měchýře.
-
Bolest neuropatická: vzniká v důsledku poškození periferního nebo centrálního nervového systému. Často současně nacházíme i jiné senzomotorické poruchy. Příklady: útlak nebo infiltrace nervových kořenů, plexů, míchy, axonální poškození po chemoterapii a radioterapii.
-
Bolest smíšená: má současně vlastnosti nocicepční i neuropatické bolesti. Příklad: nádor v oblasti malé pánve, který prorůstá do kostí a svalů pánevní stěny a současně destruuje nervové pleteně.
Obecné rozdělení druhů léčby onkologické bolesti
Pokud je to možné, je třeba vždy využívat potenciálu protinádorové (kauzální) léčby ke zmenšení velikosti nádoru, popř. jeho aktivity. Současně s protinádorovou léčbou a také při přetrvávání bolesti po jejím ukončení podáváme analgetickou (symptomatickou) léčbu.
Protinádorové modality v léčbě bolesti
-
Chirurgická intervence (radikální nebo paliativní)
-
Radioterapie (kurativní nebo nekurativní)1. teleradioterapie2. brachyradioterapie3. otevřené zářiče (izotopy)
-
Chemoterapie a hormonální terapie
Symptomatické postupy léčby bolesti
-
Systémové podávání analgetik a koanalgetik
-
Metody regionální analgezie
-
Neuroablativní postupy
-
Rehabilitace a fyzikální léčba
-
Psychoterapie
Základním pilířem léčby onkologické bolesti je farmakoterapie!
Obecná pravidla farmakologické léčby
-
Při léčbě se řídíme především pacientovým údajem o intenzitě a charakteru bolesti.
-
Při volbě analgetika vycházíme z typu bolesti (somatická, viscerální, neuropatická, smíšená – viz výše) a intenzity bolesti.
-
Léčbu somatické, viscerální a smíšené bolesti zahajujeme podáním analgetik.
-
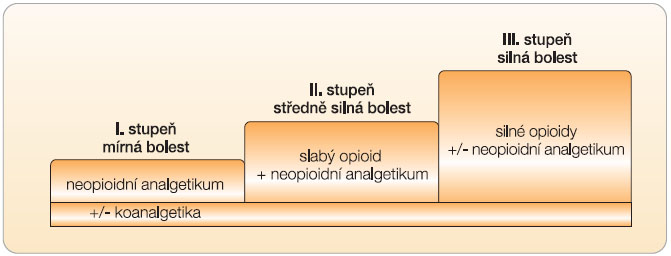
Analgetika volíme podle intenzity bolesti. Schematicky tento přístup znázorňuje třístupňový analgetický „žebříček“ WHO (viz obr. 1). Při mírné bolesti zahajujeme léčbu analgetiky 1. stupně, při středně silné bolesti volíme analgetika 2. stupně (obvykle v kombinaci s analgetiky 1. stupně). Při silné bolesti podáváme analgetika 3. stupně.
-
V léčbě neuropatické a smíšené bolesti zahajujeme léčbu podáváním koanalgetik pro léčbu neuropatické bolesti (antikonvulziva, antidepresiva) a v případě nedostatečného efektu přidáváme analgetika (obvykle 2. nebo 3. stupně).
-
Při trvalé bolesti podáváme analgetika v pravidelných časových intervalech („podle hodin“). Délka intervalu závisí na farmakokinetických vlastnostech jednotlivých léků a lékových forem.
-
K zajištění dostatečné kontroly bolesti při její kolísavé intenzitě (tzv. průlomové bolesti) je někdy třeba kombinovat lékové formy opioidů s dlouhodobým účinkem s lékovými formami s rychlým uvolňováním.
-
Dávku analgetika stanovujeme vždy individuálně podle analgetického účinku a nežádoucích účinků.
-
Dáváme přednost co nejméně invazivnímu způsobu podání. Pro dlouhodobou léčbu je výhodné podání perorální a transdermální. V případě nemožnosti těchto způsobů podání lze některá analgetika podávat rektálně.
-
Pouze menší část nemocných potřebuje k tlumení chronické bolesti injek-ční analgetika. Léky lze podávat formou jednotlivých dávek v pravidelných intervalech nebo formou kontinuální subkutánní nebo intravenózní infuze. Ke kontinuální aplikaci je výhodné užití přenosných infuzních pump („lineárních dávkovačů“).
-
Pravidelně hodnotíme výskyt nežádoucích účinků. Výskyt nežádoucích účinků není důvodem k přerušení podávání analgetik, ale k léčbě a řešení těchto nežádoucích účinků.
-
Pacientovi je třeba vypracovat písem-ný časový plán užívání léků s informací o důvodu jejich nasazení a poskytnout kontakt na lékaře pro případ výskytu závažných nežádoucích účinků.
-
Pacienta je třeba poučit o pravidlech užívání volně prodejných léků a přípravků k léčbě bolesti či potravinových doplňků na bolest a uklidnění.
-
O úspěšné farmakologické terapii bolesti lze hovořit, pouze pokud prospěch z analgezie jasně převyšuje zátěž nežádoucích účinků.
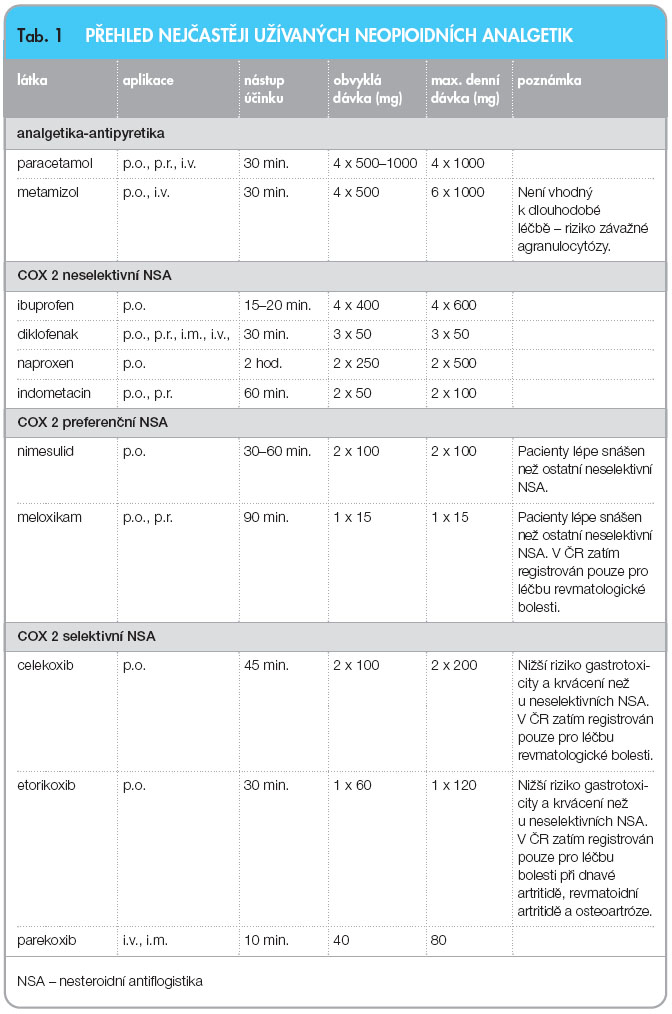
Analgetika I. stupně žebříčku WHO
-
Jsou indikována v monoterapii k léčbě mírné a středně silné nocicepční somatické a viscerální bolesti. Pro léčbu silné bolesti je třeba vždy kombinace s opioi-dy.
-
Pokud po nasazení těchto léků v maximální dávce není během 1–2 dní dosaženo zmírnění bolesti na snesitelnou míru, je indikován přechod na léčbu analgetiky II. nebo III. stupně žebříčku WHO.
-
Zvyšování dávek neopioidních analgetik nad uvedenou maximální denní dávku (tab. 1) obvykle nevede k posílení analgetického účinku, ale ke zvýšení rizika závažných nežádoucích účinků.
-
Mezi pacienty existuje velká variabilita účinku (a nežádoucích účinků) jednotlivých analgetik. Někdy je výhodné vyzkoušet jiné neopioidní analgetikum.
-
Kombinace více nesteroidních antiflogistik není racionální a zvyšuje riziko nežádoucích účinků.Analgetika II. stupně žebříčku WHO
-
Jsou indikována k léčbě středně silné a silné bolesti. Výhodné je podání v kombinaci s neopioidními analgetiky a ko-analgetiky.
-
Dávku je třeba podle léčebného efektu postupně zvyšovat až po maximální denní dávku (viz tab. 2). Další zvyšování dávky obvykle nevede ke zvýšení analgetické účinnosti, ale pouze ke zvýraznění nežádoucích účinků.
-
Pokud po nasazení těchto léků v maximální dávce (v kombinaci s neopioidními analgetiky) není do několika hodin dosaženo zmírnění bolesti na snesitelnou míru, je třeba zvážit přechod na analgetika III. stupně dle WHO.
-
V případě silné bolesti působené nádorem (např. kostní metastázy, prorůstání nádoru do měkkých tkání a nervových pletení) je obvykle indikováno podání silných opioidů (analgetika III. stupně dle žebříčku WHO) bez předchozí léčby slabými opioidy.
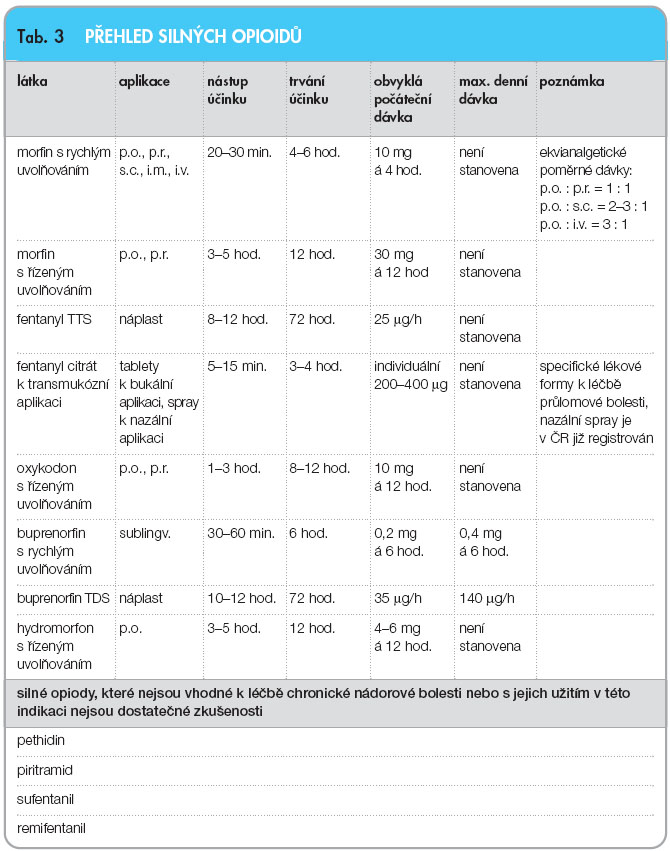
Analgetika III. stupně žebříčku WHO
-
Silné opioidy jsou základní lékovou skupinou pro léčbu silné nádorové bolesti. 60–90 % pacientů s onkologickým onemocněním (v závislosti na typu nádoru a stupni pokročilosti) trpí bolestmi, které vyžadují léčbu silnými opioidy.
-
Silné opioidy jsou indikovány vždy, když se bolest nepodaří v přijatelně krátké době zmírnit slabšími analgetiky (tj. slabými opioidy a neopioidními analgetiky), a to bez ohledu na prognózu základního onemocnění.
-
Dávku postupně zvyšujeme („titrujeme“) podle analgetického účinku a míry nežádoucích účinků. Rychlost zvyšování dávky závisí na intenzitě bolesti a farmakologických vlastnostech léku. Obvyklé počáteční dávky u pacientů, kteří dosud nebyli léčeni silnými opioidy, uvádí tab. 3. Pokud při dané dávce není bolest dostatečně tlumena, zvýšíme dávku o 30–50 %.
-
K počátečnímu nalezení účinné dávky jsou výhodnější lékové formy s rychlým uvolňováním. Při použití lékových forem s pomalým uvolňováním je třeba k posouzení účinnosti dané dávky a rozhodnutí o jejím
 případném zvýšení vyčkat dosažení vyrovnané plazmatické hladiny (u retardovaného morfinu, hydromorfonu a oxykodonu 3 dny, u transdermálního fentanylu a buprenorfinu 5–7 dní).
případném zvýšení vyčkat dosažení vyrovnané plazmatické hladiny (u retardovaného morfinu, hydromorfonu a oxykodonu 3 dny, u transdermálního fentanylu a buprenorfinu 5–7 dní). -
Je výhodné kombinovat silné opioidy s neopioidními analgetiky a koanalgetiky.
-
Není vhodné kombinovat v dlouhodobé pravidelné medikaci silné a slabé opioidy. Slabé opioidy (především tramadol) mohou být použity v léčbě průlomové bolesti u pacientů, kteří jsou léčeni silnými opioidy.
-
Je nevhodné kombinovat parciální agonisty/antagonisty a čisté agonisty opioid-ních receptorů (např. pentazocin a morfin). Tato kombinace může vést ke snížení analgetického účinku a ke zvýraznění nežádoucích účinků.
-
Někdy je výhodné kombinovat lékové formy s pomalým uvolňováním (podávané pravidelně „podle hodin“) a lékové formy s rychlým uvolňováním (podávané „dle potřeby“ v případě průlomových bolestí).
-
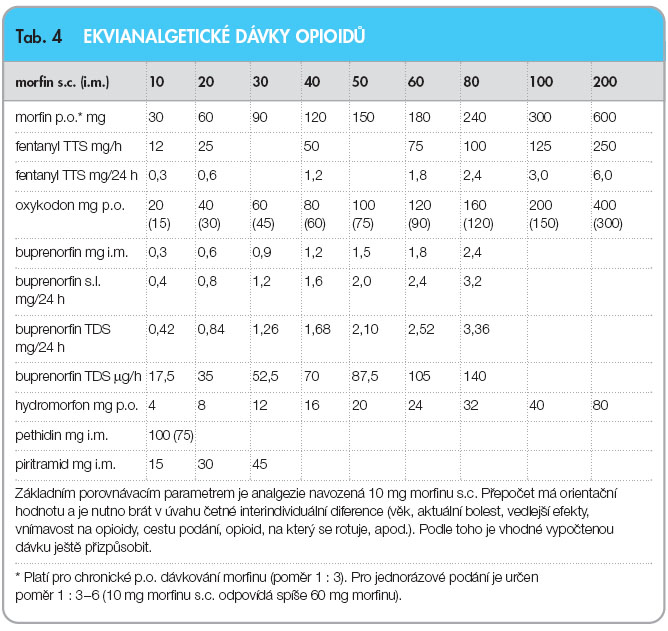
Mezi pacienty existuje velká variabilita účinku (a nežádoucích účinků) jednotlivých opioidů. Při nevýhodném poměru analgezie a nežádoucích účinků nebo při vzniku tolerance na určitý opioid je výhodné zkusit jiný opioid (tzv. rotace opioidů).
-
Při stanovení dávky nového opioidu vycházíme z tzv. ekvianalgetické dávky (dávky se stejným analgetickým účinkem), viz tab. 4. Vypočítanou dávku obvykle na začátku redukujeme o 30–50 %.
Léčba průlomové bolesti
Průlomová bolest (definice viz výše) se vyskytuje u 40–60 % pacientů s chronickou nádorovou bolestí. Základním požadavkem na výběr vhodného léku k léčbě průlomové bolesti (tzv. záchranný lék) je rychlý nástup a krátké trvání účinku, dostatečný analgetický účinek a příznivý profil nežádoucích účinků. Podle charakteru a trvání bolesti volíme jednu z následujících strategií:
-
Zvýšení dávky základní analgetické medikace.
-
Podání záchranné dávky neopioidního analgetika. Je nutné používat neretardované lékové formy. Při častém užívání záchranných dávek hrozí nebezpečí překročení nejvyšší bezpečné denní dávky.
-
Podání záchranné dávky opioidů. Velikost jednotlivé záchranné dávky je individuální, obvykle ale v rozmezí 5–15 % celkové denní dávky. U velmi krátkých epizod průlomové bolesti (v délce několika sekund až několika minut) nejsou perorální a parenterální dávky tramadolu a morfinu účinné. Jejich účinek nastupuje až po odeznění epizody bolesti. Významným přínosem bude uvedení fentanylu k transmukózní aplikaci na trh (viz tab. 3).
Pomocná analgetika (koanalgetika)
Jako pomocná analgetika označujeme lékové skupiny, které se podávají současně s analgetiky v léčbě určitých specifických bolestivých stavů. Podle toho bývají dělena na koanalgetika k léčbě:
-
kostní bolesti
-
neuropatické bolesti
-
viscerální bolesti (při maligní střevní obstrukci)
-
centrální neuropatické bolesti a bolesti při intrakraniální hypertenzi.
Kostní nádorová bolest
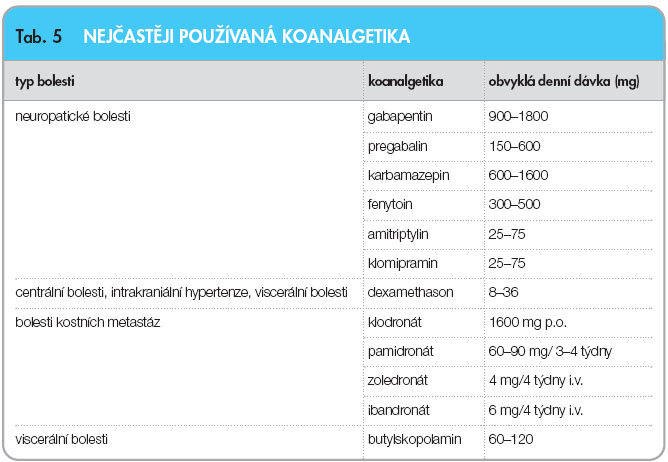 Jedná se obvykle o převážně nocicepční somatickou bolest. Někdy je přítomna významná neuropatická složka. Při léčbě užíváme kombinaci opioidních a neopioid-ních analgetik. Při vyjádřené neuropatické složce přidáváme antikonvulziva nebo antidepresiva (viz tab. 5). Analgetický efekt bisfosfonátů (viz tab. 5) byl prokázán u kostního postižení při nádoru prsu, prostaty, plic, ledviny a mnohočetného myelomu. U pacientů s bolestmi při rozsáhlém metastatickém postižení skeletu bývají analgeticky účinné kortikoidy (např. prednisolon 20–40 mg, dexamethason 4–8 mg).
Jedná se obvykle o převážně nocicepční somatickou bolest. Někdy je přítomna významná neuropatická složka. Při léčbě užíváme kombinaci opioidních a neopioid-ních analgetik. Při vyjádřené neuropatické složce přidáváme antikonvulziva nebo antidepresiva (viz tab. 5). Analgetický efekt bisfosfonátů (viz tab. 5) byl prokázán u kostního postižení při nádoru prsu, prostaty, plic, ledviny a mnohočetného myelomu. U pacientů s bolestmi při rozsáhlém metastatickém postižení skeletu bývají analgeticky účinné kortikoidy (např. prednisolon 20–40 mg, dexamethason 4–8 mg).
Viscerální bolest
Při léčbě viscerální bolesti používáme kromě analgetik také spasmolytika (viz tab. 5). V případě bolesti z distenze pouz-dra jater nebo sleziny bývají účinné kortikoidy.
Neuropatická bolest
Maligní neuropatická bolest bývá dělena na bolest vyvolanou útlakem nervových struktur a poškozením nervových struktur. Přechod mezi oběma typy je plynulý. U bolestí vyvolaných kompresí nervových struktur (např. akutní fáze maligní míšní komprese, útlak nervových pletení tumorózní expanzí v pánvi) obvykle zahajujeme léčbu kombinací analgetik a kortikoidů. Při nedostatečném efektu přidáváme koanalgetika ze skupiny antikonvulziv a antidepresiv. U bolesti vyvolané poškozením nervových struktur (např. infiltrace brachiálního plexu Pancoastovým tumorem, interkostobrachiální neuralgie po mastektomii a bolestivé neuropatie po chemoterapii) zahajujeme léčbu antikonvulzivy a/nebo antidepresivy a v případě nedostatečného účinku přidáváme analgetika (nejčastěji opioidní).
Bolest při nitrolební hypertenzi
Farmakologická léčba spočívá v anti-edematózní terapii (mannitol, kortikoidy) a v aplikaci analgetik.
Nejčastější nežádoucí účinky opioidů a jejich řešení
-
Některé nežádoucí účinky se vyskytují převážně na začátku léčby (např. nevolnost, zvracení), jiné trvají po celou dobu užívání opioidů (např. zácpa a pocení). Některé nežádoucí účinky nabývají na významu až při dlouhodobém užívání (např. hypogonadismus a imunosuprese).
-
Klinicky nejvýznamnějšími nežádoucími účinky při dlouhodobé léčbě opioidy u onkologických pacientů jsou zácpa, nevolnost a zvracení a celkový útlum.
-
Pacienta je třeba na výskyt nežádoucích účinků připravit a současně stanovit plán jejich léčby.
-
Výskyt nežádoucích účinků není důvodem k přerušení podávání analgetik, ale k léčbě a řešení těchto nežádoucích účinků.
-
Při řešení nežádoucích účinků opioidů lze obecně využít následující strategie:
-
snížení systémové dávky opioidů (např. přidáním neopioidních analgetik nebo koanalgetik, využití metod regionální analgezie, neuroablativní metody, radio-terapie);
-
změna druhu nebo aplikační formy opioidu, tzv. rotace (viz výše);
-
farmakologická léčba nežádoucích účinků.
Zácpa
-
Vyskytuje se obvykle po celou dobu užívání opioidů (na tento NÚ nevzniká tolerance) a může velmi negativně ovlivnit kvalitu života pacientů.
-
Tendence k zácpě je u onkologických pa-cientů potencována řadou dalších faktorů (ostatní léky: např. tricyklická antidepresiva a spasmolytika, setrony, omezená mo-bilita, malnutrice, dehydratace, dysfunkce autonomního nervového systému po chemoterapii).
-
K posouzení závažnosti zácpy z hlediska pacienta je možné použít některé dotazníkové nástroje, např. dotazník Bowel Function Index (BFI).
-
U části pacientů musíme po celou dobu užívání silných opioidů pravidelně podávat laxativa.
-
Obvykle začínáme podáním osmotických a změkčujících laxativ (např. laktulóza 10–60 ml, Mg SO4 10–30 g ve vodném roztoku). Pokud není efekt dostatečný, přidáme kontaktní laxativa (např. list senny, vývar z 1,5–3 g listu v 250 ml vody, bisakodyl 5–15 mg per os). Někdy je účinná rektální aplikace laxativ, např. glycerinový čípek a malé nálevy dokusátu. Často je třeba laxativa kombinovat.
-
Předpokladem účinku laxativ je dobrá hydratace (alespoň 2 l tekutin denně).
-
U refrakterní zácpy způsobené perorálním podáním opioidů je výhodné přejít na parenterální nebo transdermální lékové formy.
-
Novou strategii v profylaxi a léčbě zácpy navozené opioidy představuje podání specifických antagonistů opioidních receptorů. Předpokládá se, že v roce 2009 bude v ČR uveden na trh kombinovaný perorální preparát obsahující oxykodon a naloxon a preparát k subkutánní aplikaci obsahující methylnaltrexon.
Nevolnost a zvracení
-
Vyskytuje se často (50–80 % pacientů) na začátku podávání silných opioidů. Po 7–10 dnech na ni obvykle vzniká tolerance.
-
Během prvního týdne léčby silnými opioi-dy je výhodné podávat profylakticky antiemetika (např. metoklopramid 10 mg á 6–8 hod., popř. thiethylperazin 6,5 mg á 8–12 hod.). Většina pacientů může antiemetickou léčbu po týdnu ukončit. Někdy je třeba antiemetika podávat dlouhodobě.
-
Při dlouhodobé nevolnosti při užívání daného opioidu je vhodné zvážit změnu druhu („rotaci“) opioidu.
Celkový útlum (sedace)
-
Vyskytuje se obvykle na začátku léčby (1–2 týdny). U většiny nemocných se na sedativní účinek opioidů rozvíjí tolerance.
-
Pokud je pacient o možnosti sedace na začátku léčby informován a počítá s ní, obvykle ji mnohem lépe snáší.
-
Při léčbě vysokými dávkami silných opioi-dů (ekvivalent stovek miligramů) je sedace častá. Lékař musí s spolu s nemocným stanovit, zda je pro nemocného tento nežádoucí účinek významný.
-
Při významné přetrvávající sedaci je vhodné zvážit změnu druhu opioidu.
-
Pokud není ani změnou druhu opioidu dosaženo zmírnění celkového útlumu, je třeba zvážit použití invazivních metod analgezie (intraspinální aplikace analgetik, neurodestruktivní intervence). Pacienta je třeba odeslat na specializované pracoviště léčby bolesti.
Hyperalgezie
U části pacientů léčených velmi vysokými dávkami opioidů někdy dochází k rozvoji tzv. paradoxní bolesti. Pacient udává výraznou bolestivost, která neodpovídá rozsahu nádorového postižení a někdy dosahuje až stupně generalizované hyper-algezie. Další zvyšování dávky opioidů vede pouze k prohloubení bolestivosti. Tato tzv. opioidy navozená hyperalgezie představuje neuropatický bolestivý stav vyvolaný neurotoxicitou opioidů.
-
Léčba spočívá především ve výrazném snížení dávky opioidů a v rotaci opioidů.
-
Dobré klinické výsledky přináší podání ketaminu i.v. nebo s.c. (počáteční bolus 0,5 mg/kg a následně kontinuální infuzí o rychlosti 0,25 mg/kg/h).
-
Alternativu představuje podání lidokainu i.v. (doporučuje se začít dávkou 1–3 mg/ kg během 20–30 minut, poté pokračovat kontinuální infuzí 0,5–2 mg/kg/h).
-
Existují práce, které prokazují účinnost malých dávek naloxonu podaného formou kontinuální infuze (0,05 mg/h). Tato léčba vede k významné redukci hyperalgezie bez ovlivnění analgetického účinku opioidu.
Hypogonadismus
Při dlouhodobém podávání silných opioidů dochází u části pacientů k rozvoji hypogonadismu, který se klinicky projevuje sexuální dysfunkcí (ztráta libida, poruchy erekce), ale také úbytkem svalové hmoty, zvýšenou únavou a osteoporózou.
-
Léčba spočívá v redukci až úplném vysazení opioidu.
-
Pokud není snížení dávky možné, je při prokázaném hypogonadismu indikována hormonální substituce (testosteron, HRT).
Imunosupresivní působení opioidů
Dlouhodobé užívání opioidů vede ke snížení buněčné i humorální imunity. V současné době není jasné, zda je tato skutečnost u onkologických pacientů klinicky významná (zda může mít vliv na průběh nádorové nemoci a na četnost a závažnost infekčních komplikací).
-
Při dlouhodobém užívání vyšších dávek opioidů je třeba tuto možnost zvažovat v diferenciální diagnostice projevů imunodeficitu.
-
Některá data naznačují, že opioidem s nejnižším tlumivým účinkem na imunitu je buprenorfin.